Журнал «Здоровье ребенка» 2 (23) 2010
Вернуться к номеру
Структурно-метаболічні основи діагностування порушень вуглеводного обміну в новонароджених, дітей та підлітків
Авторы: Каліман В.П., Харківський національний медичний університет
Рубрики: Педиатрия/Неонатология
Версия для печати
У статті обговорюється можливість діагностування некомпенсованих гіперглікемічних станів у немовлят, дітей та підлітків шляхом визначення кетоаміну кератину волосся.
Цукровий діабет, гіперглікемія, некомпенсовані глікемічні реакції, кетоаміни.
Цукровий діабет (diabetes mellitus) — хронічне поліетіологічне захворювання, обумовлене абсолютною або відносною недостатністю інсуліну — гормону, що виробляється b -клітинами ендокринної частини підшлункової залози. Найчастіше діабет розвивається на фоні генетичної схильності в результаті дії різних екзогенно-ендогенних факторів та характеризується порушенням процесів утилізації глюкози, що надалі призводить до системних структурно-метаболічних порушень обміну речовин в організмі в цілому. Проте незалежно від причин всі ці порушення зрештою є наслідком абсолютної або відносної нестачі інсуліну [1, 2].
Цукровий діабет поширений у всьому світі, але в першу чергу в промислово розвинених країнах. За даними Всесвітньої організації охорони здоров''я (ВООЗ), захворюваність на цукровий діабет має прогресивну тенденцію до поширення, причому цей показник зміщується в бік «омолоджування» захворювання. Так, у даний час понад 50 % хворих на цукровий діабет першого типу (інсулінозалежний діабет) — це діти та підлітки, вік яких не перевищує 14 років.
На сьогодні захворюваність на цукровий діабет можна відобразити у вигляді піраміди, основу якої утворює величезна кількість осіб, переважно молодого віку, із так званим латентним діабетом. Ця група хворих формується останніми роками особливо активно. Цьому сприяють такі фактори, як закономірні проблеми урбанізації, численні ліподистрофії, низька фізична активність молоді, часті психоемоційні перенапруження, порушення мікро-, макро- та біоекології, а також багато інших екзогенних та ендогенних факторів. Проте вчасно поставлений діагноз дозволяє лікареві досягти основної мети терапії — збереження повноцінного життя дитини чи підлітка, а також забезпечити надалі гідну якість життя для пацієнта та його батьків.
На жаль, на момент постановки клінічного діагнозу «цукровий діабет» у дітей та підлітків вже існує ціла низка вторинних органофункціональних ускладнень у вигляді офтальмопатій, нефропатій, гіпертензій, дисліпідемій, ангіопатії та інших проявів вторинної патології цукрового діабету [3, 4]. Усе це значно ускладнює лікування дитини чи підлітка, особливо коли діагноз було встановлено занадто пізно. Діагностування цукрового діабету на етапі клінічної маніфестації захворювання значно утруднює лікування такої дитини і погіршує якість життя дитини та її батьків.
Розрахунки економістів у галузі охорони здоров''я демонструють, що на кожну гривню, виділену на лікування хворої на цукровий діабет дитині, 15 % припадає на терапію захворювання, тобто на лікування самого цукрового діабету, що клінічно маніфестує, а 85 % — на лікування вторинних ускладнень, викликаних некомпенсованим гіперглікемічним станом. Тому проблема своєчасного діагностування цукрового діабету має не тільки медичну, але ще й вагому соціально-економічну складову.
Некомпенсована гіперглікемія є одним із головних факторів виникнення та прогресування вторинних ускладнень цукрового діабету в дітей та підлітків (DCCT — Diabetes Control and Complications Trial group, 1993). Зв''язок між хронічно підвищеним умістом глюкози в крові і численними ускладненнями цукрового діабету досить переконливо підтверджують численні клінічні дослідження (DCCT, 1993).
У здорових дітей та підлітків уміст у біологічних рідинах ациклічної форми глюкози незначний, тому концентрація в них неферментативно глікозованих (глікованих) білків дуже мала. Разом із тим при стійкому збільшенні рівня глюкози в крові (що спостерігається вже при ранніх порушеннях вуглеводного обміну) вміст глікованих білків значно зростає унаслідок збільшення вмісту в біологічних рідинах ациклічних форм редукувальних моносахаридів, зокрема альдегідної форми глюкози.
Гліковані білки, на відміну від вуглеводно-білкових комплексів, утворюються посттрансляційно. Такі посттрансляційно утворені вуглеводно-білкові сполуки, які з''являються в періоди хронічної гіперглікемії, змінюють ферментативну активність та структурну належність біологічних комплексів, що надалі призводить до розвитку вторинних органофункціональних ускладнень. Таким чином, лабораторно-діагностичне визначення неферментативно утворених вуглеводно-білкових сполук, що мають строго визначений період життя та напіврозпаду, високу специфічність до неензимообумовлених реакцій та зазнають обмеженого впливу редукувальних факторів крові, має високу інформативну й клінічну цінність.
У той же час у дітей та підлітків, які народилися в матерів із гестаційним та цукровим діабетом, особливо коли в їхній родині є або були додаткові випадки захворювання на цукровий діабет, вірогідність прихованої захворюваності на цукровий діабет дуже велика, і надалі є велика вірогідність розвитку та прогресування захворювання на цукровий діабет.
Ось чому в рамках загальнонаціональної державної програми «Цукровий діабет» пріоритетним завданням є розробка доступного й інформативного лабораторно-клінічного методу, який дозволить своєчасно діагностувати латентні та приховані форми цукрового діабету, особливо коли ще можливо попередити розвиток цього захворювання, а також виявляти недіагностовані форми цукрового діабету, що, у свою чергу, дозволить знизити ризик розвитку вторинних ускладнень цукрового діабету і значно заощадити державні та приватні кошти, що ідуть на лікування таких хворих. На даний час основним показником оцінки глікемічного стану хворих на цукровий діабет є показник рівня глікованого гемоглобіну.
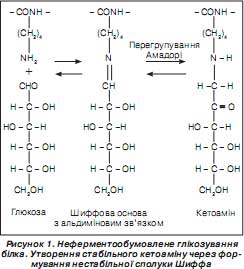
Неензиматичне глікозування (глікування) білка — це біохімічна реакція, яка полягає в приєднанні моносахариду до протеїну з подальшим перетворенням з''єднання, що утворилося, на стабільну кетоамінову сполуку і перебігає без участі ферментів; так звана реакція альдольної конденсації. Така реакція вперше була досліджена й описана L. Maillard (Л. Мейллардом) у 1913 році.
Більшість протеїнів, що синтезуються в організмі людини, піддаються глікуванню. Процес глікування білка можна поділити на ферментативний та неферментативний. Перший (ферментативний) перебігає в ендоплазматичній мережі клітини за участю ферментів (глікозилтрансфераз). Глікозилтрансферази каталізують нарощування олісахаридного ланцюга в молекулі білка з утворенням повноцінного глікопротеїну. Другий (неферментативний) є реакцією хімічного з''єднання білка з моносахаридом (реакцією альдольної конденсації) із подальшим можливим перетворенням створеної сполуки. Неферментативне глікозування (глікування) відбувається при нормальному функціонуванні білка й контакті його з альдегідної формою глюкози або іншим редукувальним моносахаридом. Реакція хімічної конденсації є реакцією з''єднання аміну (NH 2 -групи) та альдегіду (СНО-групи) (зворотна реакція Шиффа). Приєднання альдегіду відбувається, як правило, до вільної NH 2 -групи кінцевої амінокислоти, наприклад, до валіну в гемоглобіні HbА (HbA1c), або до однієї з доступних e -аміногруп залишку лізину (у більшості білків). Якщо відбувається з''єднання лізину і глюкози, то в ході реакції Мейлларда утворюється перший продукт глікування білка — зворотне утворення Шиффа, яке формується протягом декількох годин у неферментообумовленій реакції між аміногрупами протеїнів та карбонільними групами в реакції скріплення вуглеводів, особливо глюкози й фруктози, які приєднуються до бічних ланцюгів лізину або до N-терміналу білка. Шиффове утворення нестабільне й легко дисоціює. Така неферментозалежна реакція перебігає тільки з ациклічною формою глюкози, концентрація якої не перевищує 0,002 % від концентрації циклічної форми цього вуглеводу в біологічній системі.
Шиффове утворення в умовах некомпенсованої гіперглікемії, яка спостерігається при цукровому діабеті, може надалі перетворюватися на продукт Амадорі (кетоамін) — перший продукт стабільного глікування. Такий стабільно глікований протеїн змінює свою структурно-метаболічну належність, що надалі приводить як до перебудови метаболічної спрямованості самого протеїну, так і до цілої низки структурних реконструкцій у клітині в цілому. Такий неферментативно глікозований протеїн надалі може зникнути в подальших перетвореннях протеїну, який може бути перетворений через серію погано диференційованих реакцій утворення AGE — Advanced glycation end product (кінцевих продуктів просунутого глікування, або кінцевих продуктів глибокого глікозування). Такі стабільно гліковані протеїни (кетоаміни) доцільно використовувати для моніторингу глікемічного стану й діагностування ранніх порушень вуглеводного обміну, особливо в дітей та підлітків, які народились від матерів, хворих на цукровий діабет, і належать до групи підвищеного ризику що захворювання на цукровий діабет.
Схематично процес переходу звичайного протеїну через нестабільну сполуку Шиффа (альдимінове з''єднання) з подальшим перегрупуванням Амадорі й утворенням стабільної сполуки кетоаміну зображено на рис. 1.
Першим із неферментообумовлених глікозованих (глікованих) протеїнів був виявлений, виділений та детально досліджений і описаний наприкінці 50-х — на початку 60-х рр. ХХ століття глікований гемоглобін людини.
Гемоглобін людини — це складний протеїн, що складається з чотирьох субодиниць, які утворюють четвертинну структуру (рис. 2).
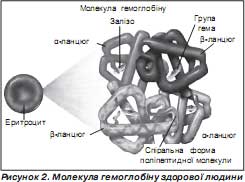
Неензиматично глікозований (глікований) гемоглобін — це гемоглобін, у якому молекула глюкози конденсується з b -кінцевим валіном у b -ланцюзі молекули гемоглобіну. Неферментообумовлене глікозування гемоглобіну веде до зміни його біохімічних властивостей, що, у свою чергу, призводить до багатьох метаболічних порушень у біологічному об''єкті. Глікований гемоглобін має завищену спорідненість до кисню, що призводить до тканинної гіпоксії та зниження здатності еритроцитів до деформації й підвищення їх в''язкості. Такі нефізіологічні структурно-метаболічні перетворення приводять до різноманітних клінічних та органо-функціональних проявів (підвищення кількості еритроцитів у одиниці об''єму крові, згущування крові, тканинної гіпоксії та ін.). Усе це призводить до утруднення кровообігу в мікросудинах, зміни тиску в них, що стимулює стовщення та структурну належність базальної мембрани судин. Таким чином, є пряма залежність між умістом у крові глікованого гемоглобіну й ступенем діабетичної ангіопатії.
Запропоновані та використовувані на даний час у галузі практичної охорони здоров''я методи визначення глікованого гемоглобіну людини виявляють різні субфракції. Одні лабораторії вимірюють гемоглобін HbА1, інші — HbA1c, треті — тотальний глікогемоглобін (GHb).
Однак, по-перше, не всі лабільні альдимінові сполуки перетворюються надалі на стабільні кетоаміни; по-друге, у дорослої людини і в дитини (особливо у немовляти) загальній гемоглобін складається з різних гемоглобінів, які мають, у свою чергу, різну здатність до глікування та структурно-метаболічні відмінності; по-третє, термін життя гемоглобіну дуже довгий, що значно зменшує його діагностичну цінність, особливо за умов швидкого клінічного реагування.
Проте використовувані на даний час у клінічних лабораторіях способи діагностування некомпенсованих гіперглікемічних станів, зокрема за рівнем глікованого гемоглобіну, мають ряд суттєвих недоліків, які на сьогоднішній день не можливо повністю усунути шляхом модифікації цих методик [5–7].
Так, головним недоліком діагностування структурно-метаболічних порушень вуглеводного обміну в новонародженого шляхом визначення глікованого гемоглобіну є те, що в постнатальному періоді в дитини є декілька форм гемоглобіну, у тому числі й фетальний гемоглобін, який відображає глікемічний стан дитини виключно щодо гестаційного процесу, у якому першою скрипкою є біологічна визначеність організму матері, а не структурно-метаболічні особливості організму дитини.
Таким чином, усі форми гемоглобіну, які є в дітей та підлітків, мають різну спорідненість до неферментообумовленних реакцій, зазнають різноманітного впливу редукуючих факторів крові та мають різний період життя [8]. Крім того, у новонародженої дитини якийсь час знаходиться фетальний гемоглобін, якій не відображає структурно-метаболічну належність глікемічного стану немовляти. Також на показник глікованого гемоглобіну можуть впливати багато додаткових факторів, таких як різноманітні анемії, гемоглобінопатії, гемоліз еритроцитів, уремія та багато інших, а також є вірогідність зараження ВІЛ-інфекцією та іншими захворюваннями, що передаються через кров. Усе це значно знижує інформативну значущість методу й обмежує клінічну доцільність використання показника глікованого гемоглобіну як маркера ранніх (донозологічних) порушень вуглеводного обміну, які нерідко спостерігаються в дітей та підлітків, народжених матерями, які хворіють на цукровий діабет або мають хворих на цукровий діабет серед найближчих родичів.
Беручи до уваги, що процес глікування білка залежить виключно від наявності в ньому вільних аміногруп, умісту ациклічної форми редукувального моносахариду й тривалості контакту з ним протеїну, єдиним змінним та визначальним фактором, що відповідає за ступінь глікування білка, є вміст у біологічному середовищі ациклічної форми глюкози та час контакту з нею протеїну.
Враховуючи, що високоспецифічним білком до альдегідної форми глюкози й високодоступним біологічним матеріалом є кератин волосся, який має чітко визначений період життя, обумовлений строком росту волосся, високу спорідненість до неферментообумовлених реакцій, чутливість до якого супутніх редукувальних речовин обмежена і який чітко відображає структурно-метаболічну приналежність біологічного об''єкту, — був вибраний цей біологічний матеріал.
Тобто глікування кератину волосся — процес неферментообумовлений, тому якісний та кількісний вміст глікованого кератину залежить виключно від кількісного вмісту в біологічному середовищі ациклічних форм редукційних моносахаридів, зокрема глюкози, і тривалості контакту з ним кератину волосся. Глікування кератину відбувається тільки при знаходженні волосся у волосяному фолікулі, а ступінь неферментообумовленого глікозування кератину залежить виключно від наявності в молекулі білка вільних аміногруп та вмісту в плазмі крові ациклічних форм редукційних моносахаридів, зокрема глюкози. Кератин волосся щодо наявності у ньому вільних аміногруп — величина постійна. Тому єдиним визначальним фактором, що впливає на ступінь глікування кератину волосся та утворення стабільного кетоаміну, є вміст у біологічному середовищі ациклічної форми глюкози та термін контакту з нею кератину волосся.
Враховуючи, що волосся в дитини починає рости ще в пренатальному періоді і продовжує свій ріст у постнатальному періоді, можна чітко розмежувати пренатальний та постнатальний періоди розвитку дитини з позиції клініко-діагностичної доцільності та клінічної ситуаційної приналежності. Усе це дає можливість клініцистові діагностувати наявність порушень, які відбулися у плода під час вагітності або відбуваються чи поглиблюються в організмі новонародженого або дитини в постнатальному періоді, і диференціювати ступень цих порушень у ланцюгу метаболізму вуглеводів. Усе це дозволяє лікареві своєчасно діагностувати структурно-метаболічні порушення вуглеводного обміну, які спостерігаються при цукровому діабеті ще на етапі відсутності клінічних прояв захворювання, та діагностувати латентні й преморбідні форми захворювання на цукровий діабет у дітей та підлітків, особливо з підвищеної групи ризику.
Враховуючи, що швидкість росту волосся — величина постійна, характеризується певною динамікою, становить 0,37–0,38 мм на добу й фактично не залежить від пори року, статі обстежуваного та інших різноманітних екзогенних та ендогенних факторів, можна вибрати практично будь-який проміжок часу для ретроспективної оцінки глікемічного стану дитині та підлітка або новонародженого.
Таким чином, проміжок часу для визначення глікемічного стану дитини чи підлітка буде обумовлено тільки довжиною досліджуваного волосся обстежуваного, професійністю медичного персоналу та клініко-діагностичними потребами лікаря.
Запропонований спосіб (метод) у клінічних умовах можна використовувати наступним чином. У дитини біля кореня зрізають декілька волосин. З урахуванням швидкості росту волосся розрізають його на декілька фрагментів, які чітко відповідають певному проміжку часу. Якщо це новонароджений, відділяють фрагмент волосся, який виріс в антенатальному періоді. Потім відповідно до авторського методу [9] якісно та кількісно визначають кетоамінову сполуку в кожному фрагменті волосся. З урахуванням часового періоду зростання кожного фрагмента дослідженого волосся ретроспективно визначають наявність та ступень структурно-метаболічних порушень вуглеводного обміну в обстежуваного новонародженого за чітко визначений пренатальний чи постнатальний період. Особливе клініко-діагностичне значення кількісне визначення глікованого кератину волосся, виключно після утворення стабільної сполуки — кетоаміну, матиме в дітей та в підлітків, у яких стан глікемії надзвичайно лабільний.
Таким чином, запропонований лабораторно-діагностичний спосіб (метод) визначення кетоамінової сполуки волосся дозволить моніторувати стан дітей та підлітків, особливо з груп підвищеного ризику, які народилися від матерів із гестаційним або цукровим діабетом, та своєчасно й об''єктивно визначати наявність латентного або недіагностованого цукрового діабету, що забезпечить можливість заздалегідь формувати лікувально-профілактичні заходи щодо попередження розвитку захворювання на клінічно маніфестуючий цукровий діабет у таких дітей, а також виключити вірогідність зараження ВІЛ-інфекцією та іншими інфекціями немовлят, дітей та підлітків в процесі обстеження, уникаючи забору крові.
Таким чином, використовуючи розроблений та запропонований авторський метод кількісного і якісного визначення глікованого кератину волосся, на який отримано патент України № 19668 [9], у новонароджених, дітей та підлітків, особливо тих, які народилися від матерів із гестаційним діабетом та хворих на цукровий діабет, можливо в умовах клінічної лабораторії діагностувати ранні порушення метаболізму вуглеводів та діагностувати латентну й донозологічну форми захворювання на цукровий діабет.
Згідно з нашими спостереженнями та дослідженнями, уміст глікованого кератину, виключно у вигляді стабільної сполуки — кетоаміну, у практично здорових дітей та підлітків не перевищує 0,120 мкмоль фруктозаміну на 100 міліграмів волосся. У той же час цей показник зростає при некомпенсованих гіперглікемічних станах більше ніж у 1,5–2 рази. Таким чином, враховуючи структурно-метаболічні особливості організму дитини та біохімічні процеси, які спостерігаються при переході звичайного протеїну в кетоамін, можна вважати, що показник кетоаміну понад 0,120 мкмоль фруктозаміну на 100 міліграмів волосся вказує на наявність порушень метаболізму вуглеводів у дітей та підлітків. Показники вмісту кетоаміну в кератині волосся у здорових дітей та підлітків, а також у дітей та підлітків з порушеннями вуглеводного обміну подані в табл. 1.

Позитивний ефект запропонованого лабораторно-діагностичного методу визначення кетоаміну волосся в дітей та підлітків обумовлений ще й тим, що на процес глікування кератину волосся практично не впливають більшість редукувальних речовин крові, а кількісне визначення цього кетоаміну дозволяє клініцистові отримати вірогідний інформативний інтегральний показник метаболізму глюкози за певний і наперед заданий лікарем період часу та оперативно визначити профілактичну та лікувальну терапію, а також виключити вірогідність зараження ВІЛ-інфекцією та іншими захворюваннями, що виникають через забір крові. Крім того, виконавши ці пропозиції, клініцист зможе ретроспективно диференціювати та моніторувати глікемічний стан новонародженого в пренатальний і постнатальний періоди життя дитини, що дозволить, у свою чергу, діагностувати ранні порушення вуглеводного обміну у дитини, діагностувати неонатальний цукровий діабет у дітей перших шести місяців життя та визначати доклінічні прояви цукрового діабету в дітей та підлітків.
Таким чином, виходячи з вищенаведеного і керуючись клініко-діагностичними потребами лікаря та завданнями прикладної медицини, можна сформулювати наступні висновки і практичні рекомендації для лікаря-клініциста та лікаря-лаборанта.
Висновки
Для практичної медицини розроблений та запропонований високоспецифічний інформативний лабораторно-діагностичний метод (спосіб) ретроспективної оцінки глікемічного стану в дітей та підлітків за певний і заздалегідь визначений лікарем проміжок часу залежно від клініко-діагностичних потреб і клінічних завдань, який дозволяє уникнути вірогідності зараження ВІЛ-інфекцією та іншими хворобами, що передаються через кров.
Діагностичне значення визначення глікованого кератину волосся визначається ще й тим, що він має високу специфічність до неферментообумовлених реакцій та зазнає обмеженого впливу супутніх редукувальних факторів крові, що дозволяє вважати його об''єктивним ретроспективним маркером глікемічного стану, особливо в дітей та підлітків, у яких глікемічний стан дуже нестабільний.
Якісне й кількісне визначення кетоаміну волосся дозволяє клініцистові ретроспективно диференціювати та моніторувати глікемічний стан новонародженого в пренатальний і постнатальний періоди, що дозволяє лікареві своєчасно запроваджувати лікувально-профілактичні заходи, особливо при діагностуванні неонатального цукрового діабету в дітей перших шести місяців життя.
Включення в загальний клініко-діагностичний комплекс обстеження немовлят, дітей та підлітків, особливо з груп підвищеного ризику, запропонованого методу якісного й кількісного визначення кетоаміну волосся дозволить клініцистові своєчасно діагностувати ранні порушення вуглеводного обміну, а також формувати комплекс лікувально-профілактичних заходів щодо компенсації вуглеводного обміну та запобігати розвитку вторинних органофункціональних ускладнень у дітей та підлітків, а також заощадити значні державні та приватні кошти, що йдуть на лікування вторинних ускладнень цукрового діабету.
1. Балаболкин М.И. Диабетология. — М.: Медицина, 2000. — 672 с.
2. Бокарев И.Н., Великов Б.К., Шубина О.И. Сахарный диабет: Руководство для врачей. — Москва: Медицинское информационное агентство, 2006, 394 с.
3. Ефимов А.С., Скробонская Н.А. Клиническая диабетология. — К.: Здоров’я, 1998, 320 с.
4. Благосклонная Я.В., Шляхто Е.В., Бабенко А.Ю. Эндокринология. — СПб.: СпецЛит, 2004, 338 с.
5. Булатова С.В., Трельская Н.Ю., Бейкин Я.Б., Усатова Т.И., Киселева Т.И. Результаты определения гликированного гемоглобина у больных сахарным диабетом // Клиническая лабораторная диагностика. — 2007. — № 9. — С. 61-62.
6. Wild S., Roglic G., Green A. et al. Global Prevalence of Diabetes. Diabetes care. — 2004 May. — Vol. 27, № 5.
7. Peterson K.P., Pavlovich J.G., Goldstein D. et al. What is haemoglobin A1C? An analysis of glaciated haemoglobin’s by electrospray ionization mass spectrometry // Clin. Chem. — 1998.
8. Mejer J.L., Swislocki A.L., Lopez J.R. et al. // Am. J. Manag. Care. — 2002. — Vol. 8, № 6. — Р. 557-565.
9. Каліман В.П., Клименко М.О., М’ясоєдов В.В., Каліман П.А., Жуков В.І., Горбач Т.В. Метод визначення глікованого кератину. Патент України № 19668. Бюл. № 12. Д.п. 15.12.2006.
