Журнал «» 1(15) 2011
Вернуться к номеру
Диференційовані методи корекції післяінфарктного ремоделювання серця у хворих на артеріальну гіпертензію в умовах хронічної бронхіальної обструкції
Авторы: Швед М.І., Гребеник М.В., Коморовський Р.Р., Маслій С.М., Тернопільський державний медичний університет ім. І.Я. Горбачевського
Рубрики: Семейная медицина/Терапия, Кардиология, Терапия
Версия для печати
Артеріальну гіпертензію (АГ), ішемічну хворобу серця та хронічне обструктивне захворювання легень (ХОЗЛ) відносять до найбільш поширених неінфекційних захворювань сучасності, які мають тенденцію розвитку «тихої епідемії» у XXI ст. Проведені нами 15-річні спостереження на базі кардіологічного і пульмонологічного відділень університетської лікарні виявили зростання мікст-патології, що спричиняє взаємообтяження, модифікацію клінічного перебігу з розвитком ускладнень, наслідком чого є рання інвалідизація й підвищення смертності. Так, частка АГ у популяції хворих на інфаркт міокарда (ІМ) становила 69,5 %, ХОЗЛ — 23,8 %, що майже втричі перевищує середній рівень у загальній популяції. Проте при поєднанні ІМ і ХОЗЛ кількість хворих із супутньою АГ виявилася дещо нижчою — 51 % (Р = 0,002), що при детальному аналізі знайшло патогенетичне пояснення. У цілому отримані показники суттєво перевищують як середньопопуляційну поширеність АГ в Україні — 34 % [5], так і при ХОЗЛ, що за різними даними становить 0,4–40 % [4, 9].
Проведений нами аналіз виживання хворих із мікст-патологією за методикою Каплана — Мейєра зі створенням моделей інтенсивних пропорційностей Кокса виявив, що АГ є одним із незалежних провісників серцево-судинних подій (співвідношення шансів 3,03, 95% довірчий інтервал 1,04–8,78) і смертності (співвідношення шансів 10,54; 95% довірчий інтервал 1,26–88,30). При цьому достовірність моделі для серцево-судинних подій становила c2 = 16,09, Р < 0,001, для інертності — c2 = 14,35, Р < 0,001 [2].
З огляду на частку АГ у досліджуваній популяції, наявність суттєвої різниці між групами хворих залежно від наявності супутнього ХОЗЛ у питомій вазі АГ (Р = 0,002), середніх рівнів артеріального тиску як за наявності анамнезу АГ (Р = 0,040), так і в пацієнтів без АГ (Р = 0,037) постало питання про доцільність аналізу процесів післяінфарктного ремоделювання серця залежно від указаних супутніх патологій та з урахуванням локалізації некробіотичих змін.
Мета дослідження — вивчити клініко-функціональні особливості й динаміку морфометричних характеристик у процесі формування післяінфарктного серця впродовж 5 років спостереження у хворих на артеріальну гіпертензію й супутнє хронічне обструктивне захворювання легень та розробити диференційовані методи корекції виявлених змін у межах регламентованих протоколів лікування окремих нозологій.
Матеріал і методи
Ремоделювання серця проаналізовано в динаміці упродовж 5 років поспіль у 138 чоловіків із гострим ІМ без супутньої бронхолегеневої патології (1-ша група) та 159 хворих на ІМ із супутнім ХОЗЛ (2-га група). Хворі цих груп розподілені на підгрупи залежно від наявності в анамнезі хронічної АГ: у 1-й групі було 96 пацієнтів з АГ та 42 — без АГ, у 2-й групі відповідно 81 — з АГ та 78 — без АГ.
Діагноз ІМ, АГ та ХОЗЛ верифікували за чинними протоколами МОЗ України. Стан внутрішньосерцевої гемодинаміки оцінювали за допомогою ехокардіографічного дослідження у М-, В- і D-режимах на апараті Аloka SSD-2000 (Японія) з датчиками 2,5 і 3,5 МГц згідно з рекомендаціями щодо ультразвукового дослідження серця Американського товариства з ехокардіографії [7]. Визначення характеру структурно-геометричного ремоделювання лівого шлуночка (ЛШ) проводили за А. Ganau та співавторами [8]. Усім хворим призначено згідно з протоколом ацетилсаліцилову кислоту, b-адреноблокатор (ББ), інгібітор ангіотензинперетворюючого ферменту/блокатор рецепторів ангіотензину II та статин. Залежно від реакції бронхів на прийом ББ за даними пікфлоуметрії (РЕF) хворі рандомізовані: за відсутності негативної реакції для тривалого прийому призначали бісопролол/бетаксолол, при виражених явищах бронхообструкції в анамнезі або у випадках зниження PEF у відповідь на тест із ББ — недигідропіридинові антагоністи кальцію (АК) — дилтіазем.
Статистичний аналіз результатів проводили за допомогою програми SРSS v.13.0. Кількісні дані представлені у вигляді M ± m. Критичний рівень значущості (Р) при перевірці статистичних даних менший за 0,05. Для порівняння середніх значень між групами використовували неспарений t-тест, а для оцінки динаміки показників у часі в межах однієї групи — спарений t-тест. Графічні моделі динаміки показників у процесі тривалого спостереження характеризували за коефіцієнтом достовірності апроксимації (R2).
Результати та їх обговорення
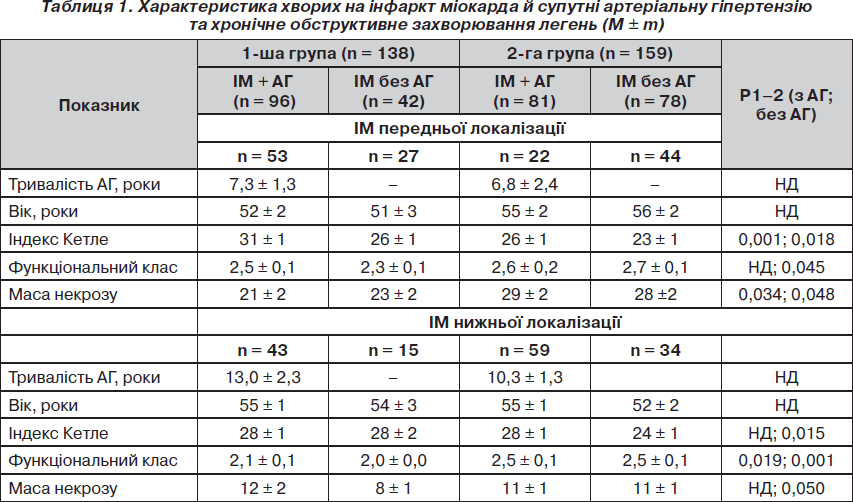
Кількісний розподіл хворих та характеристика за віком, антропометричними й функціональними даними наведені в табл. 1. Середній стаж анамнезу АГ у хворих 1-ї та 2-ї груп достовірно не відрізнявся та був майже удвічі коротшим у пацієнтів з ІМ передньої локалізації, ніж у хворих із задньою локалізацією ІМ. Хворі на ІМ суттєво відрізнялися від групи із супутнім ХОЗЛ за такими головними факторами ризику, як АГ (Р < 0,01), тютюнопаління (Р < 0,001), надмірна маса тіла (Р < 0,01), а також за впливом ксенобіотиків професійного характеру (Р < 0,01), показниками ліпідограми (Р < 0,0001) та за частотою ускладнень (75 % — при супутньому ХОЗЛ, 57 % — у контролі) і летальністю (відповідно 13,2 і 8,1 %, Р < 0,05).
Хворі на ІМ і ХОЗЛ за наявності АГ мали меншу масу тіла порівняно з контролем: індекс Кетле становив відповідно 27 ± 1 кг/м2 і 30 ± 1 кг/м2 (Р = 0,048). Подібна тенденція в різниці маси тіла між 1-ю та 2-ю групами зберігалася за наявності ІМ передньої локалізації та супутньої АГ (Р = 0,001) та у хворих без АГ (Р = 0,018), а за наявності ІМ нижньої локалізації — лише у хворих без АГ. Різниця в рівнях АТ між хворими на АГ 1-ї та 2-ї груп підтверджена лише за наявності нижньої локалізації ІМ, при якій середньодинамічний артеріальний тиск становив відповідно 115 ± 3 мм рт.ст. і 105 ± 2 мм рт.ст. (Р = 0,015).
При ІМ передньої локалізації розрахункова маса некрозу залежала лише від ХОЗЛ, при якому вона виявилася суттєво більшою. При ІМ нижньої локалізації вплив супутнього ХОЗЛ на масу некрозу встановлено лише у хворих без АГ. Середній функціональний клас на початку дослідження теж залежав від супутньої патології і виявився достовірно гіршим у хворих на супутнє ХОЗЛ.
Закономірною була різниця між хворими на АГ 1-ї та 2-ї груп у показниках функції зовнішнього дихання. Наявність хронічної бронхіальної обструкції й порушення респіраторної функції легень у хворих 2-ї групи відображалися зниженням індексу пікової швидкості видиху (222 ± ± 15 л/год • м2), форсованого видиху за 1 с (65 ± 3 %), індексу Тиффно (78 ± 3 %). Відповідні показники в 1-й групі становили: 291 ± 11 л/год • м2, 94 ± 4 % і 109 ± 4 %, достовірність різниці усіх показників між групами Р < 0,001.
Складні процеси ремоделювання серця в динаміці тривалого спостереження мали низку особливостей, пов’язаних із локалізацією ІМ, наявністю анамнезу АГ, супутньої бронхіальної обструкції. Звичайно, що наявність АГ та її тривалість призводять до ремоделювання серця й судин. Тому розвиток ІМ в умовах сформованого гіпертензивного серця накладає свій відбиток на процеси формування післяінфарктного серця. З іншого боку, хронічна бронхіальна обструкція є одним із чинників морфофункціональних змін серця, пов’язаних із наявністю хронічної легеневої гіпертензії та гіпоксемії.
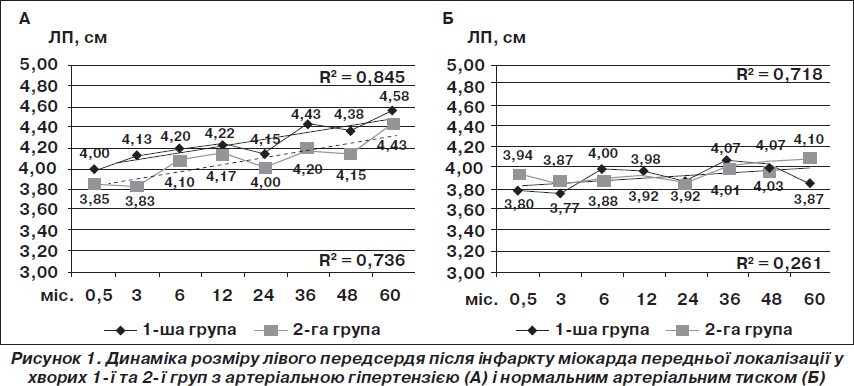
У гострий період ІМ розміри лівого передсердя (ЛП) залежали як від наявності супутньої АГ, так і від ХОЗЛ. Найменші розміри ЛП були у хворих без анамнезу АГ і без супутнього ХОЗЛ. У процесі формування післяінфарктного серця суттєве прогресування дилатації ЛП виявлено у хворих на ІМ, які мали анамнез гіпертонічної хвороби. У пацієнтів 1-ї групи значне збільшення передньозаднього розміру ЛП (до 4,43 ± 0,12 см) порівняно з вихідними значеннями (4,00 ± 0,06 см) реєстрували з третього року дослідження (Р = 0,038), у хворих 2-ї групи — наприкінці спостереження (з 3,85 ± 0,09 см до 4,43 ± 0,14 см; Р = 0,045).
Аналіз графічних моделей динаміки ЛП у часі (рис. 1) виявив чітку лінійну залежність збільшення його розмірів при АГ у хворих 1-ї і 2-ї груп (коефіцієнти достовірності апроксимації відповідно R2 = 0,845 і R2 = 0,736), а в пацієнтів без АГ — лише при супутньому ХОЗЛ (R2 = 0,718). При IМ нижньої локалізації розміри ЛП суттєво не змінювалися як у хворих на АГ, так і без анамнезу АГ.
Ремоделювання ЛШ виявлялося зміною його лінійних і об’ємних розмірів із формуванням сферичної форми, порушенням систолічної функції й посиленням діастолічної дисфункції, що властива хворим із гіпертензивним серцем. У гострий період IМ показники систолічної функції ЛШ вказували на більш виражені розлади внутрішньосерцевої гемодинаміки у хворих на ХОЗЛ. Так, за наявності ІМ передньої локалізації найбільший систолічний розмір зафіксований у хворих 2-ї групи без супутньої АГ — 5,0 ± 0,1 см, у той час як у всіх інших групах пацієнтів він становив у середньому 4,3 ± 0,1 см (Р < 0,05). Відповідно, ступінь укорочення передньозаднього розміру ЛШ виявився найнижчим у цій же групі (19 ± 1 %) та зниженим у решти хворих на ХОЗЛ (22 ± 1 %)порівняно з хворими 1-ї групи з АГ (25 ± 2 %) та без АГ (26 ± 2 %) (різниця достовірна лише між 1-ю та 2-ю групами хворих без анамнезу АГ). При ІМ нижньої локалізації достовірної різниці цих показників не виявлено.
Більш значні зміни, характерні для дилатаційного синдрому, особливо в динаміці спостереження, стосувалися кінцево-діастолічного розміру (КДР) і кінцево-діастолічного об’єму. Лінійні розміри ЛШ і його об’єм достовірно відрізнялися у хворих 1-ї та 2-ї груп незалежно від наявності АГ. Уже в гострий період ІМ на тлі ХОЗЛ індексовані до площі тіла розміри ЛШ (3,06 ± 0,09 см/м2) суттєво переважали показники контрольної групи при супутній АГ (2,79 ± 0,07 см/м2, Р = 0,028) та у хворих без АГ (відповідно 3,36 ± 0,06 см/м2 та 2,80 ± 0,05см/м2, Р = 0,004). Порівняно більші розміри ЛШ у 2-й групі утримувалися впродовж усього дослідження з максимальною різницею щодо 1-ї групи у хворих з анамнезом АГ: через 3 міс. відповідно 3,40 ± 0,10 см/м2 проти 2,80 ± 0,11 см/м2 (Р = 0,021); через 24 міс. — 3,45 ± 0,08 см/м2 проти 2,88 ± 0,09 см/м2 (Р = 0,037); у хворих без АГ: через 12 міс. — 3,25 ± 0,11 см/м2 проти 2,85 ± 0,09 см/м2 (Р = 0,013); у кінці спостереження — 3,80 ± 0,10 см/м2 проти 2,87 ± 0,07 см/м2 (Р = 0,045).
У хворих 1-ї групи динаміка розмірів ЛШ залежала від наявності АГ. У пацієнтів з АГ збільшення розмірів ЛШ мало лінійну залежність від коефіцієнту апроксимації R2 = 0,853. За умови відсутності анамнезу АГ достовірних змін розмірів ЛШ у хворих 1-ї групи після IМ передньої локалізації не спостерігали.
У хворих на ХОЗЛ динаміка розмірів ЛШ при супутній АГ була нерівномірною. Максимальне прогресування дилатаційного синдрому зафіксовано у перші 3 міс. після IМ — від 3,06 ± 0,09 см/м2 до 3,40 ± 0,14 см/м2 (Р = 0,050). У наступні 6–12 міс. спостерігали регрес і стабілізацію індексу КДР. Наступний тривалий період спостереження характеризувався поступовим збільшенням розмірів ЛШ. У хворих на ХОЗЛ без АГ до 24 міс. спостерігали тенденцію до зниження індексу КДР, надалі — до поступового його збільшення. Таким чином, найбільші розміри ЛШ у цієї категорії хворих зафіксовані в гострий період IМ і наприкінці дослідження. Очевидно, у першому випадку це є проявом компенсаторних реакцій, а у другому — свідченням декомпенсації, тобто розвитку серцевої недостатності.
Після IМ нижньої локалізації у хворих з анамнезом АГ динаміки лінійних та об’ємних характеристик ЛШ у досліджуваних групах не встановлено. У пацієнтів без АГ із ХОЗЛ збільшення індексу КДР мало лінійну залежність від коефіцієнту апроксимації R2 = 0,718.
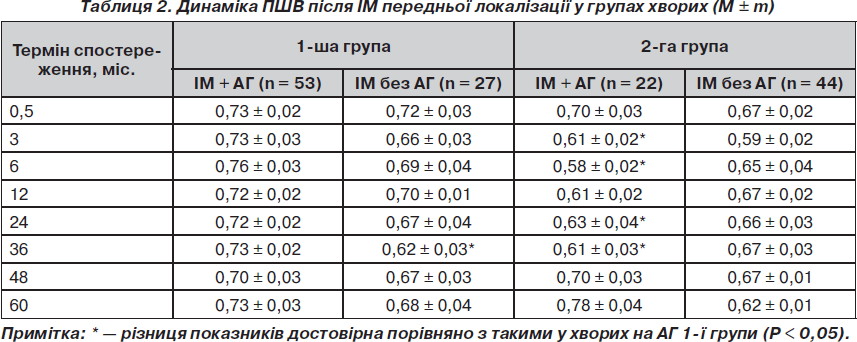
Співвідношення між дилатацією лівих камер серця більш чітко прослідковується за динамікою показника передсердно-шлуночкового відношення (ПШВ, табл. 2).
Після IМ передньої локалізації у хворих 2-ї групи із супутньою АГ ПШВ у перші 3 міс. знижувалося (Р = 0,048), що свідчило про переважання дилатації ЛШ порівняно з дилатацією ЛП. Установлено різницю ПШВ між 1-ю та 2-ю групами в інтервалі 3–36 міс. (Р = 0,045), що підтверджувало більш виражену дилатацію ЛШ у хворих на ХОЗЛ.
У хворих без анамнезу АГ незалежно від наявності ХОЗЛ динаміка ПШВ не відзначалася достовірністю різниці показників і відображала паралельні зміни, що відбувалися в ЛП і ЛШ.
При IМ нижньої локалізації лише у хворих на ХОЗЛ без анамнезу АГ відбувалося суттєве зниження ПШВ упродовж спостереження (R2 = 0,783). У контрольній групі подібна тенденція зберігалася лише до року після ІМ, а далі ПШВ достовірно збільшувалося. Таким чином, у пацієнтів без АГ через рік після ІМ спостерігали протилежні зміни ПШВ із суттєвою різницею значень між групами починаючи із 24 міс., що зберігалася до завершення дослідження (Р = 0,049). Порівняння характеру змін лівих камер серця з динамікою ПШВ у хворих без АГ після ІМ нижньої локалізації дає можливість зробити висновок про переважну роль дилатації ЛШ у тривалому процесі формування післяінфарктного серця.
Вихідні значення поперечного розміру правого шлуночка (ПШ) залежали від локалізації ІМ та наявності ХОЗЛ. Найбільші розміри ПШ у гострий період ІМ зафіксовано за нижньої його локалізації у хворих на АГ і супутнє ХОЗЛ — 2,7 ± ± 0,1 см, у контролі — 2,28 ± 0,1 см (Р = 0,023).
У динаміці значуще збільшення ПШ відзначено тільки у хворих на супутні ХОЗЛ та АГ з ІМ передньої локалізації — з 2,36 ± 0,08 см до 2,83 ± 0,09 см через 12 міс. та 3,25 ± 0,11 см через 60 міс. (Р = 0,048). У хворих без анамнезу АГ початкові характеристики ПШ у групах не відрізнялися. Очевидно, на початковому етапі перебігу ІМ вплив ХОЗЛ на стан ПШ реалізується в умовах хронічної АГ. У пацієнтів без АГ при ХОЗЛ встановлено прогресування дилатації ПШ після ІМ нижньої локалізації, особливо у перші 6 міс., до 3,00 ± 0,12 см (Р = 0,010), що зберігалася впродовж 5 років дослідження.
При хронічній АГ ремоделювання серця й судин виявляється у першу чергу процесами гіпертрофії м’язової тканини, формуванням гіпертензивного серця. Останнє, очевидно, повинно мати вплив на трансформацію ремоделювання серця в разі виникнення ІМ і формування постінфарктного серця.
Динаміка товщини міжшлуночкової перегородки (ТМШП) залежала від локалізації некрозу, наявності супутньої АГ та ХОЗЛ. На початку дослідження помірно виражену гіпертрофію міжшлуночкової перегородки реєстрували в усіх пацієнтів, які мали анамнез АГ. При ІМ передньої локалізації достовірну динаміку поступового зменшення ТМШП спостерігали лише у хворих 1-ї групи незалежно від анамнезу АГ. У цих пацієнтів подані лінійні моделі змін ТМШП у часі характеризувалися високим коефіцієнтом достовірності апроксимації: R2 = 0,760 у хворих з анамнезом АГ — зменшення від 1,36 ± 0,05 см до 1,15 ± 0,09 см і R2 = 0,812 — без АГ, від 1,23 ± ± 0,10 см до 0,87 ± 0,09 см. В обох випадках на завершальному етапі спостереження отримано достовірну різницю ТМШП порівняно з вихідними даними. У хворих на ХОЗЛ при IМ передньої локалізації ТМШП не зазнавала суттєвої трансформації. При IМ нижньої локалізації зменшення ТМШП від 1,17 ± 0,03 см до 0,95 ± 0,05 см спостерігали лише у хворих на ХОЗЛ без анамнезу АГ (коефіцієнт достовірності апроксимації R2 = 0,650). У решти хворих спостерігали протилежну тенденцію у вигляді компенсаторної гіпертрофії міжшлуночкової перегородки, проте ці зміни були недостовірними.
Незважаючи на анамнез АГ у хворих 1-ї та 2-ї груп, у гострий період IМ товщина задньої стінки (ТЗС) ЛШ незначно перевищувала цей показник у пацієнтів із нормальним артеріальним тиском. При IМ передньої локалізації у хворих на АГ розлади систолічної функції ЛШ характеризувалися зменшенням ТЗС ЛШ у систолу у хворих на ХОЗЛ — 12 ± 3 % проти 24 ± 4 % у контролі (Р = 0,036). При IМ нижньої локалізації при супутній АГ теж установлено різний ступінь збільшення ТЗС ЛШ у хворих 1-ї та 2-ї груп — відповідно 17 ± 2 % і 10 ± 2 % (Р = 0,048). Динаміка ТЗС ЛШ мала протилежний характер у групах хворих із передньою та нижньою локалізацією IМ. Так, після IМ передньої локалізації ТЗС ЛШ у хворих 1-ї групи з анамнезом АГ характеризувалася лінійною залежністю зниження показників (R2 = 0,819), а при нижній локалізації, навпаки, їх збільшенням із слабкою статистичною залежністю цього процесу (R2 = 0,526). У хворих 2-ї групи при АГ достовірні зміни в динаміці (R2 = 0,781) відбувалися лише при IМ нижньої локалізації й виявлялися компенсаторною гіпертрофією: ТЗС ЛШ збільшувалася з 1,22 ± 0,02 см до 1,38 ± ± 0,03 см (Р = 0,042). При IМ передньої локалізації у хворих 2-ї групи лише в перші 6 міс. зменшувалася ТЗС ЛШ — з 1,32 ± 0,02 см до 1,10 ± ± 0,03 см (Р = 0,018), із подальшим відновленням помірної гіпертрофії задньої стінки лівого шлуночка. У хворих без супутньої патології достовірних змін ТЗС ЛШ не виявлено, а при супутньому ХОЗЛ зафіксовано чітку тенденцію до її зменшення з 1,32 ± 0,02 см до 1,10 ± 0,03 см (R2 = 0,700) при нижній локалізації ІМ.
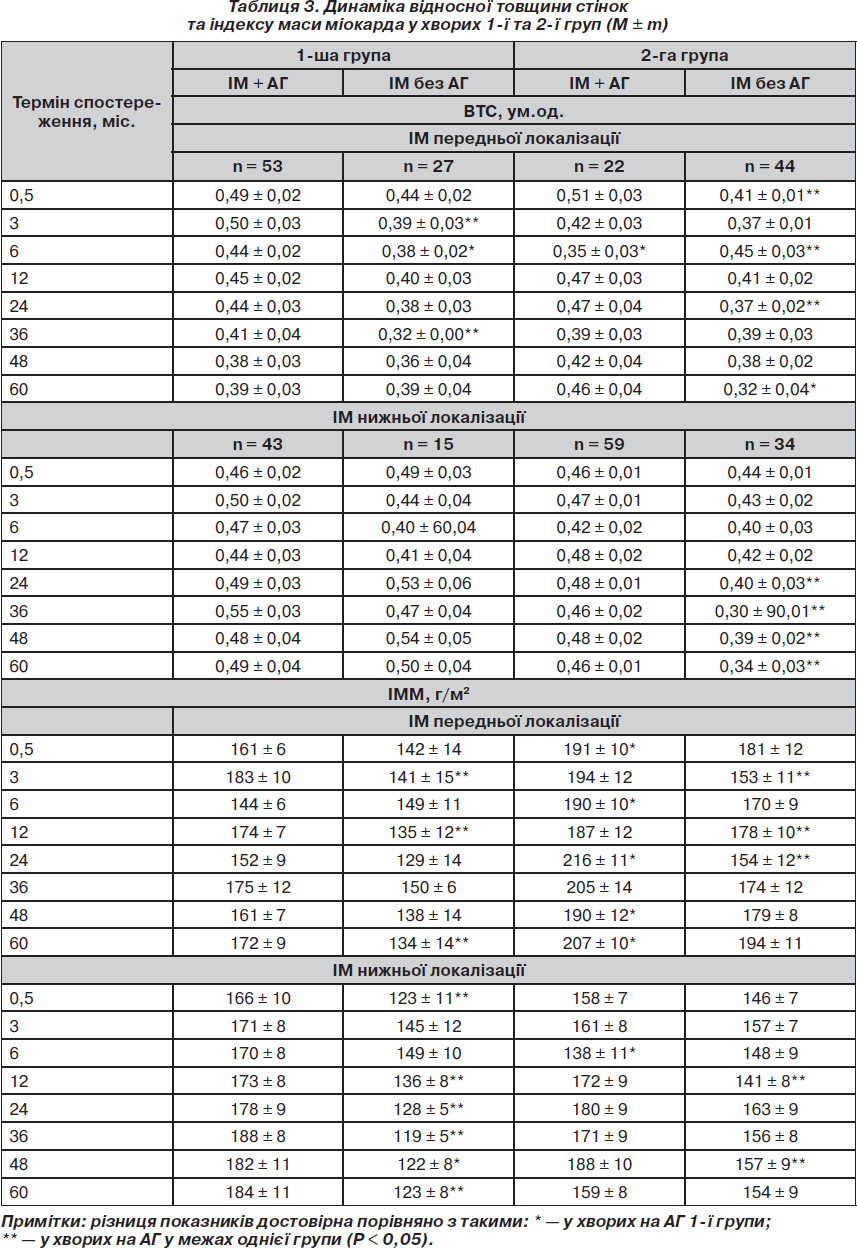
Динаміка відносної товщини стінок (ВТС) та індексу маси міокарда (ІММ) відображає складні процеси формування післяінфарктного серця, зміни товщини стінок міокарда, здатність до компенсаторної гіпертрофії міокарда і зменшення наслідків патологічного ремоделювання серця (табл. 3).
Після ІМ передньої локалізації у хворих 1-ї групи при супутній АГ підтверджено чітку тенденцію до зменшення товщини стінок і зменшення ВТС (R2 = 0,887, Р = 0,043) (табл. 3). У хворих на ХОЗЛ спостерігали достовірне зниження ВТС лише в перші 6 міс. після ІМ. Надалі значення ВТС поступово поверталися до вихідних, не досягаючи, однак, початкових значень. У хворих без АГ тенденція до зниження ВТС статистично не підтверджена. При ІМ нижньої локалізації у хворих на АГ 1-ї та 2-ї груп достовірної динаміки ВТС не спостерігали, очевидно, внаслідок компенсаторної гіпертрофії інтактних зон навколо вогнища некрозу. У хворих на ХОЗЛ без АГ показник ВТС поступово знижувався (R2 = 0,803, Р = 0,039).
Абсолютні значення ІММ у цілому у групах суттєво не відрізнялися. Проте детальний аналіз динаміки ІММ виявив низку особливостей. Зокрема, показники ІММ при ІМ передньої локалізації вказували на більшу масу ЛШ, незалежно від наявності АГ, у хворих на ХОЗЛ. Відрізнялися як вихідні значення ІММ (Р = 0,045), так і показники на окремих етапах дослідження через 6, 24, 48, 60 міс. у хворих з анамнезом АГ та через 12, 48, 60 міс. — у хворих без АГ. При ІМ нижньої локалізації у хворих 1-ї групи приріст маси тіла характеризувався чіткою лінійною залежністю значень ІММ (Р2 = 0,824) при супутній АГ. У хворих без АГ, навпаки, у процесі формування післяінфарктного серця відбувалася незначна відносна втрата маси активного міокарда з появою вірогідної різниці значень порівняно зі стабільними показниками у 2-й групі після 12 міс. спостереження і до кінця дослідження.
У хворих на ХОЗЛ і АГ у всіх випадках і при аналізі змін товщини стінок, ВТС і ІММ чітко простежується одна закономірність: у перші 6 міс. після ІМ нижньої локалізації спостерігається суттєва втрата функціонально активного міокарда як за рахунок некробіотичних змін, так і внаслідок недосконалості механізмів компенсації.
Зміни морфометричних характеристик серця в процесі формування післяінфарктного серця, ініціація розвитку пристосувальних механізмів закономірно супроводжуються дисфункцією міокарда. Механізми адаптації функціонування серця в нових умовах у першу чергу спрямовані на забезпечення глобальної скоротливої здатності ЛШ та адекватного хвилинного об’єму крові.
Глобальна скоротлива здатність ЛШ за показником фракції викиду (ФВ) мала тенденцію до зниження в усіх хворих за винятком групи без супутньої патології при нижній локалізації вогнища некрозу. У гострий період ІМ при передній його локалізації ФВ у хворих із супутнім ХОЗЛ була нижчою у хворих з АГ — 42 ± 2 %, у контролі — 46 ± 1 % (Р = 0,05); у хворих без АГ — 43 ± 1 %, у контролі — 48 ± 2 % (Р = 0,028). Зниження ФВ у динаміці в 1-й та 2-й групах при АГ було статистично незначущим, рівномірним, із збереженням вірогідної різниці значень між групами через 6, 24 та 48 міс. У хворих без АГ зниження ФВ при супутньому ХОЗЛ виражалося лінійною залежністю (Р2 = 0,779) — із 47 ± 1 % до 39 ± 1 %.
У хворих 1-ї групи з ІМ нижньої локалізації динаміка ФВ виявилася протилежною залежно від наявності АГ. В обох випадках зміни скоротливості ЛШ характеризувалися лінійними моделями, проте у хворих з анамнезом АГ встановлено помірну тенденцію до зниження ФВ (R2 = 0,633) — з 49 ± 1 % до 45 ± 1 %, а у хворих без АГ — достовірне збільшення ФВ із 48 ± 1 % до 56 ± 3 % до кінця спостереження (R2 = 0,846). При супутньому ХОЗЛ та АГ динаміка ФВ відзначалася різноманітністю показників без чіткої статистичної значущості. Незважаючи на вищі початкові показники ФВ при ІМ нижньої локалізації, найбільш виражене погіршення скоротливої здатності ЛШ у процесі динамічного спостереження (R2 = 0,908) установлено у хворих на ХОЗЛ без АГ — із 47 ± ± 1 % до 39 ± 1 % (Р = 0,032).
Розлади діастолічної функції в гострий період ІМ у хворих з анамнезом АГ були більш вираженими при супутньому ХОЗЛ. Так, при передній локалізації ІМ у хворих 2-ї групи середній тип діастолічної дисфункції становив 3,5 ± 0,3, у хворих 1-ї групи — 2,4 ± 0,2 (Р = 0,032), при ІМ нижньої локалізації — відповідно 3,6 ± 2 і 2,8 ± 3,0 (Р = 0,044).
При проведенні гострої медикаментозної проби з ББ лише у 15 % пацієнтів із супутнім ХОЗЛ відзначено зменшення РЕF у середньому на 9,1 %, що дозволило основному контингенту хворих призначити ББ. У процесі моніторування РЕF протягом 2 тиж. на тлі прийому ББ не виявлено погіршення бронхіальної прохідності, навпаки, вона збільшувалася за рахунок стабілізації кардіогемодинаміки.
Незважаючи на прийом ББ, розміри ЛП поступово збільшувалися, і на завершальному етапі спостереження зафіксовано його дилатацію як у 1-й (Р = 0,0003), так і у 2-й (Р = 0,008) групі, проте тільки в 1-й групі цей процес характеризувався достовірною лінійною залежністю (R2 = 0,75). Тривале застосування ББ запобігало прогресуванню дилатації ЛШ та ПШ після IМ, особливо у хворих на ХОЗЛ. Більше того, застосування ББ упродовж 5 років також стримувало зменшення товщини стінок міокарда, переважно міжшлуночкової перегородки, у хворих 1-ї (Р = 0,032) та 2-ї груп (Р = 0,033), у той же час у контролі спостерігали зменшення ТМШП (R2 = 0,74) та частково — ТЗС ЛШ (R2 = 0,62). Упродовж 5 років при супутньому ХОЗЛ ФВ ЛШ знизилася з 45,7 ± 1,1 % до 41,8 ± 1,4 % (Р = 0,03), у контролі — із 44,6 ± 1,2 % до 41,1 ± 1,9 % (Р = 0,07). Зниження сумарної скоротливої здатності ЛШ супроводжувалося підвищенням тиску в малому колі кровообігу з 28,4 ± 1,8 мм рт.ст. до 33,0 ± 3,7 мм рт.ст., що не виключало розвитку початкових ознак серцевої недостатності. Хоча, з іншого боку, помірне підвищення середнього тиску в легеневій артерії може бути виявом механізмів компенсації, спрямованих на обмеження кровотоку в гіповентильованих ділянках, що спричинене супутнім ХОЗЛ. Під впливом терапії із включенням ББ поліпшувалася діастолічна функція ЛШ, свідченням чого стало зменшення в динаміці частки RFP- та РNР-типів діастолічної дисфункції відповідно з 10,2 та 34,3 % до 7,4 та 29,0 % за рахунок формування найменш несприятливого АRР-типу у 60 % пацієнтів. Кількість осіб із нормальною діастолічною функцією ЛШ збільшилася з 2 до 4 %. Підтвердженням ефективності терапії ББ є дані про виживання хворих: померли 15 % осіб, які приймали ББ, і 29 % із групи контролю.
Застосування АК у комплексній терапії IМ у хворих на супутнє ХОЗЛ порівняно із ББ запобігало патологічному ремоделюванню ЛП (Р = 0,027). Аналогічні процеси зафіксовані при динамічному спостереженні за розмірами лівого і правого шлуночків порівняно з їх дилатацією в контрольних групах, що характеризувалася лінійною моделлю: відповідно для ЛШ R2 = 0,72, для ПШ — R2 = 0,70. На відміну від впливу ББ у хворих на ХОЗЛ АК не тільки запобігали зменшенню товщини стінок міокарда, а навіть сприяли розвитку компенсаторної гіпертрофії, особливо задньої стінки ЛШ (R2 = 0,86), а ФВ і тиск у легеневій артерії достовірно не змінилися у динаміці спостереження. З групи комплексної терапії з включенням АК померли 18,2 % пацієнтів у середньому через 33 ± 2 міс. після IМ, у контрольній — 29,3 % через 26 ± 4 міс.
З огляду на дані багатофакторного регресійного аналізу та виживання хворих наІМ із супутнім ХОЗЛ у процесі реалізації диференційованих заходів тривалої вторинної профілактики [1] ми визначили головні чинники несприятливого віддаленого прогнозу, за якими розраховано математичну формулу для диференційованого застосування ББ та АК, створенокомп’ютерну програму оптимізації методик тривалого лікування на підставі авторської концепції щодо корекції післяінфарктного ремоделювання серця в умовах хронічної бронхіальної обструкції [6], а також розроблені практичні рекомендації [3].
Висновки
1. Установлена залежність процесів післяінфарктного ремоделювання серця від локалізації ІМ, наявності супутніх ХОЗЛ та АГ. Наявність останньої впливала переважно на процеси ремоделювання лівих камер серця, ПШ та стінок міокарда у хворих з ІМ передньої локалізації і характеризувалася переважною дилатацією ЛП та порушеннями діастолічної функції міокарда. ХОЗЛ справляло більший вплив на ремоделювання серця у хворих з ІМ нижньої локалізації, що виявлялося переважною дилатацією шлуночків, зменшенням маси міокарда і зниженням ФВ. Поєднання ХОЗЛ з АГ, навпаки, супроводжувалося збереженням товщини стінок або навіть розвитком компенсаторної гіпертрофії інтактних кардіоміоцитів із збільшенням ІММ, що забезпечувало кращі умови для функціонування гемодинаміки в процесі формування післяінфарктного серця та певною мірою стримувало негативні тенденції ремоделювання серця на фоні супутнього ХОЗЛ.
2. Комплексна терапія із диференційованим включенням селективного b-адреноблокатора (бісопролол/бетаксолол) або антагоніста кальцію (дилтіазем) у хворих з ІМ та супутнім ХОЗЛ зменшує прояви патологічного ремоделювання серця, характеризується позитивною дією при тривалому лікуванні і спостереженні понад 5 років.
3. Диференційований підхід до вибору програми тривалої медикаментозної корекції післяінфарктного ремоделювання серця базується на застосуванні авторської формули регресійної прогностичної моделі, що дозволило знизити летальність, покращити виживання хворих при мікст-патології.