Международный эндокринологический журнал 7 (39) 2011
Вернуться к номеру
Сахарный диабет 1-го типа и латентный аутоиммунный диабет взрослых (LADA): клинические, иммуногенетические и гормонально-метаболические аспекты
Авторы: Никонова Т.В., ФГУ «Эндокринологический научный центр» Минздравсоцразвития РФ
Рубрики: Эндокринология
Версия для печати
Введение
По определению экспертов Всемирной организации здравоохранения, сахарный диабет (СД) является проблемой всех возрастов и всех стран. В связи с ранней инвалидизацией и высокой смертностью больных решение многих вопросов, связанных с этим заболеванием, поставлено во многих странах мира на государственный, федеральный уровень.
Сахарный диабет 1-го типа (СД1) составляет 10 % всех случаев диабета. Он ассоциирован как с хроническими осложнениями, так и с острыми, угрожающими жизни состояниями, такими как кетоацидоз и гипогликемия. В клинической практике диагностика различных типов сахарного диабета основывается на клинических характеристиках и в типичных случаях не вызывает трудностей. В последние годы появились формы СД, которые не отвечают критериям принятой традиционной классификации. Одним из вариантов течения аутоиммунного СД является медленно прогрессирующий аутоиммунный диабет взрослых — latent autoimmune diabetes in adults (LADA) (Zimmet P.Z., 1995). Он характеризуется клинической картиной, не типичной для классического СД1; несмотря на наличие аутоантител, аутоиммунная деструкция развивается медленно, что не сразу приводит к развитию потребности в инсулине. Данная форма СД занимает промежуточное положение между СД1 и СД2 и в последней классификации не выделяется в отдельную номенклатурную единицу. Наличие в дебюте заболевания клинической картины СД2 затрудняет диагностику и своевременное начало инсулинотерапии у пациентов с LADA. В связи с этим разработка дифференциально-диагностических критериев LADA имеет большое практическое значение.
СД1 является полигенным многофакторным заболеванием, то есть проявление болезни определяется взаимодействием средовых и генетических факторов. Наибольшее значение из известных генетических маркеров СД1 имеют гены, расположенные в области главного комплекса гистосовместимости человека (HLA) на хромосоме 6р21.3 (IDDM1) (Davies J.L., 1994). В последние годы, в том числе и на основе полных геномных по- исков, обнаружена ассоциация с СД1 ряда новых локусов. Вторым по значимости генетическим фактором, определяющим предрасположенность к СД1, является локус IDDM2, расположенный на хромосоме 11 и отождествляемый с геном инсулина (INS) (Bennett S.T., 1995). В различных популяциях IDDM2 определяет от 5 до 15 % семейного риска развития СД1. В качестве 3-го локуса предрасположенности к СД1 в настоящее время рассматривается аллельный вариант гена, кодирующего лимфоидную тирозинфосфатазу, — ген PTPN-22, отвечающий за супрессию Т-клеточной активации (Bottini N., 2004; Smyth D., 2004).
Как и классический СД1, LADA связан с потерей иммунологической толерантности к собственным антигенам и характеризуется селективным разрушением b-клеток панкреатических островков СD8+ (цитотоксическими) и СD4+ (эффекторными) лимфоцитами. В настоящее время основной группой лимфоидных клеток, отвечающих за поддержание аутотолерантности, считают пул СD4+ лимфоцитов, экспрессирующих СD25 маркерную молекулу — a-цепь рецептора IL-2 (IL-2R) [1]. Субпопуляцию CD4+CD25+ называют Т-регуляторными клетками (Treg). Treg стремятся ликвидировать активный ответ Т-клеток и предотвратить развитие аутоиммунных реакций, регулируя распространение популяции Т-клеток и их дифференциацию, а также функцию эффекторных Т-клеток [2]. Функциональные свойства Treg опосредованы активностью Fox P3 (forkhead box) — фактора транскрипции, непосредственно и косвенно регулирующего экспрессию более 300 генов. Супрессивная активность Treg непосредственно зависит от интенсивности экспрессии Fox P3. Снижение количества или супрессивной активности этих клеток может способствовать потере аутотолерантности к антигенам b-клеток и развитию аутоиммунного процесса. В литературе приводятся достаточно противоречивые данные по характеру изменений количественных и функциональных показателей этих клеток при различных заболеваниях, в том числе при СД1. При LADA количественная и функциональная активность Тreg как центральных регуляторов иммунного ответа и главных носителей феномена иммунологической толерантности до сих пор остаются не изученными.
При СД1 одной из причин развития аутоиммунитета является нарушение процесса элиминации аутореактивных иммунных лимфоидных клеток. В норме клоны аутореактивных клеток подвергаются апоптозу [3, 4]. Система Fas-FasL является наиболее изученной системой активации апоптоза. Взаимодействие поверх- ностных маркерных молекул СD95(Fas) с лигандом СD95L(FasL) запускает процесс клеточной гибели. Таким образом, уровень экспрессии CD 95 на поверхности клетки определяет ее готовность к вступлению в апоптоз. Однако маркеры апоптоза лимфоцитов у пациентов с LADA недостаточно изучены.
При СД1 важнейшую роль играет секреторная активность b-клеток, так как именно снижение секреции инсулина приводит к его абсолютному дефициту в крови. Между тем определение содержания инсулина в периферической крови неточно отражает эндогенную секрецию инсулина. Инсулин и С-пептид секретируются поджелудочной железой в эквимолярных количествах, но 50 % или более инсулина расщепляется при первом же прохождении через печень. Именно поэтому в большинстве исследований о секреции инсулина судят по концентрации С-пептида, измеренной после продолжительного голодания (более 10 часов) и на фоне стимуляции (GST, ОGТТ, ММТT). В настоящее время в международных исследованиях в качестве золотого стандарта для оценки секреторной функции b-клеток принято использовать ММТТ с количественным определением концентрации С-пептида в крови. Использование стандартного количества смешанной пищи считают более физиологичным стимулятором секреции инсулина, чем внутривенное введение глюкагона и пероральный прием раствора глюкозы. До настоящего времени остаются практически неизученными вопросы сравнительного изменения секреторной активности b-клеток при СД1 и LADA.
Цель исследования: изучить гетерогенность сахарного диабета 1-го типа, варианты дебюта и прогрессирования заболевания на основании клинических, гормонально-метаболических и иммуногенетических особенностей.
Материалы и методы исследования
Клиническая характеристика больных
В исследование были включены 684 человека (382 мужчины, 302 женщины), которые были разделены на 3 основные и 2 контрольные группы.
3 основные группы:
— 1-я группа — 387 пациентов (223 мужчины (57,6 %), 164 женщины (42,4 %)) с «классическим» дебютом СД1; с различной длительностью заболевания;
— 2-я группа — 143 пациента (97 мужчин (68,5 %), 46 женщин (31,5 %)) с медленно прогрессирующим аутоиммунным диабетом взрослых (LADA), с различной длительностью заболевания;
— 3-я группа — 33 человека (10 мужчин (30,3 %), 23 женщины (69,6 %)) с положительными аутоантителами, ассоциированными с развитием СД1 (GADA, IA-2A, ICA, IAA) (случайная выборка), группа была условно названа группой риска.
В качестве контроля были обследованы 2 группы (56 человек — контрольная группа здоровых лиц, 65 человек — контрольная группа пациентов с СД2).
Диагноз СД устанавливался на основании клинической картины и данных лабораторного обследования в соответствии с критериями Всемирной организации здравоохранения (World Health Organization, 1999). «Классический» вариант СД1 диагностировался при наличии выраженной клинической картины (полидипсия, полиурия, значительная потеря массы тела), кетонурии, значений С-пептида ниже порогового уровня. Диагноз LADA, согласно критериям P. Zimmet, ставился пациентам с дебютом заболевания в возрасте старше 30 лет, постепенным началом, положительными аутоантителами к аутоантигенам b-клетки и/или инсулину, отсутствием кетонурии, нормальными значениями базальной концентрации С-пептида в сыворотке крови. Во 2-ю группу (LADA) были включены 117 пациентов с первичным диагнозом СД2 (что составило 82,8 % от всей группы), с положительными титрами аутоантител, ассоциированных с СД, получавших в течение не менее чем 6 мес. сахароснижающие пероральные препараты в качестве монотерапии или в комбинации без значимого клинического эффекта, и 25 пациентов, которым был сразу поставлен диагноз LADA.
Критериями исключения из исследования были вакцинация и прием иммуномодулирующих препаратов в течение предшествующего года и наличие других аутоиммунных заболеваний (тиреоидит, астма и др.) при первичном обследовании.
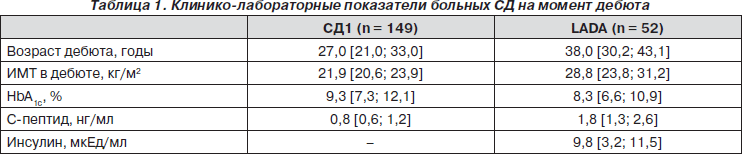
Основные клинико-лабораторные показатели обследуемых больных СД основных групп на момент дебюта представлены в табл. 1.
В третью группу (группу риска развития СД1) вошли лица с положительными результатами повторного определения аутоантител, ассоциированных с развитием СД1 (GADA, IA-2A, ICA, IAA). Обследуемые были в возрасте 28,5 года [21,5; 35,5], с индексом массы тела (ИМТ) 26,03 кг/м2 [22,77; 30,15], HbA1c 5,6 % [5,4; 5,7], базальным уровнем C-пептида в крови 1,7 нг/мл [1,2; 4,1], инсулина — 7,2 мкЕд/мл [5,4; 8,6]. У 3 человек из группы риска родственники первой степени родства болели СД1.
Первую контрольную группу составили 56 практически здоровых лиц (30 мужчин и 26 женщин) в возрасте 34 года [24; 53], ИМТ составил 21,34 кг/м2 [18,90; 30,67], масса тела составила 61,0 кг [51,0; 95,0], HbA1c 5,4 % [4,8; 5,5], базальный уровень C-пептида в крови — 2,3 нг/мл [1,5; 4,5], инсулина — 7,3 мкЕд/мл [4,2; 9,2].
Критериями включения в контрольную группу были: отсутствие нарушений углеводного обмена и аутоантител к антигенам b-клетки (GADA, IA-2A, ICA, IAA).
Вторую контрольную группу составили 65 больных СД2 (22 мужчины и 43 женщины) в возрасте 44,0 года [39,5; 51,0], ИМТ пациентов составил 30,68 кг/м2 [25,95; 35,08], масса тела — 95,0 кг [77,0; 106,0], базальный уровень C-пептида в крови — 3,1 нг/мл [1,8; 4,0], инсулина — 17,9 мкЕд/мл [7,2; 22,0].
Для определения диапазона нормальных показателей интенсивности экспрессии гена FOXP3 было обследовано 85 здоровых доноров.
Для исследования ассоциации полиморфных маркеров генов-кандидатов с СД1 использовался подход «случай — контроль». Контрольная группа (206 чел.) представляла собой случайную выборку. Выборки были этнически однородны, составлены из русских (на основании паспорт-ных данных), проживающих в г. Москве и не являющихся родственниками. В нашей работе распределение частот генотипов всех полиморфных маркеров исследуемых генов в группе здоровых индивидов соответствовало распределению Харди — Вайнберга, существенных отличий от частот аллелей и генотипов в европейских популяциях обнаружено не было (данные о частотах в европейской популяции взяты из проекта HapMap, http:// hapmap.org).
Иммуногенетическое обследование
Количественное определение ICA, GADA, IAA и IA-2A в сыворотке крови осуществляли методом иммуноферментного анализа с использованием наборов Isletest-ICA, GADA, IAA (Biomerica, Германия) и Medizym (Medipan GMBH, Германия).
Определение экспрессии поверхностных молекул на лимфоцитах периферической крови проводили на проточном цитометре FACSCalibur по стандартной методике с использованием моноклональных антител (одинарной и двойной меткой) к CD3, CD4, CD8, CD16, CD20, CD25, CD38, CD45, HLA-DR (Becton Dickinson, США) и CD95, CD95L (Immunotech, Франция). При этом оценивали процентное содержание субпопуляций лимфоидных клеток, экспрессию дифференцировочных антигенов и абсолютное количество указанных субпопуляций лимфоидных клеток.
Выделение ДНК из лейкоцитов периферической крови проводили с помощью наборов пробоподготовки DNA prep. В настоящей работе ДНК-типирование выполнялось методом мультипраймерной полимеразной цепной реакции по аллельным вариантам трех генов HLA класса II: DRB1 (14 специфичностей), DQA1 (8 аллелей) и DQB1 (13 аллелей). Для определения полиморфных аллелей данных генов применялись коммерческие наборы производства ЗАО «НПФ ДНК-Технология» (Россия). Полимеразная цепная реакция (ПЦР) проводилась согласно регламенту, указанному производителем. Амплификацию проводили на амплификаторе «Терцик» (Россия). Гаплотипы составлялись на основе известных таблиц сцепления.
Амплификацию полиморфного микросателлитного маркера R620W гена PTPN 22 и полиморфного участка 23НрhI гена инсулина проводили с помощью ПЦР в режиме реального времени (ПЦР-РВ) на термоциклере Dyad (Bio-Rad) Обозначения полиморфных маркеров даны в соответствии с базой данных dbSNP (http://www.ncbi.nlm.nih.gov/snp/). Анализ генотипов полиморфных маркеров ряда генов проводили методом детекции флуоресценции «по конечной точке» на термоциклере ABI 7500 Fast (Applied Biosystems) с помощью встроенных средств программного обеспечения SDS версии 1.4.
Для определения интенсивности экспрессии гена Fox P3 проводилось выделение тотальной РНК из образцов крови данных групп пациентов при помощи набора для выделения РНК Yellow Solve (Клоноген, Санкт-Петербург). Концентрацию выделенной РНК определяли спектрофотометрически при помощи NanoDrop ND-1000 UV/VIS NanoDrop Technologies USA. Обратную транскрипцию проводили с использованием в качестве затравки случайных гексамеров и набора для обратной транскрипции ImProm — IIIM Reverse Transcription (Promega, CША).
Количественное определение экспрессии генов осуществляли с использованием полимеразной цепной реакции в реальном времени на приборе Step One Plus фирмы Applied Biosystems (США). Каждое измерение проводили трехкратно. Для проведения ПЦР-РВ были синтезированы праймеры и отработаны оптимальные условия амплификации. В качестве эндогенного конт-роля использовали ген GAPDH.
Биохимическое обследование
Содержание уровня HbA1c определяли методом высокоэффективной жидкостной хроматографии высокого давления (HPLC) на аппарате D-10 (Bio-Rad, Франция) по стандартной методике производителя.
Определение концентрации С-пептида и инсулина проводили иммунохемолюминесцентным методом на аппарате Elecsys 2010 (Roche, Германия).
Для оценки функциональной возможности b-клеток был проведен тест ММТТ (mixed meal tolerance test) с приемом стандартного количества жидкой смешанной пищи (Ensure Plus). Определение базальной секреции происходило путем измерения концентрации С-пептида после длительного голодания (в течение 10 часов); определение выраженности секреторного ответа проводилось путем определения концентрации С-пептида через 30, 60, 90, 120, 180 минут в ходе ММТТ. Оценивался суммарный секреторный ответ в виде площади под кривой значений концентрации С-пептида. Для характеристики общей функциональной активности b-клеток использовался относительный показатель — HOMA-F-индекс.
HOMA (homeostasis model assessment) — эмпирическая, математически обработанная модель, предназначенная для характеристики общей функциональной активности b-клеток и инсулинорезистентности на основании только базальных показателей глюкозы плазмы и инсулина, что доступно для выполнения и широко используется в исследованиях. Условно в норме функция b-клеток составляет 100 %. Общая функциональная активность b-клеток = 20 ИРИ0 (мкЕд/мл) / (ГПН (ммоль/л) — 3,5). HOMA-IR-индекс — относительный параметр, характеризующий общую периферическую инсулинорезистентность. Индекс инсулинорезистент-ности = ИРИ0 (мкЕд/мл) ГПН (ммоль/л) / 22,5. По HOMA-модели условно инсулинорезистентность у здорового человека соответствует 1 баллу.
Статистическая обработка полученных данных была проведена с использованием пакета прикладных программ Statistica (StatSoft Inc. США, версия 6.0) [26]. Для анализа вида распределений применялись критерии Шапиро — Уилка и Лиллиефорса, дисперсии распределений признаков оценивались с помощью F-критерия в процедуре дисперсионного анализа ANOVA. Сравнение групп по количественным признакам осуществлялось непараметрическим методом с использованием U-критерия Манна — Уитни. Сравнение групп по качественным признакам осуществлялось непараметрическим методом путем анализа таблиц сопряженности с использованием двухстороннего точного критерия Фишера для несвязанных групп и критерия МакНемара для связанных групп. Статистически значимыми считали различия при p < 0,05. Анализ связи (корреляции) двух количественных признаков осуществлялся непараметрическим методом ранговой корреляции по Спирмену. Для сравнения частот аллелей и генотипов исследуемых полиморфных маркеров в группах с наличием и отсутствием заболевания нами использовался критерий c2. Значимыми считали различия при p < 0,05.
Результаты исследований, обработанные статистически и представленные в виде таблиц или диаграмм, дают возможность судить о динамике медианы параметра, достоверности и интерквартильном отрезке, а также связи с изменениями других параметров в соответствии с современными требованиями.
Результаты исследования и их обсуждение
С учетом аутоиммунного характера СД и выраженной генетической ассоциации заболевания с генами (DRB1, DQA1, DQB1) локуса HLA класса II нами был определен ряд генетических и иммунологических характеристик при СД1 и LADA.
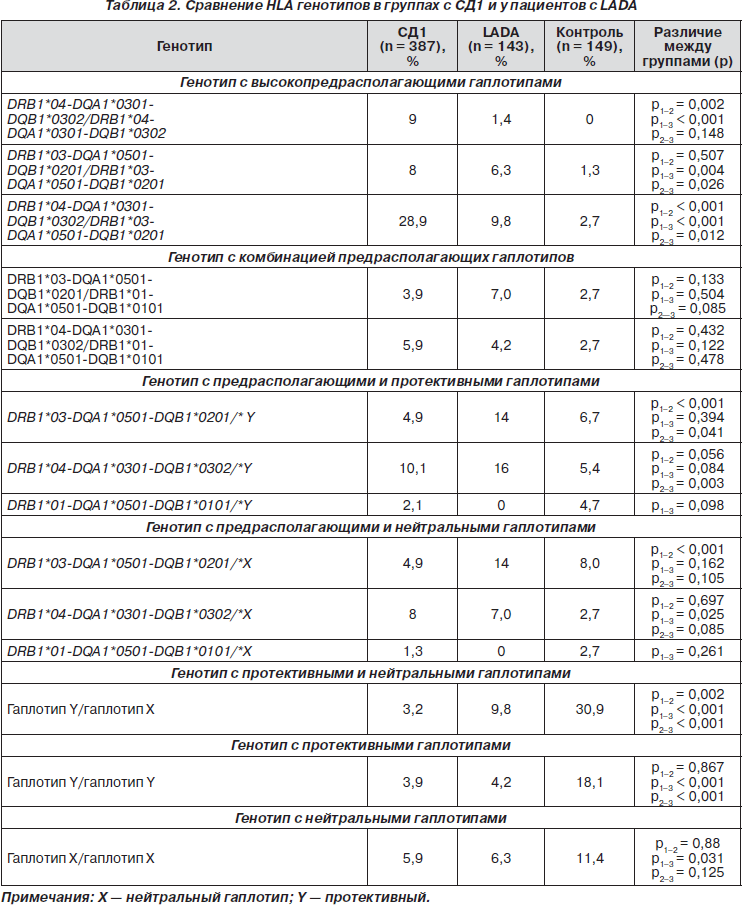
HLA-генотипирование было проведено всем обследуемым в трех основных группах. Контрольная группа (149 чел.) представляла собой случайную выборку. Выборка была этнически однородна, составлена из русских (на основании паспортных данных), проживающих в г. Москве и не являющихся родственниками. Анализировали частоту встречаемости различных генотипов и комбинаций гаплотипов в генотипе HLA у пациентов с СД1 и LADA (табл. 2).
При сравнительном анализе генотипов HLA класса II наблюдаются выраженные отличия по частоте встречаемости как высокопредрасполагающих, так и протективных генотипов и гаплотипов.
В группе пациентов с СД1 частота генотипов с двумя предрасполагающими гаплотипами значительно выше (55,7 %), чем с одним предрасполагающим гаплотипом в сочетании с протективным или нейтральным (31,3 %). Напротив, в группе пациентов с LADA, в отличие от СД1, частота генотипов с двумя предрасполагающими гаплотипами значительно ниже (28,7 %) (р < 0,001), чем с одним предрасполагающим гаплотипом в сочетании с протективным или нейтральным (51,0 %) (р < 0,001). В контрольной группе преобладали генотипы с комбинацией протективных и нейтральных гаплотипов, частота генотипов с двумя предрасполагающими гаплотипами была статистически значимо ниже по сравнению с СД1 и LADA. Таким образом, подтверждена ассоциация HLA класса II с развитием как LADA, так и СД1. Вероятно, именно наличие только одного предрасполагающего гаплотипа в сочетании с протективным или нейтральным в генотипе больных LADA обусловливает менее агрессивное течение заболевания и может являться одной из характеристик LADA при генотипировании HLA класса II.
При HLA-типировании в группе риска развития СД1 были получены результаты преобладания частоты встречаемости протективных и нейтральных гаплотипов и генотипов по сравнению с классическими предрасполагающими. Поскольку исследование было проведено на малой выборке, полученные данные требуют дальнейшего анализа.
Область предрасположенности IDDM2 содержит собственно ген INS и полиморфный мини-сателлит, расположенный в 5’-концевой части этого гена, который обычно называют 5’-VNTR. Он состоит из тандемно повторяющихся единиц размером 14–15 п.н. Генетический риск объясняется разным числом повторов мини-сателлитного маркера VNTR. В зависимости от их числа аллели VNTR подразделяют на 3 класса. Аллели класса I содержат от 26 до 63 повторяющихся единиц, тогда как аллели класса III включают от 141 до 209 звеньев. Промежуточный по длине класс II редко встречается у европеоидов и состоит из аллелей, содержащих около 80 тандемных повторов. Короткие формы варьирующего количества тандемных повторов в промоторной области (мини-сателлитный участок локуса) гена инсулина ассоциировались с «диабетической» предрасположенностью, в то время как длинные формы были связаны с протекторной функцией кандидатного гена. Показана способность аллелей VNTR модулировать экспрессию инсулина в тимусе. Накоплено достаточно данных о корреляции между аллелями 5’-VNTR гена INS, уровнем синтеза мРНК проинсулина и секрецией продукта этого гена в клетках поджелудочной железы и тимуса. У носителей аллелей класса I уровень мРНК проинсулина в клетках поджелудочной железы в 1,5–2 раза выше, чем у носителей аллелей класса III. Противоположная ситуация наблюдается в клетках тимуса. У носителей аллелей класса III уровень мРНК проинсулина в 2–3 раза выше, чем у носителей аллелей класса I. Предполагается, что более высокие уровни экспрессии гена INS в тимусе способствуют развитию центральной толерантности, что может объяснять защитную роль этого некодирующего полиморфного маркера. Во многих исследованиях для идентификации аллелей VNTR использовался сцепленный с ним полиморфный маркер 23HphI (rs689) гена INS. Для русской популяции подобное исследование показало высокий уровень ассоциации этого полиморфного маркера с СД1. В настоящем исследовании изучалась ассоциация полиморфного маркера 23HphI (находится в неравновесии по сцеплению с VNTR-повтором) гена INS у пациентов с заболеванием LADA в сравнении с «классическим» СД1 с использованием подхода «случай — контроль».
Сравнительный анализ распределения частот аллелей и генотипов полиморфного маркера 23HphI гена INS в группе с СД1 и контрольной группе, а также в группе с LADA и контрольной группе показал наличие достоверных отличий. Достоверное увеличение частоты аллеля А в группе больных СД1 и LADA говорит об ассоциации аллеля А и генотипа АА с повышенным риском развития как СД1, так и LADA. В то же время установлена ассоциация аллеля Т и генотипа ТТ с пониженным риском развития СД1 и LADA. Достоверной разницы исследуемого распределения между LADA и СД1 обнаружено не было. Таким образом, полиморфный маркер 23HphI гена INS достоверно ассоциирован как с СД1, так и с LADA.
Ген PTPN22, расположенный в хромосомной области 1p13.3-p13.1, входит в число наиболее значимых генов, предрасполагающих не только к СД типа 1, но и к ревматоидному артриту, системной красной волчанке и ряду других аутоиммунных заболеваний (Lee et al., 2007; Gregersen et al., 2006; Criswell et al., 2005). Тирозиновая фосфатаза лимфоидных клеток (LYP), которая кодируется геном PTPN22, — внутриклеточный белок, специфичный для клеток иммунной системы. Тирозиновые фосфатазы Т-лимфоцитов осуществляют дефосфорилирование соответствующих белков, передающих сигнал от антигенных рецепторов Т-клеток и рецепторов цитокинов. В 2004 г. обнаружена ассоциация полиморфного маркера C1858T гена PTPN22 с СД типа 1 (Bottini N. et al., 2004). Однонуклеотидному полиморфизму C1858T соответствует аминокислотный полиморфизм R/W в положении 620 аминокислотной последовательности тирозиновой фосфатазы Т-лимфоцитов (R620W). Так как вклад полиморфного маркера C1858T гена PTPN22 в формирование предрасположенности к СД1 подтвердился в нескольких геномных анализах с использованием микрочипов высокой плотности (Todd et al., 2007; Cooper et al., 2008), мы изучили ассоциацию этого полиморфного маркера с заболеванием LADA в сравнении с СД1.
При сравнительном анализе распределения частот аллелей и генотипов полиморфного маркера R620W гена PTPN22 в группах с СД1 и контрольной группой, а также в группе LADA и СД1 получены достоверные отличия, в то время как между группой LADA и контрольной группой достоверной разницы обнаружено не было. Достоверное увеличение частоты аллели Т (ОR = 1,7, p = 0,01) и генотипа СТ (ОR = 1,7, p = 0,04) в группе больных СД1 говорит об их ассоциации с повышенным риском развития данной патологии. В то же время была установлена ассоциация аллели С (ОR = 0,59, p = 0,01) и генотипа СС (ОR = 0,55, p = 0,04) с пониженным риском развития СД1. Таким образом, обнаружена ассоциация данного полиморфного маркера R620W гена PTPN22 с развитием СД1, однако ассоциации с развитием LADA в нашей выборке не установлено. Поскольку исследование было проведено на малой выборке больных, полученные данные требуют дальнейшего анализа.
Исследование субпопуляционного состава лимфоцитов, естественных регуляторных Т-клеток и их молекулярного маркера — гена FOXP3
Исследование субпопуляционного состава лимфоцитов, естественных регуляторных Т-клеток и их молекулярного маркера — гена FOXP3 проводилось в выборке из 116 больных (67 мужчин, 49 женщин) СД1, выборке из 74 больных LADA (51 мужчина, 23 женщины), а также в исследуемой группе риска развития СД1 в сравнении с контрольной группой здоровых лиц.
Больные СД1 были разделены на подгруппы в зависимости от длительности заболевания: первые 6 мес. заболевания — 21 человек, 6–12 мес. — 38 человек, со стажем СД от 1 года до 5 лет — 16, от 5 до 10 лет — 15, свыше 10 лет — 26.
Больные LADA были разделены на подгруппы в зависимости от длительности заболевания: первые 6 мес. заболевания — 14 человек, 6–12 мес. — 20 человек, со стажем СД от 1 года до 5 лет — 26, от 5 до 10 лет — 14. Пациенты со стажем заболевания свыше 10 лет в данную выборку не вошли в связи с малочисленностью.
В группе больных с СД1, как с впервые выявленным, так и при продолжительном течении заболевания, количество регуляторных Т-лимфоцитов не отличалось от такового в группе контроля (p > 0,05).
Однако их функциональная активность (интенсивность экспрессии гена FOXP3) была достоверно ниже, чем в контроле. Низкая интенсивность экспрессии гена FOXP3 в сравнении с контролем отмечалась при любой продолжительности заболевания.
Изменение экспрессии гена FOXP3 у пациентов с LADA носило волнообразный характер, что не наблюдалось у пациентов с СД1. Начало заболевания характеризовалось показателями экспрессии, не отличающимися от контрольных значений, при этом наблюдалось достоверное повышение относительного количества CD4+25+high-Т-лимфоцитов.
Снижение экспрессии гена FOXP3 при диабете LADA в отличие от СД1 наблюдается через 6–12 месяцев от начала заболевания, при этом количество CD4+25+high-Т-лимфоцитов нормализуется и при дальнейшем течении заболевания не отличается от контрольных значений. В период от года до пяти лет вновь наблюдается нормализация экспрессии гена FOXP3, при длительности болезни более пяти лет — достоверное снижение.
Нарастание процентного содержания Тreg в период до 6 мес. может отражать их регулирующую роль на подавление активности аутоиммунитета. Возможно, увеличение численности Тreg компенсирует их функциональный дефицит. Таким образом, при заболевании LADA функциональный дефицит Тreg возникает отсрочено, что, очевидно, обусловливает медленное прогрессирование аутоиммунной деструкции b-клеток. Прогрессирование индуцированной аутоиммунной реакции при длительности заболевания от года до пяти лет по неизвестным пока причинам замедляется, несмотря на наличие антител. Возможно, индукция аутоиммунного процесса происходит на фоне имеющейся периферической инсулинорезистентности, характерной для больных LADA.
Низкая интенсивность экспрессии гена FOXP3 (несмотря на отсутствие существенной разницы в содержании Тreg в крови) в сравнении с контролем при любой продолжительности СД1 говорит о дефекте иммунологической толерантности и дефекте подавления аутоиммунного ответа при любом сроке заболевания.
В группе риска развития СД1 отмечена тенденция повышения относительного количества CD25+ и CD4+CD25+high-клеток по сравнению с контролем (p > 0,05) и достоверное снижение экспрессии гена FOXP3 (0,49rq [0,24; 0,81] (p < 0,05). Результаты, полученные в группе риска развития СД1, могут свидетельствовать о постепенно снижающейся способности Тreg подавлять Т-клеточную пролиферацию. Можно предположить, что у пациентов этой группы для компенсации функционального дефицита Тreg возникает увеличение их численности, которое, однако, нельзя рассматривать как показатель роста активности этих клеток.
Исследование маркеров апоптоза
Исследование маркеров апоптоза проведено в той же выборке пациентов, что и исследование регуляторных Т-лимфоцитов и экспрессии гена FOXP3.
Были определены уровни экспрессии CD95 и CD95L на поверхности периферических лимфоцитов и концентрация их растворимых форм в сыворотке крови. В дебюте СД1 отмечено достоверное снижение экспрессии CD95 лимфоцитами по сравнению с контрольной группой — 27 и 33 % соответственно (p < 0,01). У пациентов с LADA этот показатель составил 31 % и при попарном сравнении достоверно не отличался от 1-й группы и контрольной (p > 0,05).
Более высокий уровень экспрессии CD95L на лимфоцитах периферической крови был выявлен у пациентов с СД1 (3,1 %), чем у пациентов с LADA (1,6 %) и практически здоровых лиц (1,9 %). Однако различия между группами оказались статистически недостоверны (р1–2 = 0,19, p1-к = 0,9, p2-к = 0,27).
Нами отмечено изменение уровня экспрессии маркерных молекул апоптоза (CD95, CD95L) на лимфоцитах периферической крови в разные сроки заболевания. Количество лимфоидных клеток, экспрессирующих CD95 на поверхности, увеличилось при длительности заболевания до 6 мес. и составило 27 %, через 6–12 мес. — 32 %, а через 1–5 лет — 33 % (p = 0,04). При парном сравнении показателей были также получены статистически достоверные различия: до 6 мес. vs 6–12 мес. p < 0,05; до 6 мес. vs 1–5 лет p < 0,01.
При дальнейшем развитии заболевания достоверных изменений экспрессии маркерной молекулы апоптоза CD95 отмечено не было.
Количество CD95L+-лимфоцитов в течение первого года наблюдения, наоборот, снизилось с 3,1 до 2,2 %, однако различия оказались статистически не достоверны (р = 0,81). Дальнейшее изменение количества CD95L+-лимфоцитов при прогрессировании заболевания оказалось также статистически недостоверным (р = 0,7).
В отличие от пациентов с СД1 при сравнительном анализе уровня экспрессии маркерных молекул апоптоза на лимфоцитах в группе пациентов с LADA мы не отметили отличий ни одного из показателей в течение первого года. Корреляционных связей между маркерами апоптоза у пациентов с LADA также выявлено не было.
Показатели экспрессии CD95L на лимфоцитах в течение первого года у пациентов с LADA были сопоставимы с контролем и не различались между собой (p > 0,05). Уровень экспрессии CD95 на лимфоцитах у пациентов с LADA во всех группах был сопоставим с контролем.
Снижение экспрессии CD95 на клетках может свидетельствовать о резистентности лимфоцитов к апоптозу и способствовать пролонгации иммунного ответа.
Исследование показателей функции b-клеток натощак, общей функциональной активности b-клеток и периферической инсулинорезистентности
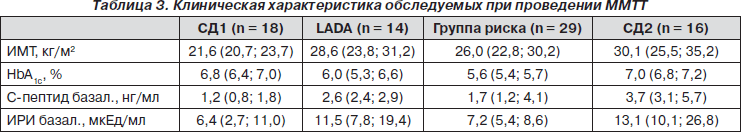
В рамках данной работы были проанализированы показатели функции b-клеток натощак, общая функциональная активность b-клеток и периферическая инсулинорезистентность у больных LADA, СД1, СД2, группы риска в сравнении с контрольной группой практически здоровых лиц по данным базального уровня ИРИ и С-пептида, а также по данным HOMA. У пациентов с впервые выявленным СД1 (n = 28), LADA (n = 23) и СД2 (n = 31) до назначения терапии была взята кровь для определения ИРИ и С-пептида. Был произведен расчет функции b-клеток и инсулинорезистентности периферических тканей с использованием HOMA-модели.
В группе больных LADA средние показатели инсулина и С-пептида были достоверно ниже, чем у больных СД 2-го типа (9,8 [3,2; 11,5] и 17,9 [7,2; 22,0] мкЕд/мл; 1,8 [1,6; 2,6] и 3,1 [1,8; 4,0] нг/мл, p < 0,05), но выше, чем у больных СД1 (0,7 [0,5; 1,2] нг/мл), p < 0,05). При оценке функции b-клеток и инсулинорезистентности периферических тканей с использованием HOMA-модели также были получены достоверные различия между группами. Показатели функции b-клеток и инсулинорезистентности при LADA были достоверно ниже, чем при СД2.
Таким образом, дебют LADA происходит как на фоне сниженной функциональной активности b-клеток (HOMA-F — 39,2 %, в контрольной группе — 96 %) (р < 0,05), так и на фоне инсулинорезистентности (HOMA-IR — 3,7, в контрольной группе — 1,6) (р < 0,05). При этом начало СД2 характеризуется как большим показателем функциональной активности b-клеток (HOMA-F — 66,3 %), так и большим показателем периферической инсулинорезистент- ности (HOMA-IR — 7,1) (р < 0,05). Вероятно, инсулинорезистентность является фактором риска при иммуноопосредованной деструкции b-клеток. Высокие потребности в инсулине у инсулинрезистентных пациентов приводят их к диабету при меньшем повреждении b-клеток (у худых, с хорошей чувствительностью к инсулину должны быть более серьезные повреждения b-клеток для развития клинической манифестации диабета).
Оценка секреторной функции b-клеток в ходе ММТТ в исследуемых группах
В рамках данного исследования был проведен анализ секреторной функции b-клеток в ходе ММТТ в исследуемых группах (табл. 3). Тест проводился в выборке больных на фоне компенсации углеводного обмена. Оценивался суммарный секреторный ответ в виде площади под кривой значений концентраций С-пептида.
Суммарный секреторный ответ у пациентов СД1 и LADA достоверно между собой не различался. При этом было отмечено достоверное отличие этих показателей от суммарного секреторного ответа пациентов в группе с СД2 (p < 0,05). Максимальные пики секреции у пациентов в группах с СД1 и LADA также достоверно между собой не различались, при этом отмечено их достоверное отличие от максимального пика секреции С-пептида у пациентов в группе с СД2. Секреция инсулина в ответ на смешанную пищу у пациентов с СД1 в начале болезни на фоне компенсации в среднем составила 67,7 % от ответа обследованных в контрольной группе, а у пациентов с LADA — 88,1 %. Полученные данные могут свидетельствовать как о значении глюкотоксичности в подавлении секреторной активности b-клеток в дебюте заболевания, так и об эндогенно-регенеративном потенциале b-клеток.
В результате выполненной работы были сформулированы дифференциально-диагностические характеристики аутоиммунного сахарного диабета и СД2. Несмотря на сходство клинической картины LADA в дебюте заболевания с СД2, отмечено достоверное снижение общей функциональной активности b-клеток у пациентов с LADA (до 39%) по сравнению с пациентами с СД2 (до 64 %) (p < 0,05), а также достоверно больший индекс инсулинорезистентности у пациентов с СД2 по сравнению с пациентами с LADA (7,2 и 3,7 балла соответственно) (p < 0,05). Отмечено генетическое сходство СД1 и LADA в контексте ассоциаций с локусами IDDM1 и IDDM2. Подтверждена ассоциация генов HLA класса II с развитием как LADA, так и СД1. При этом наличие в генотипе больных LADA только одного высокопредрасполагающего гаплотипа в комбинации с протективным или нейтральным гаплотипом, вероятно, обусловливает более позднее начало и менее агрессивное течение заболевания. Установлена ассоциация аллели А и генотипа АА полиморфного маркера 23HphI гена INS с повышенным риском развития как СД1, так и LADA, и ассоциация аллели Т и генотипа ТТ с пониженным риском развития СД1 и LADA. Суммарный секреторный ответ у пациентов с СД1 и LADA достоверно между собой не различался. При этом было отмечено достоверное отличие этих показателей от суммарного секреторного ответа пациентов в группе с СД2.
Выводы
1. Гетерогенность клинической картины аутоиммунного СД1 обусловлена значительными различиями гормонально-метаболических и иммуногенетических характеристик пациентов. Особенностью LADА является сочетание СД1 (аутоиммунного процесса) с инсулинорезистентностью, что приводит к манифестации сахарного диабета при меньшем уровне разрушения b-клеток. LADA развивается как на фоне сниженной функциональной активности b-клеток, так и на фоне инсулинорезистентности. Инсулинорезистентность может выступать в роли фактора риска развития иммуно-опосредованной деструкции b-клеток.
2. У пациентов с LADА в генотипе значительно чаще встречается только один из высокопредрасполагающих гаплотипов HLA (DR3-DQ2;DR4-DQ8) в комбинации с протективным или нейтральным гаплотипом, что может определять более позднюю манифестацию заболевания и менее агрессивное течение. Обнаружена ассоциация полиморфного маркера 23HphI (rs689) гена INS с развитием как СД1, так и LADA. Установлено, что носители аллели А данного полиморфного маркера имеют повышенный риск развития как СД1, так и LADA, тогда как носители аллели Т имеют пониженный риск развития как СД1, так и LADA. Ассоциация полиморфного маркера R620W гена PTPN22 с развитием LADA в нашей выборке не выявлена, в то время как при СД1 обнаружена данная ассоциация. Установлено, что носители аллели Т данного полиморфного маркера имеют повышенный риск развития СД1, тогда как носители аллели С имеют пониженный риск развития СД1.
3. При сахарном диабете снижается экспрессия ключевого маркера апоптоза лимфоцитов (CD95+), что является косвенным признаком подавления программированной гибели аутореактивных лимфоидных клеток, при LADA в меньшей степени, чем при классическом варианте клинической картины СД1. На фоне компенсации углеводного обмена в течение первого года заболевания количество CD95+-лимфоцитов нормализуется у пациентов как с классическим дебютом СД1, так и с LADA, что может свидетельствовать о частичном восстановлении иммунорегуляторных механизмов. Развитие СД1 связано с нарушением иммунорегуляторных механизмов, включая изменения количества регуляторных Т-лимфоцитов и их активности. При СД1 экспрессия FOXP3 остается сниженной на всем протяжении заболевания (несмотря на отсутствие существенной разницы в содержании Тreg в крови), что обусловливает низкую супрессивную активность Тreg клеток в отношении аутореактивных цитотоксических Т-лимфоцитов. При LADA функциональный дефицит Тreg возникает отсрочено, что, очевидно, обусловливает медленное прогрессирование аутоиммунной деструкции b-клеток, несмотря на наличие аутоантител.
4. У лиц из группы риска развития аутоиммунного сахарного диабета 1-го типа увеличивается популяция CD4+CD25+-Тreg, что может отражать подавление аутоиммунной реакции в отношении b-клеток. Фаза клинической ремиссии, развивающаяся после манифестации заболевания и назначения фармакотерапии, характеризуется нормализацией базальной концентрации С-пептида в крови, снижением титров аутоантител к компонентам b-клеток, повышением интенсивности экспрессии CD95 и снижением интенсивности экспрессии CD95L на лимфоцитах. В период ремиссии сохраняется низкая функциональная активность Тreg (низкая интенсивность экспрессии FOXP3), однако повышается численность этой популяции лимфоцитов.
5. У пациентов с впервые выявленным СД1 в состоянии метаболической компенсации секреторный ответ на смешанную пищу в ходе теста ММТТ составляет в среднем 67,7 % от такового у обследованных из конт-рольной группы, а у пациентов с LADA — 88,1 %. Данные показатели отражают роль глюкозотоксичности в подавлении секреторной активности b-клеток в дебюте заболевания, а также могут свидетельствовать об их высоком эндогенно-регенеративном потенциале.
1. Гарибашвили А.Ю., Смирнова О.М., Никонова Т.В. Случай семейной формы сахарного диабета 2 типа у молодых // Сахарный диабет. — 2000 — № 3. — C. 37-42.
2. Табеева К.И. Аутоиммунный полигладулярный синдром III типа (ДТЗ, сахарный диабет 1 типа, аутоиммунный гломерулонефрит) / К.И. Табеева, Т.В. Никонова, О.М. Смирнова // Сахарный диабет. — 2004. — № 4. — С. 30-32.
3. Смирнова О.М. Впервые выявленный сахарный диабет 1 типа: механизмы развития, клиника, лечение (Пособие для врачей) / О.М. Смирнова, Т.В. Никонова // М.: ГУП «Медицина для Вас», 2005. — 48 с.
4. Никонова Т.В. Возможности клеточных технологий в лечении сахарного диабета / Т.В. Никонова, Е.В. Пекарева, Ю.И. Филиппов // Сахарный диабет. — 2008. — № 4. — С. 93-95.