Журнал «Боль. Суставы. Позвоночник» 3 (03) 2011
Вернуться к номеру
Влияние стронция ранелата на вертебральный болевой синдром и качество жизни у женщин, длительно принимающих глюкокортикоиды: post hoc анализ многоцентрового украинского исследования
Авторы: Поворознюк В.В., Дзерович Н.И., Бондаренко Л.И., Вайда В.М., Верич В.Ф., Гнилорыбов А.М., Гриценко Г. Н., Костерин С.Б., Кухтей О.А., Рекалов Д.Г., Синенький О.В., Трубина С.Ю., Чижикова И.В., Шпилевая Н.И., Яшина Е. Г., Украинский научно-медицинский центр проблем остеопороза, г. Киев
Рубрики: Семейная медицина/Терапия, Ревматология, Травматология и ортопедия, Неврология
Версия для печати
Остеопороз — наиболее распространенное системное заболевание скелета, характеризующееся снижением прочности костной ткани c последующим увеличением риска и количества остеопоротических переломов. Наиболее распространенной формой вторичного остеопороза является глюкокортикоид-индуцированный.
Глюкокортикоиды (ГК) в связи с их высокой противовоспалительной и иммуносупрессивной активностью часто применяют в лечении различных хронических заболеваний, таких как ревматоидный артрит, ревматическая полимиалгия, воспалительные заболевания кишечника и хронические обструктивные заболевания легких. Частота использования глюкокортикоидов в популяции в возрасте старше 50 лет в среднем составляет 3 %, при этом данный показатель увеличивается до 5,2 % у населения 80 лет и старше. Терапия глюкокортикоидами приводит к потере костной ткани и увеличению как вертебральных, так и невертебральных переломов. Установлено, что у 30 % пациентов, получающих глюкокортико- иды на протяжении 6 месяцев, развивается остео- пороз. Потеря костной ткани наиболее выражена в трабекулярной кости, которая преимущественно находится в телах позвонков и ребрах. При этом снижение плотности костной ткани имеет двухфазный характер: наиболь- шая потеря наблюдается на протяжении 1-го года терапии глюкокортикоидами (3–5 %), при последующем приеме препаратов снижение показателей более медленное и ежегодно составляет 0,5–1 %. Более того, риск переломов зависит от дозы используемых глюкокортикоидов. Общеизвестно, что средние и высокие дозы глюкокортикоидов ассоциируются с потерей костной ткани и увеличением риска перелома. Считалось, что пороговой суточной дозой относительно развития побочных эффектов со стороны костной ткани является 7,5 мг в эквиваленте по преднизолону [1, 2, 14]. Однако результаты проведенных исследований на протяжении последних лет показали, что более низкие дозы и даже ингаляционные формы глюкокортикоидов могут инициировать потерю костной ткани. У детей, которые принимали низкие дозы ингаляционных ГК, наблюдалось нарушение роста. У взрослых, которые пользовались высокими дозами ингаляционных глюкокортикоидов, наблюдалось снижение плотности костной ткани в зависимости от дозы, и установлено, что кумулятивная доза ингаляционных глюкокортикоидов у больных с бронхиальной астмой негативно коррелирует с плотностью костной ткани [6, 16]. Кроме того, установлено достоверное снижение уровня маркеров формирования и повышение маркеров резорбции костной ткани под влиянием ингаляционных форм глюкокортикоидов, даже при коротком курсе терапии. Длительная терапия глюкокортикоидами в супрафизиологических дозах приводит к нарушению костного ремоделирования и развитию остеопенического синдрома, в дальней- шем — к остеопорозу. Обращает на себя внимание также то, что после прекращения приема глюкокортикоидов риск переломов уменьшается до исходного уровня, что также зависит от дозы используемых препаратов. Так, при приеме высоких доз глюкокортикоидов риск переломов достигает начальных показателей через 15 ме- сяцев и более. Более того, установлено, что риск переломов увеличивается как у мужчин, так и у женщин и зависит от возраста. Другими детерминантами потери костной ткани при приеме глюкокортикоидов выступают следующие факторы риска: начало применения препаратов до формирования пика костной массы, перименопауза, постменопаузальный период, курение, снижение функциональной активности и др. [4, 8, 9, 12–18].
Большое значение в профилактике и терапии глюкокортикоид-индуцированного остеопороза имеет приверженность пациентов к антиостеопоротической терапии. В недавно представленном ретроспективном исследовании J.C. Netelenbos приверженными к терапии антирезорбентами оставались менее 40 % пациентов через 1 год наблюдения. Полученный низкий показатель можно объяснить несколькими причинами. Во-первых, антиостеопоротические препараты рекомендуют с целью профилактики последующих переломов (возникающих в будущем). Во-вторых, при назначении глюкокортикоидов врач информирует пациента о нескольких возможных побочных явлениях терапии, среди которых гипертония, сахарный диабет, глаукома, инфекции и остеопороз. Кроме того, при приеме глюкокортикоидов пациент может сразу оценить эффективность терапии (противовоспалительный эффект), а осознать необходимость применения дополнительно 2–3 лекарственных средств для профилактики глюкокортикоид-индуцированной потери костной ткани пациенту иногда бывает затруднительно. В-третьих, на сегодняшний день остается дискутабельным вопрос об оптимальных отрезках времени мониторирования терапии. Известно, что наиболее ранней является динамика со стороны маркеров формирования и резорбции костной ткани через 2–3 месяца после начала терапии. Но использование данных лабораторных показателей в рутинной практике врача ограничено в связи с их значительной аналитической вариабельностью, циркадными ритмами и, безусловно, высокой стоимостью. Кроме того, лаборатории, специализирующиеся на диагностике структурно-функционального состояния костной ткани, не многочисленны. Таким образом, учитывая высокую актуальность проблемы глюкокортикоид-индуцированного остеопороза, одним из наиболее важных направлений профилактики и лечения данного состояния является разработка социальных программ, направленных на информирование пациентов с возможными побочными явлениями при приеме глюкокортикоидов, улучшение образа жизни, профилактику глюкокортикоид-индуцированной потери костной ткани, достаточное потребление кальция, витамина D и т.д. [14].
Согласно рекомендациям Американской коллегии ревматологов по профилактике глюкокортикоид-индуцированного остеопороза при назначении глюкокортикоидов в дозе 5 мг в эквиваленте по преднизолону обязательным является дополнительное назначение препаратов кальция и витамина D, при длительном назначении глюкокортикоидов (≥ 6 мес.) препаратами первой линии среди антирезорбентов являются бисфосфонаты [8–10, 14].
Бисфосфонаты показали свою эффективность в профилактике глюкокортикоид-индуцированной потери костной ткани в нескольких рандомизированных контролируемых исследованиях.
При терапии алендронатом у пациентов, принимающих глюкокортикоиды на протяжении 1 года, достоверно повышалась минеральная плотность костной ткани (МПКТ) по сравнению с плацебо; через 2 года достоверные различия сохранялись. Интересным остается тот факт, что увеличение МПКТ в основном наблюдается на протяжении 1 года терапии.
В двух исследованиях была продемонстрирована эффективность ризедроната в профилактике глюкокортикоид-индуцированной потери костной ткани. Так, в исследовании S. Cohen et al. установлена эффективность ризедроната у пациентов, начинающих терапию глюкокортикоидами, в исследовании D.M. Reid — у пациентов, получающих глюкокортикоиды длительное время. Динамика МПКТ у пациентов, принимающих бисфосфонаты, составила 4,6 % по сравнению с плацебо. При добавлении к терапии витамина D показатель увеличивался до 6 % [13].
При приеме алендроната и ризедроната наблюдается снижение риска остеопоротических переломов. Так, в двухлетнем исследовании J.D. Adachi частота вертебральных переломов при приеме алендроната составила 0,7 % по сравнению с плацебо — 6,8 % (р = 0,026). Относительно невертебральных переломов достоверных различий не установлено (9,8 % при приеме плацебо против 5,4 % при приеме алендроната) [13].
В недавно опубликованных работах представлены данные, подтверждающие эффективность золедроновой кислоты в профилактике глюкокортикоид-индуцированной потери костной ткани. Так, в сравнительном исследовании D.M. Reid применение золедроновой кислоты оказалось более эффективным по сравнению с ризедронатом как в группе, получающей бисфосфонаты с целью терапии глюкокортикоид-индуцированного остеопороза (при приеме золедроновой кислоты динамика МПКТ на уровне L1–L4 составила 4,6 %, ризедроната — 2,7 %), так и в группе, получающей их с целью его профилактики (при приеме золедроновой кислоты динамика МПКТ на уровне L1–L4 — 2,6 %, ризе- дроната — 0,6 %) на протяжении 12 месяцев. В данном исследовании достоверных различий относительно риска переломов не выявлено.
Теоретически, учитывая патогенез глюкокортикоид-индуцированного остеопороза, применение анаболических агентов должно быть более эффективным по сравнению с антирезорбентами. На сегодняшний день недостаточно данных относительно эффективности терипаратида в профилактике и лечении глюкокортикоид-индуцированной потери костной ткани.
В исследовании S.G. Kaag проводилось сравнение эффективности терипаратида и алендроната при глюкокортикоид-индуцированном остеопорозе у 428 женщин и мужчин, получающих глюкокортикоиды более 3 месяцев. Через 18 месяцев терапии установлены достоверные различия динамики МПКТ на уровне поясничного отдела позвоночника (терипаратид — 7,2 %, алендронат — 3,4 %). Частота вертебральных переломов также достоверно отличалась (терипаратид — 0,6 %, алендронат — 6,1 %, р = 0,004). Таким образом, учитывая более значимую эффективность терипаратида по сравнению с бисфосфонатами, препарат терипаратида может быть рекомендован пациентам с очень высоким риском переломов (10-летний абсолютный риск переломов > 20 %).
Препарат с двойным механизмом действия — стронция ранелат — находится на этапе изучения, уже получены первые данные.
В 2009 году завершилось 2-летнее сравнительное исследование GIOP (Glucocorticoid Induced OsteoPorosis Trial), в котором проводилась оценка эффективности стронция ранелата в лечении глюкокортикоид-индуцированного остеопороза, а также сравнительный анализ его эффективности с ризедронатом. В исследовании приняло участие 107 пациентов (61 женщина, 46 мужчин). Результаты исследования показали, что при приеме стронция ранелата достоверно повышалась МПКТ как на уровне поясничного отдела позвоночника, так и на уровне шейки бедренной кости. Динамика показателя на уровне L1–L4 через 12 месяцев терапии стронция ранелатом составила 5,2 %, ризедронатом — 4,1 %; на уровне бедренной кости — 3,1 и 1,9 % соответственно. Через 24 месяца лечения стронция ранелатом МПКТ на уровне L1–L4 увеличилась на 9,1 %, при терапии ризедронатом — на 5,4 %; на уровне бедренной кости — на 5,3 и 2,4 % соответственно. Кроме того, в исследовании проводилась оценка эффективности исследуемых препаратов в лечении вертебрального болевого синдрома у пациентов с глюкокортикоид-индуцированным остеопорозом. Установлено, что при терапии ризедронатом выраженность болевого синдрома уменьшилась через 12 месяцев на 33 %, через 24 месяца — на 50 %, в то время как при лечении стронция ранелатом — на 52 и 78 % соответственно. Таким образом, результаты исследования GIOP показали, что применение стронция ранелата приводит к достоверному снижению выраженности болевого синдрома и повышению МПКТ на уровне поясничного отдела позвоночника, шейки бедренной кости у пациентов с глюкокортикоид-индуцированным остеопорозом. Кроме того, установлены достоверные различия у пациентов, получающих стронция ранелат и ризедронат, по влиянию на выраженность вертебрального болевого синдрома и МПКТ в пользу стронция ранелата [9].
В предыдущем номере журнала «Боль. Суставы. Позвоночник» были представлены результаты мультицентрового украинского исследования по изучению эффективности стронция ранелата в лечении нарушений структурно-функционального состояния костной ткани (остеопороза, остеопении) у женщин [3]. В изучаемой выборке 27 % пациенток принимали глюкокортикоиды в течение 3 месяцев и более в дозе, превышающей 5 мг в эквиваленте по преднизолону. В связи с этим нами был проведен post hoc анализ представленного исследования.
Целью нашего исследования было изучение влияния стронция ранелата на динамику веретебрального болевого синдрома и ежедневную функциональную активность у женщин, длительно и постоянно принимающих глюкокортикоиды.
Объект и методы исследования
Под руководством проф. В.В. Поворознюка была создана научно-исследовательская группа, в состав которой вошли врачи и научные сотрудники из различных регионов Украины (Днепропетровск, Донецк, Запорожье, Киев, Львов, Харьков). В исследовании при- нимало участие 257 женщин. В течение 4 месяцев препарат принимали 152 пациентки, 8 месяцев — 78, 11 месяцев — 27. Средний возраст обследованных составил 59,6 ± 11,1 года, средний рост — 161,3 ± 6,4 см, средняя масса — 70,4 ± 12,8 кг. В исследование включали женщин, которые постоянно принимали глюкокортикоиды внутрь в течение 3 месяцев и более в дозе 5 мг и больше в эквиваленте по преднизолону.
58 пациенток (24 %) отметили низкоэнергетические переломы различной локализации в анамнезе. Основными факторами риска остеопороза среди обследуемых женщин были наличие низкоэнергетических переломов у пациента в анамнезе (24 %), переломов бедренной кости у матери обследуемой (19 %), подтвержденный диагноз ревматоидного артрита (75 %), курение (28 %) и др. В исследование не включали пациентов, которые с лечебной целью в течение последних 3 месяцев применяли другие лекарственные средства (кроме глюкокортикоидов), влияющие на метаболизм костной ткани, а также пациентов с сопутствующей патологией в стадии суб- или декомпенсации.
Пациентки получали стронция ранелат (Бивалос, Servier) по 1 саше 1 раз в день и комбинированный препарат кальция и витамина D (кальцемин адванс по 1 табл. 2 раза в день) постоянно в течение 11 месяцев.
Обследование пациенток проводили до начала терапии (М0), через 4 месяца (М4), 8 месяцев (М8) и 11 месяцев (М11) лечения стронция ранелатом.
Для оценки эффективности лечения использовали 5-балльную шкалу оценки выраженности боли: 0 баллов — нет боли, 1 балл — незначительная боль, 2 балла — умеренная боль, 3 балла — сильная боль, 4 балла — резко выраженная боль. В каждой точке наблюдения пациентке предлагалось оценить, насколько сильно ее беспокоит боль в спине или области тазобедренного сустава.
Относительное изменение выраженности боли по отношению к исходному показателю на основании средних значений было оценено по формуле:
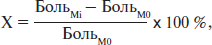
где Мi = М4, М8 и М11.
В каждой точке наблюдения пациенткам предлагали оценить ежедневную активность согласно 4-балльной шкале оценки ежедневной функциональной активности: 1 балл — плохая, 2 балла — удовлетворительная, 3 балла — хорошая, 4 балла — отличная.
Относительное изменение активности по отношению к исходному показателю было оценено по формуле:
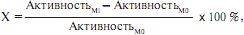
где Мi = М4, М8 и М11.
С целью дальнейшего анализа удовлетворенности пациенток лечением стронция ранелатом им предлагалось определить:
— удовлетворен ли пациент терапией;
— удовлетворен ли пациент приемом препарата 1 раз в день.
Так как отметки ставились только в случае утвердительного ответа относительно удовлетворенности лечением, то в случае отсутствия отметки при анализе считали, что данная пациентка не удовлетворена лечением.
Также в каждой точке наблюдения оценивали побочные явления. Во время визитов М4, М8 и М11 принимали решение относительно продолжения терапии стронция ранелатом. Если же решение было отрицательным, то указывалась причина прекращения терапии.
Статистический анализ полученных результатов проводили с помощью пакетов программ Microsoft Excel и SPSS 13.0. При анализе использовали методы описательной статистики (для количественных переменных вычисляли такие показатели, как среднее арифметическое, медиана, стандартное отклонение, минимум и максимум, а для категориальных — частота и доля в процентах), графические методы, методы интервального оценивания (выполнялось построение доверительных интервалов для средних арифметических или медиан в зависимости от согласования данных с нормальным законом распределения). Для анализа согласованности распределения данных с нормальным законом распределения применялся критерий Шапи- ро — Уилка при уровне значимости 0,01. Анализ достоверности изменения выраженности боли был выполнен при помощи двухфакторного дисперсионного анализа по смешанной модели: зависимая переменная — выраженность боли в баллах, фактор «время» — фиксированный (уровни М0, М4, М8 и М11), фактор «пациентки» — случайный.
Результаты исследования
Отмечена положительная динамика выраженности болевого синдрома и нарушений показателя ежедневной функциональной активности у обследованных женщин на всех этапах исследования (М4, М8 и М11).
Оценка эффективности лечения пациенток, принимавших стронция ранелат в течение 11 месяцев
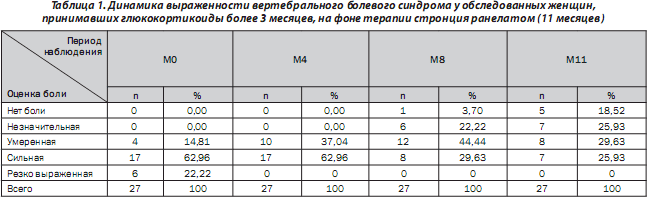
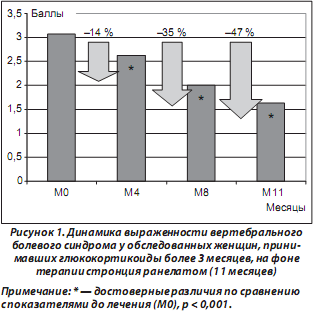
Пациентки отмечали достоверное уменьшение выраженности болевого синдрома уже через 4 месяца терапии. Динамика данного показателя через 4 месяца составила 14 %, через 8 месяцев — 35 % и через 11 месяцев — 47 % (рис. 1). Таким образом, через 11 месяцев терапии стронция ранелатом выраженность болевого синдрома уменьшилась почти в 2 раза.
Согласно проведенному анализу (табл. 1), среди пациенток, принимавших стронция ранелат в течение 11 месяцев, от боли разной выраженности в момент времени М0 страдали все 27 пациенток. Во время визитов М4–М11 пациентки не отмечали резко выраженной боли, во время визита М8 боль не беспокоила или беспокоила незначительно 7 пациенток (25,90 %) из 27, а во время визита М11 — 12 пациенток (44,44 %). Соответ- ственно только 7 пациенток (25,90 %) отмечали сильные болевые ощущения во время визита М11.
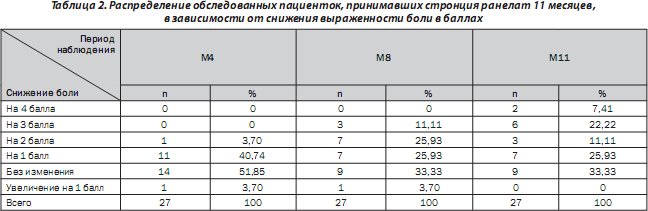
Определяли степень снижения боли в баллах. Полученные результаты для пациенток, принимавших стронция ранелат в течение 11 месяцев, приведены в табл. 2. Только у 13 пациенток (18,06 %) не отмечалось динамики выраженности болевого синдрома, а у 1 пациентки (1,39 %) отмечалась отрицательная динамика.
Согласно результатам дисперсионного анализа, эффект фактора «время» статистически значим (р < 0,001), что свидетельствует о влиянии длительной терапии стронция ранелатом на уменьшение выраженности боли. Проверка нормальности распределения остатков дисперсионного анализа — основной предпосылки дисперсионного анализа — была выполнена при помощи критерия Шапиро — Уилка. Так как остатки были распределены нормально, то выполненный дисперсионный анализ правомерен.
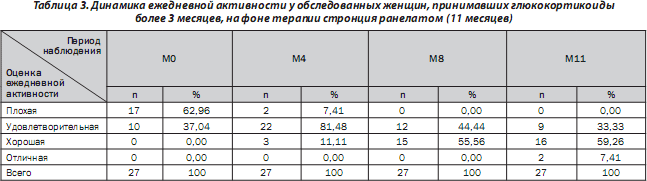
На фоне проводимой терапии пациентки отметили увеличение физической активности и расширение двигательного режима. Так, через 11 месяцев ежедневная функциональная активность у женщин, принимавших стронция ранелат, улучшилась на 100 % (рис. 2).
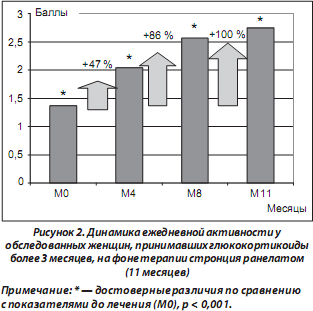
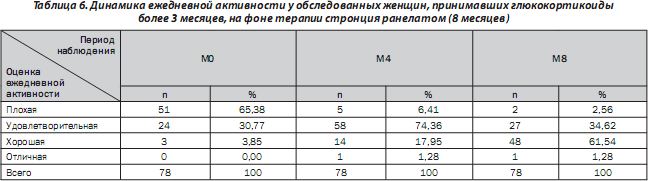
По мере увеличения длительности приема пациентками препарата отмечена тенденция к повышению их ежедневной активности. Через 8 месяцев терапии 56 % пациенток оценили ежедневную активность как хорошую или отличную, а через 11 месяцев — 66,66 % женщин (табл. 3).
Согласно результатам дисперсионного анализа, эффект фактора «время» статистически значим (р < 0,001), что свидетельствует о влиянии длительной терапии стронция ранелатом на увеличение оценок ежедневной активности.
Таким образом, эффект длительности терапии стронция ранелатом статистически достоверно (р < 0,001) влияет на уменьшение выраженности болевого синдрома и увеличение оценок ежедневной активности. Согласно результатам контрастного анализа, можно констатировать, что уменьшение выраженности боли и увеличение оценок ежедневной активности статистически достоверно (р < 0,001) уже после 4 месяцев терапии стронция ранелатом (М4), а также в других точках наблюдения (М8 и М11).
В течение исследования проводилась оценка пациентом удовлетворенности лечением. Во время визитов М4–М11 пациентки были удовлетворены проводимым лечением в 100 % случаев. Удовлетворенность режимом лечения (прием препарата один раз в день) через 11 месяцев также составила 100 %.
Во время визита М11 не было выявлено побочных реакций, о прекращении приема препарата не заявила ни одна пациентка.
Оценка эффективности лечения пациенток, принимавших стронция ранелат в течение 8 месяцев
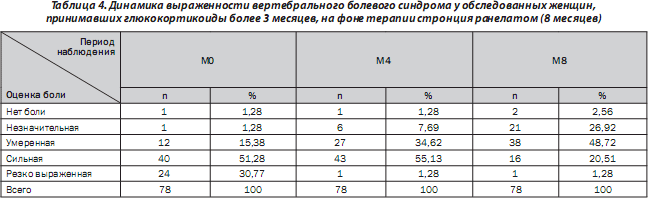
Согласно проведенному анализу, среди пациенток, принимавших стронция ранелат в течение 8 месяцев (табл. 4), от боли различной выраженности в начале исследования (М0) страдали 77 пациенток из 78. Во время визита М8 резко выраженная боль присутствовала у одной пациентки (1,28 %) из 24 (30,77 %) в начале исследования. Болевые ощущения остались во время визита М8 у 76 пациенток (97,44 %).
Выраженность боли к концу 8-го месяца наблюдения (М8) уменьшилась на 38 % по сравнению с исходным показателем.
Определена степень снижения боли в баллах. Полученные результаты для пациенток, принимавших стронция ранелат в течение 8 месяцев, представлены в табл. 5.
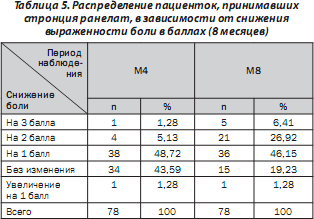
Согласно результатам дисперсионного анализа, эффект фактора «время» статистически значим (р < 0,001), что свидетельствует о влиянии 8-месячной терапии стронция ранелатом на уменьшение выраженности боли.
В начале исследования ежедневную функциональную активность пациентки оценили как плохую в 65,38 % случаев, а уже через 8 месяцев лечения данный показатель уменьшился до 2,56 %. Во время визита М8 61,54 % пациентов оценили ежедневную активность как хорошую, 34,26 % пациентов — как удовлетворительную. Результаты распределения пациенток в зависимости от оценки их ежедневной активности в каждой точке графика наблюдения приведены в табл. 6.
Таким образом, возросла доля пациенток с хорошими и отличными оценками, что свидетельствовало об увеличении их ежедневной активности.
Относительное изменение средних оценок ежедневной активности по отношению к исходному показателю во время визита М4 составило 54,63 %, во время визита М8 — 88,89 %.
Согласно результатам дисперсионного анализа, эффект фактора «время» статистически значим (р < 0,001), что свидетельствует о влиянии длительной терапии стронция ранелатом на увеличение оценок ежедневной активности.
Таким образом, эффект длительности терапии стронция ранелатом (8 месяцев) статистически достоверно (р < 0,001) влияет на уменьшение выраженности болевого синдрома и увеличение оценок ежедневной активности. Согласно результатам контрастного анализа, уменьшение выраженности болевого синдрома и увеличение оценок ежедневной активности статистически достоверно (р < 0,001) после 4 и 8 месяцев терапии стронция ранелатом.
Среди пациенток, принимавших стронция ранелат на протяжении 8 месяцев, на вопрос об удовлетворенности терапией утвердительно ответили 94,87 % человек в точке М4, в точке М8 — 88,46 % из включенных в анализ (78 пациенток). Во время визита М4 91,03 % пациенток были удовлетворены приемом препарата 1 раз в день, М8 — 87,18 %.
Во время визита М8 была выявлена 1 побочная реакция — незначительная тошнота, не требующая отмены препарата. Во время визита М8 о прекращении приема препарата не заявила ни одна пациентка.
Оценка эффективности лечения пациенток, принимавших стронция ранелат в течение 4 месяцев
Во время визита М0 от боли разной выраженности страдали 150 пациенток из 152 (табл. 7). Через 4 месяца отсут- ствие болевого синдрома отмечено у 3 пациенток (1,97 %). Соответственно болевые ощущения выявлены во время визита М4 у 149 пациенток (98,03 %). Резко выражен- ную боль в начале исследовании отмечали 46 пациенток (30,26 %), через 4 месяца — 1 (0,66 %) из 152 пациенток.
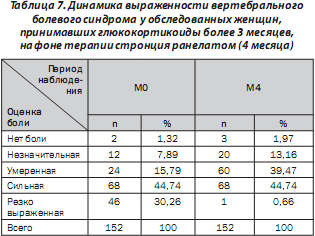
Средний балл выраженности боли к концу 4-го месяца наблюдения (М4) уменьшился на 22,32 % по сравнению с исходным показателем.
Определена степень снижения боли в баллах. Полученные результаты для пациенток, принимавших стронция ранелат в течение 4 месяцев, приведены в табл. 8.
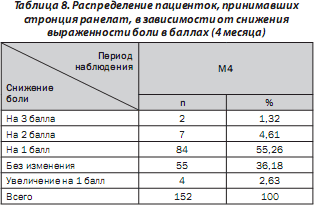
Во время визита М4 по сравнению с М0 отмечена тенденция повышения оценок ежедневной активности у пациенток. Так, доля пациенток с плохими оценками уменьшилась, в то время как возросла доля пациенток с относительно хорошими оценками. Результаты распределения пациенток в зависимости от оценки их ежедневной активности в каждой точке графика наблюдения приведены в табл. 9.
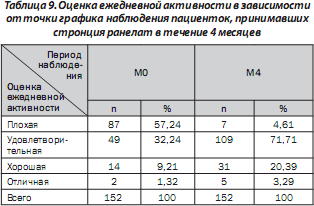
Таким образом, терапия стронция ранелатом на протяжении 4 месяцев статистически достоверно (р < 0,001) влияет на уменьшение выраженности боли и увеличение физической активности.
Относительное изменение средних оценок ежедневной активности по отношению к исходному показателю к концу 4-го месяца наблюдения составило 43,83 %.
На вопрос об удовлетворенности терапией утвердительно ответили 90,79 % пациенток в точке М4 из включенных в анализ (152 пациентки). Приемом 1 раз в день препарата были удовлетворены 90,79 % пациенток.
Во время визита М4 было выявлено 11 побочных реакций (табл. 10).
У основной части пациентов данные явления были кратковременными и не требовали отмены препарата. Во время визита М4 заявили о прекращении приема препарата 13 (19,8 %) пациенток. 2 пациентки (3 %) прекратили прием препарата из-за побочных явлений. Основной же причиной прекращения приема препарата в течение первых месяцев терапии были финансовые сложности с приобретением препарата у 9 пациенток (13,7 %) (табл. 11).
Обсуждение полученных результатов
Проведенный нами post hoc анализ мультицентрового украинского исследования показал положительное влияние стронция ранелата на вертебральный болевой синдром и качество жизни у женщин со структурно-функциональными нарушениями костной ткани (остеопороз, остеопения), принимавших глюкокортикоиды более 3 месяцев. Достоверные различия относительно указанных показателей наблюдались уже через 4 месяца и увеличивались через 8 и 11 месяцев лечения стронция ранелатом. Так, через 11 месяцев терапии стронция ранелатом у обследованных пациенток выраженность болевого синдрома уменьшилась в 2 раза (47 %). Необходимо отметить, что положительная динамика вертебрального болевого синдрома практически не отличалась от результатов, полученных в исследовании GIOP, которые показали снижение болевого синдрома при терапии стронция ранелатом (12 месяцев) на 52 %. Показатели приверженности к терапии стронция ранелатом и удовлетворенности лечением на всех этапах наблюдения оставались высокими.
Выводы
Таким образом, применение стронция ранелата у женщин, принимавших глюкокортикоиды более 3 месяцев в дозе 5 мг и более в эквиваленте по преднизолону, приводит к достоверному снижению выраженности болевого синдрома, повышению ежедневной активности и улучшению качества жизни. Эффект длительности терапии стронция ранелатом достоверно влияет на уменьшение выраженности болевого синдрома и увеличение оценок ежедневной активности. Лечение сопровождается минимальным количеством побочных эффектов, хорошо переносится пациентами.
1. Поворознюк В.В., Нейко Є.М., Головач І.Ю. Глюкокортикоїд-індукований остеопороз. — К.: ТМК, 2000. — 206 с.
2. Поворознюк В.В. Захворювання кістково-м’язової системи в людей різного віку: Вибр. лекції, огляди, ст. — К., 2004. — Т. 2. — 519 с.
3. Поворознюк В.В., Дзерович Н.И., Бондаренко Л.И. и др. Влияние стронция ранелата на вертебральный болевой синдром и качество жизни у женщин в постменопаузальном периоде: результаты многоцентрового украинского исследования // Боль. Суставы. Позвоночник. — 2011. — 2. — С. 52-59.
4. Bruyere O., Delferriere D., Roux C. et al. Effects of strontium ranelate on spinal osteoarthritis progression // Ann. Rheum. Dis. — 2008. — 67. — P. 335-339.
5. Dore R.K. How to prevent glucocorticoid-induced osteoporo- sis // Cleve Clin. J. Med. — 2010. — 77. — P. 529-536.
6. Israel E., Banerjee T.R., Fitzmaurice G.M. et al. Effects of inhaled glucocorticoids on bone density in premenopausal women // N. Engl. J. Med. — 2001. — 345(13). — Р. 941-947.
7. Hamdy N.A. Strontium ranelate improves bone microarchitecture in osteoporosis // Rheumatology (Oxford). — 2009. — 48. — P. 9-13.
8. Kanis J.A., Johansson H., Oden A. et al. A meta-analysis of prior corticosteroid use and fracture risk // J. Bone Miner. Res. — 2004. — 19(6). — P. 893-899.
9. Kanis J.A. Diagnosis of osteoporosis and assessment of fracture risk // Lancet. — 2002. — 359. — P. 1929-1936.
10. Pereira R.M.R., Carvalho J.F., Сanalis E. Glucocorticoid-induced osteoporosis in rheumatic diseases // CLINICS. — 2010. — 65(11). — P. 1197-1205.
11. Ringe J.D. Strontium ranelate: an effective solution for diverse fracture risks // Osteoporos Int. — 2010. — 21(2). — P. 431-436.
12. Ringe J., Dorst A., Farahmand P. Treatment of glucocorticoid-induced osteoporosis with strontium ranelate: a 2-year observational, controlled study versus risedronate (abstract) // Osteoporos Int. — 2009. — 20(1). — P. 72.
13. Ruf K.M., Johnson N.K., Clifford T., Smith K.M. Risk factors, prevention, and treatment of corticosteroid-induced osteoporosis in adults // Orthopedics. — 2008. — 31(8). — P. 768-772.
14. Uyl D., Bultink I.E.M., Lems W.F. Advances in Glucocorticoid-Induced Osteoporosis // Curr. Rheumatol. Rep. — 2011. — 13. — P. 233-240.
15. Van Staa T.P., Leufkens H.G., Abenhaim L. et al. Oral corticosteroids and fracture risk: relationship to daily and cumulative doses // Rheumatology (Oxford). — 2000. — 39. — P. 1383-1389.
16. Walsh L.J., Lewis S.A., Wong C.A. et al. The impact of oral corticosteroid use on bone mineral density and vertebral fracture // Am. J. Respir. Crit. Care Med. — 2002. — 166(5). — Р. 691-695.
17. Wolinsky-Friedland M. Drug-induced metabolic bone disease // Endocrinol. Metab. Clin. North. Am. — 1995. — 24. — P. 395-420.
18. Wong C.A., Walsh L.J., Smith C.J. et al. Inhaled corticosteroid use and bone-mineral density in patients with asthma // Lancet. — 2000. — 355(9213). — Р. 1399-1403.