Журнал «Боль. Суставы. Позвоночник» 3 (03) 2011
Вернуться к номеру
Полиэтиологичность остеопороза
В последнее время в диагностике остеопороза особое внимание уделяется факторам риска, поскольку известно, что причиной потери прочности костной ткани может быть не только эстрогенный дефицит в постменопаузальном периоде. В клинической практике врач часто встречается с ситуацией, когда у конкретного больного при сборе анамнеза выявляются не одна, а по крайней мере несколько причин развития остеопороза. Общеизвестно, что в классификации остеопороза, кроме первичных, к которым относят постменопаузальную и сенильную, существует огромная группа вторичных форм остеопороза, среди которых огромное значение имеет ятрогенная (в частности, глюкокортикоид-индуцированная), эндокринная (при заболеваниях щитовидной и паращитовидной желез, сахарном диабете) и др. Более того, дополнительные модифицируемые и немодифицируемые факторы риска остеопороза, имеющиеся у конкретного больного, также могут влиять на степень потери костной ткани и развитие остеопороза. Известно, что суммация факторов риска наряду с низкими показателями минеральной плотности костной ткани (МПКТ) может значительно увеличивать риск остеопоротических переломов различной локализации. При наличии одного перелома тела позвонка и низкой МПКТ риск последующего вертебрального перелома возрастает в 25 раз, при наличии множественных вертебральных переломов и низкой МПКТ — в 75 раз [P.D. Ross, J.W. Davis, R.S. Epstein и соавт., 1991]. Риск переломов бедренной кости также повышается при увеличении факторов риска, особенно при низких показателях МПКТ. Так, при наличии 3–4 факторов риска и низкой МПКТ риск переломов бедренной кости увеличивается в 4 раза, а при наличии более 5 факторов риска — более чем в 27 раз [S. Cummings et al., 1995].
Тщательный сбор анамнеза может помочь в объяснении причин потери костной ткани, проанализировать риск последующих вертебральных и невертебральных переломов для конкретного пациента и сделать выбор при определении тактики лечения.
Ниже представлен клинический случай, детальный разбор которого еще раз обратит внимание клиницистов на важность тщательного сбора анамнеза, проведения дифференциальной диагностики в каждой клинической ситуации.
Пациентка М., 74 лет, обратилась в Украинский научно-медицинский центр проблем остеопороза (10.11.2010) по направлению из Института эндокринологии АМН Украины для проведения дополнительного обследования в связи с перенесенным оперативным вмешательством (субтотальная паратиреоидэктомия 09.04.2010) и появившимися в течение последних 2 мес. жалобами.
Предъявляет жалобы на судороги в мышцах верхних и нижних конечностей, особенно в икроножных мышцах, усиливающиеся в вечернее и ночное время и являющиеся причиной отсутствия сна. Кроме того, беспокоят умеренные боли в шейном и поясничном отделе позвоночника, боли в голеностопных, плечевых, локтевых и коленных суставах. Ухудшение общего состояния отмечает после перенесенного оперативного вмешательства.
Анамнез жизни и заболевания
Считает себя больной с января 2010 года, когда появились боли в суставах и длинных трубчатых костях разлитого ноющего характера. Кроме того, нарастало уменьшение мышечной массы и мышечная слабость. Также беспокоили слабость, быстрая утомляемость и жажда. Тогда же впервые был установлен диагноз желчнокаменной болезни, хронического калькулезного холецистита.
Менархе с 12 лет, менопауза с 55 лет (постменопаузальный период без выраженных проявлений климактерического синдрома и не требующий какой-либо медикаментозной коррекции). В анамнезе — 4 родов физиологическим путем. Травмы или переломы в прошлом отрицает.
Тщательный сбор анамнеза установил, что в 1974 году через 4 мес. после третьих физиологических родов на фоне отсутствия каких-либо жалоб была госпитализирована в отделение скорой медицинской помощи с явлениями гематурии. Клинико-лабораторное обследование подтвердило впервые выявленный диагноз гипопластической анемии.
Анемия — распространенное заболевание крови среди различных групп населения в разных странах мира. Около 4 % мужчин и 8 % женщин США страдают анемией. После 50 лет распространенность анемии увеличивается с возрастом и превышает 20 % в возрасте 85 лет и старше. Гипопластические анемии (апластическая, арегенераторная, гипорегенераторная) обусловлены уменьшением продукции клеток костного мозга. Причиной развития могут быть различные факторы экзогенного и эндогенного происхождения: ионизирующая радиация, химические вещества (бензол, бензин, мышьяк, ртуть, висмут), органические растворители, минеральные удобрения, инсектициды, лекарственные средства (цитостатические и сульфаниламидные препараты, левомицетин, стрептомицин, салициловая кислота, антигистаминные, противомалярийные, противосудорожные, противотиреоидные, противотуберкулезные средства, препараты золота и др.), хронические инфекции, стресс. Однако в 50–75 % случаев причина гипопластической анемии остается невыясненной. Наиболее характерным признаком картины крови является пангемоцитопения (эритро-, тромбо-, лейкопения с нейтропенией и относительным лимфоцитозом). Анемия носит нормохромный, реже гиперхромный характер. У большинства больных увеличена СОЭ.
В лечении важное место занимают глюкокортикостероиды, которые назначают всем больным, но особенно они необходимы больным с выраженной кровоточивостью и гемолитическим синдромом. Интенсивная терапия глюкокортикоидами (преднизолон 60–100 мг/сут) проводится в течение 10–15 дней с последующим постепенным снижением доз.
Пациентка во время нахождения в стационаре и после выписки получала симптоматическое лечение в течение 1 мес. Взята под наблюдение гематолога. Тогда же был назначен преднизолон по 80 мг/день, который принимала в течение 3,5 года (минимальная доза 20 мг/день). На фоне данной терапии отмечала относительно удовлетворительное состояние, жалоб со стороны костно-мышечной системы не было.
Глюкокортикоиды являются одной из важных причин развития ятрогенного (глюкокортикоид-индуцированного) остеопороза. Они уменьшают абсорбцию кальция и фосфора в кишечнике и увеличивают экскрецию кальция прежде всего за счет влияния на тубулярную реабсорбцию, что приводит к развитию вторичного гиперпаратиреоза. Кроме того, глюкокортикоиды угнетают синтез половых гормонов, непосредственно влияя на функцию гонад, а также опосредованно — через снижение уровня эндогенных гормонов гипофиза. Применение глюкокортикоидов замедляет пролиферацию остеобластов, синтез коллагена 1-го типа и неколлагеновых белков. Глюкокортикоид-индуцированная миопатия и слабость мышц увеличивают риск падения и возникновения вертебральных и периферических переломов.
В 1976 году на фоне терапии преднизолоном впервые установлен диагноз узлового зоба. В 1977 году самостоятельно прекратила прием преднизолона в связи с беременностью (незапланированной). В 1977 году срочные роды физиологическим путем. В послеродовом периоде терапию преднизолоном не возобновляла, на учете у гематолога не состояла. В связи с ухудшением состояния со стороны щитовидной железы (в связи с резким ее увеличением) и признаками гипертиреоза оперирована по поводу узлового зоба 3-й ст. Выполнена операция — субтотальная тиреоидэктомия (1978 г.).
Гипертиреоз (тиреотоксикоз) — клинический синдром, вызванный повышением гормональной активности щитовидной железы и характеризующийся избыточной продукцией тиреоидных гормонов — тироксина (Т3) и трийодтиронина (Т4). Гипертиреоз преимущественно диагностируется у женщин молодого возраста. Избыточная продукция Т3 и Т4 усиливает катаболизм костной ткани, способствуя увеличению выделения кальция и фосфора с мочой, что приводит к развитию вторичного гиперпаратиреоза, который, в свою очередь, способствует дальнейшему разрушению костной ткани. Важным моментом патогенеза остеопороза при гипертиреозе является угнетение синтеза гликозаминогликанов, входящих в состав белкового матрикса кости.
В послеоперационном периоде пациентке рекомендовано наблюдение эндокринолога и прием тироксина (50–75 мг/день), однако под наблюдением не состояла и тироксин не принимала.
С января 2010 года отмечает ухудшение общего состояния, боли в суставах и в костях диффузного ноющего характера, уменьшение мышечной массы и мышечную слабость. Направлена на консультацию к эндокринологу в связи с измененными показателями анализа крови (в том числе тиреотропин — 7,8 мкМЕ/мл (N: 0,27–4,2); паратгормон — 115,48 пг/мл (N: 15,0–65,0)).
В апреле 2010 года находилась в Институте эндокринологии АМН Украины с диагнозом: первичный гиперпаратиреоз (Е21.01), гиперпластическая форма. Гиперплазия щитовидных желез. Состояние после субтотальной тиреоидэктомии (1978 г.). Послеоперационный гипотиреоз средней степени тяжести в состоянии неполной медикаментозной компенсации. Выполнено оперативное вмешательство: субтотальная паратиреоидэктомия. Назначены препараты кальция 2–3 г/день, L-тироксин по 50–75 мкг/день.
Паратиреоидная остеодистрофия (син. — гиперпаратиреоидная остеодистрофия, болезнь Энгеля — Реклингхаузена, генерализованная болезнь Реклингхаузена, фиброзная кистовидная остеодистрофия) — синдром, вызванный гиперфункцией паращитовидных желез. Описан в 1881 г. немецким патологом Реклингхаузеном (F.D. Recklinghausen). Частота заболевания составляет 25–28 новых случаев на 100 000 населения ежегодно, чаще болеют женщины. Характерно линейное увеличение заболеваемости с возрастом. Причиной гиперфункции паращитовидных желез является солитарная или множественная их аденома, диффузная гиперплазия или гормонально активная карцинома. Увеличение уровня паратгормона (первичный гиперпаратиреоз) ведет к нарушению функции остеобластов, увеличению количества и активности остеокластов. Повышается синтез 1,25-дигидроксихолекальциферола, снижаются синтез 24,25-дигидроксихолекальциферола, реабсорбция соединений фосфора в проксимальных и увеличивается его экскреция в дистальных почечных канальцах. Клиника. Превалирует поражение костей, в меньшей степени нарушается функция почек, желудочно-кишечного тракта, кроветворных органов и др. Ранними симптомами являются слабость, утомляемость, мышечная гипотония. Ранний, но необязательный симптом — жажда и полиурия со сниженным удельным весом мочи. В 25 % случаев у больных развивается двусторонний нефролитиаз, сопровождающийся пиелонефритом. Позже появляются боли в костях диффузного ноющего характера, локализующиеся преимущественно в костях конечностей, реже в позвоночнике. Часто возникают патологические переломы бедренной, плечевой, тазовых костей, нередки множественные переломы ребер. Особенность переломов — их менее выраженная болезненность и медленная консолидация. Дифференциальная диагностика. По клинико-рентгенологической картине и некоторым биохимическим показателям гиперпаратиреоидная остеодистрофия имеет сходство с фиброзной остеодисплазией, миеломной болезнью, системным остеопорозом, остеомаляцией. Прогноз при раннем оперативном лечении благоприятный: возможно полное восстановление структуры костной ткани.
После операции до июля 2010 года принимала тироксин по 50 мкг/день нерегулярно, кальций D3 никомед по 4–5 табл/день. По данным анализа крови (05.07.2011): тиреотропин (результаты иммунохимического анализа) — 6,83 мкМЕ/мл (N: 0,27–4,2); кальций общий — 1,84 ммоль/л (N: 2,15–2,58); кальций ионизированный — 0,94 (N: 1,05–1,35); магний — 0,98 мкмоль/л (N: 0,7–1,05); фосфор — 1,83 мммоль/л (N: 0,87–1,45).
При проведении сцинтиграфии скелета (Тс99) (26.10.11) признаков опухолевого повреждения скелета не выявлено.
Данные объективного обследования
Рост 155 см, масса тела 50,0 кг, индекс массы тела 20,8 усл.ед. Кожные покровы и видимые слизистые оболочки бледные, периферических отеков нет. Уровень подкожной клетчатки уменьшен. Дыхание везикулярное, хрипов нет; тоны сердца несколько приглушены, ритмичны, гемодинамика стабильна; живот — без особенностей; симптом Пастернацкого отрицательный с двух сторон. Осанка сутулая, походка замедленная. Усилен грудной кифоз в нижнегрудном отделе позвоночника, уплощен поясничный лордоз. При пальпации позвоночника отмечаются незначительные боли в проекции остистых отростков и паравертебральных точек на уровне С5–С6 и L3–L5. Движения в шейном и поясничном отделе позвоночника умеренно ограничены и болезненны. Чувствительных и двигательных нарушений не обнаружено. Фаланги пальцев верхних и нижних конечностей деформированы с наличием узелков Бушара и Гебердена (2–5-е фаланги пальцев верхних конечностей). Умеренная гипотрофия большинства мышц верхних и нижних конечностей.
Учитывая характер жалоб, возраст пациентки и особенности течения заболевания, было проведено лабораторно-инструментальное обследование.
Основные результаты инструментального и лабораторного исследований
Общий анализ крови: Hb — 66 г/л (N: 110–165); Ht — 0,2 (N: 0,35–0,50); эр. — 2,0 • 109/л (N: 3,8–5,8); цв. показатель — 1,0 (N: 0,85–1,05); лейк. — 1,3 • 106/л (N: 4–10); тромбоциты — 140 (150–400); СОЭ — 60 (N: 2–18 мм/ч); формула крови: лимфоциты — 51 (N: 17–48), моноциты — 19 (N: 4–10), гранулоциты — 30 (N: 43–76), сегментоядерные — 19 (N: 51–65), палочкоядерные — 7 (N: 1–4), эозинофилы — 3 (N: 2–4), базофилы — 1 (N: 0–1). Умеренно выраженный анизоцитоз, пойкилоцитоз не выраженный. Полихроматофилы единичные в поле зрения, эритроциты преимущественно нормохромные.
Основными факторами развития остеопении (остеопороза) при различных заболеваниях системы крови являются избыточная выработка протеинов, лейкемоидная инфильтрация костной ткани, гиперплазия костного мозга и изменение структуры костной ткани, нарушение микроциркуляции, развитие инфарктов в костях, внутрикостных геморрагий, продукция факторов, стимулирующих остеокласты, угнетающих остеобласты (миеломные клетки), отложение в костях гемосидерина, избыточный синтез гепарина тучными клетками (мастоцитоз).
Общий анализ мочи: удельный вес — 1,21; реакция кислая, следы белка, плоский эпителий — небольшое кол-во, лейкоциты — 2–4 в поле зрения, слизь — небольшое кол-во.
Биохимический анализ крови: альбумин — 28,85 г/л (N: 35,0–50,0). Другие биохимические показатели (АСТ, АЛТ, мочевая кислота, триглицериды, холестерин, коэффициент атерогенности и др.) в пределах нормы. Кальций общий — 1,22 ммоль/л (N: 2,15–2,58); кальций ионизированный — 0,6 (N: 1,05–1,35); магний — 0,61 мкмоль/л (N: 0,70–0,98); фосфор — 2,26 мммоль/л (0,81–1,45); калий — 4,5 мммоль/л (N: 3,8–5,6); натрий — 132 мммоль/л (N: 130–156).
Иммуноферментный анализ: тиреотропин — 2,2 мкМЕ/мл (N: 0,27–4,20).
Иммуноферментный анализ маркеров костного ремоделирования (18.11.2010): tP1ND — 32,41 нг/мл (N: 20,0–100,0); остеокальцин — 5,25 нг/мл (N: 11,0–43,0); βCTx — 0,079 нг/мл (для женщин в постменопаузе N: < 1,008); паратгормон — 5,81 пг/мл (N: 15,0–65,0), витамин D — 29,97 нмоль/л (N: 50,0–100,0).
Ультразвуковое исследование органов брюшной полости. Заключение: признаки хронического калькулезного холецистита, хронического панкреатина.
Электрокардиографическое исследование. Заключение: ритм синусовый, правильный, ЧСС 61 уд/мин. Электрическая ось сердца отклонена влево. Нарушение внутрижелудочковой проводимости. Признаки гипертрофии левого желудочка.
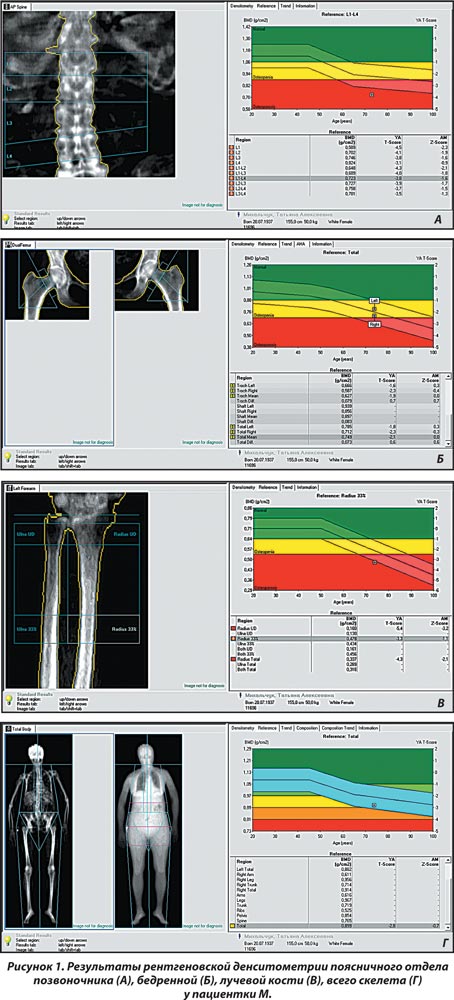
Результаты двухфотонной рентгеновской абсорбциометрии (рис. 1): Т-критерий составил на уровне позвоночника — –4,5 SD; бедренной кости — –2,1; лучевой кости — –2,1; всего скелета — –2,8 SD. По данным рентгенморфометрического исследования позвоночника, деформации тел позвонков не выявлено.
Наиболее частой причиной развития системного остеопороза является его постменопаузальная форма.
Постменопаузальная потеря костной ткани обусловлена дефицитом половых гормонов, в частности эстрогенов. Уже в перименопаузальном периоде наблюдается повышение скорости ремоделирования костной ткани (резорбция преобладает над формированием), снижается абсорбция кальция в результате нарушений его всасывания в тонком кишечнике, увеличивается потеря кальция с мочой. Данные изменения прогрессируют в постменопаузальном периоде.
Установлено также, что снижение продукции половых гормонов ведет к снижению секреции кальцитонина и изменению синтеза активной формы витамина D — кальцитриола. Эстрогены активируют 1α-гидроксилазу, под воздействием которой синтезируется 1,25(ОН)2Д3 в корковом веществе почек, а андрогены подавляют активность 24‑гидроксилазы 25-гидроксихолекальциферола, синергически действуя на синтез активной формы витамина D.
Кроме взаимодействия со специфическими рецепторами в костной ткани, эстрогены влияют на синтез локальных медиаторов (стимулируют продукцию трансформирующего фактора роста β (TФР-β) и снижают синтез ИЛ-1 и ИЛ-6 и функционирование системы RANK-RANKL-OPG). Механизм защитного действия эстрогенов проявляется также в снижении чувствительности костной ткани к резорбтивному действию метаболитов витамина D, снижении катаболического эффекта тироксина за счет усиления синтеза тиреоглобулина и др.
Наибольшая потеря костной ткани наблюдается в первые 5 лет постменопаузы, хотя постменопаузальный остеопороз и относится к поздним обменно-эндокринным нарушениям постменопаузы.
Таким образом, по данным рентгеновской денситометрии установлен системный остеопороз, однако изменения в биохимическом анализе крови вызывают необходимость дополнительных исследований (рентгенографическое исследование, консультации других специалистов и прочее для исключения диагноза вторичного остеопороза).
Рентгенография черепа в 2 проекциях (29.12.2010). Заключение: на рентгенограмме в области правой височной кости участки деструкции с достаточно четкими контурами размером в диаметре 1,0–1,5 см. Рентгенологически не исключена миеломная болезнь.
Рентгенография кистей (01.12.2010). Заключение: на рентгенограммах определяется остеопороз, деформирующий артроз проксимальных и дистальных межфаланговых суставов с кистовидной перестройкой сочленяющихся костей и разрушением замыкающих пластинок дистальных суставов справа 2–4 и слева 2–5, проксимальных суставов справа 3–4 и слева 3–5. Деформирующий артроз седловидных и лучезапястных суставов.
Согласно рентгенологической картине выделяют 3 формы гиперпаратиреоидной остеодистрофии: остеопоротическую, кистозную и педжетоидную. Снижение плотности тени на рентгенограммах может быть как незначительным, так и очень выраженным. Своеобразные изменения наблюдаются в костях свода черепа: рисунок их мелкозернистый, рано исчезает внутренняя пластинка крыши черепа. Довольно характерный симптом — субпериостальная резорбция концевых фаланг пальцев кисти, которые имеют кружевной, фестончатый вид. Подобные изменения могут быть также в большеберцовой кости, дистальном отделе локтевой кости, акромиальном конце ключицы. Кисты разного размера располагаются в центре или по периферии костей скелета и встречаются (в убывающем порядке) в бедренных костях, костях голени, предплечья, плечевых, тазовых.
При фиброзной остеодисплазии отсутствуют характерные для гиперпаратиреоидной остеодистрофии изменения в костях черепа, субпериостальная резорбция ногтевых фаланг, измененные показатели фосфора крови и его тубулярной реабсорбции, активность ксантиноксидазы нормальные.
При остеопоротической форме миеломной болезни показатели фосфора крови и его тубулярной реабсорбции нормальные, отмечаются увеличение содержания белка в крови, одной из белковых фракций, появление миеломного белка в крови и белка Бенс-Джонса в моче, увеличиваются СОЭ и процент плазматических клеток в стернальном пунктате.
При остеопорозе увеличение активности щелочной фосфатазы и уровня остеокальцина незначительное. Определяется нормальный уровень фосфора крови и его тубулярной реабсорбции. Сохраняется в пределах нормы активность ксантиноксидазы, отсутствуют жажда, полиурия, субпериостальная эрозия ногтевых фаланг.
В клинике пациентка консультирована гематологом, проведена стернальная пункция. По результатам миелограммы, выполненной при стернальной пункции, и заключению гематолога подтвержден диагноз гипопластической анемии. Признаков миеломной болезни не выявлено.
С учетом жалоб больной, анамнеза заболевания и жизни, данных объективного статуса и дополнительных методов исследования был верифицирован клинический диагноз: вторичный системный остеопороз. Детальный сбор анамнеза выявил множество причин, влияющих на метаболизм костной ткани в различные периоды жизни конкретной больной, — гипопластическая анемия, прием глюкокортикоидов, узловой зоб с гипертиреозом, гиперпаратиреоз, и, наконец, дефицит эстрогенов в постменопаузе. Поскольку проведение рентгеновской абсорбциометрии проводилось пациентке впервые в клинике, чрезвычайно сложно определить, какая из причин была наиболее значимой для потери костной массы у конкретной пациентки. Однако наличие определенного симптомокомплекса жалоб (судороги, ноющие боли в длинных костях) и полученных результатов инструментального (системный остеопороз) и лабораторного обследования (гипокальциемия, гипомагниемия, гиперфосфатемия, низкий уровень витамина D) обусловливает выбор назначаемого лечения.
Пациентке назначен кальцемин адванс по 1 табл. 3 раза в день и активный метаболит витамина D альфакальцидол по 50 мкг/день в течение 9 мес. Рекомендовано продолжать прием L-тироксина в дозе 50 мкг/день. Лечение переносила хорошо, выраженность судорожного синдрома и болевого синдрома в костях значительно уменьшилась. Контроль маркеров костного ремоделирования через 3 мес. терапии выявил увеличение уровня витамина D на фоне низкого показателя уровня сывороточного остеокальцина.
Иммуноферментный анализ маркеров костного ремоделирования (18.02.2011): tP1ND — 22,71 нг/мл (N: 20,0–100,0); остеокальцин — 9,85 нг/мл (N: 11,0–43,0); bCTx — 0,081 нг/мл (для женщин в постменопаузе N: < 1,008); паратгормон — 6,43 пг/мл (N: 15,0–65,0), витамин D — 79,97 нмоль/л (N: 50,0–100,0), кальций общий — 2,16 моль/л (N: 2,15–2,58).
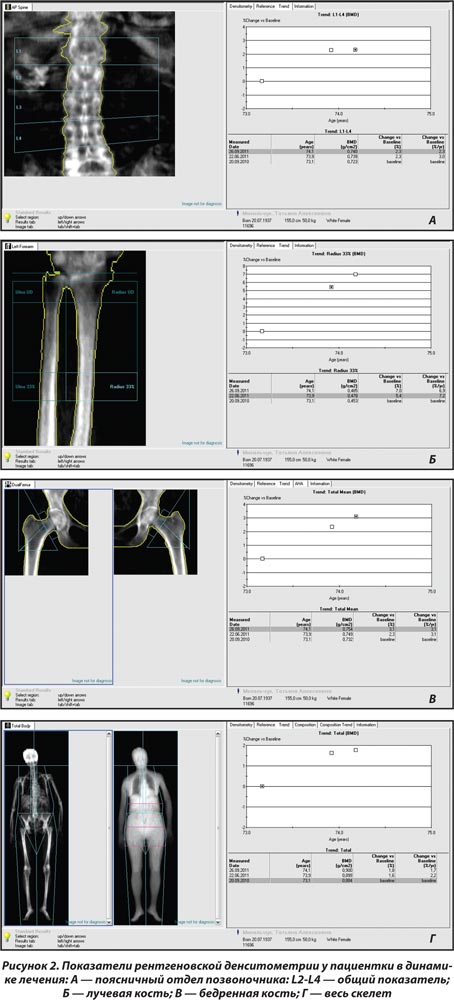
Через 3 мес. наблюдения в связи с системным остеопорозом пациентке назначена антиостеопоротическая терапия препаратом бивалос (по 1 саше 1 раз в день) на фоне приема препаратов кальция и активных метаболитов витамина D. Контроль денситометрических показателей костной ткани через 3 мес. лечения выявил положительную тенденцию МПКТ (рис. 2) на фоне улучшения общего состояния больной.
В настоящее время пациентка остается под наблюдением в Украинском научно-медицинском центре проблем остеопороза и продолжает регулярный прием препаратов.
Представленный клинический случай заставляет задуматься о сложности патогенетических механизмов развития остеопороза. Многочисленные эндогенные и экзогенные причины могут быть выявлены у одного больного и приводить к суммации неблагоприятного влияния на костную ткань.
Детальный сбор анамнеза, учет факторов риска у конкретного пациента, правильно проведенная дифференциальная диагностика позволяют вовремя установить диагноз и назначить адекватное лечение.
Подготовила Н.В. Григорьева,
д.м.н., главный научный сотрудник отдела клинической физиологии и патологии опорно-двигательного
аппарата ГУ «Институт геронтологии НАМН Украины»
