Международный неврологический журнал 7 (45) 2011
Вернуться к номеру
Новый взгляд на эффективность натализумаба при рассеянном склерозе (данные предварительных клинических исследований и исследований, выполненных после вывода препарата на рынок)
Авторы: Bates David, Department of Neurology, The Institute of Neuroscience, Newcastle University, UK
Рубрики: Неврология
Версия для печати
Рассеянный склероз (РС) является хроническим инвалидизирующим заболеванием с тяжелыми клиническими и социальными последствиями. Современные средства болезнь-модифицирующей терапии первого выбора имеют ограниченную эффективность и не останавливают на длительное время прогрессирование болезни у большинства пациентов. Натализумаб (Тизабри®) является единственным моноклональным антителом, лицензированным для использования при рецидивирующе-ремиттирующем РС. Многие неврологи рассматривают натализумаб как наиболее эффективный препарат для лечения РС среди других лекарственных средств, доступных на рынке; его применение может привести к пересмотру критериев успешности терапии РС. Эффективность данного препарата была подтверждена как в крупных предварительных клинических исследованиях, так и в исследованиях, выполненных после вывода препарата на рынок. К положительным эффектам, связанным с назначением натализумаба, относят снижение таких показателей активности РС, как частота рецидивов, прогрессирование болезни и данные магнитно-резонансной томографии. Лечение натализумабом оказывало существенное влияние на качество жизни пациентов. Более того, после терапии данным препаратом у пациентов наблюдалось значительное улучшение, что впервые делает непрерывную клиническую ремиссию реальной целью при РС. Однако необходимо помнить, что существенные выгоды, наблюдаемые при использовании натализумаба, должны быть сбалансированы с возможными рисками. Редким осложнением при назначении натализумаба является развитие прогрессирующей мультифокальной лейкоэнцефалопатии. Оно может быть минимизировано с помощью специальных программ по управлению рисками, направленных на обучение врачей правильному отбору и ведению пациентов, получающих лечение натализумабом.
AFFIRM, натализумаб, прогрессирующая мультифокальная лейкоэнцефалопатия, рецидивирующе-ремиттирующий рассеянный склероз, Тизабри.
Рассеянный склероз (РС) является хроническим воспалительным и нейродегенеративным заболеванием, при котором Т-клетки пересекают гематоэнцефалический барьер и атакуют миелиновые оболочки, запуская воспалительный каскад. Результатом этого процесса является образование бляшек демиелинизации, глиоза и аксональной дегенерации [1]. РС является лидирующей причиной нетравматической инвалидизации среди молодых людей. Его распространенность, оцененная в целом для последних 30 лет, составила 83 случая на 100 000 населения, в то время как ежегодная заболеваемость в Европе составляет 4,3 случая на 100 000 населения. Соотношение распространенности заболевания среди женщин и мужчин составляет примерно 2 : 1 и может увеличиваться [2]. Болезнь поражает мужчин и женщин по-разному, включая возраст начала заболевания, его течение и прогноз [3]. Географическое положение также оказывает влияние на распространенность болезни: она увеличивается к северу и югу от экватора [4]. Заболевание может проявиться в возрасте до 50 лет, хотя наиболее часто начало приходится на 20–30 лет. При этом возраст начала болезни влияет на ее прогноз: у более молодых пациентов в общем наблюдается более медленное прогрессирование заболевания до более выраженных стадий инвалидизации по сравнению с более взрослыми пациентами (в цитируемом исследовании [5] оценивалось прогрессирование до 4 баллов по расширенной шкале инвалидизации (EDSS), что соответствует ограничению способности к прогулкам).
РС приводит к выраженной инвалидизации: спустя 15 лет (медиана) после начала болезни многие пациенты становятся неспособными ходить без посторонней помощи [6], а спустя 25 лет оказываются прикованными к инвалидному креслу [7]. Было показано, что на время между началом заболевания и началом необратимой инвалидизации влияет большое количество факторов: пол, возраст, симптомы, течение болезни, степень восстановления после первого рецидива, время до второго неврологического эпизода и количество рецидивов в первые пять лет заболевания. Однако эти факторы не влияют на последующее прогрессирование необратимой инвалидизации [5]. В дополнение к физической инвалидизации у 43 % пациентов наблюдается некоторая степень когнитивной дисфункции [8]. Социальные последствия РС велики и включают ограничение способности к работе и выполнению рутинных задач по хозяйству, социального функционирования и рост психопатологии [9]. Вдобавок к этому РС относится к заболеваниям, сокращающим жизнь пациентов: в среднем ожидаемая длительность жизни снижается на 10–12 лет [10, 11]. Исследование причин смертности среди пациентов с РС выявило, что 47 % смертей были связаны с осложнениями РС и что частота суицидов была в 7,5 раза выше, чем в общей популяции сравнимого возраста [12].
Клиническое течение РС является гетерогенным, варьирующим между пациентами, а также у одного и того же пациента. По клиническому течению РС делят на вторично-прогрессирующий (ВПРС), первично-прогрессирующий и рецидивирующе-ремиттирующий (РРРС); последняя форма встречается у 85 % пациентов в начальной стадии течения болезни. Настоящая статья будет сфокусирована на РРРС, характеризующемся рецидивами, во время которых могут появиться новые симптомы и ухудшиться течение имеющихся симптомов, а также ремиссиями, во время которых пациент полностью или частично избавляется от нарушений, развившихся во время рецидивов [13].
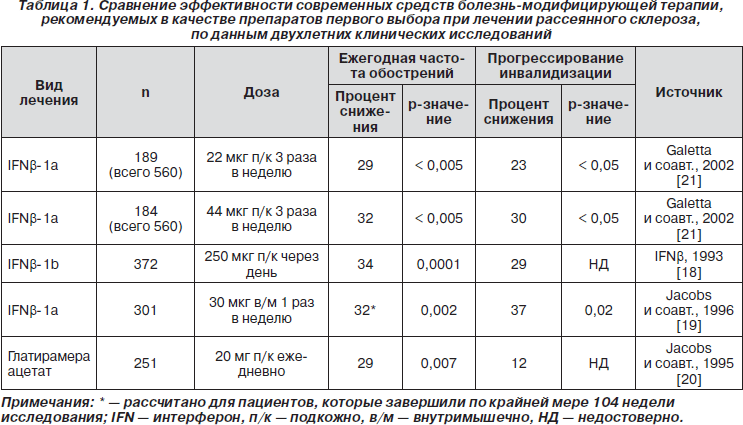
Эффективность доступной в настоящее время болезнь-модифицирующей терапии первого выбора
Считается, что инициирование воспалительных повреждений при РС связано с миграцией лимфоцитов через гематоэнцефалический барьер. Этот процесс опосредуется адгезией молекул и лигандов, экспрессируемых на эндотелиальных клетках и лейкоцитах. Современные средства болезнь-модифицирующей терапии (БМТ) имеют множество механизмов действия, включая возможное влияние на взаимодействие одной из таких молекул адгезии, интегрина-a4b1, с лигандом VCAM-1 (сосудистая молекула клеточной адгезии 1). Было показано, что некоторые средства БМТ увеличивают экспрессию VCAM-1 в активных бляшках головного и спинного мозга. Молекулы VCAM-1 могут связываться с активированными Т-клетками, предотвращая их проникновение через гематоэнцефалический барьер [14–16]. Доступная терапия включает интерфероны-b: IFNb-1a (вводимый подкожно (п/к) — ребиф или внутримышечно (в/м) — авонекс) и IFNb-1b (вводимый п/к — бетаферон). Точный механизм действия глатирамера ацетата, также известного как сополимер-1 (копаксон), неизвестен: он может действовать как иммуномодулятор или как «ловушка», учитывая его структурное сходство с миелином. Данные клинических исследований свидетельствуют о том, что все средства БМТ снижают ежегодную частоту рецидивов (ЕЧР), и только IFNb-1a (п/к или в/м) достоверно снижал нарастание инвалидизации по сравнению с плацебо, что было выявлено по изменению значений шкалы EDSS [17–21] (табл. 1). Однако подобная терапия характеризуется лишь умеренной эффективностью, и у большинства пациентов все еще наблюдается прогрессирование болезни. У большей части из них (62–75 %) в течение двух лет наблюдается рецидив, а у 20–27 % в течение двух лет происходит ухудшение на ≥ 1 балл по шкале EDSS. Кроме того, возникают проблемы с комплайeнсом к БМТ, главным образом вследствие развития побочных эффектов, особенно реакций в месте инъекций и гриппоподобных симптомов. В рамках ирландского исследования, включавшего анализ медицинских карт 394 пациентов с РС, было выявлено, что пятилетняя частота прекращения приема IFNb составила 28 % [22]. В этом исследовании была также обнаружена достоверная разница между частотой прекращения приема IFNb в группе с РРРС (14 %) и ВПРС (23 %) спустя три года лечения (p = 0,0003). Было показано, что пациенты прекращали прием IFNb вследствие развития побочных эффектов через 13 месяцев (медиана), а вследствие недостаточной эффективности проводимой терапии — через 35 месяцев (медиана) (p = 0,0004). Необходимо отметить, что у многих пациентов с РС наблюдается «прорыв» в активности болезни, несмотря на терапию вышеприведенными средствами, или же пациенты вовсе не чувствительны к проводимому лечению [23]. Из всего сказанного следует, что по состоянию на сегодняшний день все еще имеется острая необходимость в поиске более эффективных лекарственных средств, которые могли бы ограничить рецидивы и прогрессирование РС.
Натализумаб (Тизабри®) является относительно новым лекарственным средством, представляющим собой рекомбинантные человеческие антитела к интегрину-a4. Обычно его рассматривают в качестве препарата второй линии терапии при РС; в качестве препарата первой линии терапии он может быть использован в случаях быстро развивающегося тяжелого РРРС [24]. Цель настоящей статьи сводилась к тому, чтобы выполнить обзор широкого спектра традиционных и нетрадиционных эффектов натализумаба исходя из данных предварительных клинических исследований и исследований, выполненных после вывода препарата на рынок.
Механизм действия натализумаба
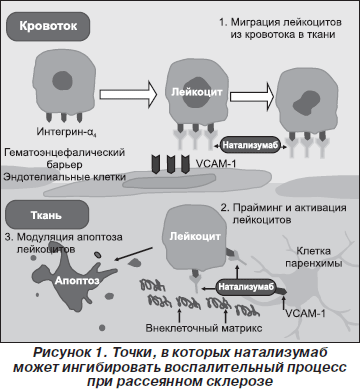
Натализумаб является первым антагонистом интегрина-a4 в классе лекарственных средств, называемых селективными ингибиторами молекул адгезии. Он связывается с интегрином-a4 на поверхности активированных Т-клеток, предотвращая адгезию между Т-клетками и эндотелиальными клетками и прерывая таким образом воспалительный каскад. Данный препарат представляет собой человеческие моноклональные антитела к интегрину-a4b1, полученные из моноклональных антител к человеческому интегрину-a4. Для натализумаба характерны три отчетливых механизма действия (рис. 1). Он тормозит миграцию лейкоцитов через гематоэнцефалический барьер путем блокирования адгезии к эндотелиальным клеткам и взаимодействия с белками внеклеточного матрикса, такими как фибронектин. Он также ограничивает прайминг и активацию лейкоцитов путем блокирования их взаимодействия с остеопорином и VCAM-1, экспрессируемыми на поверхности микроглиальных клеток и моноцитов мозговой паренхимы, и модулирует апоптоз лейкоцитов путем блокирования взаимодействия лейкоцитов, экспрессирующих интегрин-a4, с внеклеточным матриксом. Было показано, что после внутривенной инфузии 300 мг натализумаба время полувыведения составляет от шести до девяти дней, но молекулы интегрина-a4 остаются на 80 % процентов насыщенными данным препаратом приблизительно в течение одного месяца. Следовательно, натализумаб необходимо вводить один раз в месяц [16].
Данные клинических исследований применения натализумаба при рассеянном склерозе
В два крупных ключевых клинических исследования фазы III, посвященных клиническому применению натализумаба, в общей сложности было включено 2113 пациентов (3804 пациенто-года приема препарата). В ходе исследования эффективности и безопасности натализумаба при рецидивирующе-ремиттирующем рассеянном склерозе (AFFIRM) сравнили натализумаб и плацебо в течение 120 недель терапии у 942 пациентов с РРРС [25]. В рамках исследования SENTINEL сравнили комбинированную терапию натализумабом/IFNb-1a и монотерапию IFNb-1a в течение 120 недель у 1171 пациента с РРРС [23]. Группы пациентов в обоих исследованиях были больше по сравнению с таковыми в ранее выполненных исследованиях БМТ (табл. 1). Так как натализумаб в настоящее время рекомендуется принимать только в виде монотерапии, в настоящей статье мы сфокусируемся на исследовании AFFIRM.
Исследование AFFIRM
Исследование AFFIRM было выполнено как крупное клиническое исследование фазы III. Критерии включения: возраст 18–50 лет, диагноз РРРС, наличие одного документированного клинического рецидива или более в течение предшествующих 12 месяцев, значение по шкале EDSS между 0 и 5,0, выявление повреждений, характерных для РС, при выполнении магнитно-резонансной томографии [25]. Первичными конечными точками исследования были частота клинических рецидивов в течение одного года и частота стойкого прогрессирования инвалидизации в течение двух лет (последний показатель определялся как увеличение в течение 12 недель либо на 1,0 балла и более по шкале EDSS с исходного значения ≥ 1,0 баллa, либо на 1,5 балла и более с исходного значения 0 (прогрессирование не определяли во время рецидивов)). Пациенты были рандомизированы к внутривенным инфузиям натализумаба 300 мг (n = 627) или плацебо (n = 315) каждые четыре недели, общее количество инфузий — 30. Неврологическую оценку выполняли каждые 12 недель; МРТ-сканограммы головного мозга, взвешенные по протонной плотности или Т2-взвешенные и гадолиний-контрастированные Т1-взвешенные, снимали в исходных условиях, а также на 52-й и 104-й неделях. Средний возраст пациентов в плацебо-группе — 36,7 года, в группе с натализумабом — 35,6 года; количество женщин составило соответственно 67 и 72 %. Демографические характеристики и анамнез РС не различались между группами.
Исследование показало, что в течение двух лет терапии натализумаб существенно превзошел плацебо не только в общей популяции пациентов, но и в подгруппе с высокоактивным течением болезни (в нее включали пациентов, имеющих по крайней мере два рецидива за год до исследования и как минимум одно гадолиний-контрастированное повреждение в исходных условиях). Частота клинических рецидивов в общей популяции спустя один год лечения снизилась на 68 % (p < 0,001), что наблюдалось также и спустя два года лечения (рис. 2); в группе пациентов с высокой активностью РС уменьшение составило 81 % (p < 0,001). Риск стойкого прогрессирования инвалидизации (определяли по увеличению значений EDSS, удерживаемому на 12-й и 24-й неделях) при приеме натализумаба по сравнению с плацебо сократился на 42–54 % (p < 0,001) в общей популяции и на 53–64 % (p = 0,029 и p = 0,008) — среди пациентов с высокой активностью болезни. Во время дополнительной открытой фазы исследования AFFIRM (третий год терапии натализумабом) ЕЧР была низкой и наблюдалось минимальное увеличение значений EDSS [27]. Эффективность терапии подтверждалась также с помощью МРТ. Спустя два года терапии натализумаб снижал среднее число новых или увеличивающихся Т2-гиперинтенсивных повреждений на МРТ на 83 % (p < 0,001) и новых повреждений по данным гадолиний-контрастированной МРТ на 92 % (p < 0,001).
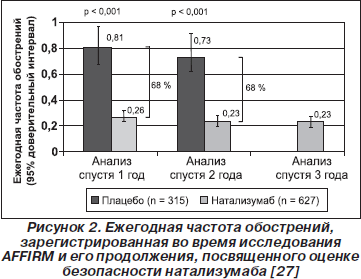
В рамках цитируемого исследования было показано, что натализумаб обладает хорошим профилем безопасности и переносимости. Единственными побочными эффектами, которые наблюдались достоверно более часто в группе с натализумабом по сравнению с плацебо-группой, были повышенная утомляемость и аллергические реакции. Реакции гиперчувствительности отмечены у 4 % пациентов, получавших натализумаб, при этом серьезный характер они носили у 1 % пациентов [25].
Нетрадиционные эффекты
При проведении апостериорного анализа данных исследования AFFIRM было обнаружено, что натализумаб превосходит плацебо по ряду нетрадиционных эффектов. В частности, было показано, что натализумаб достоверно улучшал качество жизни, зависящее от состояния здоровья (оценивали с помощью краткого варианта (SF-36) шкалы, оценивающей индекс физического и психического здоровья) [28]. Препарат также снижал потерю зрения на 35–46 % (p < 0,008) (оценивали в тесте на остроту зрения с неконтрастными буквами) [29]. Спустя два года лечения натализумаб достоверно снижал выраженность нарушений ходьбы, функции рук/ног и когнитивных функций. Кроме того, натализумаб уменьшал ЕЧР, требующих приема стероидных средств, и ежегодную частоту госпитализаций, связанных с РС [30]. На основе массива данных исследования AFFIRM была оценена пригодность нового показателя, предложенного для классификации прогрессирования инвалидизации, — ухудшение по крайней мере одного функционального композитного компонента рассеянного склероза на 20 % (MSFC-20) или 15 % (MSFC-15). Было получено, что этот показатель может быть рассмотрен в качестве чувствительного и всестороннего метода оценки [31].
Переопределение целей терапии
Несмотря на интенсивное лечение современными средствами БМТ, у большинства пациентов с РС болезнь продолжает быть активной и прогрессировать. При любых воспалительных процессах конечной целью терапии является устранение активности болезни и улучшение состояния больного. Однако до сегодняшнего дня она не была достижима у пациентов с РС [17–19].
При проведении ретроспективного анализа данных исследования AFFIRM было выявлено, что назначение натализумаба пациентам с исходным значением EDSS ≥ 2 приводило к достоверному увеличению вероятности стойкого уменьшения инвалидизации (что определялось как снижение на 1 балл по шкале EDSS в течение 12 недель) на 69 % по сравнению с плацебо (p = 0,006). У пациентов с высокой активностью болезни аналогичный показатель составил 143 % (p = 0,045) [32]. Механизм наблюдаемого улучшения не вполне понятен. Предварительные данные исследований, выполненных после выведения препарата на рынок, свидетельствуют о том, что натализумаб усиливает ремиелинизацию нейронов, особенно при РРРС. Однако для подтверждения этих данных необходимо проводить дальнейшие исследования [33].
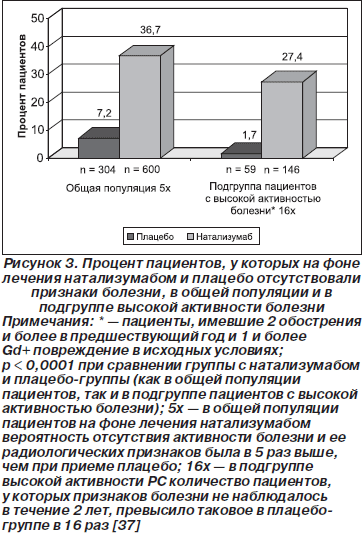
В другом анализе данных исследования AFFIRM было выявлено, что в группе с натализумабом вероятность отсутствия активности болезни была на 164 % выше, чем в плацебо-группе (p < 0,0001; отсутствие активности определялось как отсутствие рецидивов и стойкого прогрессирования болезни, оцениваемого по шкале EDSS). Кроме того, в группе с натализумабом вероятность отсутствия радиологических признаков болезни в течение двух лет терапии была в 4 раза выше, чем в плацебо-группе (p < 0,0001; отсутствие радиологических признаков определялось как отсутствие гадолиний-контрастированных повреждений и новых или увеличивающихся Т2-гиперинтенсивных повреждений). Когда приведенные результаты обобщили (выразили как композит клинических и радиологических данных), было получено, что улучшение в группе с натализумабом по сравнению с плацебо-группой было в пять раз больше. Это свидетельствует о том, что в будущем достижение ремиссии болезни может стать вполне реалистичной целью терапии. В подгруппе пациентов с высокой активностью болезни среди тех, которые получали натализумаб, улучшение композита клинических и радиологических данных в течение 2 лет терапии было в 16 раз больше по сравнению с таковым у получавших плацебо (рис. 3). Эффекты натализумаба были выраженнее на второй год, что свидетельствует о том, что эффективность лечения может увеличиваться с течением времени [34].
В ходе одного из исследований длительное время наблюдали за 23 пациентами с РС, которые ранее принимали участие в двух клинических исследованиях фазы III, посвященных оценке натализумаба [35]. Было отмечено, что спустя 14 месяцев после прекращения лечения натализумабом не появлялись какие-либо клинические, радиографические или иммунологические признаки, свидетельствующие о развитии «феномена отдачи». Более того, в течение этого периода времени наблюдалось возвращение сниженного содержания лимфоцитов и нарушенных клеточных соотношений к нормальному уровню, не было отмечено и каких-либо инфекционных осложнений. Таким образом, данные, полученные на ограниченном числе пациентов, свидетельствуют о том, что рецидивирование болезни и других осложнений может и не быть проблемой после лечения натализумабом, по крайней мере в течение рассматриваемого периода наблюдения.
Последствия прекращения терапии натализумабом были оценены при анализе данных крупного исследования [36], посвященного безопасности данного препарата, которое включало пациентов, принимавших участие в исследованиях AFFIRM [25], SENTINEL [23] и GLANCE (GLatiramer Acetate and Natalizumab Combination Evaluation — Комбинированная оценка глатирамера ацетата и натализумаба; в этом клиническом исследовании фазы II оценивали безопасность натализумаба + глатирамера ацетата по сравнению с таковой плацебо + глатирамера ацетата у 110 пациентов с РРРС в течение 24 недель терапии) [37]. Исследование безопасности [36] было быстро прекращено — терапию натализумабом добровольно приостановили после регистрации двух случаев прогрессирующей мультифокальной лейкоэнцефалопатии (ПМЛ) у пациентов с РС. Именно прекращение лечения натализумабом дало возможность оценить эффекты, связанные с отменой данного препарата. Анализ включал данные 946 пациентов, получавших натализумаб, которые вернулись в исследование для оценки безопасности после периода прекращения приема препарата. Эти пациенты получили в среднем 34,13 ± 4,08 дозы (диапазон 6–41) натализумаба, прежде чем перестали его принимать. Полученные данные подтвердили тот факт, что, как и ожидалось исходя из механизма действия и фармакодинамики натализумаба, к 4-му месяцу после прекращения лечения активность болезни возвращалась к плацебо-уровням, зарегистрированным в оригинальных исследованиях. При этом возвращение активности болезни, исходя из ЕЧР, было одинаковым во всех клинических подгруппах. В то же время у тех пациентов, у которых до включения в оригинальные исследования болезнь протекала более активно, после прекращения терапии наблюдалось большее абсолютное увеличение активности болезни по сравнению с теми пациентами, у которых исходно РС протекал менее активно. По-видимому, это было связано с большей тяжестью основного патологического процесса. После прекращения терапии натализумабом активность болезни не возвращалась к уровням, превышающим исходные. Было также обнаружено, что применение других средств БМТ после прекращения лечения натализумабом не приводило к задержке возвращения активности болезни; этот факт, однако, подлежит дальнейшей проверке в исследованиях с большим количеством пациентов [36].
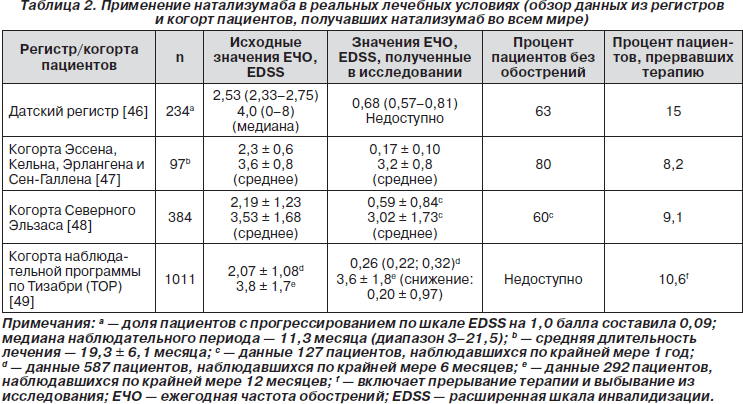
Данные об эффективности и безопасности натализумаба, полученные после вывода препарата на рынок
К июню 2009 г. натализумаб был одобрен более чем в 40 странах мира для лечения РРРС у пациентов, у которых другие лекарственные средства для лечения РС неэффективны или плохо переносятся. Он также был одобрен Управлением по контролю за качеством продуктов и лекарственных средств США (FDA) для лечения взрослых пациентов с умеренным и тяжелым течением болезни Крона. К концу сентября 2009 г. натализумаб получало около 60 700 пациентов [38]. Обзор данных из регистров и когорт пациентов, получавших натализумаб во всем мире после вывода препарата на рынок, включая влияние на частоту рецидивов и прогрессирование инвалидизации, представлен в табл. 2. Эти данные более объективно отражают истинную картину и свидетельствуют о том, что пациенты, получающие натализумаб в реальных лечебных условиях, немного старше, имеют более длительное течение болезни, более высокие значения по шкале EDSS и более высокую исходную ЕЧР, чем пациенты, включаемые в клинические исследования. Несмотря на эти различия, у пациентов, получавших натализумаб в реальной клинической практике, наблюдались стабилизация инвалидизации и ослабление активности болезни, сравнимые с таковыми в клинических исследованиях. Доля пациентов, прекращающих лечение натализумабом, была одинаковой во всех четырех исследованиях (8,2–15 %), а профиль безопасности был аналогичен тому, который наблюдался в исследовании AFFIRM [25]. В исследовании, выполненном на стыке медицины и экономики в Великобритании, было показано, что ценовая эффективность терапии натализумабом у всех пациентов с высокоактивным РРРС выше по сравнению с другими современными средствами БМТ [39].
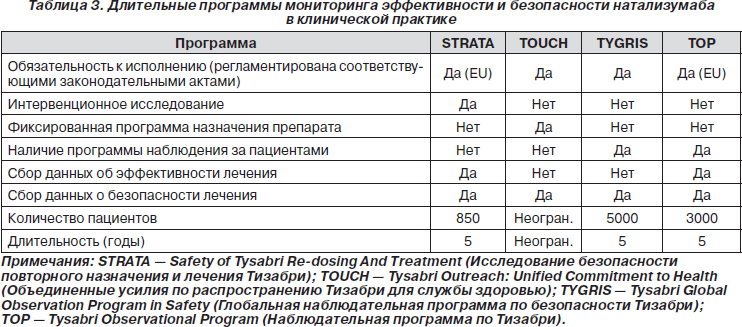
Безопасность при длительной терапии натализумабом
Натализумаб был добровольно выведен с рынка спустя один год после одобрения его FDA в 2004 г. в связи с регистрацией трех подтвержденных случаев прогрессирующей мультифокальной лейкоэнцефалопатии, которая представляет собой оппортунистическую вирусную инфекцию головного мозга. Данное заболевание было обнаружено у двух пациентов из исследования SENTINEL и у одного пациента с болезнью Крона [40, 41]. В 2006 г. FDA и Европейское медицинское агентство вновь одобрили данный препарат с обновленной инструкцией, и теперь он рекомендуется только в виде монотерапии [42]. В США натализумаб можно назначать, только придерживаясь специальной программы минимизации риска, которая обязательна к исполнению. От пациентов и врачей требуется участие в программе TOUCH (Tysabri Outreach: Unified Commitment to Health — Объединенные усилия по распространению Тизабри для службы здоровью), в рамках которой пациенты проходят скрининг на наличие ПМЛ перед каждой инфузией натализумаба [43]. По состоянию на 30 ноября 2009 г. было зафиксировано 28 случаев ПМЛ среди более чем 60 000 пациентов, получивших натализумаб после выхода данного препарата на рынок. Эта абсолютная цифра не должна пугать, ее следует рассматривать через призму того большого количества пациентов, которые получали натализумаб. В действительности более полезным показателем является частота развития ПМЛ у пациентов, получавших лечение в течение периода длительностью до трех лет. После проведения такого расчета оказалось, что риск развития ПМЛ возрастает по мере увеличения длительности терапии. У пациентов, получавших лечение в течение двух-трех лет, частота развития ПМЛ была сравнима с той, которая была зафиксирована в предварительных клинических исследованиях (до вывода препарата на рынок). По состоянию на сегодняшний день накоплено очень мало данных о пациентах, которые получали Тизабри сроком более трех лет.
Длительность приема натализумаба до развития ПМЛ варьировала от приблизительно одного года до более чем 3,5 года (12–44 инфузии). При этом частота развития ПМЛ возрастала по мере увеличения длительности терапии (рис. 4). К клиническим признакам и симптомам, заставляющим думать о развитии ПМЛ у пациентов, получающих натализумаб, относили появление новых или ухудшение имеющихся неврологических симптомов, наблюдаемое в течение нескольких недель, развитие фокальных неврологических признаков и других симптомов, таких как гемипарез, фокальная миоклония, афазия, ретрохиазмальное нарушение зрения, изменения в когнитивной сфере, поведении и изменения личности. При проведении МРТ-исследования у пациентов с ПМЛ обычно обнаруживали неконтрастируемые Т2-гиперинтенсивные повреждения в лобной, височной, теменной или затылочной областях; многие из этих повреждений являлись унифокальными. В дополнение к этому идентифицировались также гадолиний-контрастированные повреждения. При выполнении анализа методом полимеразной цепной реакции у пациентов с ПМЛ в цереброспинальной жидкости обнаруживали ДНК вируса JC. Необходимо отметить, что у большинства пациентов титры были низкими (< 500 копий/мл). Если развитие ПМЛ не было обусловлено приемом натализумаба, то появление новых или ухудшение имеющихся неврологических признаков и симптомов, изменения в ментальном статусе, судорожные припадки и лихорадка обычно не были связаны с наличием гадолиний-контрастированных повреждений [38].

Прием натализумаба прекращали при появлении первых признаков или симптомов и/или МРТ-данных, предполагающих развитие ПМЛ. Большинству пациентов, у которых развилась ПМЛ, была выполнена замена плазмы или иммуноадсорбция с целью ускорить выведение натализумаба из сосудистого русла.
Во время восстановления после ПМЛ вполне ожидаемым событием является развитие воспалительного синдрома восстановления иммунитета (IRIS). По-видимому, он появляется всегда при ПМЛ, связанных с приемом натализумаба, в отличие от ПМЛ при СПИДе, и при этом не зависит от того, быстро ли выводился натализумаб из организма или просто был прекращен прием данного препарата [40]. IRIS обычно развивался через четыре недели после прекращения приема натализумаба, хотя в некоторых случаях — и раньше. Как можно более раннее назначение кортикостероидов, иногда множественными курсами, при развитии IRIS приводило к улучшению у большинства пациентов. По состоянию на сегодняшний день большинство пациентов, которые получали натализумаб и у которых развилась ПМЛ, живы, но у них присутствует инвалидизация различной степени выраженности [38].
Количественный анализ рисков/выгод показал, что преимущества от назначения натализумаба, особенно у пациентов с высокой активностью болезни и при неэффективности других средств БМТ, существенно превышают риск развития ПМЛ [44]. Сегодня проводится множество долговременных программ по оценке эффективности и безопасности длительной терапии натализумабом (табл. 3). В настоящее время накоплено недостаточно данных об эффективности и безопасности натализумаба у пациентов с прогрессирующими формами РС, что не позволяет рекомендовать использование данного препарата при первично- и вторично-прогрессирующем РС [45].
Обсуждение
РС является серьезным заболеванием со значительными клиническими и социальными последствиями, поэтому имеется особая необходимость в поиске более эффективной его терапии. Высокий уровень эффективности натализумаба, продемонстрированный в клинических исследованиях и в исследованиях, выполненных после вывода препарата на рынок, подтверждает его терапевтическую значимость; одновременно его использование заставило пересмотреть цели лечения при РС в сторону их увеличения. Применение натализумаба приводит к уменьшению таких показателей активности болезни, как клиническая частота рецидивов, количество гадолиний-контрастированных и новых или увеличивающихся Т2-повреждений у пациентов с рецидивирующим РС. В дополнение к этому уменьшаются такие показатели тяжести болезни, как частота прогрессирования болезни по шкале EDSS и количество Т1- и Т2-повреждений, определяемых с помощью МРТ, у пациентов с РРРС. Применение натализумаба существенно улучшало связанное с состоянием здоровья качество жизни, а также физические и когнитивные функции. Его влияние особенно заметно у пациентов с высокой активностью болезни. Более того, было показано, что применение натализумаба приводит к стойкому снижению инвалидизации и отсутствию активности болезни, что представляет собой новые цели в терапии РС. Однако нужно помнить, что выявленные преимущества натализумаба должны быть сбалансированы с рисками. При его применении изредка развивается ПМЛ и другие оппортунистические инфекции. Обучение врачей и пациентов играет ключевую роль в ранней диагностике ПМЛ, и раннее прекращение приема натализумаба при подозрении на ПМЛ может улучшить наблюдаемые исходы. Предикторы риска развития ПМЛ в настоящее время тщательно исследуются. Поскольку натализумаб облегчал течение болезни даже у пациентов с высокоактивным РС, в будущих клинических исследованиях необходимо оценить эффективность лечения РС не только в отношении замедления прогрессирования, но также и в отношении снижения инвалидизации и достижения ремиссии.
Перевод А.В. САВУСТЬЯНЕНКО
Оригинал статьи опубликован в US Neurology. — 2010. — 5(2). — 72-7
1. Goodin D.S. et al. // Neurology. — 2002. — 58. — 169-78.
2. Pugliatti M. et al. // Eur. J. Neurol. — 2006. — 13. — 700-722.
3. Schwendimann R.N., Alekseeva N. // Int. Rev. Neurobiol. — 2007. — 79. — 377-92.
4. Richards R.G. et al. // Health Technology Assessment. — 2002. — 6(10).
5. Confavreux C. et al. // Brain. — 2003. — 126. — 770-82.
6. Weinshenker B.G. et al. // Brain. — 1989. — 112 (Pt 1). — 133-46.
7. Compstone A. McAlpine’s Multiple Sclerosis. — London: Churchill Livingstone, 1998.
8. Rao S.M. et al. // Neurology. — 1991. — 41. — 685-91.
9. Rao S.M. et al. // Neurology. — 1991. — 41. — 692-6.
10. Ebers G.C. // J. Neurol. Neurosurg. Psychiatry. — 2001. — 71 (Suppl. 2). — 16-19.
11. Sadovnick A.D. et al. // Neurology. — 1992. — 42. — 991-4.
12. Sadovnick A.D. et al. // Neurology. — 1991. — 41. — 1193-6.
13. Lublin F.D., Reingold S.C. // Neurology. — 1996. — 46. — 907-11.
14. Calabresi P.A. et al. // Ann. Neurol. — 1997. — 41. — 669-74.
15. Graber J. et al. // J. Neuroimmunol. — 2005. — 161. — 169-76.
16. Rudick R.A., Sandrock A. // Expert Rev. Neurother. — 2004. — 4. — 571-80.
17. PRISMS, Study and Group et al. // Lancet. — 1998. — 352. — 1498-1504.
18. IFNB Multiple Sclerosis Study Group // Neurology. — 1993. — 43. — 655-61.
19. Jacobs L.D. et al. // Ann. Neurol. — 1996. — 39. — 285-94.
20. Johnson K.P. et al. // Neurology. — 1995. — 45. — 1268-76.
21. Galetta S.L. et al. // Arch. Intern. Med. — 2002. — 162. — 2161-9.
22. O’Rourke K.E., Hutchinson M. // Mult. Scler. — 2005. — 11. — 46-50.
23. Rudick R.A. et al. // N. Engl. J. Med. — 2006. — 354. — 911-23.
24. Tysabri European Public Assessment Report (EPAR) Revision 6, June 18, 2009. Available at: www.emea.europa.eu/humandocs/Humans/EPAR/tysabri/tysabri.htm.
25. Polman C.H. et al. // N. Engl. J. Med. — 2006. — 354. — 899-910.
26. Hutchinson M. et al. // J. Neurol. — 2009. — 256(3). — 405-15.
27. O’Connor P.W. et al. The safety and tolerability of natalizumab: results from the safety-extension study in patients with multiple sclerosis. Paper presented at the 22nd Congress of the European Committee for Treatment and Research in Multiple Sclerosis, Madrid, Spain, September 29, 2006.
28. Rudick R.A. et al. // Ann. Neurol. — 2007. — 62. — 335-46.
29. Balcer L.J. et al. // Neurology. — 2007. — 68. — 1298-1304.
30. Phillips J.T. et al. The Effects of Natalizumab on Clinical Measures of Efficacy in MS, 20th Consortium of Multiple Sclerosis Centers (CMSC) Conference, Scottsdale, Arizona, 2006, abstract S61.
31. Rudick R.A. et al. // Mult. Scler. — 2009. — 15. — 984-997.
32. Munschauer F. et al. // Mult. Scler. — 2008. — 14. — S167-8 (P474).
33. Zivadinov R. et al. Natalizumab (Tysabri®) Promotes Remyelination in Patients with Multiple Sclerosis. A Voxel-Wise Magnetization Transfer Imaging Case-Control Study, Proceedings of the 61st Annual Meeting of the American Academy of Neurology, 2009, P03.071.
34. Havrdova E. et al. // Lancet Neurol. — 2009. — 8. — 254-60.
35. Stuve O. et al. // Neurology. — 2009. — 72(5). — 396-401.
36. O’Connor P.W. et al. Return of Disease Activity After Cessation of Natalizumab Therapy in Patients with Multiple Sclerosis, Presented at the 25th Congress of the European Committee for Treatment and Research in Multiple Sclerosis (ECTRIMS), Dusseldorf, Germany, September 9–12, 2009.
37. Goodman A.D. et al. // Neurology. — 2009. — 72(9). — 806-12.
38. Gani R. et al. // Pharmacoeconomics. — 2008. — 26. — 617-27.
39. Langer-Gould A. et al. // N. Engl. J. Med. — 2005. — 353. — 375-81.
40. Kleinschmidt-DeMasters B.K., Tyler K.L. // N. Engl. J. Med. — 2005. — 353. — 369-74.
41. Tysabri prescribing information. Biogen Idec. Inc., 2006. Available at: www.tysabri.com/en_US/tysb/site/pdfs/TYSABRI-pi.pdf.
42. Baker D.E. // Rev. Gastroenterol. Disord. — 2007. — 7. — 38-46.
43. Hyde R. et al. Utilization and safety of natalizumab in patients with relapsing Multiple Sclerosis in the postmarketing setting. Presented at the 19th World Congress of Neurology, Bangkok, Thailand, October 24–30, 2009. Presentation FP33-WE-04.
44. Thompson J.P. et al. // Neurology. — 2008. — 71(5). — 357-64.
45. Kappos L. et al. // Lancet Neurol. — 2007. — 6. — 431-41.
46. Oturai A.B. et al. // Eur. J. Neurol. — 2009. — 16(3). — 420-23.
47. Putzki N. et al. // Eur. J. Neurol. — 2010. — 17. — 31-7.
48. Outteryck O. et al. // J. Neurol. — 2009, Aug 27 (published online).
49. Wiendl H. et al. TYSABRI® Observational Program (TOP): Assessment of Long-term Safety and Impact on Disease Activity and Progression of TYSABRI (natalizumab) in Patients with Relapsing Remitting MS, Presented at the 25th Congress of the European Committee for Treatment and Research in Multiple Sclerosis (ECTRIMS), Dusseldorf, Germany, September 9–12, 2009, poster P814.