Международный неврологический журнал 4(4) 2005
Вернуться к номеру
Особенности антикоагулянтной терапии больных с мозговым полушарным ишемическим инсультом
Авторы: В.И. Дарий, Н.И. Бодня, Н.В. Березовская, О.В. Бут, И.Г. Ломейко, Е.Н. Бригадир, Н.М. Коломиец, О.А. Василакина, Запорожский государственный медицинский университет
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
Под нашим наблюдением находились 159 больных с полушарным мозговым инсультом, осложненным вторичным геморрагическим синдромом. 91 из них получал антикоагулянтную терапию гепарином, 37 — эноксапарином, 31 — надропарином. Детальному патоморфологическому обследованию подлежал 41 больной с полушарным ишемическим инсультом (ИИ), осложненным вторичным геморрагическим синдромом.
Исследования показали, что в зависимости от использования при ИИ разной антикоагулянтной терапии патанатомическая картина имела явные геморрагические изменения, а геморрагические осложнения — разную частоту. Наименьшая частота вторичных геморрагических осложнений была при использовании эноксапарина и надропарина.
мозговой инсульт, антикоагулянтная терапия.
Введение
Мозговой инсульт (МИ) представляет одну из главных проблем современной ангионеврологии и является основной причиной инвалидизации и смертности больных [4, 5, 6, 8]. Ведущую роль в течении МИ играют различные осложнения, запускающие целую цепь патофизиологических сдвигов, влияющих на исход процесса [2, 3, 7, 9]. Одним из таких осложнений являются всевозможные геморрагические трансформации. Геморрагические вторичные изменения в головном мозге, как правило, являются необратимыми и предопределяют неблагоприятный исход инсульта. В связи с этим диагностика этих осложнений в остром периоде, особенно полушарного ишемического инсульта (ИИ), необходима для оптимизации дифференцированной медикаментозной коррекции МИ и предупреждения его смертельных осложнений [1, 2, 3, 7]. В системе ургентной помощи ишемического инсульта в последнее время имеются достаточно определенные представления об эффективности фармакологической коррекции, влияющей на свертываемость крови. При этом предпочтение отдается антикоагулянтам [1, 2, 3, 10, 11, 12].
Высокий процент различных геморрагических осложнений (ГО) при ИИ, несмотря на современные подходы к показаниям и противопоказаниям применения антикоагулянтной терапии, рождает новые пути к дифференцируемому использованию этих средств [2, 3, 10].
Результаты исследования
Под нашим наблюдением находилось 159 больных с полушарным интрацеребрально осложненным ишемическим инсультом (ИОИИ) в возрасте от 42 до 85 лет. Из них было 89 мужчин и 70 женщин. Наблюдаемой группе проводилось комплексное клинико-патоморфологическое обследование.
Для определения удельного веса вторичных геморрагических трансформаций, как интраинфарктных, так и смешанных форм, была проанализирована структура смертности за год у 77 умерших с полушарным ИИ. Из 77 умерших с полушарным ишемическим инсультом у 22 отмечались геморрагические осложнения. То есть у трети умерших больных ИИ процесс усугублялся вторичными геморрагиями.
О роли вторичных геморрагических осложнений в исходе ИИ убедительно свидетельствуют данные продолжительности жизни этих больных, где демонстрируется зависимость прогнозирования течения ИИ от патоморфологического характера очага у больных с полушарными ишемическим инсультами. У лиц с ИИ без ГО она составила 7,87 ± 0,71 суток, а у лиц с ИИ, осложнившимся ГО, — 4,52 ± 0,47.
Вышеприведенные результаты показывают, что продолжительность жизни при ГО сокращается более чем в 1,5 раза по сравнению с группой больных ИОИИ, не осложнившимся вторичными кровоизлияниями.
Все вторичные кровоизлияния в мозг сочетались с ишемией, резко выраженным отеком и деформацией мозговых структур. При этом в условиях гипоксических изменений в области очага геморрагии и вокруг него происходит диапедез лейкоцитов, а затем эритроцитов в зону вторичного очага или по его периферии. Непременными предпосылками для геморрагического пропитывания является замедление тока крови, возникающего при быстрой дислокации и компрессии артерий, вен и капилляров, а в дальнейшем стаз, аноксия и нарушение проницаемости сосудов непосредственно в области вторичных поражений. Вторичные массивные кровоизлияния, преимущественно артериального происхождения, характеризовались наличием множества сливающихся между собой геморрагических фокусов с разрывом артерий в центре этих образований или с тяжелыми некробиотическими изменениями стенок артерий и вен.
По нашему мнению, антикоагулянты при определенных условиях обладают явной способностью запускать эти механизмы или усугублять уже имеющиеся геморрагические вторичные проявления в стволе.
Таким образом, почти каждый третий больной с развившимся тяжелым ИИ может иметь ГО, от которых во многом зависит исход мозговой сосудистой катастрофы. Поэтому особую важность приобретает подход к лечению ИИ, осложнившегося геморрагическим компонентом, так как в условиях полушарного ИИ, когда характер последнего абсолютно доказан компьютерными и клиническими данными, врач выбирает дифференцированную терапию, в которой на одном из первых мест в практической ангионеврологии стоят антикоагулянтные препараты — гепарин и низкомолекулярные гепарины [1, 2, 3, 4].
В связи с вышеизложенным целью настоящего исследования явилось изучение применения антикоагулянтной терапии (нефракционированного гепарина, эноксапарина (клексана), надропарина (фраксипарина) при ишемическом полушарном инсульте в остром периоде.
Для достижения поставленной цели был проведен метаанализ результатов медикаментозной терапии 159 больных с полушарными ИИ, получавших на фоне базисной антикоагулянтную терапию по общепринятой схеме : 1-я группа (91 больной) — гепарин (по схеме — внутривенно по 10 000 ЕД каждые 6 часов, затем внутримышечно под контролем свертываемости крови); 2-я группа (37 больных) — эноксапарин (по схеме — подкожно 20 мг раз в сутки либо 40 мг раз в сутки); 3-я группа (31 больной) — надропарин (по схеме — подкожно 0,3 мл раз в сутки либо 0,3 мл 2 раза в сутки). Причем были отобраны больные с артериальным давлением не более 180 мм рт.ст. и не имевшие коматозного состояния в дебюте ИИ, что являлось противопоказанием к назначению антикоагулянтов [4, 11].
Исходные данные системы гемостаза, исследованные в динамике острого периода МИ, характеризующие одновременно состояние свертывающей, фибринолитической и антикоагулянтной системы крови, показали идентичность результатов групп больных. Зависимость частоты возникновения ГО у лиц с ИИ от применения эноксапарина и надропарина представлена в табл. 1.
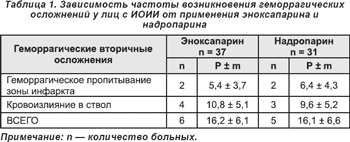
Как видно из вышеприведенной таблицы, достоверной разницы в возникновении при ИОИИ различных геморрагических осложнений в сравниваемых группах не возникало.
Поэтому представило определенный интерес проведение метаанализа результатов применения различных групп гепаринов. Зависимость частоты возникновения геморрагических осложнений у лиц с ИОИИ от применения различных групп антикоагулянтов представлены в табл. 2.
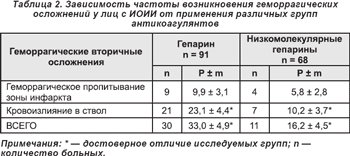
Как видно, пациенты, получавшие антикоагулянтную терапию гепарином, имели достоверно большее количество геморрагических осложнений (33,0 ± 4,9%), чем больные, применявшие низкомолекулярные гепарины (16,2 ± 4,5%) (p < 0,05). Причем, хотя и имелось некоторое снижение ГО в зоне инфаркта при применении низкомолекулярных гепаринов, достоверных отличий между двумя исследуемыми группами не отмечено. При этом вторичные геморрагические осложнения ствола значительно реже имели место при использовании низкомолекулярных гепаринов (p < 0,05).
При патоморфологических исследованиях разницы в структурных изменениях ГО в зоне инфаркта не отмечалось. Однако данные по частоте вторичных стволовых кровоизлияний прямо коррелировали с результатами патологоанатомических изменений в стволе мозга. На вскрытии у умерших, получавших антикоагулянтную терапию гепарином, в 14 случаях (66,7%) из 21 были обнаружены массивные вторичные кровоизлияния в стволе, состоящие из множества сливающихся между собой геморрагических очагов. У лиц, получавших низкомолекулярные гепарины, патоморфологически в стволе мозга массивные вторичные кровоизлияния отмечены лишь у трех (42,9%) из семи умерших с ГО.
Выводы
Резюмируя вышеприведенные результаты антикоагулянтной терапии при полушарном ИОИИ, можно судить о том, что, несмотря на улучшение состояния в области очага ишемии полушарий за счет оптимизации реологических свойств крови и повышенного ее притока, имеется угроза дополнительных геморрагических осложнений как в зоне очага, так и вне ее, вызванная применением данной терапии. Вышеизложенное доказывает необходимость учета дифференцированного лечения в зависимости от характера первичного поражения полушарных структур и от наличия вторичных ГО. Из препаратов антикоагулянтной направленности наиболее безопасными в плане геморрагических осложнений являются низкомолекулярные гепарины.
Перспективность дальнейшего исследования предполагает отработку безопасных доз препаратов и уточнение безопасных показаний к препаратам.
1. Ашман А.А., Суханин В.С., Липина Л.Н., Васильчев А.В. Принципы диагностики инфаркта мозга с геморрагическим компонентом // Материалы VIII Всероссийского съезда неврологов. — Казань, 2001. — С. 198.
2. Виничук С.М. Геморрагическая трансформация инсульта мозга: диагностические, клинические проявления и последствия // Укр. мед. часопис. — 2001. — №1 (21). — С. 91-95.
3. Виленский Б.С. Осложнение инсульта: профилактика и лечение. — СПб.: Фолиант, 2000. — 128 с.
4. Волошин П.В., Тайцлин В.И. Лечение сосудистых заболеваний головного и спинного мозга. — М.: Знание, 1999. — 557 с.
5. Григорова І.А. Стан біоенергетичного гомеостазу і метаболізму у хворих на ішемічний інсульт // Український вісник психоневрології. — 2002. — Т. 10. — Вип. 1 (30). — С. 41-42.
6. Гусев Е.И., Скворцова В.И. Ишемия головного мозга. — М.: Медицина, 2001. — 328 с.
7. Дарий В.И., Туманский В.А. Патоморфологические и клинические особенности вторичного стволового синдрома при мозговых инсультах // Материалы 6 конгресса невропатологов Украины. — Винница, 1998. — С. 65-68.
8. Зозуля І.С., Боброва В.І. Вторинна профілактика ішемічного інсульту: оптимізація лікувальної тактики // Український вісник психоневрології. — 2002. — Т. 10. — Вип. 1 (30). — С. 97-98.
9. Davenport R. Complications following acute stroke // Stroke. — 1996-b. — Vol. 27. — P. 415-420.
10. Frank M., Yatsu F., Robert G., Hart M. Anticoagulation of Embolic Strokes of Cardiac Origin: an Update. — Houston, 1988.
11. Samuels M.A. Manual of Neurologic Therapeutics. — Boston, New York, Toronto, London: Little, Brown and Company. — 1995. — 451 р.
