Журнал «Медицина неотложных состояний» 1 (40) 2012
Вернуться к номеру
Сердечно-легочная и церебральная реанимация
Авторы: Думанский Ю.В., чл.-корр. НАМН Украины, д.м.н., профессор Кабанова Н.В., д.м.н., профессор кафедры анестезиологии и интенсивной терапии ДонНМУ им. М. Горького Верхулецкий И.Е., зав. кафедрой хирургических болезней № 1 факультета интернатуры и последипломного образования ДонНМУ им. М. Горького, д.м.н., профессор Синепупов Н.А., доцент кафедры хирургических болезней № 1 факультета интернатуры и последипломного образования ДонНМУ им. М. Горького, к.м.н. Осипов А.Г., доцент кафедры хирургических болезней № 1 факультета интернатуры и последипломного образования ДонНМУ им. М. Горького, к.м.н. Синепупов Д.Н., ассистент кафедры хирургических болезней № 1 факультета интернатуры и последипломного образования ДонНМУ им. М. Горького
Рубрики: Семейная медицина/Терапия, Анестезиология-реаниматология, Медицина неотложных состояний, Кардиология, Неврология, Терапия
Разделы: Медицинское образование
Версия для печати
Актуальность
По данным статистики, ежегодно в нашей стране умирают более 2 млн человек, причем 75 % всех смертей происходят вне стен стационара. На первом месте среди причин смерти стоят болезни органов кровообращения. В течение первого часа, т.е. на догоспитальном этапе, погибают более 50 % из всех умирающих больных от острого инфаркта миокарда, причем основной причиной смерти (по некоторым данным — до 85 %) является фибрилляция желудочков. Около 1/4 всех смертельных исходов у людей не связано с инкурабельными заболеваниями либо старческими (деструктивными) изменениями в мозгу. Первичная остановка сердца у детей случается гораздо реже, чем у взрослых. У 10 % детей развившаяся клиническая смерть обусловлена фибрилляцией желудочков. Чаще всего она является следствием врожденной патологии. Наиболее частой причиной проведения сердечно-легочной реанимации у детей является травма. В Европе ежегодно у около 700 000 людей регистрируют внезапную смерть. Еще в конце 1950-х годов при проведении патологоанатомических исследований было отмечено отсутствие морфологических обоснований летальных исходов у значительной части умерших. Сердечно-легочная и церебральная реанимация является активно развивающимся направлением медицины критических состояний, и последующий прогресс в этой области связан с фундаментальными исследованиями критических состояний, процессов умирания и восстановления организма, минимизацией времени оказания медицинской помощи пострадавшим, оптимизацией методов предотвращения постреанимационной энцефалопатии. Философия реанимации обращена на личности людей, чья жизнь была внезапно прервана какими-либо причинами, когда имеет место необоснованная смерть вполне жизнеспособного и здорового организма, в отсутствие летального неизлечимого заболевания или тяжелой сенильной деменции. При этом определяющим критерием успешности сердечно-легочной и церебральной реанимации является восстановление полноценной функции мозга. В повседневной жизни появление врача на месте происшествия в течение первых пяти минут от развития остановки кровообращения нереально, и скорая помощь, особенно в условиях городских уличных пробок, в течение 0,5–1 часа добирается до пациента, в то время как счет идет на секунды (следует напомнить, что продолжительность клинической смерти, т.е. состояния, когда еще можно спасти жизнь человеку, продолжается до 5 минут). Таким образом, оказать помощь на месте развития клинической смерти может и должен любой человек, первый оказавшийся в данный момент рядом с пострадавшим. Очевидна закономерность: чем раньше начато оказание помощи, тем выше вероятность спасения человека, поэтому реанимационные мероприятия на месте происшествия должны быть наиболее эффективными и своевременными. Учитывая вышесказанное, можно сделать вывод о высокой актуальности проблемы организации первичной реанимационной помощи при терминальных состояниях, таких как, например, внезапная остановка кровообращения. Решение этой проблемы является одним из основных путей снижения уровня смертности и существенного повышения эффективности медицинской помощи населению.
Основные термины и их определение
Терминальные состояния (от лат. terminalis — «относящийся к концу, пограничный») — пограничные состояния между жизнью и смертью, критический уровень расстройства жизнедеятельности с катастрофическим снижением АД, глубоким нарушением газообмена и метаболизма. Широко распространена разработанная академиком АМН СССР В.А. Неговским трехстепенная классификация терминального состояния: предагония, агония, клиническая смерть. Кроме того, к терминальным состояниям относят также состояние оживленного организма после реанимации. Терминальные состояния этого типа возникли в связи с развитием реаниматологии. Они имеют сложную патофизиологическую природу и требуют от врача применения специального комплекса лечебных мер.
Предагональное состояние: общая заторможенность, сознание спутанное, АД не определяется, пульс на периферических артериях отсутствует, но пальпируется на сонных и бедренных артериях; дыхательные нарушения проявляются выраженной одышкой, цианозом и бледностью кожных покровов и слизистых оболочек.
Агональное состояние: диагностируют на основании следующего симптомокомплекса: отсутствие сознания и глазных рефлексов, неопределяемое АД, отсутствие пульса на периферических и резкое ослабление на крупных артериях; при аускультации определяются глухие сердечные тоны; на ЭКГ регистрируются выраженные признаки гипоксии и нарушения сердечного ритма.
Клиническая смерть: ее констатируют в момент полной остановки кровообращения, дыхания и выключения функциональной активности ЦНС. Непосредственно после остановки и прекращения работы легких обменные процессы резко понижаются, однако полностью не прекращаются благодаря наличию механизма анаэробного гликолиза. В связи с этим клиническая смерть является состоянием обратимым, а ее продолжительность определяется временем переживания коры больших полушарий головного мозга в условиях полной остановки кровообращения и дыхания. Диагностика клинической смерти проводится по основному, раннему, достоверному признаку — отсутствию пульса на сонных артериях и более позднему — наличию широких зрачков глаз. Для пальпации сонных артерий достаточно указательным и средним пальцами (пальцы располагать плашмя, а не кончиками) нащупать боковую поверхность щитовидного хряща, скользя затем по нему в направлении к позвоночнику, нащупать пульсирующую артерию. Отсутствие пульсации в этой области указывает на прекращение сердечных сокращений. Проверять пульс надо не прижимая сонную артерию, а только прикасаться к ней. Проверяйте пульс в течение 5–10 с. К этому приему нужно относиться так же ответственно, как и к технике искусственного дыхания и массажа сердца. «Мозговую смерть» как диагноз регистрируют при необратимом повреждении коры больших полушарий головного мозга (декортикация). Его обосновывает триада симптомов:
1. Отсутствие спонтанного дыхания (продолженная искусственная вентиляция легких (ИВЛ)).
2. Исчезновение корнеального и зрачковых рефлексов, как правило, соответствующее полной арефлексии.
3. Угасшая биоэлектрическая активность коры больших полушарий головного мозга, регистрируемая в виде изоэлектрической линии на ЭЭГ в течение 3 часов.
Биологическую смерть в обобщенном виде определяют как необратимое прекращение жизнедеятельности, то есть конечную стадию существования живой системы организма. Ее объективными признаками являются гипостатические пятна, понижение температуры и трупное окоченение мышц.
Сердечно-легочная и церебральная реанимация (СЛР) — система мероприятий, направленных на восстановление жизнедеятельности организма и выведение его из состояния клинической смерти. Включает в себя искусственную вентиляцию легких (искусственное дыхание) и непрямой массаж сердца. Решение о начале СЛР принимается при отсутствии реакции на раздражители и отсутствии видимого дыхания в течение 10 секунд. Всем указанным выше мероприятиям предшествует подготовительный период реанимации, предусматривающий диагностику терминальных состояний, укладывание на спину на жесткое основание, освобождение от стесняющих частей одежды. Учитывая острейший дефицит времени, вызванный продолжающейся гипоксией коры головного мозга, подготовительный этап реанимации должен занимать не более 10–15 с, что возможно только при строго определенной последовательности действий и отработке этих навыков. Определяющим фактором сердечно-легочной и мозговой реанимации является защита функции центральной нервной системы путем быстрого восстановления оксигенации, вентиляции и циркуляции у пациентов с остановкой кровообращения. Успех сердечно-легочной и мозговой реанимации высоковариабелен. Сердечно-легочная реанимация весьма эффективна при внезапной остановке сердечной деятельности, обусловленной электрической нестабильностью, но часто неэффективна при длительной дефибрилляции и если остановка сердца служит одним из проявлений прогрессирующего синдрома полиорганной недостаточности.
Большинство успешных реанимаций осуществляется только в течение 2–3 минут. У большинства успешно реанимированных пациентов потребовалось только восстановление проходимости дыхательных путей и кардиоверсия. Сердечно-легочная реанимация после 5–7 минут остановки кровообращения имеет худший прогноз, однако успешное восстановление может быть достигнуто и после 20–30-минутной реанимации, если она начата в первые минуты остановки сердечной деятельности. В условиях гипотермии успех может быть достигнут через 1 час сердечно-легочной реанимации.
Ранняя диагностика острых сердечно-сосудистых нарушений возможна только при наличии мониторинга. У большинства людей восстановление эффективного ритма достигается кардиоверсией при фибрилляции желудочков или вентрикулярных тахиаритмиях или путем ускорения ритма при желудочковых брадиаритмиях.
У пациентов, госпитализированных в отделения реанимации и интенсивной терапии, остановка сердечной деятельности часто имеет специфические причины (напряженный пневмоторакс, гипоксемия, гиповолемия, несахарный диабет и др.), и поэтому реанимационные мероприятия необходимо проводить строго индивидуально с учетом основного этиологического фактора. Одним из основных факторов, влияющих на уровень выживаемости, является длительность интервала времени с момента остановки кровообращения до начала СЛР. Поэтому после установления признаков клинической смерти (отсутствие пульсации на сонных артериях, апноэ, расширение зрачков) необходимо сразу приступать к проведению СЛР согласно алгоритму, предложенному П. Сафаром. Весь комплекс СЛЦР П. Сафар разделил на 3 стадии, каждая из которых имеет свою цель и последовательные этапы.
I cтадия. Элементарное поддержание жизни. Цель — экстренная оксигенация
Этапы:
А. Bосстановление проходимости дыхательных путей.
B. Искусственное поддержание дыхания.
C. Искусственное поддержание кровообращения.
А. Bосстановление проходимости дыхательных путей
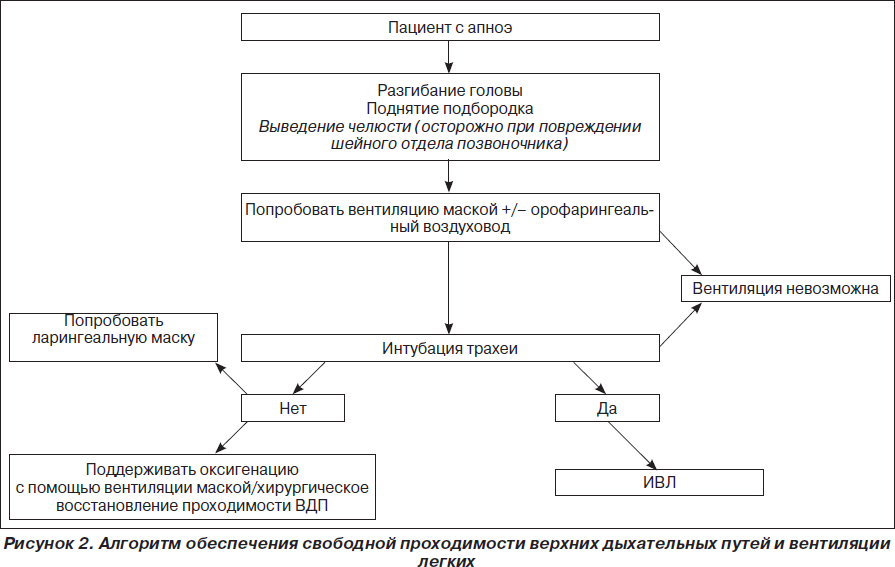
Золотым стандартом обеспечения проходимости дыхательных путей остается тройной прием по П. Сафару (запрокидывание головы, открытие рта, выдвижение нижней челюсти) и интубация трахеи. В качестве альтернативы эндотрахеальной интубации рекомендуется применение ларингеальной маски или двухпросветного воздуховода Combitube, как технически более простых в сравнении с интубацией, но одновременно надежных методов протекции дыхательных путей.
В. Искусственное поддержание дыхания
При проведении искусственной вентиляции легких методом «рот ко рту» каждый искусственный вдох должен проводиться в течение 2 секунд (не форсированно) при одновременном наблюдении за экскурсией грудной клетки для достижения оптимального дыхательного объема и предотвращения попадания воздуха в желудок. При этом реаниматор должен производить глубокий вдох перед каждым искусственным вдохом для оптимизации концентрации О2 во выдыхаемом воздухе, поскольку последний содержит только 16–17 % О2 и 3,5–4 % СО2. Дыхательный объем должен составлять 500–600 мл (6– 7 мл/кг), частота дыхания — 10/мин для недопущения развития гипервентиляции, которая вызывает повышение внутриторакального давления, что обусловливает снижение венозного возврата к сердцу и уменьшает сердечный выброс, ассоциируясь с плохим уровнем выживаемости больных.
С. Искусственное поддержание кровообращения
Фундаментальной проблемой искусственного поддержания кровообращения является очень низкий уровень (менее 30 % от нормы) сердечного выброса, создаваемого при компрессии грудной клетки. Правильно проводимая компрессия обеспечивает поддержание систолического АД на уровне 60–80 мм рт.ст., в то время как АД диастолическое редко превышает 40 мм рт.ст. и, как следствие, обусловливает низкий уровень мозгового (30–60 % от нормы) и коронарного (5–20 % от нормы) кровотока. Поэтому существенные изменения произошли в отношении компрессии грудной клетки. Так, при ее проведении коронарное перфузионное давление повышается только постепенно, поэтому с каждой очередной паузой, необходимой для проведения дыхания «рот ко рту», оно быстро снижается. Однако проведение нескольких дополнительных компрессий приводит к восстановлению исходного уровня мозговой и коронарной перфузии. Было показано, что соотношение числа компрессий к частоте дыхания, равное 30 : 2, является более эффективным, чем 15 : 2, обеспечивая наиболее оптимальное соотношение между кровотоком и доставкой кислорода:
1) соотношение числа компрессий к частоте дыхания без протекции дыхательных путей как для одного, так и для двух реаниматоров должно составлять 30 : 2 и осуществляться синхронизированно;
2) с протекцией дыхательных путей (интубация трахеи, использование ларингомаски или комбитьюба) компрессия грудной клетки должна проводиться с частотой 100/мин, вентиляция — с частотой 10/мин, асинхронно (т.к. компрессия грудной клетки с одновременным раздуванием легких увеличивает коронарное перфузионное давление).
II cтадия. Дальнейшее поддержание жизни. Цель — восстановление спонтанного кровообращения
Этапы:
D. Медикаментозная терапия (пути введения и фармакологическое обеспечение реанимации).
E. Электрокардиография или электрокардиоскопия.
F. Дефибрилляция.
D. Фармакологическое обеспечение реанимации
Путь введения лекарственных препаратов. Рекомендуются два основных доступа для введения препаратов:
— внутривенный, в центральные или периферические вены. Оптимальным путем введения являются центральные вены – подключичная и внутренняя яремная, поскольку обеспечивается доставка вводимого препарата в центральную циркуляцию. Для достижения этого же эффекта при введении в периферические вены препараты должны быть разведены в 10–20 мл физиологического раствора или воды для инъекций;
— эндотрахеальный: доза препаратов удваивается и вводится в разведении 10 мл воды для инъекций. При этом более эффективная доставка препарата может быть осуществлена при помощи катетера, проведенного за конец эндотрахеальной трубки. В момент введения препарата необходимо прекратить компрессию грудной клетки, а для улучшения всасывания несколько раз быстро провести нагнетание воздуха в эндотрахеальную трубку.
1. Адреналин: 1 мг каждые 3–5 минут в/в или 2–3 мг на 10 мл физиологического раствора эндотрахеально.
2. Атропин: 3 мг в/в однократно (этого достаточно для устранения вагусного влияния на сердце) при асистолии и электрической активности без пульса, ассоциированной с брадикардией (ЧСС < 60 уд/мин).
3. Амиодарон (кордарон) — антиаритмический препарат первой линии при фибрилляции желудочков/желудочковой тахикардии без пульса (ФЖ/ЖТ), рефрактерной к электроимпульсной терапии после 3-го неэффективного разряда, в начальной дозе 300 мг (разведенные в 20 мл физиологического раствора или 5% глюкозы), при необходимости повторно вводить по 150 мг. В последующем продолжить в/в капельное введение в дозе 900 мг более 24 часов.
4. Лидокаин: начальная доза 100 мг (1–1,5 мг/кг), при необходимости дополнительно болюсно по 50 мг (при этом общая доза не должна превышать 3 мг/кг в течение 1 часа) — в качестве альтернативы при отсутствии амиодарона. При этом он не должен использоваться в качестве дополнения к амиодарону.
5. Бикарбонат натрия — несмотря на то что при остановке сердечной деятельности и во время реанимационных мероприятий всегда развивается системный метаболический ацидоз, показания к введению бикарбоната натрия в настоящее время ограничены. Лучшая стратегия борьбы с ацидозом заключается в оптимизации циркуляции для созданий условий аэробного обмена. Бикарбонат натрия нельзя применять рутинно, его применение показано в случаях длительной реанимации и глубоком ацидозе (хотя большинство экспертов рекомендуют вводить при рН < 7,1). Бикарбонат натрия рекомендуется вводить в дозе 50 ммоль (50 мл — 8,4% раствора) в случае остановки кровообращения, ассоциированной с гиперкалиемией или передозировкой трициклических антидепрессантов.
6. Эуфиллин 2,4%: 250–500 мг (5 мг/кг) в/в при асистолии и брадикардии, резистентной к введению атропина.
7. Магния сульфат — при подозрении на гипомагниемию (8 ммоль = 4 мл 50% раствора).
8. Хлорид кальция: в дозе 10 мл 10% раствора при гиперкалиемии, гипокальциемии, передозировке блокаторов кальциевых каналов.
Е. Электрокардиографическая диагностика механизма остановки кровообращения
В реаниматологической практике для оценки ЭКГ применяют II стандартное отведение, позволяющее дифференцировать мелковолновую фибрилляцию желудочков и асистолию.
Выделяют 3 основных механизма остановки кровообращения: электрическую активность без пульса (ЭАБП), включающую в себя электромеханическую диссоциацию и тяжелую брадиаритмию (клинически брадиаритмия проявляется при ЧСС < 45 уд/мин у больного человека и при ЧСС < 30 у здорового), ФЖ/ЖТ без пульса и асистолию.
F. Дефибрилляция
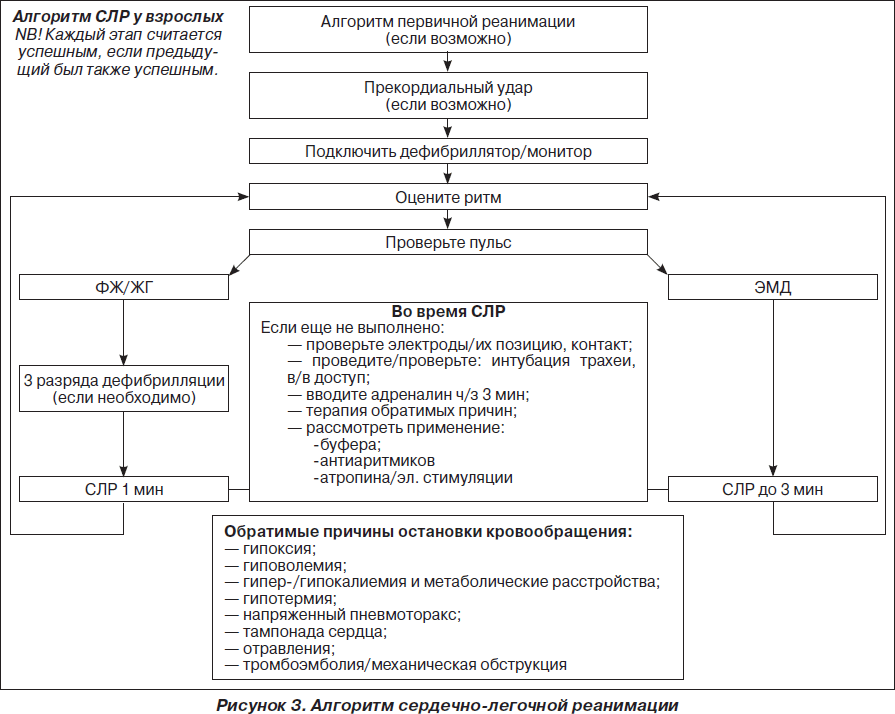
При ФЖ/ЖТ без пульса рекомендуется как можно раннее проведение дефибрилляции, т.к. с ее задержкой вероятность успешной дефибрилляции уменьшается на 10 % каждую минуту. Уровень выживаемости пациентов, которым была проведена дефибрилляция в первые 3 минуты с момента остановки кровообращения, составляет 74 %. В современном алгоритме дефибрилляции ERC’2005 рекомендуется проведение 1 начального разряда взамен стратегии трех последовательных разрядов более ранних рекомендаций ERC’2000. При невосстановлении самостоятельного кровообращения проводят базовый комплекс СЛР в течение 2 минут. После чего проводят второй разряд, и в случае неэффективности цикл повторяют.
Энергия первого разряда, которая рекомендуется в настоящее время ERC’2005, должна составлять для монополярных дефибрилляторов 360 Дж, как и все последующие разряды, что способствует большей вероятности деполяризации критической массы миокарда. Начальный уровень энергии для биполярных дефибрилляторов должен составлять 150–200 Дж с последующей эскалацией энергии до 360 Дж при повторных разрядах. С обязательной оценкой ритма после каждого разряда:
Разряд => СЛР в течение 2 мин => Разряд => СЛР в течение 2 мин…
Особенности проведения СЛР и условия ее прекращения
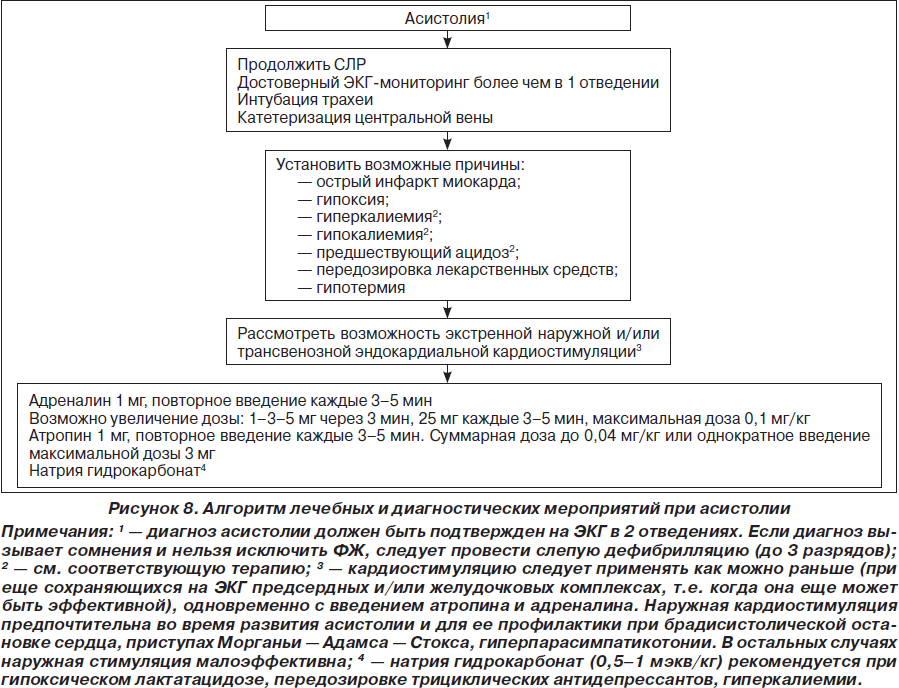
Возможности терапии при ЭАБП/асистолии достаточно ограничены и заключаются в проведении комплекса СЛР (включая введение адреналина и атропина) в течение 2 минут. Вероятность благоприятного исхода СЛР при ЭАБП/асистолии (как и при рефрактерной ФЖ/ЖТ без пульса) можно повысить только в том случае, если имеются потенциально обратимые причины остановки кровообращения, поддающиеся лечению. Они представлены в виде универсального алгоритма «четыре Г — четыре Т» (рис. 4).
Принятие решения о прекращении реанимации является достаточно сложным, однако пролонгирование СЛР более 30 минут редко сопровождается восстановлением спонтанного кровообращения. Исключение составляют следующие состояния: гипотермия, утопление в ледяной воде, передозировка лекарственных препаратов и перемежающаяся ФЖ/ЖТ без пульса. В целом СЛР должна продолжаться до тех пор, пока на ЭКГ регистрируется ФЖ/ЖТ без пульса, при которых сохраняется минимальный метаболизм в миокарде, обеспечивающий потенциальную возможность восстановления нормального ритма.
III cтадия. Длительное поддержание жизни. Цель — церебральная реанимация и постреанимационная интенсивная терапия полиорганной дисфункции
Этапы:
G. Оценка состояния (установление причины остановки кровообращения и ее устранение) и возможности полноценного спасения больного с учетом степени повреждения ЦНС.
H. Восстановление нормального мышления.
I. Интенсивная терапия, направленная на коррекцию нарушенных функций других органов и систем.
Ведение постреанимационного периода
Постгипоксическая энцефалопатия является наиболее распространенным вариантом течения постреанимационного синдрома, проявляющаяся в той или иной степени у всех пациентов, перенесших остановку кровообращения.
Экстрацеребральный гомеостаз
После восстановления спонтанного кровообращения терапия постреанимационного периода должна строиться на следующих принципах:
1. Поддержание нормотензии. Выраженная гипотензия, как и гипертензия, должна быть откорригирована. Непосредственно после восстановления самостоятельного кровообращения развивается церебральная гиперемия, но через 15–30 мин реперфузии общий мозговой кровоток снижается и развивается гипоперфузия. И поскольку происходит срыв ауторегуляции мозгового кровотока, его уровень зависит от уровня среднего артериального давления (САД). Поэтому очень важно удерживать САД на нормальном уровне.
2. Поддержание нормального уровня РаО2 и РаСО2.
3. Поддержание нормотермии тела. Риск плохого неврологического исхода повышается на каждый градус > 37 °С.
4. Поддержание нормогликемии (4,4–6,1 ммоль/л). Персистирующая гипергликемия ассоциирована с плохим неврологическим исходом. Пороговый уровень, при достижении которого необходимо начинать коррекцию инсулином, составляет 6,1–8,0 ммоль/л.
Интрацеребральный гомеостаз
1. Фармакологические методы. На данный момент отсутствуют, с точки зрения доказательной медицины эффективные и безопасные методы фармакологического воздействия на головной мозг в постреанимационном периоде.
Проведенные на нашей кафедре исследования позволили установить целесообразность применения перфторана в постреанимационном периоде. Перфторан уменьшает отек головного мозга, выраженность постреанимационной энцефалопатии и повышает активность коры мозга и подкорковых структур, способствуя быстрому выходу из коматозного состояния. Перфторан рекомендуется вводить в первые 6 часов постреанимационного периода в дозе 5–7 мл/кг.
2. Физические методы. В проведенном европейском рандомизированном клиническом испытании мягкой гипотермии (32–34 °С) у пациентов, перенесших остановку кровообращения с использованием охлаждения организма холодным воздухом (через 41–75 мин с момента остановки) до температуры 33 ± 1 °С в течение 24 часов, были получены хорошие неврологические исходы у 55 % в сравнении с 39 % пациентов с нормотермией. Поэтому пациентам без сознания, перенесшим остановку кровообращения во внебольничных условиях по механизму фибрилляции желудочков, необходимо обеспечить проведение гипотермии тела до 32–34 оС в течение 12–24 часов. Также указывается, что этот же режим гипотермии может быть эффективен у пациентов с другими механизмами остановки и в случае внутрибольничных остановок кровообращения.
Особенности сердечно-легочной реанимации у детей
Сердечно-легочная реанимация у детей имеет определенные особенности.
При проведении дыхания «рот ко рту» необходимо избегать чрезмерно глубоких вдуваний (то есть выдоха реаниматора). Показателем может служить объем экскурсии грудной стенки, которая у детей лабильна, и ее движения хорошо контролируются визуально. Инородные тела вызывают обструкцию дыхательных путей у детей чаще, чем у взрослых.
При отсутствии спонтанного дыхания у ребенка после 2 искусственных вдохов необходимо начинать массаж сердца, поскольку при апноэ сердечный выброс, как правило, неадекватно низкий, а пальпация пульса на сонной артерии у детей часто затруднена. Рекомендуется пальпировать пульс на плечевой артерии.
Следует отметить, что отсутствие видимого верхушечного толчка и невозможность его пальпации еще не свидетельствуют об остановке сердечной деятельности.
Если пульс есть, а спонтанное дыхание отсутствует, то реаниматор должен делать примерно 20 дыханий в 1 мин до восстановления спонтанного дыхания или применения более современных методов ИВЛ. Если пульсация центральных артерий отсутствует, необходим массаж сердца.
Компрессию грудной клетки у маленького ребенка производят одной рукой, а другую подкладывают под спину ребенка. При этом голова не должна быть выше плеч. Местом приложения силы у маленьких детей является нижняя часть грудины. Компрессию проводят 2 или 3 пальцами. Амплитуда движения должна составлять 1– 2,5 см, частота компрессий примерно 100 в 1 мин. Так же, как и у взрослых, нужно делать паузы для вентиляции. Соотношение «вентиляция/компрессия» также составляет 1 : 5. Примерно через каждые 3–5 мин проверяют наличие спонтанных сердечных сокращений. Аппаратную компрессию у детей, как правило, не применяют. Использовать противошоковый костюм у детей не рекомендуется.
Если открытый массаж сердца у взрослых считается более эффективным, чем закрытый, то у детей такого преимущества прямого массажа не выявлено. По-видимому, это объясняется хорошей податливостью грудной стенки у детей. Хотя в некоторых случаях при неэффективности непрямого массажа следует прибегать к прямому. При введении препаратов в центральные и периферические вены такой разницы в скорости наступления эффекта у детей не наблюдается, но если есть возможность, то катетеризация центральной вены должна быть произведена. Начало действия препаратов, вводимых детям внутрикостно, сравнимо по времени с внутривенным введением. Этот путь введения можно применять при сердечно-легочной реанимации, хотя могут наблюдаться осложнения (остеомиелит и др.). Риск микрожировой эмболии легочной артерии при внутрикостном введении есть, но клинически это не представляет особой важности. Также возможно эндотрахеальное введение жирорастворимых препаратов. Дозу рекомендовать трудно ввиду большой вариабельности скорости всасывания препаратов из трахеобронхиального дерева, хотя, по всей видимости, внутривенная доза адреналина должна быть увеличена в 10 раз. Дозу других препаратов также следует увеличить. В трахеобронхиальное дерево препарат вводят глубоко через катетер.
Внутривенное введение жидкости при проведении сердечно-легочной реанимации у детей имеет большее значение, чем у взрослых, особенно при тяжелой гиповолемии (кровопотеря, дегидратация). Детям нельзя вводить растворы глюкозы (даже 5%), потому что большие объемы содержащих глюкозу растворов быстрее, чем у взрослых, приводят к гипергликемии и увеличению неврологического дефицита. При наличии гипогликемии ее корригируют раствором глюкозы.
Наиболее эффективным препаратом при остановке кровообращения является адреналин в дозе 0,01 мг/кг (эндотрахеально в 10 раз больше). При отсутствии эффекта вводят повторно через 3–5 мин, увеличив дозу в 2 раза. При отсутствии эффективной сердечной деятельности продолжают внутривенную инфузию адреналина со скоростью 20 мкг/кг в 1 мин, при возобновлении сердечных сокращений дозу уменьшают. При гипогликемии необходимы капельные инфузии 25% растворов глюкозы, болюсных введений следует избегать, так как даже кратковременная гипергликемия может негативно отразиться на неврологическом прогнозе.
Дефибрилляция у детей применяется по тем же показаниям (фибрилляция желудочка, желудочковая тахикардия с отсутствием пульса), что и у взрослых. У детей младшего возраста применяют электроды несколько меньшего диаметра. Начальная энергия разряда должна составлять 2 Дж/кг. Если эта величина энергии разряда недостаточна, попытку надо повторить с энергией разряда 4 Дж/кг. Первые 3 попытки должны быть произведены с короткими интервалами. При отсутствии эффекта проводят коррекцию гипоксемии, ацидоза, гипотермии, вводят адреналина гидрохлорид, лидокаин.
Причины остановки сердца у детей и взрослых
1. Заболевания сердца:
— ишемическая болезнь сердца;
— острая обструкция кровообращения;
— синдром низкого выброса;
— кардиомиопатии;
— миокардит;
— травма и тампонада;
— прямая кардиостимуляция.
2. Циркуляторные причины:
— гиповолемия;
— напряженный пневмоторакс;
— воздушный или легочный эмболизм;
— вагальный рефлекс.
3. Респираторные причины:
— гипоксия (часто вызывает асистолию);
— гиперкапния.
4. Метаболические изменения:
— дисбаланс калия;
— острая гиперкальциемия;
— циркулирующие катехоламины;
— гипотермия.
5. Эффекты медикаментов:
— прямое фармакологическое действие;
— вторичные эффекты.
6. Разные причины:
— электротравма;
— утопление.
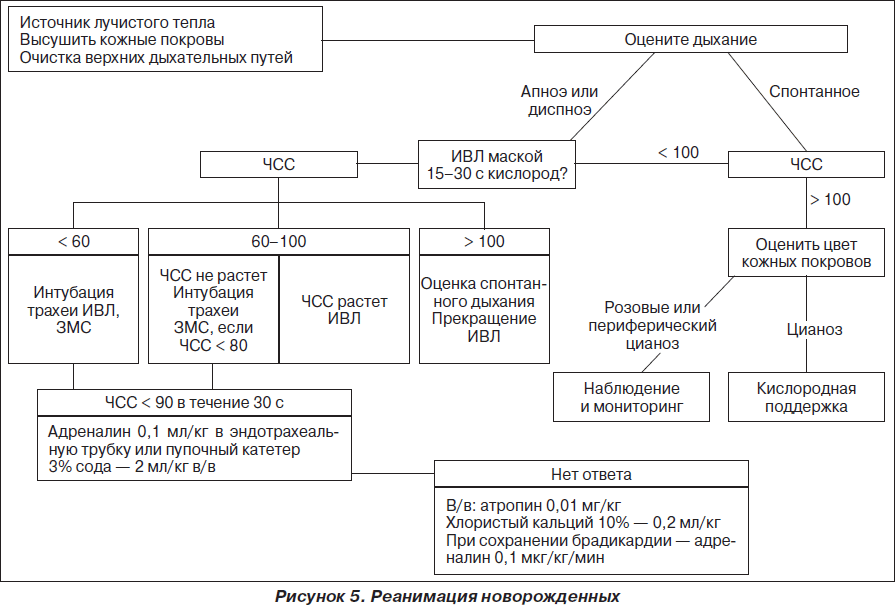
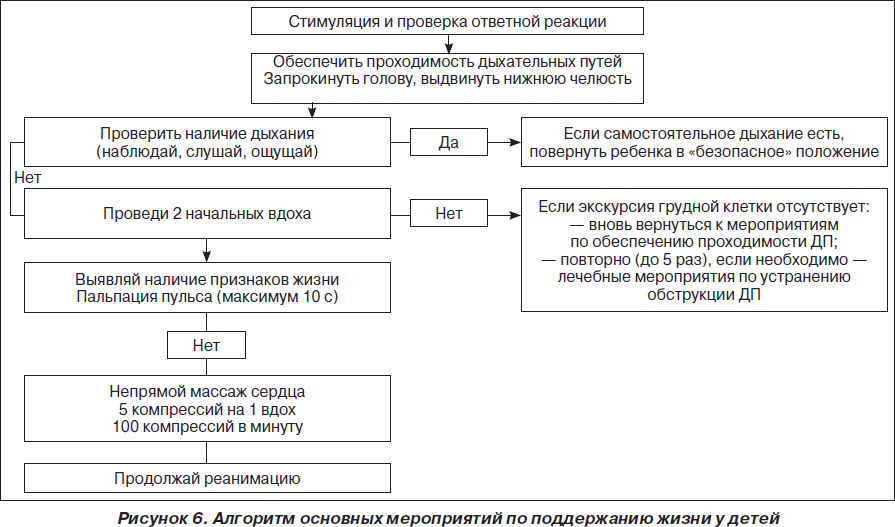
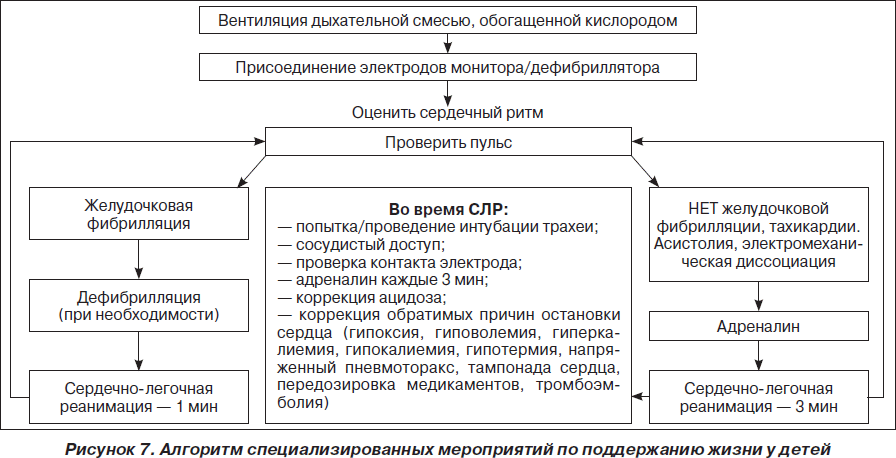
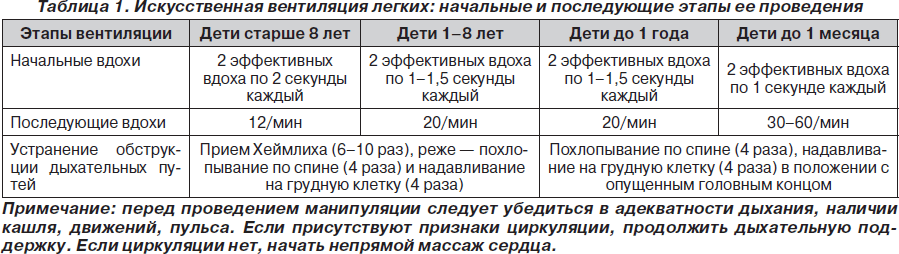
Алгоритмы основных действий при сердечно-легочной и церебральной реанимации у детей и взрослых
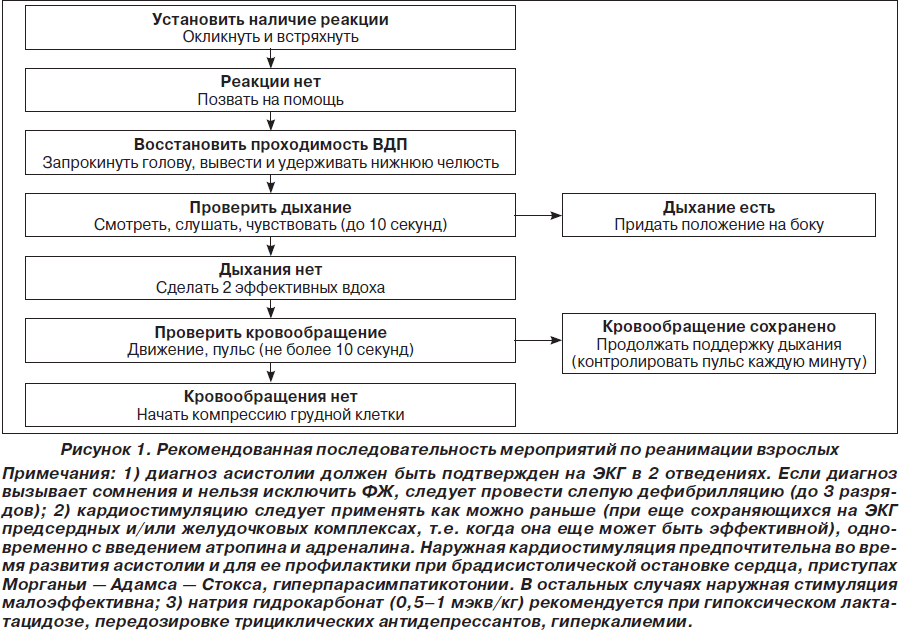
Алгоритмы основных действий при сердечно-легочной и церебральной реанимации у детей и взрослых представлены на рис. 1–8 и табл. 1, 2.