Журнал «Боль. Суставы. Позвоночник» 4 (04) 2011
Вернуться к номеру
Дефіцит та недостатність вітаміну D у жителів України
Авторы: Поворознюк В.В., Балацька Н.І., Муц В.Я., Вдовіна О.А., ДУ «Інститут геронтології імені акад. Д.Ф. Чеботарьова НАМН України», м. Київ
Рубрики: Семейная медицина/Терапия, Ревматология, Травматология и ортопедия, Неврология
Версия для печати
У статті детально розглядається роль вітаміну D в організмі людини, причини та клінічна картина його дефіциту. З метою вивчення частоти дефіциту вітаміну D серед населення України було проведено комплексне обстеження жителів різних регіонів країни. Для визначення впливу вікового фактору та сезону на рівень 25(ОН)D проводилося дослідження даного показника в різних вікових групах та за різної пори року.
Summary. In the article there were analyzed in detail the role of vitamin D in human organism, causes and clinical picture of its deficiency. To investigate the incidence of vitamin D deficiency among population of Ukraine there was carried out complex examination of residents of different regions of the country. To define the impact of age factor and season on the level of 25(ОН)D there was carried out a study of this index in various age groups and in different seasons.
Резюме. В статье детально рассматривается роль витамина D в организме человека, причины и клиническая картина его дефицита. С целью изучения частоты дефицита витамина D среди населения Украины было проведено комплексное обследование жителей разных регионов страны. Для определения влияния возрастного фактора и сезона на уровень 25(ОН)D проводилось исследование данного показателя в разных возрастных группах и в разные времена года.
Вітамін D, недостатність, дефіцит.
Key words: vitamin D, insufficiency, deficit.
Ключевые слова: витамин D, недостаточность, дефицит.
Історичні дані
Можливість вилікувати рахіт після відкриття вітаміну D вважається однією з найбільших перемог сучасної медицини [1]. Від ранніх досліджень, проведених McCollum та Davis [2] у 1913 році (коли вітамін був власне відкритий), і аж до 1940 року, коли був знайдений зв’язок між цим вітаміном та запобіганням розвитку гіпокальцемічних судом, відбулося кілька ключових подій. Спочатку вважалося, що антирахітична активність риб’ячого жиру пов’язана з поки що не виявленими властивостями вітаміну А, але McCollum деактивував вітамін А шляхом пропускання кисню через нагрітий риб’ячий жир — і він усе ще мав антирахітичні властивості. Власне тоді й була дана назва вітаміну D [4]. Структура вітаміну D2 була визначена в 1931 році [5], а структура D3 була відтворена синтетичним методом дещо пізніше [6]. Вітамін D був виявлений майже одночасно з низкою інших вітамінів, і ця назва за ним зберігається навіть в наш час. Щоправда знахідки другої половини ХХ століття вказують на те, що правильніше його називати прогормоном, а не вітаміном.
Роль вітаміну D в організмі людини
Концентрація вітаміну D у плазмі крові повинна бути достатньою для забезпечення формування кісткового матриксу. Якщо ж цей рівень виявляється недостатнім, адекватна мінералізація стає неможливою, що спричинює рахіт у дітей та остеомаляцію в дорослих [7]. Вітамін D підтримує концентрацію кальцію в сироватці крові трьома різними способами.
1. Індукція білків, що беруть участь в активній абсорбції кальцію в просвіті шлунково-кишкового тракту. Крім того, вітамін D стимулює активну інтестинальну абсорбцію фосфатів. Цей механізм реалізується після з’єднання ліганда 1,25(ОН)2D та рецептора вітаміну D (VDR). При гіповітамінозі D лише близько 10–15 % кальцію може всмоктуватися у просвіті тонкої кишки. В той самий час при достатньому рівні вітаміну D абсорбція збільшується в 2–3 рази [8].
2. Підтримання стабільного рівня кальцію в сироватці крові навіть за відсутності його надходження з їжею: вітамін D стимулює остеобласти до продукції RANKL (receptor activator nuclear factor-kB ligand). RANKL, у свою чергу, стимулює остеокластогенез та активує резорбцію кісткового матриксу шляхом впливу на неактивні остеокласти [9]. Для активації цього механізму дуже важливим є не лише наявність вітаміну D, але і паратгормону (ПТГ) [10, 11].
3. Близько 1 % кальцію реабсорбується у дистальних ниркових канальцях, і на цей процес мають вплив як вітамін D, так і паратгормон [12]. Доведено, що у дорослих щодня таким чином утримується близько 7 г кальцію.
Гіповітаміноз D стимулює ентероцити до абсорбції як кальцію, так і фосфатів. Якщо сироваткові рівні кальцію внаслідок цього не підвищуються достатнім чином, збільшується концентрація паратгормону, що стимулює вивільнення кальцію з кісткового депо (цей процес також потребує участі вітаміну D). Отже, існує механізм першочергового використання кальцію, що надходить із їжею, але за відсутності цього джерела мобілізуються власні запаси організму, що, у свою чергу, призводить до підвищеної резорбції кісткової тканини та в подальшому до розвитку остеопорозу.
Джерела вітаміну D
В організм людини вітамін D2 надходить у відносно невеликих кількостях — не більше 20–30 % від потреби. Основними його постачальниками є продукти зі злакових рослин, риб’ячий жир, вершкове масло, маргарин, молоко і яєчний жовток. Вітамін D2 метаболізується з утворенням похідних, що справляють подібну до метаболітів вітаміну D3 дію.
Інша природна форма вітаміну D — вітамін D3, або холекальциферол, є малозалежним від надходження ззовні та найближчим аналогом вітаміну D2.
Холекальциферол синтезується в організмі хребетних тварин, у тому числі амфібій, рептилій, птахів і ссавців, у зв’язку з чим відіграє значно більшу роль у процесах життєдіяльності людини, аніж вітамін D2, що надходить із їжею. Вітамін D3 утворюється в дермальному шарі шкіри з попередника провітаміну D3 — 7-дегідрохолестеролу під впливом короткохвильового ультрафіолетового випромінювання спектра В (довжина хвилі 290–315 нм) у результаті фотохімічної реакції розкриття кільця стероїдного ядра і термоізомеризації, характерної для секостероїдів [20].
Вітамін D (надходить із їжею або утворюється в організмі в процесі ендогенного синтезу) у результаті двох послідовних реакцій гідроксилювання біологічно малоактивних прегормональних форм піддається перетворенню в активні гормональні форми: найбільш важливу, якісно і кількісно значиму — 1,25-дигідроксивітамін D (1,25(ОН)2D), так званий D-гормон (кальцитріол), і мінорну — 24,25(ОН)2D.
Рівень утворення D-гормону в організмі дорослої здорової людини становить близько 0,3–1,0 мкг/добу. Перша реакція гідроксилювання здійснюється переважно в печінці (до 90 %) за участю мікросомального ферменту 25-гідроксилази з утворенням проміжної біологічно малоактивної транспортної форми — 25-гідроксивітамін D3 (25(ОН) вітаміну D) або кальцидіолу (25(OH)D3).
Гідроксилювання вітаміну D в печінці не є об’єктом будь-яких позапечінкових регулюючих впливів та є повністю субстратзалежним процесом. Реакція 25-гідроксилювання перебігає досить швидко і веде до підвищення рівня 25(ОН)D у сироватці крові. Рівень цієї речовини відображає як утворення вітаміну D у шкірі, так і його надходження з їжею, у зв’язку з чим сьогодні вважається золотим стандартом для визначення статусу вітаміну D в організмі людини [22]. Частково транспортна форма 25(ОН)D, що надходить у жирову та м’язову тканини, може створювати тканинні депо з невизначеним терміном існування.
Подальша реакція 1a-гідроксилювання 25(ОН)D перебігає в основному в клітинах проксимальних відділів канальців кори нирок за участю ферменту 1a-гідроксилази (25-гідроксивітамін D-1a-гідроксилаза, CYP27В1). У значно меншому, ніж у нирках, обсязі 1a-гідроксилювання здійснюється і клітинами лімфогемопоетичної системи, в кістковій тканині і, як установлено останнім часом, клітинами деяких інших тканин, що містять як 25(ОН)D, так і 1a-гідроксилазу (рис. 1).
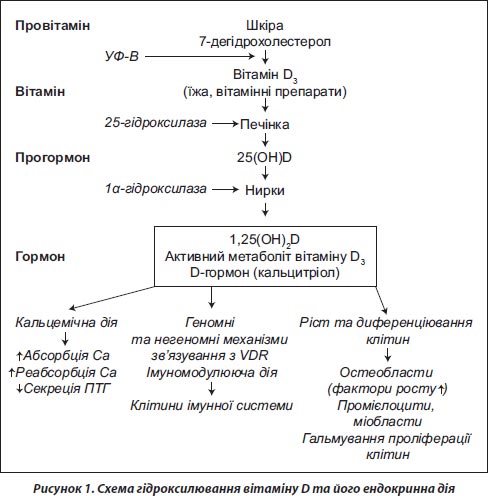
Утворення в нирках 1,25(ОН)2D регулюється низкою ендогенних і екзогенних факторів. Зокрема, регуляція синтезу 1,25(ОН)2D в нирках є безпосередньою функцією ПТГ, на концентрацію якого в крові, у свою чергу, за механізмом зворотного зв’язку, впливає як рівень активного метаболіту вітаміну D, так і концентрація кальцію та фосфору в плазмі крові. Крім того, активуючий вплив на 1a-гідроксилазу і процес 1a-гідроксилювання мають й інші фактори, до яких належать статеві гормони (естрогени та андрогени), кальцитонін, пролактин, гормон росту (через інсуліноподібний фактор росту 1) та інші. Інгібіторами 1a-гідроксилази є 1,25(ОН)2D і низка його синтетичних аналогів, зокрема глюкокортикостероїди, фактор росту фібробластів (FGF23), що секретується в клітинах кістки та викликає утворення натрій-фосфат-котранспортера, який діє в клітинах нирок і тонкого кишечника, має гальмівний вплив на синтез 1,25(ОН)2D. На метаболізм вітаміну D впливають і деякі лікарські засоби (наприклад, протиепілептичні засоби, глюкокортикоїди).
1,25(ОН)2D підвищує експресію 25-гідроксивітаміну D-24-гідроксилази (24-OHази) — ферменту, який каталізує його подальше перетворення, що призводить до утворення водорозчинної біологічно неактивної кальцитрієнової кислоти, яка виділяється з жовчю [23, 24].
Усі перераховані компоненти метаболізму вітаміну D та RVD об’єднують в ендокринну систему вітаміну D, функції якої полягають у здатності генерувати біологічні реакції у більше ніж 40 тканинах-мішенях за рахунок регуляції RVD-транскрипції генів (геномний механізм) і швидких позагеномних реакцій, здійснюваних при взаємодії з RVD, локалізованими на поверхні низки клітин. За рахунок геномних і позагеномних механізмів D-ендокринна система здійснює реакції підтримки мінерального гомеостазу (насамперед, у рамках кальцій-фосфорного обміну), концентрації електролітів та обміну енергії. Крім того, вона бере участь у підтриманні адекватної мінеральної щільності кісток, метаболізму ліпідів, регуляції артеріального тиску, росту волосся, стимуляції диференціювання клітин, інгібування клітинної проліферації, реалізації імунологічних реакцій (імунодепресивна дія).
Причини дефіциту вітаміну D
Основною причиною дефіциту вітаміну ДВD є недостатнє перебування на сонці, оскільки дуже мало харчових продуктів містять вітамін D або збагачені ним [25, 26]. Застосування сонцезахисних засобів з фактором захисту SF 30 зменшує синтез вітаміну D у шкірі на більше ніж 95 % [27]. Люди, в яких від природи темна шкіра, забезпечені природним захистом від сонця, і для синтезу однакової кількості вітаміну D вони повинні перебувати на сонці принаймні в 3–5 разів довше, ніж люди зі світлою шкірою [25]. Існує зворотний зв’язок між сироватковим рівнем 25(OH)D та індексом маси тіла (ІМТ) понад 30 кг/м2, і, таким чином, ожиріння асоціюється з дефіцитом вітаміну D [28]. У пацієнтів із синдромом мальабсорбції жирів та у хворих, які перенесли баріатричне лікування, часто жиророзчинний вітамін D не всмоктується, а в пацієнтів із нефротичним синдромом 25(OH)D з’єднується з вітамін-D-зв’язувальним білком та виділяється з сечею [25]. До групи ризику належать також ті пацієнти, які приймають цілу низку лікарських засобів, зокрема протисудомні препарати та препарати для лікування ВІЛ/СНІДу, оскільки ці лікарські засоби посилюють катаболізм 25(OH)D і 1,25(OH)2D [29]. Хворі на хронічні захворювання, що супроводжуються утворенням гранульом, пацієнти з деякими лімфомами та хворі на первинний гіперпаратиреоз, у яких відзначається підвищений рівень метаболізму 25(OH)D до 1,25(OH)2D, також належать до групи підвищеного ризику дефіциту вітаміну D [29]. Нижче наведено показання щодо визначення рівня 25(ОН)D у сироватці крові.
Показання до вимірювання рівня 25(OH)D:
— Рахіт.
— Остеомаляція.
— Остеопороз.
— Хронічна хвороба нирок.
— Печінкова недостатність.
— Синдроми мальабсорбції:
- муковісцидоз;
- запальні захворювання кишечника;
- хвороба Крона;
- баріатрична операція;
- радіаційний ентерит.
— Гіперпаратиреоз.
— Прийом лікарських засобів:
- протисудомні препарати;
- глюкокортикоїди;
- противірусні препарати для лікування СНІДу;
- протигрибкові препарати, наприклад кетоконазол;
- холестирамін.
— Діти і дорослі афроамериканського і латиноамериканського походження.
— Вагітні жінки і жінки, які годують груддю.
— Особи літнього віку з падіннями в анамнезі.
— Особи літнього віку з патологічними переломами в анамнезі.
— Діти і дорослі з ожирінням (ІМТ > 30 кг/м2).
— Захворювання, що супроводжуються утворенням гранульом:
- саркоїдоз;
- туберкульоз;
- гістоплазмоз;
- кокцидіомікоз;
- бериліоз;
- деякі лімфоми.
Класифікація
Згідно з сучасними рекомендаціями [29], дефіцит вітаміну D визначається як рівень 25(OH)D менший за 20 нг/мл (50 нмоль/л), недостатність вітаміну D — як рівень 25(OH)D, що становить 21–29 нг/мл (50,1–74,9 нмоль/л). Рівень 25(ОН)D вище за 75,0 нмоль/л знаходиться в межах норми. Інтоксикація вітаміну D, як правило, не виникає при рівні нижче за 150 нг/мл (375 нмоль/л).
Клінічна картина
Дефіцит вітаміну D викликає порушення мінералізації кісткової тканини. У дітей спостерігається розм’якшення кісток, що з часом спричиняє їх деформацію, затримку фізичного розвитку, гіперплазію епіфізів довгих трубчастих кісток, деформацію нижніх кінцівок. Дорослі з остеомаляцією можуть відчувати загальний дискомфорт у кістках, що посилюється при натискуванні на грудину чи великогомілкову кістку, біль у нижній частині спини (у жінок літнього віку). Також пацієнти відчувають біль у м’язах, що нагадує фіброміалгії. Таким хворим часто встановлюють діагноз хронічної втоми, фіброміалгії, артриту. Оскільки рецептори до вітаміну D знаходяться в скелетних м’язах, то дефіцит може призводити до слабкості проксимальних м’язів та підвищеного ризику падінь [23, 25, 30].
Поширеність дефіциту вітаміну D у світі
За винятком більшості країн Африки та деяких держав Азії, питання поширеності дефіциту вітаміну D у світі досить добре вивчене. Порівнюючи дані з різних джерел, потрібно брати до уваги такі фактори:
1. Культурно-історичні традиції. У ряді країн, близьких до екватора, ДВD є більш поширеним, ніж у помірному поясі. Носіння одягу, який закриває практично все тіло через релігійні переконання (хіджаб) або через популярні уявлення (світла шкіра вважається показником благородного походження у ряді країн), повністю нівелюють фактор ультрафіолету.
2. Метаболізм вітаміну D дещо відрізняється у людей різних національностей.
3. Глобалізація. Жителі приполярних областей можуть досить часто відпочивати у тропіках, а мешканці приекваторіальних країн переймають більш сидячий спосіб життя, прийнятий в індустріалізованих державах. Змінюються і харчові звички.
Таким чином, відповідно до існуючих даних можна зробити чіткий висновок про повномасштабну пандемію гіповітамінозу D [30]. Розглянемо це на прикладі декількох регіонів.
Незважаючи на достатню кількість ультрафіолету, частота рахіту на Близькому Сході (15–36° північної широти) та в Африці (35° південної — 37° північної широти) найвища. Поряд з традиціями уникання сонячного опромінення і темною шкірою людей тут має значення тривале вигодовування груддю без додавання вітаміну D у дієту [30].
В Індії 96 % новонароджених [31], 91 % здорових дівчаток шкільного віку [32], 78 % здорових працівників системи охорони здоров’я [33] і 84 % вагітних жінок [31] мають гіповітаміноз D. Подібні дані отримані в Пакистані [34] та Бангладеш [35]. Необхідно відзначити, що висока поширеність гіповітамінозу D у Південній Азії пов’язана не лише з досить типовим стилем одягу, але й із високою забрудненістю повітря в індустріалізованих містах [36], рослинною їжею та темним кольором шкіри. Так, темношкірі люди потребують більшої експозиції ультрафіолету для синтезу тієї самої кількості вітаміну D порівняно зі світлошкірою популяцією [37, 38]. На противагу решті азіатів статус вітаміну D у жителів Японії є кращим [39] за рахунок традиційно вищого споживання рибопродуктів.
Незважаючи на те, що надходження вітаміну D з їжею має лише вторинне значення, рибна дієта справляє відчутний позитивний вплив не лише у Японії, а й у Скандинавії та Канаді. Так, було доведено [40], що жителі цих північних країн мають вищі рівні 25(ОН)D, ніж жителі Бразилії, оскільки регулярне споживання жирних видів риби північноєвропейцями еквівалентне 400 МО вітаміну D щодня [41]. Більше того, як було показано у дослідженні EURONUT-SENECA, жителі Північної Європи мають середні рівні 25(ОН)D 40–50 нмоль/л, у той час як у південноєвропейців цей показник був у межах 20–30 нмоль/л [42]. Крім харчового фактора, тут слід узяти до уваги і те, що жителі Скандинавії зазвичай мають світлішу шкіру і не схильні уникати сонячних променів при найменшій можливості.
У жителів переважно мононаціональних країн із спільними історично-культурними традиціями спостерігається різний рівень вітаміну D залежно від географічної широти. Так, у Франції (дослідження SUVIMAX) були отримані такі дані: у чоловіків та жінок віком 35–65 років середня концентрація 25(ОН)D була 43 нмоль/л у північних областях та 94 нмоль/л у південно-західних провінціях [43]. В Аргентині такий самий показник був у межах 52 нмоль/л у жителів північних районів і 36 нмоль/л — на півдні країни [44].
У США в 2002–2004 роках проводилось повномасштабне дослідження NHANES із залученням 20 289 амбулаторних пацієнтів [45]. Порівнювали статус вітаміну D у трьох вікових групах: 1–5, 20–49 та понад 70 років. ДВD був діагностований у 2, 13 та 11 % чоловіків відповідно. У жінок ці цифри були 3, 19 та 16,5 % у тих же вікових групах. Більше того, середні рівні 25(ОН)D були нижчими на 5–9 нмоль/л порівняно з подібним дослідженням за 15 років до того, в основному за рахунок таких чинників: більший індекс маси тіла, зниження споживання молока та більша частота використання кремів проти засмаги.
Зі збільшенням віку та зниженням рухової активності відсоток пацієнтів із ДВD значно вищий у всіх регіонах. Зокрема, в Австралії (район Сіднею) серед осіб, які знаходилися в будинках престарілих, ДВD був діагностований у 68 % чоловіків та 86 % жінок (середній рівень — 17 нмоль/л).
Незважаючи на певні відмінності у визначенні порогової величини 25(ОН)D для діагностування ДВD у різних країнах, очевидним є факт, що практично в усіх регіонах світу реєструються субоптимальні рівні 25(ОН)D у широких верств населення. Як правило, ці цифри залежать від сезону. Зокрема, гіповітаміноз D більш виражений взимку в усіх вікових групах жителів Азії [46–47], Європи [48–49], Латинської Америки [50], Близького Сходу [51], Північної Америки [52] та Океанії [53].
Рівень 25(ОН) вітаміну D у дорослого населення різних регіонів України
Територія України розташована у декількох географічних широтах, тому синтез холекальциферолу в різних регіонах України може відрізнятися. Крайня північна точка України знаходиться на державному кордоні біля с. Гремяч Чернігівської області (52°22ў північної широти). Крайня південна точка розташована на мисі Сарич в Автономній Республіці Крим (44°23ў північної широти). Крайня західна точка припадає на м. Чоп у Закарпатській області, на кордоні з Угорщиною та Словаччиною (48°05’ північної широти). Крайня східна точка розташована на кордоні з Росією на околиці с. Червона Зірка Міловського району Луганської області (49°15ў північної широти). Протяжність території між крайніми точками з півночі на південь становить 893 км, а з заходу на схід — 1316 км.
Тому з метою вивчення частоти дефіциту вітаміну D серед населення України було проведено комплексне обстеження жителів різних регіонів країни згідно з основними принципами епідеміологічного дослідження. Для визначення впливу вікового фактора та сезону на рівень 25(ОН)D проводилося дослідження цього показника в різних вікових групах та за різної пори року.
Матеріали та методи
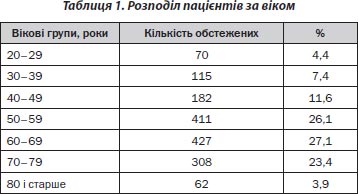
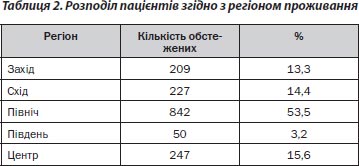
Обстежено 1575 жителів України віком 20–95 років. Переважну більшість становили жінки (86,3 %), середній вік яких був 58,61 ± 0,37 року, чоловіків — 54,93 ± 1,09 року (р < 0,001). Розподіл пацієнтів за віком та регіоном проживання поданий у табл. 1 та 2.
Усім обстеженим досліджували рівень (25(ОН)D) та ПТГ у сироватці крові. Слід зауважити, що в дане дослідження включали лише тих пацієнтів, які не приймали препаратів кальцію та вітаміну D протягом останніх 6 місяців.
Дослідження рівня 25(ОН)D та ПТГ проводили за допомогою електрохемілюмінесцентного методу на аналізаторі Eleksys 2010 (Roche Diagnostics, Німеччина) тест-системами cobas. Даний метод на сьогодні є найбільш чутливим і дозволяє вимірювати концентрацію досліджуваної речовини в широкому діапазоні з високою точністю.
Оцінку статусу вітаміну D здійснювали відповідно до останньої класифікації [28].
Результати та їх обговорення
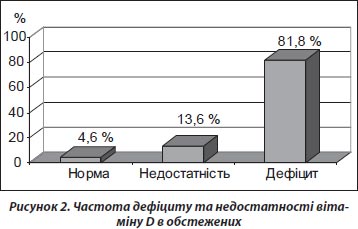
Результати проведеного дослідження показали, що лише 4,6 % жителів України мали 25(ОН)D в сироватки крові у межах норми, у 13,6 % відзначено недостатність, а в 81,8 % — ДВD. Слід зазначити, що тяжка форма ДВD (діагностується при показнику 25(ОН)D нижче 25 нмоль/л) зустрічалася в 37,3 % людей, у 12,2 % осіб уміст 25(ОН)D знаходився нижче рівня, який може дослідити апарат (рис. 2).
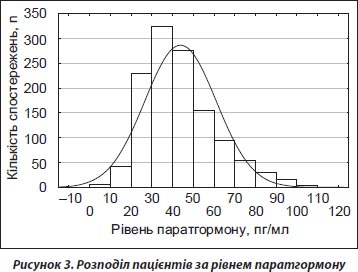
У 1235 пацієнтів досліджували вміст ПТГ у сироватці крові, з них 147 (11,9 %) жителів мали рівень ПТГ вищий за норму, причому в 92,5 % випадків — на тлі ДВD (рис. 3), що мав характер вторинного гіперпаратиреозу [54].
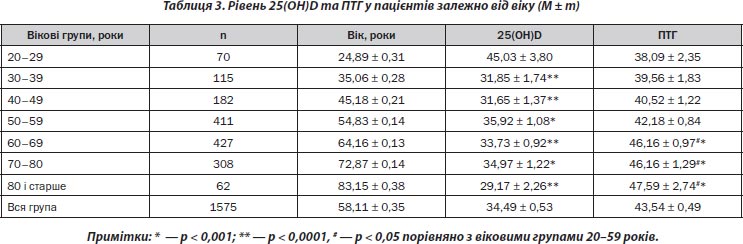
За аналізом показників 25(ОН)D та ПТГ у кожній віковій групі (табл. 3) встановлено, що вірогідно вищі рівні 25(ОН)D були в пацієнтів віком 20—29 років порівняно з обстеженими інших вікових груп (р < 0,01–0,001).
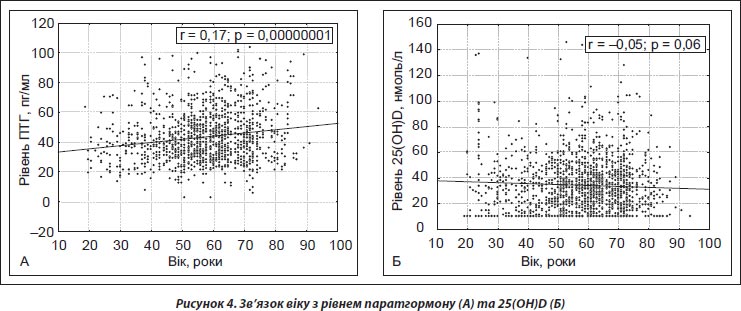
При проведенні кореляційного аналізу відзначено, що ПТГ має слабкий позитивний вірогідний кореляційний зв’язок із віком (r = 0,17; p < 0,0001) (рис. 4А). Кореляційного зв’язку між рівнем 25(ОН)D із віком обстежених не виявлено (рис. 4Б). Рівень ПТГ у людей віком 60 років і старше вірогідно відрізнявся від осіб віком 20–49 років (р < 0,001) (табл. 3).
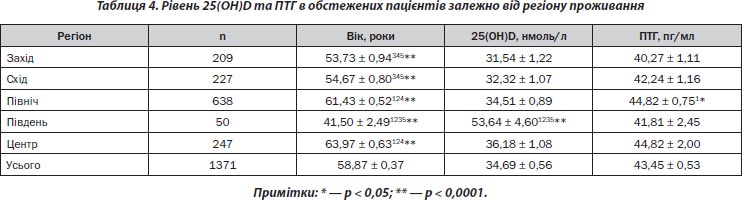
Оскільки синтез вітаміну D залежить від географічної широти, тому епідеміологічні дослідження цього показника проводилися в різних географічних регіонах країни. Результати дослідження рівня 25(ОН)D та ПТГ подано в табл. 4.
При порівнянні показників 25(ОН)D та ПТГ у регіонах обстеження було встановлено, що рівень 25(ОН)D був вірогідно вищим у жителів південного регіону (р < 0,0001). В обстежених інших областей вірогідної відмінності щодо рівня 25(ОН)D не було. Рівень ПТГ вірогідно відрізнявся лише у жителів північного регіону порівняно з західним регіоном (р < 0,05).
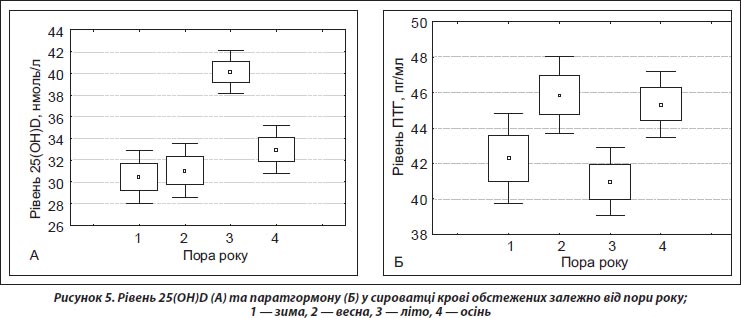
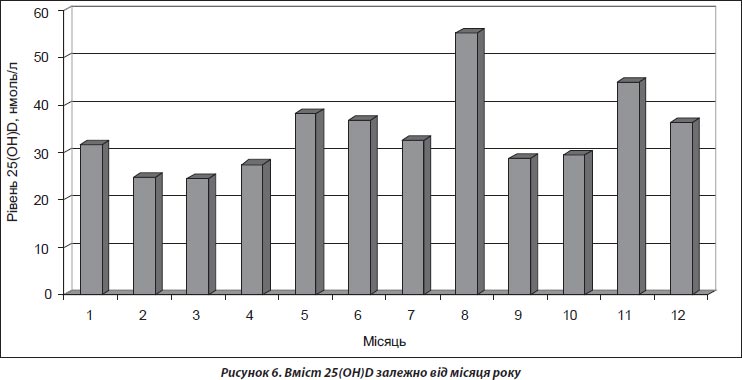
Нами вивчено вплив сезонного фактора на середні показники 25(ОН)D. Отримані результати наведено на рис. 5.
Вірогідно вищі показники 25(ОН)D відзначено в обстежених у літню пору року (40,11 ± 0,99 нмоль/л), а саме у серпні (р < 0,00 001). Проте звертає на себе увагу рівень 25(ОН)D у пацієнтів у листопаді, що є вірогідно вищим порівняно з лютим, березнем (р < 0,0001) та квітнем (р < 0,005) (рис. 6).
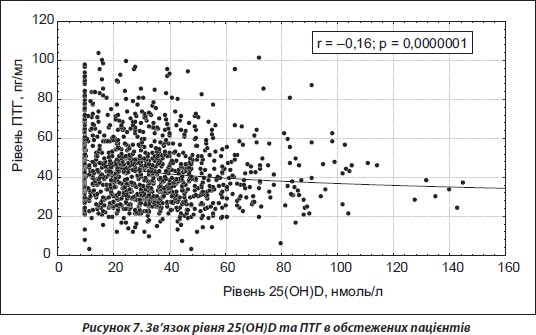
За результатами проведеного аналізу зв’язку між рівнем 25(ОН)D та ПТГ встановлено негативний вірогідний зв’язок між 25(ОН)D та ПТГ (рис. 7). Зі зростанням дефіциту вітаміну D зростає рівень ПТГ, тобто виникає вторинний гіперпаратиреоз, що веде до підвищеної резорбції кісткової тканини.
Проведені в Україні дослідження встановили високу частоту дефіциту вітаміну D. Для порівняння наших результатів було використано декілька міжнародних досліджень. Зокрема, у дослідженні MORE (International Multiple Outcomes of Raloxifene Evaluation Study), що проводилося у 25 країнах світу в жінок віком старше 65 років із системним остеопорозом [55], чітко відзначено вплив сезонного фактора на показники 25(ОН)D, що також спостерігається й у наших результатах. Середній показник 25(ОН)D становив 55,2 нмоль/л, що є набагато вищим, ніж в українських пацієнток даного віку, проте слід зазначити, що у дослідженні MORE усі пацієнтки приймали препарати кальцію з вітаміном D до моменту лабораторного дослідження сироватки крові, а у наведеній роботі таких суб’єктів виключали. Наступним великим дослідженням частоти дефіциту вітаміну D є SENECA study (Survey in Europe on Nutrition and the Elderly: a Concerted Action) [56]. У цьому спостереженні зразки крові брали лише у зимові місяці та лише у пацієнтів віком старше 65 років, які не приймали препаратів із вітаміном D. Середній рівень 25(ОН)D у даному дослідженні становив 33 нмоль/л, а в пацієнтів України — 30,4 нмоль/л, тобто дещо нижчий, ніж у жителів Європи. Проте цю відмінність можна обґрунтувати тим, що у дослідженні SENECA брали участь в основному жителі Південної та Центральної Європи.
У дослідженні польських учених частота ДВD є подібною до наших досліджень і становить у жінок у постменопаузальному періоді 83,2 % [57].
У більшості досліджень відзначають вірогідний зв’язок між рівнем 25(ОН)D та віком обстежених [57–69]. У наших результатах даної залежності не виявлено, що, на нашу думку, обумовлено високою частотою ДВD у всіх вікових групах та невеликою кількістю жителів із рівнем 25(ОН)D у межах норми.
Висновки
1. Проведені дослідження встановили, що лише 4,6 % жителів України мають рівень 25(ОН)D у межах норми, у 13,6 % відзначено недостатність, а в 81,8 % — дефіцит вітаміну D.
2. Встановлено негативний вірогідний зв’язок між рівнем 25(ОН)D та паратгормону (r = –0,16; р < 0,00001), тобто зі зростанням дефіциту вітаміну D зростає рівень паратгормону.
3. В 11,9 % обстежених рівень паратгормону був вищий за норму, причому в 92,5 % випадків діагностовано вторинний гіперпаратиреоз.
4. Вірогідно вищі показники 25(ОН)D реєструвалися в молоді віком 20–29 років порівняно з обстеженими інших вікових груп (р < 0,01–0,001). Рівень паратгормону зростав із віком (r = 0,17; p < 0,0001) та вірогідно відрізнявся у людей старших за 60 років (р < 0,05).
5. Проведені дослідження виявили, що вірогідно вищі показники 25(ОН)D у жителів південних областей України (р < 0,0001). Відзначено, що влітку, особливо в серпні, середні показники 25(ОН)D є найвищими (р < 0,00001).
1. Steenbock H. The induction of growth promoting and calcifying properties in a ration by exposure to light [Текст] / H. Steenbock // Science. — 1924. — Vol. 60. — P. 224-225.
2. McCollum E.V. The necessity of certain lipins in the diet during growth [Текст] / McCollum E.V., Davis M. // J. Biol. Chem. — 1913. — Vol. 25. — P. 167-231.
3. Mellanby E. An experimental investigation on rickets [Текст] / E. Mellanby // Lancet. — 1919. — Vol. 1. — P. 407-412.
4. An experimental demonstration of the existence of a vitamin which promotes calcium depositio n [Текст] // McCollum E.V., Simmonds N., Becker J.E. et al. // J. Biol. Chem. — 1922. — Vol. 53. — P. 293-298.
5. The distillation of vitamin D [Текст] // Askew F.A., Bourdillon R.B., Bruce H.M. // Proc. R. Soc. Lond. — 1931. — Vol. 81. — P. 76-90.
6. Windaus A. Uber das antirachitisch wirksame Bestrahlungs-produkt aus 7-Dehydrocholesterin. (Concerning the antirachitic activity of the irradiation product of 7-dehydrocholesterol) [Текст] / A. Windaus, F. Schenck, F. von Werder F. et al. // Physiol. Chem. — 1936. — Vol. 241. — P. 100-103.
7. Underwood J.L. Vitamin D is not directly necessary for bone growth and mineralization [Текст] // J.L. Underwood, H.F. DeLuca // Am. J. Physiol. — 1984. — Vol. 246. — P. 493-498.
8. Heaney R.P. Calcium absorption varies within the reference range for serum 25-hydroxyvitamin D [Текст] // R.P. Heaney // J. Am. Coll. Nutr. — 2003. — Vol. 22. — P. 142-146.
9. Vitamin D and bone [Текст] / Suda T., Ueno Y., Fujii K. et al. // J. Cell. Biochem. — 2002. — Vol. 88. — P. 259-266.
10. Control of 25-hydroxycholecalciferol metabolism by the parathyroid glands [Текст] / Garabedian M., Holick M.F., DeLuca H.F., Boyle IT. // Proc. Natl. Acad. Sci. USA. — 1972. — Vol. 69. — P. 1673-1676.
11. Response of intestinal calcium transport and bone calcium mobilization to 1,25-dihydroxyvitamin D3 in thyroparathyroidectomized rats [Текст] // Garabedian M., Tanaka Y., Holick M.F., DeLuca H.F. // Endocrinology. — 1974. — Vol. 94. — P. 1022-1027.
12. Vitamin D deficiency and renal calcium transport in the rat [Текст] / Yamamoto M., Kawanobe Y., Takahashi H. et al. // J. Clin. Invest. — 1984. — Vol. 74. — P. 507-513.
13. Jones G. Current understanding of the molecular actions of vitamin D [Текст] / G. Jones, S.A. Strugnell, H.F. DeLuca // Physiol. Rev. — 1998. — Vol. 78. — P. 1193-1231.
14. DeLuca H.F. Overview of general physiologic features and functions of vitamin D [Текст] / Hector F. DeLuca // American Journal of Clinical Nutrition. — Vol. 80(6). — P. 1689-1696.
15. Sutton A.L. Vitamin D: more than a «bone-a-fide» hormone [Текст] / A.L. Sutton, P.N. MacDonald // Mol. Endocrinol. — 2003. — Vol. 17. — P. 777-791.
16. Rachez C., Suldan Z., Ward J. et al. A novel protein complex that interacts with the vitamin D3 receptor in a ligand-dependent manner and enhances VDR transactivation in a cell-free system [Текст] // Genes. Dev. — 1998. — Vol. 12. — P. 1787-800.
17. DNA binding is induced by binding of vitamin D receptor-retinoid X receptor heterodimers to vitamin D response elements [Текст] // Kimmel-Jehan C., Darwish H.M., Strugnell S.A. et al. // J. Cell. Biochem. — 1999. — Vol. 74. — P. 220-228.
18. Brown T.A. Phosphorylation of the 1,25-dihydroxyvitamin D3 receptor: a primary event in 1,25-dihydroxyvitamin D3 action [Текст] // T.A. Brown, H.F. DeLuca // J. Biol. Chem. — 1990. — Vol. 265. — P. 10025-10029.
19. Holick M.F. Sunlight and vitamin D for bone health and prevention of autoimmune diseases, cancers, and cardiovascular disease [Текст] / M.F. Holick // Am. J. Clin. Nutr. — 2004. — Vol. 80 (6; suppl.). — P. 1678-1688.
20. Velluz L. Chimie organique-equilibre de rйaction entre prйcalcifйrol et calcifйrol. (The organic chemical equilibrium of the reaction between precalciferol and calciferol.) [Текст] // L. Velluz, G. Amiard // C. R. Assoc. Anat. — 1949. — Vol. 228. — P. 853-855.
21. Blunt J.W. 25-Hydroxycholecalciferol: a biologically active metabolite of vitamin D3 [Текст] / J.W. Blunt, H.F. DeLuca, H.K. Schnoes // Biochemistry. — 1968. — Vol. 7. — P. 3317-3322.
22. Global vitamin D status and determinants of hypovitaminosis D [Текст] / A. Mithal, D. Wahl, J. Bonjour et al. // Osteoporos Int. — 2009. — Vol. 20. — P. 1807-1820.
23. Recognition and management of vitamin D deficiency [Текст] / Bordelon P., Ghetu M.V., Langan R. // American Family doctor. — 2009. — Vol. 80. — P. 841-846.
24. Jones G. Current understanding of the molecular actions of vitamin D [Текст] // G. Jones, S.A. Strugnell, H.F. DeLuca // Physiol. Rev. — 1998. — Vol. 78. — P. 1193-1231.
25. Holick M.F. Vitamin D deficiency [Текст] / M.F. Holick // N. Engl. J. Med. — 2007. — Vol. 357(3). — P. 266-281.
26. Schneider D.L. Vitamin D and skeletal health [Текст] / D.L. Schneider // Curr. Opin. Endocrinol. Diabetes. — 2006. — Vol. 13(6). — P. 483-490.
27. Sunscreens suppress cutaneous vitamin D3 synthesis [Текст] / Matsuoka L.Y., Ide L., Wortsman et al. // J. Clin. Endocrinol. Metab. — 1987. — Vol. 64. — P. 1165-1168.
28. Decreased bioavailability of vitamin D in obesity [Текст] / Wortsman J., Matsuoka L.Y., Chen T.C. // Am. J. Clin. Nutr. — 2000. — Vol. 72. — P. 690-693.
29. Evaluation, Treatment, and Prevention of Vitamin D Deficiency: an Endocrine Society Clinical Practice Guideline [Текст] / M.F. Holick, N.C. Binkley, H.A. Bischoff-Ferrari et al. // J. Clin. Endocrinol. Metab. — 2011. — Vol. 96(7). — P. 1911-193.
30. Holick M.F. Vitamin D deficiency: a worldwide problem with health consequences [Текст] / M.F. Holick, T. Chen // American Journal of Clinical Nutrition. — 2008. — Vol. 87(4). — P. 1080-1086.
31. High prevalence of vitamin D deficiency among pregnant women and their newborns in northern India [Текст] / Sachan A. et al. // Am. J. Clin. Nutr. — 2004. — Vol. 81. — P. 1060-1064.
32. Vitamin D status of apparently healthy schoolgirls from two different socioeconomic strata in Delhi: relation to nutrition and lifestyle [Текст] // Puri S. et al. // Br. J. Nutr. — 1999. — P. 876-882.
33. Vitamin D status and its relationship with bone mineral density in healthy Asian Indians [Текст] / Arya V. et al. // Osteoporos Int. — 2004. — Vol. 15. — P. 56-61.
34. Vitamin D status of breastfed Pakistani infants [Текст] / Atiq M. et al. // Acta Paediatr. — 1998. — Vol. 87. — P. 737-740.
35. Hypovitaminosis D is common in both veiled and nonveiled Bangladeshi women [Текст] / Islam M.Z. et al. // Asia Pac. J. Clin. Nutr. — 2006. — Vol. 15. — P. 81-87.
36. The impact of atmospheric pollution on vitamin D status of infants and toddlers in Delhi India [Текст] // Agarwal K.S. et al. // Arch. Dis. Child. — 2002. — Vol. 87. — P. 111-113.
37. Regulation of cutaneous previtamin D3 photosynthesis in man — skin pigment is not an essential regulator [Текст] /Holick M.F. et al. // Science. — 1981. — Vol. 211. — P. 590-593.
38. Increased skin pigmentation reduces the capacity of skin to synthesise vitamin D3 [Текст] / Clemens T.L. et al. // Lancet. — 1982. — Vol. 1. — P. 74-76.
39. Low serum concentrations of 25-hydroxyvitamin D in young adult Japanese women: a cross sectional study [Текст] / Nakamura K., Nashimoto M. et al. // Nutrition. — 2001. — Vol. 17. — P. 921-925.
40. Vitamin D deficiency [Текст] / Bandeira et al. // Arg. Bras. Endocrinol. Metab. — 2006. — Vol. 54. — P. 643-646.
41. Vitamin D status in a rural population of northern Norway with high fish liver consumption [Текст] / Brustad M. et al. // Public. Health. Nutr. — 2004. — Vol. 7. — P. 783-789.
42. Serum vitamin D concentraions among elderly people in Europe [Текст] / Vanderwielen R.P. et al. // Lancet. — 1995. — Vol. 346. — P. 207-210.
43. Prevalence of vitamin D insufficiency in an adult normal population [Текст] // Chapuy M.C. et al. // Osteoporos Int. — 1997. — Vol. 7. — P. 439-443.
44. Prevelence of vitmin D inadequancy among postmenopausal North American women receiving osteoporosis therapy [Текст] /Holick M.F., Siris E.S., Binkley N. et al. // J. Clin. Endocrinol. Metab. — 2005. — Vol. 90. — P. 3215-3224.
45. Serum 25-hydroxyvitamin D status of the US population: 1988–1994 compared with 2000–2004 [Текст] / Looker A.C. et al. // Am. J. Clin. Nutr. — 2008. — Vol. 88. — P. 1519-1527.
46. Prevalence and significance of low 25-hydroxyvitamin D concentrations in healthy subjects in Delhi [Текст] / Goswami R. et al. // Am. J. Clin. Nutr. — 2000. — Vol. 72. — P. 472-475.
47. Effect of vitamin D supplementation on bone health parameters of healthy young Indian women [Текст] / Malhotra N. et al. // Osteoporos Int. — 2000. — Vol. 19(1). — P. 29-207.
48. Fatty fish and supplements are the greatest modifiable contributors to the serum 25-hydroxyvitamin D concentration in a multiethnic population [Текст] / Van der Meer I.M. et al. // Clin. Endocrinol. — 2008. — Vol. 68. — P. 466-472.
49. Vitamin D status predicts physical performance and its decline in older persons [Текст] / Wicherts I.S. et al. // J. Clin. Endocrinol. Metab. — 2007. — Vol. 92. — P. 2058-2065.
50. Vitamin D status in women living in Buenos Aires [Текст] / Fradinger E.E. et al. // Medicina. — 1999. — Vol. 59. — P. 449-452.
51. Hypovitaminosis D in healthy schoolchildren [Текст] / El-Hajj Fuleihan G. et al. // Pediatrics. — 2001. — Vol. 107. — P. 53.
52. Hypovitaminosis D in medical inpatients [Текст] / Thomas M.K. et al. // N. Engl. J. Med. — 1998. — Vol. 338. — P. 777-783.
53. Vitamin D status of women in the Geelong Osteoporosis Study: association with diet and casual exposure to sunlight [Текст] / Pasco J.A. et al. // Med. J. Aust. — 2001. — Vol. 175. — P. 401-405.
54. Lips P. Vitamin D Deficiency and Secondary Hyperparathyroidism in the Elderly: Consequences for Bone Loss and Fractures and Therapeutic Implications [Текст] / P. Lips // Endocrine Reviews. — 2001. — Vol. 22. — P. 477-501.
55. A global study of vitamin D status and parathyroid function in postmenopausal women with osteoporosis: baseline data from the multiple outcomes of raloxifen evaluation clinical trial [Текст] / P. Lips, T. Duong, A. Oleksik et al. // J. Clin. Endocrinol. Metab. — 2001. — Vol. 86. — P. 1212-1221.
56.Serum vitamin D concentrations among elderly people in Europe [Текст] / R.P. van der Wielen, M.R. Lowik, H. van den Berg // Lancet. — 1995. — Vol. 346. — P. 207-210.
57. Prevalence of low serum vitamin D concentration in an urban population of elderly women in Polan [Текст] / L. Napiorkowska, T. Budlewski, W. Jakubas et al. // Polskie Archiwum Medycyny Wewnętrznej. — 2009. — 119(11). — P. 699-702.
58. Teenage girls and elderly women living in northern Europe have low winter vitamin D status [Текст] / R. Andersen, C. Molgaard, L. Skoygaard et al. // Eur. J. Clin. Nutr. — 2005. — Vol. 59. — P. 533-541.
59. Age-related decrease in serum 25-hydroxyvitamin D concentrations in the frail elderly: a longitudinal study [Текст] / K. Nakamura, T. Nishiwaki, K. Ueno et al. // J. Bone Miner. Metab. — 2007. — Vol. 25. — P. 232-236.