Журнал «Боль. Суставы. Позвоночник» 1 (05) 2012
Вернуться к номеру
Оптимізація аналгетичної і протизапальної терапії в амбулаторній травматологічній практиці
Авторы: Кваша В.П., кафедра травматології та ортопедії Національного медичного університету імені О.О. Богомольця, Легенький О.Г., ДКЛ № 1 ст. Київ
Рубрики: Семейная медицина/Терапия, Ревматология, Травматология и ортопедия, Неврология
Версия для печати
Резюме. Стаття присвячена вивченню ефективності анальгезії кеторолаку трометаміном (Кеторол) у пацієнтів з ураженнями опорно-рухового апарату. Визначені його висока ефективність при гострому скелетно-м’язовому болі порівняно з іншими анальгетиками і НПЗП та малий відсоток побічних впливів, що обґрунтовано дозволяє рекомендувати застосування препарату для впровадження та використання в практиці.
Резюме. Статья посвящена изучению эффективности анальгезии кеторолака трометамином (Кеторол) у пациентов с поражениями опорно-двигательного аппарата. Определены его высокая эффективность при острой скелетно-мышечной боли по сравнению с другими анальгетиками и НПВП и малый процент побочных явлений, что обоснованно позволяет рекомендовать способ для внедрения и использования в практике.
Summary. The article deals with study of efficacy of Ketorolac tromethamine (Ketorol) analgesia in patients with injuries of support and locomotion system. There was defined its high efficacy in acute musculoskeletal pain as compared with other analgetics and non-steroidal anti-inflammatory drugs and low percentage of adverse effects, that reasonably enables to recommend this method for introduction and use in clinical practice.
Ключові слова: ураження, кеторолак, ефективність, гострий скелетно-м’язовий біль.
Ключевые слова: поражение, кеторолак, эффективность, острая скелетно-мышечная боль.
Key words: injury, ketorolac, efficacy, acute musculoskeletal pain.
Вступ
Одним із важливих завдань при лікуванні пацієнтів із пошкодженням опорно-рухового апарату є боротьба з больовим синдромом і асептичним запаленням, що особливо виражено в ранньому післятравматичному та післяопераційному періоді. У більшості випадків призначають переважно значні дози анальгетиків, у тому числі наркотичних, повністю ігноруючи фактор асептичного запалення.
J. Wilson и J. Pendleton (1989 р.) при ретроспективному дослідженні встановили, що з 198 пацієнтів, які звернулися з гострим болем, тільки 44 % отримали достатню допомогу, а за даними S. McLean (2002 р.) адекватне лікування проведено тільки 21 % пацієнтів, які мали потребу в екстреному знеболюванні. Навіть у випадках, коли знеболювання проводилось у рамках невідкладної допомоги, воно далеко не завжди було ефективним. Факторами цього є використання малоефективних лікарських засобів, стандартних або застарілих схем їх використання, рефрактерність пацієнтів, які часто використовують анальгетики, побічні ефекти препаратів (гематотоксичні, розвиток анафілактичного шоку) та ін. (А.Е. Жуков і співавт., 2002).
Мета роботи: вивчити ефективність анальгезії кеторолаку трометаміном (Кеторол) у пацієнтів з ураженнями опорно-рухового апарату.
Матеріал та методи дослідження
Кеторолак — похідне арилоцтової кислоти, використовується у вигляді трометамінової солі, що збільшує його розчинність у воді, при цьому трометамінова сіль легко розщеплюється з вивільненням кеторолаку.
У Північній Америці, Великобританії, деяких інших європейських країнах кеторолак є єдиним парентеральним НПЗП, що використовується для лікування больового синдрому. При внутрішньом’язовому застосуванні 30 мг препарату його дія дорівнює ефекту 10–12 мг морфіну або 50 мг меперидину, але порівняно з наркотичними анальгетиками препарат не впливає на функцію дихання, не справляє седативну і психомоторну дію.
Кеторолак є препаратом вибору для купірування інтенсивного болю, особливо при травмі, однак короткочасне його використання можливе і при хронічному перебігу (при дегенеративно-дистрофічних захворюваннях, ревматоїдному артриті тощо).
Препарат має виражену анальгезуючу, жарознижуючу дію, що зумовлено пригніченням активності циклооксигенази, ферменту, який регулює синтез простагландинів, простацикліну, тромбоксану А2 з арахідонової кислоти. Поряд із цим він не впливає на опіатні рецептори, тому не викликає побічних реакцій з боку ЦНС, не пригнічує дихання.
Препарат швидко всмоктується, має високу біодоступність (80–100 %), що забезпечує швидку анальгезію. Після прийому per os 10 мг ефект настає через 10–60 хвилин, після внутрішньом’язового введення 30 мг — через 15–75 хвилин і триває протягом 10 годин.
Кеторолак зв’язується з білками плазми крові на 90–99 %. Виводиться нирками (90 %) та кишечником (6 %). Період напіввиведення у пацієнтів похилого віку більший, ніж у молодих (4,7–8,6 і 3,8–6,3 год відповідно).
Використання кеторолаку протипоказане при реакціях гіперчутливості, гіповолемії, тяжкій нирковій і печінковій недостатності, пептичних виразках, порушенні гемостазу, вагітності, пологах, дітям до 16 років.
Кеторолак випускається у 2 формах: таблетки по 10 мг і розчин для парентерального застосування в ампулах по 30 мг/1 мл.
Однак кеторолаку не властивий достатній протизапальний вплив на патологічний процес, що зумовило використання в комплексному лікуванні Найзу (німесулід, 4’-нітро-2’-феноксиметансульфонанілід), одна таблетка якого містить 100 мг німесуліду.
Німесулід — нестероїдний протизапальний засіб нового покоління з класу сульфонанілідів. Має протизапальну, знеболювальну та жарознижувальну дію. Механізм дії пов’язаний із пригніченням ферменту циклооксигенази II та впливом на деякі інші фактори. Найз пригнічує утворення вільних радикалів без впливу на гемостаз та фагоцитоз, а також вивільнення ферменту мієлопероксидази і, таким чином, пригнічує утворення фактора некрозу пухлини.
Після прийому всередину препарат добре всмоктується зі шлунково-кишкового тракту. Максимальна концентрація активної речовини в плазмі досягається через 1,5–2,5 години після прийому. Застосування препарату разом з їжею уповільнює швидкість всмоктування, але не впливає на ступінь всмоктування. Зв’язування з білками плазми досягає 99 %, об’єм розподілу — 0,19–0,35 л/кг. Найз активно метаболізується в печінці, з утворенням декількох метаболітів, виводиться з сечею (70 %) та калом (30 %). Основний метаболіт — гідроксинімесулід (25 %) — є фармакологічно активним.
Найз призначають дорослим по 1 таблетці (100 мг) 2 рази на добу. Таблетки приймають із достатньою кількістю води, переважно перед їжею. Максимальна добова доза — 200 мг на добу. Тривалість курсу лікування становить 15 діб.
Біль — суб’єктивний феномен, який включає відчуття, що вказують на пошкодження або загрозу пошкодження тканин і афективну реакцію на ці відчуття. Неприємні відчуття призводять до специфічної поведінки пацієнта і появи вегетативних реакцій, що викликають страждання та мають різну клінічну характеристику.
Вираженість больового синдрому визначається цілою низкою факторів: тривалістю впливу травмуючого агента на психічну та соматичну сферу; конституційними, генетичними і психологічними особливостями пацієнтів; відчуттям страху і тривоги; ступенем самоконтролю болю; якістю соціальної підтримки; знанням ознак реакції на біль тощо.
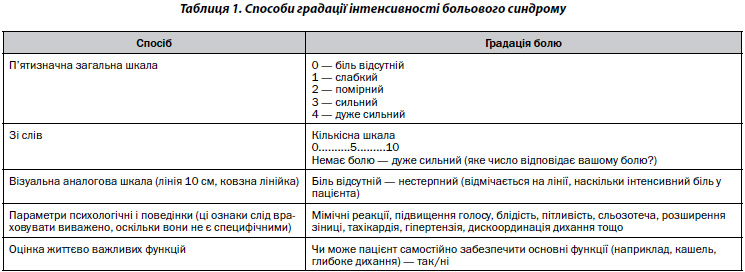
Для оцінки інтенсивності больового синдрому й ефективності терапії використовували візуальну аналогову шкалу — ВАШ (табл. 1) та шкалу полегшення болю. При використанні ВАШ пацієнт відмічає рівень вираженості больового синдрому на 100-мм шкалі (де 0 — відсутність болю, 100 — максимальний біль) до і після використання препарату.
Для оцінки ефективності проведеного знеболювання використовували шкалу полегшення болю. Через визначений термін після введення препарату пацієнту ставили питання: «Чи зменшилась інтенсивність болю після введення препарату?». Можливі варіанти відповіді в балах: 0 — біль не зменшився, 1 — дещо зменшився, 2 — зменшився, 3 — суттєво зменшився, 4 — відсутній.
При використанні препарату дотримувались таких принципів:
— індивідуальний — доза, спосіб введення, лікарська форма визначалась індивідуально з урахуванням віку, інтенсивності болю, супутньої патології та на основі постійного моніторингу;
— своєчасність введення — інтервал між введенням визначався ступенем болю і фармакокінетичними особливостями препарату і його лікарською формою;
— адекватність способу введення.
Робота виконувалась згідно з Всеукраїнською програмою «Оптимізація аналгетичної і протизапальної терапії в амбулаторній травматологічній практиці». Були передбачені заходи із забезпечення безпеки для здоров’я пацієнта, дотримання його прав, людської гідності та морально-етичних норм відповідно до принципів Гельсінської декларації прав людини, Конвенції Ради Європи про права людини та відповідних законів України.
Отримані результати та обговорення
Критеріями виключення був вік менше 18 років, вагітність, лактація, реакція гіперчутливості на НПЗП (у том числі на анальгін, аспірин) в анамнезі, захворювання системи кровотворення, виразкова хвороба шлунка та дванадцятипалої кишки у стадії загострення, серцева недостатність, бронхіальна астма, виражені порушення функції печінки, нирок, систолічний тиск менше 100 мм рт.ст.
Всього в дослідженні взяли участь 12 060 пацієнтів: 4950 із переломами кісток гомілки; 7110 — з переломами кісток передпліччя, середній вік яких становив 54,10 ± 0,46 року, у тому числі 7498 чоловіків і 4562 жінки, які застосовували Кеторол у 1-шу — 2-гу добу (ін’єкції та таблетки або тільки таблетки), з подальшим переходом на Найз таблетки до 15 діб.
Використовуючи власні результати застосування кеторолаку + найз та літературні дані стосовно використання метамізолу натрію (в/м 2 мл 50% розчину), диклофенаку (3 мл — 75 мг), ми провели порівняльний аналіз їх ефективності [1–6].
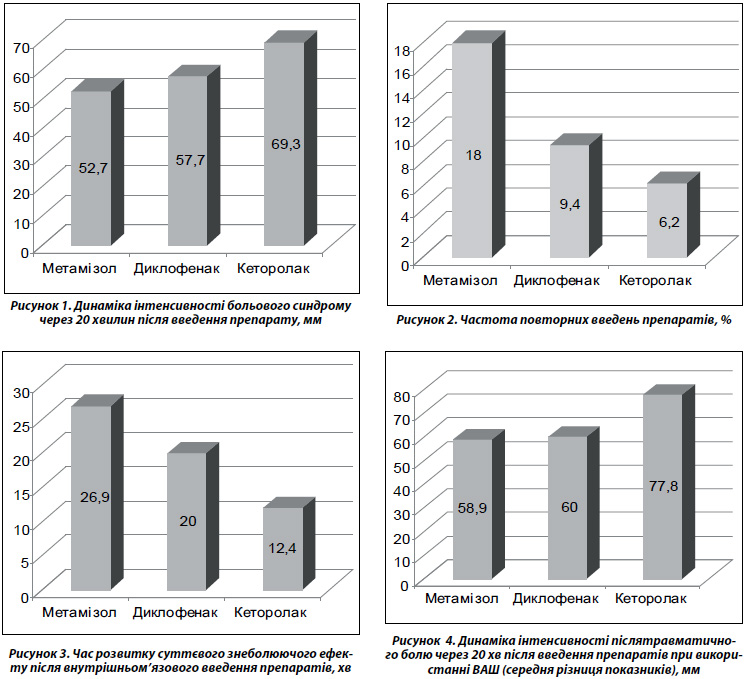
Середню різницю інтенсивності болю до та після лікування оцінювали за допомогою ВАШ, у групі метамізолу вона становила 52,7 ± 1,8, диклофенаку — 57,7 ± 4,6, кеторолаку — 69,3 ± 1,9.
За критеріями ВАШ кращою ефективністю характеризувався кеторолак, гіршою — метамізол; диклофенак зайняв проміжне положення. Метамізол вірогідно поступався диклофенаку (р < 0,05), кеторолаку (р < 0,01); диклофенак вірогідно (р < 0,05) поступався кеторолаку (рис. 1).
Згідно з отриманими результатами (динаміка больового синдрому за ВАШ), кеторолак переважає метамізол натрію в 1,3 раза.
Повторні введення з приводу скелетно-м’язового болю були відмічені у 18 % випадків у групі метамізолу, у 9,4 % — диклофенаку, у 6,2 % — кеторолаку (рис. 2).
Метамізол помітно зменшував біль через 26,90 ± ± 0,47 хв, диклофенак — 20,0 ± 0,5 хв, кеторолак — 12,40 ± ± 0,33 хв (рис. 3). За цим показником метамізол вірогідно (р < 0,01) поступався обом препаратам, диклофенак — кеторолаку.
За ВАШ середня різниця інтенсивності болю, що виникав при травмі, до і після лікування у групі метамізолу становила 58,9 ± 3,0, диклофенаку — 60,0 ± 4,6, кеторолаку — 77,8 ± 1,9 (рис. 4).
Різні знеболюючі препарати по-різному переносились пацієнтами. Серед системних небажаних проявів найбільш часто зустрічались дискомфорт в епігастрії, сонливість, анорексія, частіше вони спостерігались при застосуванні метамізолу. Частка розвитку побічних ефектів при використанні кеторолаку становила 2,7 %.
Висновки
Зростання кількості травматичних уражень опорно-рухового апарату в цілому і високоенергетичних зокрема обумовлює необхідність пошуку нових заходів знеболювання на різних етапах надання допомоги потерпілим. Результати дослідження поєднаного використання Кеторолу та Найзу за наведеною схемою свідчать про його високу ефективність при гострому скелетно-м’язовому болі порівняно з іншими анальгетиками і НПЗП та малий відсоток побічних впливів, що обґрунтовано дозволяє рекомендувати застосування препарату для впровадження та використання в практиці.
1. Насонова В.А. Перспективы развития ревматологии в XXI веке // Тер. арх. — 2008. — № 80(5). — С. 5-8.
2. Насонов Е.Л. Нестероидные противовоспалительные препараты при ревматических заболеваниях: стандарты лечения // РМЖ. — 2001. — 9, 78. — 265-270.
3. Насонов Е.Л. Целебрекс: доказанная эффективность и безопасность (новые данные) // Терапевтический архив. — 2001. — 5. — 57-61.
4. Насонов Е.Л. Эффективность и переносимость нестероидного противовоспалительного препарата Нимесулид: новые данные // РМЖ. — 2001. — 9. — 636-639.
5. Яременко О.Б. Нестероидные противовоспалительные препараты: проблемы безопасности // Doctor. — 2002. — № 2. — С. 68-72.
6. MacDonald T.M., Morant S.V., Goldstein J.L., Burke T.A., Pettitt D. Channelling bias and the incidence of gastrointestinal haemorrhage in users of meloxicam, coxibs, and older, non-specific non-steroidal anti-inflammatory drugs // Gut. — 2003. — 52. — 1265-70.