Газета «Новости медицины и фармации» 7 (455) 2013
Вернуться к номеру
Гипертензивные кризы: диагностика и лечение. Консенсус Ассоциации кардиологов Украины и Украинской ассоциации по борьбе с инсультом (Часть 2). Особенности коррекции артериального давления при осложненных гипертензивных кризах в зависимости от поражения органа-мишени
Авторы: Пархоменко А.Н.1 (Киев), Амосова Е.Н.1 (Киев), Дзяк Г.В.1 (Днепропетровск), Нетяженко В.З.1 (Киев),
Иркин О.И.1 (Киев), Голобородько Б.И.1 (Одесса), Коваль О.А.1 (Днепропетровск), Копица Н.П.1 (Харьков),
Шумаков В.А.1 (Киев), Тащук В.К.1 (Черновцы), Лутай Я.М.1 (Киев), Коваленко В.Н.1 (Киев), Сиренко Ю.Н.1
(Киев), Свищенко Е.П.1 (Киев), Мищенко Т.С.2 (Харьков), Дзяк Л.А.2 (Днепропетровск), Полищук Н.Е.2 (Киев), Волошин П.В.2 (Харьков), Шлапак И.П.3 (Киев), Черний В.И.3 (Донецк), Титов И.И.3 (Ивано-Франковск), Ткаченко Р.А.3 (Киев), Малыш И.Р.3 (Киев), Лоскутов О.А.3 (Киев), Згржебловская Л.В.3 (Киев),
Смирнова Н.М.3 (Донецк), Городник Г.А.3 (Донецк)
1Ассоциация кардиологов Украины; 2Украинская ассоциация по борьбе с инсультом; 3Ассоциация анестезиологов Украины
Рубрики: Кардиология, Неврология
Разделы: Руководства
Версия для печати
Уважаемые коллеги!
Предлагаем рассмотреть документ, имеющий характер соглашения (консенсуса) экспертов по чрезвычайно актуальной проблеме современной медицины — гипертензивных кризов. Ее важность определяется не только большой распространенностью артериальных гипертензий среди населения Украины и многочисленными случаями дестабилизации течения, но и высокой частотой развития осложнений с повреждениями органовмишеней. Многие из этих осложнений развиваются внезапно и представляют угрозу для жизни (острые нарушения коронарного и мозгового кровообращения, расслоение стенок аорты и др.), другие — имеют отсроченный характер и приводят к прогрессирующему нарушению функции органов. Поэтому проблема своевременной диагностики и лечения гипертензивных кризов особо актуальна для специалистов различного профиля, а не только кардиологов. Это стало основой для создания документа при участии комитета экспертов различных медицинских специальностей, которые впервые совместно рассматривают проблему острого повышения артериального давления с позиции врачакардиолога, невропатолога, анестезиологареаниматолога, акушерагинеколога. С учетом современных представлений о патофизиологических закономерностях формирования гипертонического криза в различных клинических ситуациях подходы к снижению артериального давления могут отличаться и иметь разное прогностическое значение. Таким образом, представленная первая попытка мультидисциплинарного подхода к проблеме гипертензивных кризов не является окончательной и требует дальнейшего развития с участием большего количества специалистов.
Выражаю благодарность всем, кто принял активное участие в подготовке и всестороннем обсуждении этого документа.
Пархоменко А.Н., д.м.н., профессор, членкорреспондент НАМН Украины, председатель рабочей группы по неотложной кардиологии Ассоциации кардиологов Украины, руководитель отдела реанимации и интенсивной терапии Национального научного центра «Институт кардиологии им. акад. Н.Д. Стражеско» НАМН Украины
Острый коронарный синдром
Часто у больного с ОКС и повышенным уровнем АД очень трудно определить, является ли это повышение первичным (причина ОКС) или развилось в ответ на острое нарушение коронарного кровообращения. Но подходы к контролю АД в большинстве случаев одинаковы и определяются уровнем АД на момент оценки и до развития ОКС, наличием осложнений ОКС (острая СН, механические осложнения и др.) и поражений других органовмишеней.
Специфическую антигипертензивную терапию необходимо начинать при повышении САД > 160 мм рт.ст. и/или ДАД > 100 мм рт.ст. Цель терапии — снижение среднего АД на 20–30 % в течение часа [105]. Проведение тромболитической терапии возможно, только если уровень АД составляет < 185/110 мм рт.ст. [58]. Препаратами выбора для контроля АД у больных с ОКС являются нитроглицерин и bадреноблокаторы.
Нитроглицерин снижает гемодинамические нагрузки на сердце (в основном преднагрузку), уменьшает его потребность в кислороде и энергетические затраты, расширяет венечные сосуды, что, помимо снижения АД, обеспечивает дополнительный клинический эффект при острой ишемии миокарда и делает нитроглицерин препаратом выбора у этих больных. В то же время перед назначением нитропрепаратов у больного необходимо выяснить возможность приема ингибиторов 5фосфодиэстеразы. Применение нитратов на фоне препаратов этой группы может вызвать развитие значительной гипотензии, поэтому в течение 24 (силденафил) — 48 (тадалафил) часов от последнего приема ингибиторов 5фосфодиэстеразы использование нитропрепаратов противопоказано [106].
Альтернативой нитроглицерину могут быть bадреноблокаторы. Относительно возможности раннего внутривенного назначения препаратов этой группы пациентам с острым ИМ единого мнения нет. В нескольких исследованиях выявили снижение летальности больных [107, 108], уменьшение размера ИМ [109–111], предотвращение нарушений ритма сердца и уменьшение количества реинфарктов при раннем внутривенном назначении bадреноблокаторов [112]. Самую высокую эффективность наблюдали у пациентов без элевации сегмента ST [113].
Впрочем, по результатам крупнейшего исследования COMMIT (45 852 больных), внутривенное назначение метопролола (особенно в первые 24 ч) у больных с ОКС с элевацией сегмента ST (кроме предотвращения реинфарктов и нарушений ритма сердца) достоверно повышало риск кардиогенного шока [114].
Поэтому на сегодняшний день у пациентов с ОКС только при значительном повышении АД и развитии тахиаритмий показано применение внутривенных bадреноблокаторов [115].
Противопоказаниями для назначения bадреноблокаторов являются умеренная или выраженная СН и отек легких, брадикардия (< 60 сокращений сердца в 1 мин), признаки нарушения периферического кровообращения, блокада 2–3й степени или обструктивные заболевания легких.
Ингибиторы АПФ рекомендуется назначать всем больным с острым ИМ при отсутствии противопоказаний уже с первых суток заболевания [116–118]. При этом внутривенное введение эналаприла этим пациентам в исследовании CONSENSUS II сопровождалось увеличением летальности, что скорее было связано с развитием гипотензии [119]. Поэтому назначение внутривенных ингибиторов АПФ у больных с ОКС (в том числе и для лечения ГК) противопоказано. Как альтернативу bадреноблокаторам и нитратам при ОКС можно использовать урапидил [120].
Острый отек легких
Приблизительно у 50 % пациентов с острым отеком легких (ООЛ) наблюдают повышенные уровни АД (САД > 140 мм рт.ст.). У части больных такая гипертензивная реакция не является первичной, а развивается в ответ на одышку, возбуждение и/или стенокардическую боль. Поэтому таким больным надо наладить оксигенотерапию, успокоить и обеспечить адекватное обезболивание. Препаратом выбора в этом случае является морфин, который имеет также некоторые другие положительные эффекты у больных с ООЛ. Цель дальнейшего лечения этой категории больных — снижение пред и постнагрузки и обеспечение достаточного диуреза. Снижение АД позволяет уменьшить потребность сердца в кислороде и повысить сердечный выброс. При ООЛ АД необходимо снижать срочно и быстро. Препаратами выбора являются нитроглицерин и нитропруссид натрия, которые используют на фоне мочегонной терапии [58, 121]. Схемы введения препаратов представлены в табл. 5.
В одном нерандомизированном открытом исследовании было продемонстрировано преимущество использования высоких доз нитроглицерина (повторные болюсные инъекции 2 мг каждые 3 мин) для снижения АД над стандартной схемой (внутривенная инфузия) у больных с ООЛ на фоне ГК (CAД ≥ 160 мм рт.ст. или среднее АД ≥ 120 мм рт.ст.) [122].
Группа интенсивного лечения характеризовалась значительно меньшей частотой случаев госпитализации в отделение интенсивной терапии (37,9 против 80,0 %), проведения интубации (13,8 против 26,7 %) и повышения уровня тропонина (17,2 против 28,9 %). У одного (3,4 %) больного группы активного лечения отмечено развитие симптоматической гипотензии, в группе стандартной терапии таких случаев не зафиксировано. Поэтому такая схема применения нитроглицерина может использоваться только после тщательного взвешивания возможных пользы и риска и требует дальнейшего подтверждения.
Альтернативой нитровазодилататорам для снижения АД у больных с ООЛ может быть применение урапидила. Этот препарат в отличие от других вазодилататоров не вызывает развития рефлекторной тахикардии [62], что особенно важно у больных с острой СН. В исследовании NITURA использование урапидила (на фоне оксигенотерапии, морфина и диуретиков) у больных с ГК, осложненными ООЛ, сопровождалось значительным снижением АД и более существенным улучшением респираторных и метаболических показателей, чем при применении нитроглицерина [123].
Острое расслоение аорты
Расслоение аорты (РАо) — это неотложное кардиологическое состояние, характеризующееся повреждением среднего слоя аорты (медиа) в виде его сепарации с последующим проникновением и распространением крови вдоль аортальной стенки. В большинстве случаев (90 % больных) проникновение крови в стенку аорты происходит в результате повреждения ее внутреннего слоя (интимы) напрямую или за счет пенетрации атеросклеротической язвы [124], но возможно также первичное образование гематомы в среднем слое аорты в результате кровотечения из vasa vasorum [125, 126].
Прогноз больных с РАо является крайне неблагоприятным — до 40 % больных умирают мгновенно, далее летальность составляет около 1 % больных в течение каждого последующего часа и 5–20 % во время или сразу после оперативного вмешательства [127–129].
Поэтому при РАо своевременная диагностика и быстрое начало терапии имеют чрезвычайно большое значение. Подходы к лечению острого расслоения грудной аорты зависят от его анатомического расположения. По классификации Стэнфорда выделяют два типа РАо: тип А — охватывает все расслоения, которые затрагивают восходящую аорту, и тип В — все расслоения без поражения восходящей части аорты [124].
Изменения АД — очень частое явление у этой категории пациентов. По данным реестра IRAD, у 71 % больных с расслоением типа В и у 36 % больных с расслоением типа А уровень САД составляет более 150 мм рт.ст. [130, 131]. Напротив, около 20 % больных при госпитализации имеют устойчивую гипотензию или симптомы шока [228]. Именно эта категория больных характеризуется плохим прогнозом [132].
Частичная окклюзия основных ветвей аорты (в том числе подключичных артерий) за счет расслоения может быть причиной ложно низких результатов при измерении АД. Поэтому измерения следует обязательно проводить на обеих руках и обеих ногах пациента.
Основой начального этапа ведения больных с РАо является предотвращение дальнейшего расслоения за счет уменьшения гемодинамического стресса и одновременное определение больных, требующих хирургического или эндоваскулярного вмешательства.
Для решения первого вопроса необходимо помнить, что распространение расслоения, обусловлено не только уровнем АД, но и параметрами работы ЛЖ, а именно скоростью его сокращения (dP/dt) и ЧСС. Поэтому bадреноблокаторы (эсмолол, лабеталол, метопролол или пропранолол), которые влияют на все указанные компоненты патогенеза, являются препаратами выбора для лечения больных с РАо. Цель терапии — снижение ЧСС до менее 60 в 1 мин и поддержание уровня САД в пределах 100–120 мм рт.ст. [133].
У пациентов с относительными противопоказаниями для использования bадреноблокаторов (астма, СН, хроническое обструктивное заболевание легких и др.) препаратом выбора может быть эсмолол, который характеризуется очень малым периодом полувыведения. При непереносимости bадреноблокаторов приемлемой альтернативой может быть применение недигидропиридиновых антагонистов кальция (верапамил, дилтиазем). Впрочем, снижение ЧСС у больных со значительной аортальной регургитацией должно проводиться очень аккуратно, поскольку может спровоцировать развитие острой СН.
Использование bадреноблокаторов в большинстве случаев не позволяет адекватно контролировать уровень АД, поэтому рекомендуется применение вазодилататоров [130, 134, 135].
В исследовании [136] для целевого снижения АД у пациентов с РАо требовалось назначение 4 различных антигипертензивных препаратов. Для этого можно использовать внутривенное введение нитропруссида натрия, нитроглицерина, никардипина и ряда других антигипертензивных средств [124]. Однако надо помнить, что назначение вазодилататоров перед bадреноблокаторами очень опасно и может спровоцировать развитие рефлекторной тахикардии и повышение силы сердечных сокращений, которые являются факторами риска дальнейшего расслоения [229].
Адекватная аналгезия на фоне внутривенного введения опиатов позволяет значительно повысить эффективность антигипертензивной терапии, прежде всего за счет уменьшения симпатической активации.
Всем пациентам в случае расслоения аорты требуется консультация кардиохирурга для определения необходимости хирургического лечения [124]. При отсутствии тяжелой сопутствующей патологии хирургическое вмешательство показано всем больным с расслоением типа А [137].
Пациенты с РАо типа В нуждаются в интенсивной медикаментозной терапии. Операцию в этом случае проводят только при невозможности стабилизировать состояние больного (прогрессирование расслоения, синдром недостаточной перфузии, нестабильность гемодинамики и др.) [130, 138–141].
После стабилизации состояния за счет хирургического вмешательства и внутривенной антигипертензивной терапии большинству больных с РАо необходимо назначать длительную антигипертензивную терапию. Эта терапия, кроме bадреноблокатора, должна включать ингибитор АПФ или блокатор рецепторов ангиотензина, применение которых может сократить дальнейшую дилатацию аорты [124].
Острая гипертензивная энцефалопатия
Острая гипертензивная энцефалопатия (ОГЭ) — это неотложное состояние, обусловленное острым отеком головного мозга на фоне ГК и характеризующееся развитием неврологической (в основном общемозговой) симптоматики в виде нарушения сознания, головной боли, эпилептических припадков, менингеального синдрома. ОГЭ занимает промежуточное положение между неосложненным ГК и острым инсультом и диагностируется только в случае неподтверждения последнего.
ОГЭ, как правило, развивается у пациентов с длительным анамнезом АГ. Нарушение ауторегуляции мозгового кровотока у этих больных приводит к увеличению проницаемости гематоэнцефалического барьера в ответ на значительное повышение АД [142].
При этом возникают условия для фильтрации плазмы крови к тканям мозга и развития его вазогенного отека. Ухудшение реологических свойств крови за счет уменьшения ее жидкой части и компрессия микроциркуляторного русла отечными тканями приводят к возникновению участков ишемии головного мозга. Дальнейшее повреждение и некроз артериол на фоне повышения АД является причиной их паретического расширения и усиления отека головного мозга, что обусловливает клиническую картину заболевания [143].
Главный клинический симптом ОГЭ — головная боль. В большинстве случаев головная боль сопровождается тошнотой, рвотой, вестибулярными (головокружение, неустойчивость, ощущение покачивания) и/или зрительными (фотопсии, выпадение полей зрения) нарушениями, судорожным синдромом. В отличие от инсульта устойчивых очаговых неврологических симптомов не наблюдают, но возможно развитие проходящей рассеянной мелкоочаговой симптоматики (онемение или парестезии конечностей, языка, губ, слабость в конечностях и т.д.), обусловленной очаговой ишемией головного мозга. Тяжесть состояния больного с ОГЭ определяется уровнем нарушения сознания, который может изменяться от незначительного (слабость, спутанность) до развития комы [144, 145].
ОГЭ — это диагноз, который устанавливают путем исключения других возможных причин для возникновения неврологической симптоматики (прежде всего ишемического и геморрагического инсультов, субарахноидального кровотечения, новообразования и т.д.). Очень важно быстро и правильно диагностировать ОГЭ, поскольку подходы к снижению АД при различных неврологических неотложных состояниях разные. Поэтому, кроме обязательного осмотра невролога и офтальмолога [146], этим больным рекомендовано как можно более раннее проведение магнитнорезонансной (лучше) или компьютерной томографии. Признаки отека головного мозга при отсутствии его очагового поражения, травмы или кровоизлияния являются подтверждением диагноза ОГЭ [147].
Механизмы ауторегуляции обеспечивают относительно постоянный уровень мозгового кровотока в условиях значительных колебаний параметров центральной гемодинамики (рис. 2). Морфофункциональное перестроение мозговых артерий у пациентов со стойкой АГ приводит к смещению кривой ауторегуляции вправо. Это позволяет, с одной стороны, приспосабливаться к значительным повышениям АД без существенных изменений в уровне мозгового кровотока, с другой — приводит к возникновению ишемии в случае быстрого или значительного снижения АД [29, 142].
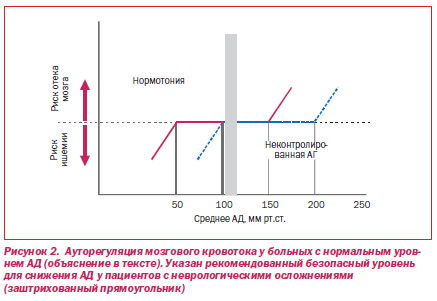
Поэтому у пациентов с ОГЭ (особенно при длительном гипертензивном анамнезе) рекомендован взвешенный подход к степени и скорости снижения АД. Считается, что снижение среднего АД на 25 % в течение 8 ч или ДАД до 100–110 мм рт.ст. достаточно безопасно и позволяет вернуться в пределы ауторегуляции [148].
Фармакологические препараты для снижения АД у больных с ОГЭ не должны иметь побочных эффектов со стороны центральной нервной системы. Используют урапидил, лабеталол. Не рекомендуется применять нифедипин, нитропруссид и гидралазин. Нитропруссид можно назначать только в случае неэффективности других препаратов, а также при ДАД выше 140 мм рт.ст. [148].
Препаратами выбора для лечения отека мозга являются салуретики (фуросемид, торасемид). В отличие от осмодиуретиков эти препараты не приводят к образованию отложенного повышения ВЧД вследствие гиперосмолярности. При неэффективности таких методов терапии применяют барбитураты и декомпрессионную хирургию.
Ишемический инсульт
У большинства пациентов с острым ишемическим инсультом (ОИИ) наблюдают существенное повышение АД в первые часы заболевания, с последующим его непроизвольным снижением в течение следующих нескольких дней [149, 150].
Повышение АД может быть обусловлено стрессовой реакцией на развитие нарушения мозгового кровообращения, тошнотой, болью, предварительной АГ, ответом на гипоксию или повышение ВЧД [151, 152].
В механизмах развития острой гипертензивной реакции при нарушении мозгового кровообращения также существенную роль играет нарушение барорефлекса [153]. Зависимость протекания ОИИ от уровня АД до конца не изучена. В некоторых исследованиях была подтверждена связь между повышением исходного уровня АД и неблагоприятным течением заболевания [154, 155], в некоторых такой зависимости не выявляли. Это свидетельствовало о том, что повышение АД при ОИИ имеет проективный характер и направлено на поддержание адекватного внутримозгового кровотока, особенно в периинфарктной зоне [156–158].
Согласно другим исследованиям, эта зависимость имела Uобразный характер, т.е. осложнения чаще наблюдали у пациентов с очень высокими и низкими уровнями АД [159–161]. Так, в исследовании L.G. Stead и соавт. наблюдали увеличение летальности среди больных с уровнем САД < 155 мм рт.ст. и > 220 мм рт.ст. и уровнем ДАД < 70 мм рт.ст. и > 105 мм рт.ст. [162]. Показана также взаимосвязь неблагоприятного прогноза с увеличением пульсового АД [163].
Теоретически поводами для снижения АД у пациентов с ОИИ являются возможность уменьшения отека головного мозга, предотвращение геморрагической трансформации и профилактика дальнейшего сосудистого повреждения. Немедленное снижение АД необходимо также при поражении других органовмишеней или развитии гипертензивной энцефалопатии [152, 164]. С другой стороны, активное снижение АД может привести к ухудшению неврологической симптоматики за счет снижения перфузии ишемизированных участков головного мозга, которые образуются вокруг основного очага [165, 166]. Оптимальный уровень АД у больных с АГ в анамнезе — 180–190/105 мм рт.ст., без АГ — 160/90 мм рт.ст.
Большинство исследований, в которых проверяли эффективность раннего активного снижения АД у пациентов с ОИИ, были неудачными. Причем отрицательные последствия быстрого снижения АД у этой категории пациентов не зависели от того, использовали ли для этого специфические антигипертензивные препараты. Так, J. OliveiraFilho и соавт. продемонстрировали снижение АД в среднем на 28 % в течение первых суток ОИИ, независимо от использования антигипертензивных препаратов, при этом снижение АД на каждые 10 % приводило к увеличению количества ранних осложнений почти в два раза [167].
В исследовании J. Castillo и соавт. ухудшение неврологической симптоматики, увеличение размера очага поражения и количества неблагоприятных событий, учитывая смерть, ассоциировались со снижением как САД, так и ДАД более чем на 20 мм рт.ст. [161].
В рандомизированном многоцентровом исследовании INWEST неблагоприятный эффект нимодипина при ОИИ был связан именно со снижением АД на фоне его приема [168, 169].
В то же время при применении других препаратов (ингибитор АПФ и bадреноблокатор) в исследовании CHHIPS снижение АД у пациентов с ОИИ не приводило к ухудшению результатов лечения и даже снижало летальность. 179 больных с АД ≥ 160 мм рт.ст. до 36 ч от начала симптоматики ОИИ начинали получать лизиноприл, лабеталол или плацебо. Дозы препаратов увеличивали до достижения целевых значений САД 145–150 мм рт.ст. или его снижения на 15 мм рт.ст. В результате лечения уровень САД был значительно ниже в активной группе, чем в группе контроля, как через 24 ч, так и через 2 нед. от момента рандомизации. Не выявлено различий между группами по частоте развития серьезных побочных явлений в течение периода наблюдения, ухудшения неврологической симптоматики в первые 72 ч, а также смерти/недееспособности через 2 нед. от начала лечения. Была установлена тенденция к снижению частоты возникновения смерти от всех причин через 3 мес. наблюдения в группе активного лечения (9,7 против 20,0 %, Р = 0,05) [170].
В исследовании COSSACS (n = 763) доказано, что продолжение антигипертензивной терапии в острой фазе ОИИ приводит к значительному снижению АД, но не уменьшает вероятности развития смерти/недееспособности через 2 нед. наблюдения, а также не влияет на количество серьезных побочных явлений и основных сердечнососудистых событий в течение 6 мес. [171].
Уменьшение частоты возникновения смерти и неблагоприятных сосудистых событий после острого инсульта было продемонстрировано в исследовании ACCESS с применением блокатора рецепторов ангиотензина II кандесартана. Кандесартан назначали с первых суток ОИИ с постепенным увеличением дозы при уровне САД > 160 мм рт.ст. или ДАД > 100 мм рт.ст., а на 7е сутки в случае необходимости добавляли другие антигипертензивные средства. При очень высоких уровнях АД применяли неотложную внутривенную его коррекцию. Однако положительных эффектов кандесартана не наблюдали в течение первых месяцев лечения, а достоверное расхождение кривых начиналось только после 1 года [172].
В недавно опубликованном многоцентровом плацебоконтролируемом исследовании SCAST (n = 2029) у пациентов с ОИИ и АД > 140 мм рт.ст. также не выявили положительного эффекта раннего (в течение первых 7 дней) назначения кандесартана на развитие основных сердечнососудистых событий (смерть/нефатальный ИМ/инсульт) в течение 6 мес. наблюдения. Функциональное состояние пациентов, принимавших кандесартан, по модифицированной шкале Rankin через 6 мес. было оценено как худшее, чем в группе контроля (Р = 0,048, хотя в этом исследовании достоверными считали различия при Р < 0,025) [173].
При анализе результатов 37 исследований (всего 9008 пациентов), в которых тестировали эффективность 13 различных антигипертензивных препаратов, не выявили статистически значимых преимуществ ранней антигипертензивной терапии у больных с ОИИ по сравнению с группой контроля. В группе активного лечения зависимость неблагоприятных событий от изменений АД имела U или Jобразный характер — как значительное снижение, так и любое повышение АД ассоциировалось с ухудшением результатов лечения. Наиболее хорошие результаты в группе активного лечения наблюдали при достаточно умеренном (от 8,1 до 14,6 мм рт.ст.) снижении уровня САД [174].
Результаты исследований достаточно неоднозначны, но в большинстве своем свидетельствуют о безопасности умеренного подхода к снижению АД у больных с ОИИ и повышенным АД. Вместе с тем довольно четко не установлены уровни АД, которые требуют неотложного лечения, а также не определены скорость и предел для его снижения. На сегодняшний день повышенное АД у пациентов с ОИИ корректируют, учитывая возможность проведения тромболитической терапии. Больным, которым планируют введение тканевого активатора плазминогена, неотложное снижение АД рекомендуется при повышении САД > 185 мм рт.ст. и/или ДАД > 110 мм рт.ст., поскольку превышение этих уровней является противопоказанием для введения тромболитического препарата. У остальных пациентов пределом для безотлагательного лечения определены уровни САД > 220 мм рт.ст. и ДАД > 120 мм рт.ст. [175].
Снижение АД необходимо проводить очень осторожно, чтобы предотвратить усиление неврологической симптоматики за счет ухудшения внутримозговой гемодинамики. Целесообразным считается снижение среднего АД на 15–25 % в течение первых суток [98, 175].
Выбор антигипертензивного препарата зависит от скорости и продолжительности (в случае ухудшения неврологической симптоматики на фоне снижение АД) его действия, от возможных побочных эффектов и влияния на внутримозговое кровообращение.
На сегодня с целью снижения АД у пациентов с ОИИ рекомендовано применение лабеталола, урапидила. Учитывая отсутствие негативного влияния на внутримозговое кровообращение в целом и на кровообращение в периинфарктной зоне при ОИИ, Европейской организацией инсульта урапидил рекомендован для коррекции АД при остром нарушении мозгового кровообращения.
Режимы антигипертензивной терапии представлены в табл. 7. При этом для предотвращения развития гипотензивной реакции необходимо строго придерживаться рекомендованных протоколов по режиму введения препаратов и четко контролировать уровень АД [176].
Нитропруссид натрия и нифедипин повышают уровень ВЧД и нарушают ауторегуляцию внутримозгового кровообращения [50–52], поэтому использование этих препаратов при ОИИ противопоказано.
Нитропруссид можно использовать только как средство «последней надежды» в случае неэффективности других антигипертензивных препаратов и ДАД выше 140 мм рт.ст. при необходимости быстрого снижения АД (например, сопутствующий отек легких или расслоение аорты). В случае получения больным антигипертензивной терапии до инсульта он продолжает ее принимать в острый период инсульта. Пациенты с нелеченой АГ со второй недели заболевания должны принимать комбинированные антигипертензивные препараты.
Геморрагический инсульт
У больных с геморрагическим инсультом прогноз заболевания прежде всего определяется объемом внутричерепной гематомы (ВЧГ), увеличение которой происходит в течение первых часов (особенно первых 3 ч) и существенно замедляется или прекращается через 1 сутки [177, 178].
Объем ВЧГ напрямую коррелирует со степенью повышения САД (≥ 160 мм рт.ст.) [179], которое наблюдается у 46–75 % больных с внутричерепным кровотечением (ВЧК) [180–182].
Потенциальными патофизиологическими механизмами повышения АД считают стрессиндуцированную активацию нейроэндокринной системы (симпатической нервной системы, ренинангиотензинальдостеронового механизма, глюкокортикоидной системы) и повышение ВЧД. АГ теоретически может способствовать гидростатическому увеличению гематомы и перигематомного отека, а также увеличивать вероятность повторного кровотечения [194].
По результатам метаанализа, повышение САД от 140 до 150 мм рт.ст. в первые 12 ч от развития ВЧК сопровождалось увеличением риска возникновения смерти почти в два раза или ограничением дееспособности [154, 183].
К сожалению, данных о влиянии снижения АД на размер ВЧГ сегодня немного. Напротив, теоретически существует угроза, что активное снижение АД может ухудшить перфузию головного мозга и вызвать его ишемическое поражение. Поэтому в рекомендациях Американской ассоциации сердца/Американской ассоциации инсульта в 2007 г. был закреплен достаточно умеренный подход к коррекции АД у больных с ВЧК (табл. 8) [184].
Этот подход основывался прежде всего на мнении экспертов и результатах небольших клинических исследований. Однако в ряде экспериментальных и клинических работ не обнаружили зон гипоперфузии или нарушений ауторегуляции мозгового кровотока вокруг ВЧГ, которые могли бы вызвать ишемическое поражение головного мозга [180, 185–189].
Несколько нерандомизированных клинических исследований также подтвердили безопасность раннего снижения АД либо даже показали улучшение клинического течения заболевания у больных с ВЧГ. В исследовании S. Koch и соавт. сравнивали стандартную (среднее АД 110–130 мм рт.ст.) и интенсивную (среднее АД < 110 мм рт.ст.) антигипертензивную терапию у пациентов с ВЧК, которые были рандомизированы в первые 8 ч (в среднем 3,2 ± 2,2 ч) от момента появления симптомов заболевания. Уровень среднего АД удерживали стандартными препаратами, согласно рутинной клинической практике (лабеталол, никардипин или нитропруссид натрия) в течение 48 часов. В среднем необходимого уровня АД достигали через 87,1 ± 59,6 и 163,5 ± 163,8 мин в группах стандартной и интенсивной терапии соответственно. Через 90 суток различий между группами по частоте раннего ухудшения неврологической симптоматики, размерам гематомы и окологематомного отека и клиническим результатам наблюдения не выявлено [190].
A. Qureshi и соавт. оценивали переносимость и безопасность интенсивной антигипертензивной терапии (гидралазин и лабеталол) у 27 пациентов с ВЧК. Удерживали CAД ниже 160 мм рт.ст. и ДАД меньше 90 мм рт.ст. в течение не менее 24 ч от развития заболевания. Ухудшение неврологической симптоматики наблюдали у 2 (7,4 %) больных, увеличение размера ВЧГ — у 2 (9,1 %) из 22 пациентов, которым проводили повторную компьютерную томографию. Авторы сделали вывод о возможности раннего применения интенсивной фармакотерапии при остром повышении АД у больных с ВЧК [191].
В феврале 2010 г. были опубликованы результаты исследования АТАСН, в котором больных распределили на три группы в зависимости от целевых уровней CAД: 170–200, 140–170 и 110–140 мм рт.ст. В исследование включали больных с симптомами спонтанной ВЧК на протяжении 6 ч от развития заболевания и CAД 170 мм рт.ст. Снижения и удержания целевых уровней АД в течение 18–24 ч достигали путем внутривенной инфузии никардипина по стандартной схеме. Из 774 отобранных больных рандомизировали только 60 пациентов — 18, 20 и 22 пациента соответственно в 1, 2 и 3ю группы. Целевые уровни САД были достигнуты у всех пациентов 1й и 2й группы и у 13 (59,1 %) пациентов 3й группы. Ухудшение неврологической симптоматики в течение первых 24 часов наблюдали у 1 (6 %), 2 (10 %) и 4 (18 %) пациентов, а развитие серьезных побочных явлений в течение 72 часов — у 0; 1 (5 %) и 3 (14 %) пациентов 1, 2 и 3й группы. Через 3 мес. наблюдения умерло соответственно 3 (17 %), 2 (10 %) и 5 (23 %) пациентов. Частота нежелательных побочных явлений была меньше, чем ожидали перед началом исследования, поэтому авторы сделали вывод о безопасности интенсивного подхода к снижению АД у больных с ВЧК [192].
Результаты исследования послужили основанием для проведения нового проекта — АТАСНІІ. Его цель – определить возможность предотвращения смерти и ограничения дееспособности через 90 дней путем интенсивной антигипертензивной терапии никардипином в первые 24 ч от развития заболевания. В исследование включают пациентов с ВЧК в пределах 3 ч от появления первой неврологической симптоматики и уровнем САД 180–240 мм рт.ст. Целевое САД в группе интенсивной терапии составляет 140 мм рт.ст., в группе контроля — 180 мм рт.ст. Набор пациентов начался в 2010 г., планируемое количество участников — около 1300 [193].
В исследование INTERACT привлекали пациентов со спонтанным ВЧК в течение 6 часов от возникновения симптоматики и повышенным уровнем САД (150–220 мм рт.ст.). В дальнейшем больных распределили в группы стандартного (CAД ≤ 180 мм рт.ст.) и активного контроля АД (снижение САД ≤ 140 мм рт.ст. в течение 1 ч после начала терапии и удержание такого уровня в течение недели). Для снижения АД использовали наиболее используемые в клинике препараты по стандартной схеме (урапидил и/или фуросемид более 80 % больных из группы интенсивного лечения). В 2008 г. были опубликованы результаты первой фазы исследования (203 пациента в группе интенсивного и 201 пациент в группе стандартной терапии). Через 1 час после рандомизации среднее САД в группе стандартного контроля составляло 167 мм рт.ст., в группе интенсивного контроля — 153 мм рт.ст. (Р < 0,0001), средний уровень САД от 1 до 24 часов — соответственно 157 и 146 мм рт.ст. (Р < 0,0001). Через 24 ч лечения в группе интенсивного контроля АД отмечен на 22,6 % меньший прирост размера ВЧГ (Р = 0,06), а также значительно меньший процент больных с существенным (>33 % или 12,5 мл) увеличением размера ВЧГ (Р = 0,05). Частота возникновения нежелательных побочных явлений и смерти в течение 90 дней наблюдения существенно не отличалась. Полученные результаты позволили авторам сделать вывод, что раннее интенсивное снижение АД у больных с ВЧК достижимо, хорошо переносится и, вероятно, приводит к уменьшению прироста ВЧГ [76].
Таким образом, на сегодня остаются действительными рекомендации по умеренному снижению АД у больных со спонтанной ВЧК с учетом уровня ВЧД. Вместе с тем, учитывая данные предыдущих исследований, у пациентов с ВЧК и САД 150–220 мм рт.ст. острое снижение АД до 140 мм рт.ст. может считаться безопасным. Именно это положение нашло отражение в новых рекомендациях Американской ассоциации сердца/Американской ассоциации инсульта 2010 г. [194].
Субарахноидальное кровоизлияние
Субарахноидальное кровоизлияние (САК) нетравматического генеза — это довольно частый патологический процесс (до 5 % всех инсультов), который заключается в попадании крови в субарахноидальное пространство за счет разрыва мешкообразной аневризмы или артериовенозной мальформации. Основной метод лечения этого заболевания — хирургический (или инвазивный). Задача медикаментозной терапии заключается в предотвращении и лечении отека мозга, повторного кровоизлияния и ангиоспазма. Поэтому контроль АД является очень важной составляющей медикаментозной терапии. Хотя сегодня нет однозначных данных, влияет ли адекватный контроль АД на вероятность повторного кровоизлияния, большинство исследований подтверждают развитие этого осложнения у пациентов с повышенным уровнем и значительными изменениями АД [195, 196]. В этих исследованиях развитие повторного кровотечения ассоциировалось с уровнем САД более 150–160 мм рт.ст.
На современном этапе целью антигипертензивной терапии у больных с САК в предоперационный период является поддержание САД ниже 140 мм рт.ст. и ДАД ниже 90 мм рт.ст. [197, 198].
Для достижения целевых уровней АД используют длительную инфузию никардипина, лабеталола или эсмолола. Следует избегать использования нитропруссида натрия в связи с возможностью повышения ВЧД и токсичности в случае длительного использования [199].
В отличие от этого урапидил не влияет на уровень ВЧД и позволяет надежно и безопасно контролировать АД у этих больных [200].
После САК у 30–70 % больных регистрируют спазм артерий основания головного мозга, что приводит к существенному ухудшению дистального мозгового кровотока. Как правило, признаки вазоспазма наблюдают на 3и — 5е сутки, достигают максимума на 5–14е сутки и проходят к концу 2–4й недели [201, 202].
Примерно у половины больных ухудшение внутримозговой гемодинамики вследствие вазоспазма приводит к возникновению нового неврологического дефицита, который может проходить или приводить к развитию инфаркта мозга [203, 204].
Для предотвращения и лечения мозгового вазоспазма оперативные вмешательства по поводу САК следует проводить как можно быстрее. Уже с первых часов после развития САК все больные должны принимать нимодипин (60 мг 4 раза в сутки). Данных об эффективности других антагонистов кальция в настоящее время нет [199, 205].
Лечение нарушений мозгового кровообращения вследствие мозгового вазоспазма заключается в увеличении объема циркулирующей крови (hуреrvolemia), гемодилюции (haemodilution) и повышении АД (hypertension) — правило 3h [199].
У некоторых больных в этот период наблюдается спонтанное повышение АД, которое в большинстве случаев имеет компенсаторный характер и направлено на поддержание надлежащего уровня мозгового кровообращения [206].
Поэтому у больных с САК в послеоперационный период (ликвидирована причина повторного кровотечения) антигипертензивную терапию не проводят, если уровень САД составляет до 200 мм рт.ст. [198].
Эклампсия и преэклампсия
АГ осложняет течение беременности примерно у 12 % женщин и является причиной материнской смертности в 18 % случаев [207].
Терапия преэклампсии/эклампсии является достаточно сложной и состоит в контроле обмена жидкости, профилактике возникновения судорог и нормализации АД [208–210].
Лечение АГ не является патогенетическим, но необходимо для матери и плода. Снижение АД необходимо для предотвращения развития гипертензивной энцефалопатии и мозговых кровоизлияний. Следует стремиться довести АД до безопасного уровня (140/90–150/100 мм рт.ст., не ниже!), который обеспечивает сохранение адекватного мозгового и плацентарного кровотока. Быстрое и резкое снижение уровня АД может вызвать ухудшение состояния матери и плода.
Антигипертензивную терапию проводят при повышении САД более 160 мм рт.ст. и/или ДАД более 105 мм рт.ст. [211, 212]. Она необходима для снижения и поддержания АД на оптимальном уровне, что позволит, с одной стороны, предотвратить развитие ВЧК, СН и инфаркта/отслойки плаценты, с другой — не приведет к ухудшению мозгового и/или плацентарного кровообращения [213].
Считают, что оптимальный уровень САД составляет 140–160 мм рт.ст., ДАД — 90–105 мм рт.ст. Достаточно узкий диапазон целевых уровней АД в сочетании с нестабильностью его показателей, что является характерной особенностью больных с преэклампсией/эклампсией, обусловливает необходимость постоянного мониторинга таких больных в отделениях интенсивной терапии. Применение больших доз магния также требует ежечасного контроля диуреза и уровня глубоких сухожильных рефлексов. Идеального препарата для контроля АД у больных с преэклампсией/эклампсией не существует. Традиционно с этой целью используют гидралазин. Этот препарат незначительно проникает через плацентарный барьер и не приводит к ухудшению плацентарного кровообращения. В большинстве случаев он хорошо переносится, но может приводить к развитию побочных эффектов (головная боль, тошнота, рвота, рефлекторная тахикардия), которые трудно отличить от обострения преэклампсии. Препарат также характеризуется отсроченным, непредсказуемым и длительным гипотензивным действием, что значительно ограничивает его применение [214].
Гидралазин: 20 мг (1 мл) препарата растворяют в 20 мл 0,9% раствора хлорида натрия, вводят медленно внутривенно по 5 мл (5 мг гидралазина) каждые 10 мин, пока ДАД не снизится до безопасного уровня (90–100 мм рт.ст.). При необходимости повторяют введение гидралазина по 5–10 мг ежечасно или 12,5 мг внутримышечно каждые 2 часа.
С целью снижения АД у беременных может также использоваться лабеталол [215–218]. Он является водорастворимым препаратом, поэтому почти не проникает через плацентарный барьер. Прямое сравнение применения лабеталола и гидралазина в рандомизированном клиническом исследовании не выявило у матерей существенных различий по частоте возникновения гипотензии, в то время как терапия гидралазином чаще сопровождалась тахикардией. Новорожденные также не отличались по основным показателям, кроме АД и брадикардии, частота которых была значительно выше при использовании лабеталола. По результатам этого исследования оба препарата были признаны приемлемыми для лечения тяжелой АГ во время беременности [230].
Лабеталол применяют вначале внутривенно 10 мг, через 10 мин при отсутствии адекватной реакции (ДАД выше 110 мм рт.ст.) — дополнительно еще 20 мг. АД контролируют каждые 10 мин, и, если ДАД сохраняется выше 110 мм рт.ст., вводят 40 мг, а затем 80 мг лабеталола (максимально до 300 мг).
При отсутствии лабеталола возможно применение нифедипина 5–10 мг под язык. Если эффекта не наблюдают, то через 10 мин необходимо дать еще 5 мг под язык. Следует помнить, что на фоне введения сульфата магния нифедипин может привести к быстрому развитию гипотензии.
Урапидил. Начальная доза урапидила составляет 6,5 мг, через 5 мин, если нет адекватной реакции, — дополнительно еще 2,5 мг. АД контролируют каждые 10 мин. В дальнейшем продолжают инфузию урапидила со скоростью 2–4 мг/ч до стабилизации АД или до окончания родов.
Урапидил и дигидралазин одинаково эффективно снижали уровень АД у беременных с преэклампсией. Однако гемодинамические эффекты урапидила были более предсказуемы, и этот препарат лучше переносится [78, 79].
В другом исследовании использование урапидила ассоциировалось со значительно меньшим влиянием на гемодинамические параметры новорожденных, чем внутривенное введение дигидралазина [80].
Урапидил рекомендуется для оказания неотложной помощи больным с АГ во время беременности (Европейское общество кардиологов, 2011).
Как антиконвульсант с одновременным антигипертензивным действием используют сульфат магния, который является препаратом выбора для профилактики и лечения судорог, которые у госпитализированных женщин возникают вследствие недостаточного лечения тяжелой преэклампсии. Магнезиальную терапию начинают с момента госпитализации, если ДАД > 105 мм рт.ст. Стартовую дозу — 4 г сухого вещества (16 мл 25% раствора сульфата магния) — вводят шприцем очень медленно в течение 15 мин (в случае эклампсии — в течение 5 мин). Поддерживающую терапию стандартно начинают с дозы 1 г сухого вещества сульфата магния в час.
Применение ингибиторов АПФ и нитропруссида натрия у беременных противопоказано.
Гипертонический криз вследствие гиперсимпатикотонии
Чаще всего этот вид ГК вызван применением средств симпатомиметического действия, таких как кокаин или амфетамины, реже наблюдается у больных с феохромоцитомой, а также при одновременном приеме ингибиторов моноаминоксидазы и продуктов питания, содержащих тирамин (твердые сыры, алкогольные напитки, белковые смеси). Развитие гиперсимпатикотонии возможно также у пациентов, которые резко отменили прием клонидина или bадреноблокаторов.
При лечении таких ГК не следует использовать bадреноблокаторы, по крайней мере как препараты первого ряда. Блокада bадренорецепторов может повысить уровень катехоламинов в плазме крови и усилить активацию aадренорецепторов. Следствием такой активации является спазм венечных артерий с развитием острой ишемии миокарда, прогрессирующее повышение АД и увеличение летальности [92, 219, 220].
Даже для лабеталола, который в течение длительного времени теоретически рассматривали как идеальный препарат для лечения этой категории больных, нет подтверждения эффективности в клинической практике вследствие подавляющей блокады bадренорецепторов [221–225]. Препаратами выбора для лечения таких больных являются периферические aадреноблокаторы (в Украине только урапидил) или нитроглицерин/нитропруссид в сочетании с диазепамом. Возможно использование верапамила [226].
Периоперационная гипертензия
Периоперационную АГ наблюдают примерно у 25 % пациентов с сопутствующей АГ. С учетом значительной распространенности гипертонической болезни (в 2009 г. в Украине зарегистрировано около 12 млн больных) проблема предоперационной подготовки, интра и послеоперационного ведения этих больных становится очень актуальной в связи с высоким риском сердечнососудистых осложнений и смерти на фоне изменений АД. Отдельной проблемой является также рост риска геморрагических осложнений.
Периоперационное повышение АД чаще наблюдают во время вводного наркоза интраоперационно — за счет стимуляции симпатической нервной системы в ответ на боль; в ранний посленаркозный период — в результате боли, гипотермии, гипоксии или перегрузки жидкостью во время хирургического вмешательства; через 24–48 ч после операции — в ответ на перераспределение жидкости из внесосудистого пространства в сосуды. Послеоперационное повышение АД также может быть обусловлено отменой антигипертензивной терапии. Чаще АД возрастает при операциях на сонных артериях, брюшной аорте, периферических артериях, органах брюшной или грудной полости. Повышение ДАД > 110 мм рт.ст. является предоперационным маркером развития сердечнососудистых событий во время и сразу после операции. Таким образом, все пациенты, которые принимают антигипертензивную терапию, должны продолжать это делать непосредственно до проведения операции, включая утро перед вмешательством.
Предоперационная гипертензия
В большинстве случаев предоперационная АГ соответствует критериям неосложненного ГК. Повышение АД не приводит к поражению органовмишеней, а лишь представляет потенциальную угрозу для больного. Кроме того, в большинстве случаев перед оперативным вмешательством есть достаточно времени для адекватного снижения АД. Однако сам факт предоперационной АГ (САД > 180 мм рт.ст. или ДАД >> 110 мм рт.ст.) у мужчин связан с ростом риска возникновения смерти более чем в 3–4 раза после хирургического вмешательства не на сердце. Поэтому плановые операции следует отсрочить до адекватного контроля АД. Существенное повышение АД у пациентов перед неотложным хирургическим вмешательством без непосредственного поражения органовмишеней тоже рассматривают как неосложненный ГК. В этом случае АД необходимо снижать непосредственно перед операцией, желательно препаратами короткого действия, что позволит предотвратить возникновение кровотечений и поражения жизненно важных органов во время и после операции.
Особое внимание следует обращать на пациентов, принимающих клонидин для контроля АД. Внезапная отмена препарата может привести к рикошетному синдрому с развитием ГК, как при феохромоцитоме, особенно у больных, принимающих bадреноблокаторы. Поэтому перед выполнением планового вмешательства необходимо постепенно перевести больного на прием других антигипертензивных препаратов или использовать клонидин перед неотложной операцией. В случае развития рикошетного синдрома применяют внутримышечное введение клофелина.
При шунтировании периферических сосудов, аортокоронарном шунтировании, эндартерэктомии сонной артерии, резекции внутримозговой опухоли и операциях по удалению артериальной аневризмы особенно важно контролировать АД во время вмешательства для предотвращения появления осложнений, поэтому предоперационная подготовка этой категории больных должна проводиться очень тщательно.
Как осложненные рассматривают предоперационные ГК у пациентов с острым расслоением аорты, АГ беременных и с феохромоцитомой. Эти состояния требуют активного снижения АД перед вмешательством и во время операции по принципам, рекомендованным для таких нозологий.
Интра и послеоперационная гипертензия
Острое повышение САД или среднего АД на 20 % и более во время хирургической операции рассматривают как осложненный ГК. Чаще ГК возникают во время операций на сердце, магистральных сосудах (сонная артерия, аорта), почках, голове и шее, нейрохирургических вмешательств и операций, связанных с травмами (ожоги, травмы головы), однако возможны и при любом оперативном вмешательстве под общей или местной анестезией.
В основном препараты для наркоза вызывают снижение АД, однако некоторые (например, кетамин) способны резко дестабилизировать гемодинамику и спровоцировать интраоперационную АГ, особенно при монотерапии.
Нередко причиной развития интраоперационной АГ является неадекватная общая анестезия. В таких случаях устранение АГ предусматривает прежде всего переоценку глубины общей анестезии, при необходимости — углубление анестезии, а затем — применение антигипертензивных средств.
Частой причиной интраоперационной АГ является использование вазоконстрикторов (адреналина гидрохлорид) отдельно (аппликация на слизистые оболочки) или вместе с местными анестетиками (инфильтрационная или проводниковая анестезия). Эта ситуация типична для стоматологических, отоларингологических, офтальмологических, эндоскопических оперативных вмешательств. Причем похожие случаи интраоперационной АГ регистрируют тогда, когда используют не готовую форму местного анестетика, а готовят смесь местного анестетика и адреналина гидрохлорида ex tempore. При условии тщательного мониторинга АД возрастание уровня ДАД может достигать 45–70 %. В результате у больных даже после одного перенесенного интраоперационного эпизода ГК может развиваться острая гипертоническая энцефалопатия, клиническими признаками которой являются замедленное пробуждение, психомоторное возбуждение, судорожная готовность, тошнота и/или рвота, выраженная головная боль, проявления атаксии. Интраоперационные ГК, как правило, усиливают объем операционной кровопотери.
Послеоперационную АГ определяют как повышение САД ≥ 190 мм рт.ст. и/или ДАД ≥ 100 мм рт.ст. по результатам двух последовательных измерений. Развитие АГ, которая является достаточно частым событием в ранний послеоперационный период, связывают с увеличением тонуса симпатической нервной системы и увеличением сосудистого сопротивления. Основными причинами дестабилизации АД являются послеоперационная боль, психоэмоциональные реакции, пропуск дозы антигипертензивного препарата или их комбинации перед операцией и т.п. Повышение АД, как правило, начинается примерно через 10–20 мин после вмешательства и продолжается до 4–6 часов. Если адекватно и своевременно не провести лечение, то резко возрастает риск развития кровотечения, цереброваскулярного события или ИМ. Распространенность послеоперационной АГ варьирует от 4 до 35 % в зависимости от популяции больных и вида оперативного вмешательства. Наиболее высокий риск отмечают у больных с операциями на сердце и магистральных сосудах.
Лечение периоперационной гипертензии
Лучший результат имеет профилактика периоперационной АГ. У большинства больных повышение АД во время или после операции возникает в ответ на нарушение длительного режима антигипертензивной терапии. Поэтому рекомендуется перед вмешательством (хотя бы за несколько суток) перевести больного на прием препаратов длительного действия, последнюю дозу антигипертензивного средства принять утром перед операцией, а после нее как можно скорее возобновить прием привычной терапии.
Предоперационную АГ перед неотложным оперативным вмешательством лечат по принципу терапии неосложненных ГК. При этом оптимально применять антигипертензивные средства короткого действия и такие, которые не имеют негативного фармакологического взаимодействия с препаратами для наркоза.
Наличие повышенного АД у пациентов, которым намечается проведение плановой операции, требует более тщательного подбора терапии, желательно с использованием препаратов длительного действия. У пациентов с анамнезом гипертонической болезни уровень ДАД в пределах 110 мм рт.ст. не является поводом для задержки хирургического вмешательства.
Во время и сразу после оперативного вмешательства уровень АД рекомендуется поддерживать в пределах 20 % от предоперационного. При лечении интра и послеоперационной АГ общепринятого мнения относительно темпов снижения и целевых уровней АД (особенно у пациентов некардиологического профиля) не существует. Решение относительно вида терапии часто принимается у постели больного анестезиологом и хирургом, с учетом исходных уровней АД, сопутствующей патологии и возможного риска осложнений. В большинстве случаев целью терапии является снижение среднего АД не более чем на 25 % с помощью парентеральных антигипертензивных средств. В первые 30–60 мин терапии необходимо добиться уменьшения ДАД на 10–15 % или примерно до 110 мм рт.ст. На фоне снижения АД рекомендуется проводить умеренную инфузионную терапию солевыми растворами для восполнения объема циркулирующей крови, восстановления перфузии и предотвращения стремительного снижения АД и гипоперфузии жизненно важных органов (прежде всего головного мозга и почек). Вернуться к исходному уровню АД рекомендуется через 24–48 часов.
У пациентов кардиохирургического профиля рекомендуется более активный подход. Антигипертензивную терапию в этом случае следует начинать при уровне АД > 140/90 мм рт.ст. или уровне среднего АД 105 мм рт.ст. и выше.
Боль и тревога также способствуют повышению АД, поэтому их необходимо преодолеть еще до начала антигипертензивной терапии. Также необходимо устранить такие возможные причины повышения АД в послеоперационный период, как гипотермия с ознобом, гипоксемия, гиперкапния, переполнение мочевого пузыря.
Для стабилизации АД при возникновении периоперационного осложненного ГК доказанным является использование урапидила, лабеталола и эсмолола. Преимущества использования того или иного антигипертензивного препарата у различных категорий хирургических больных тестировались во многих клинических исследованиях. Однако следует заметить, что на фоне действия пропофола упомянутые средства могут чрезмерно снижать АД, поэтому их применение требует более тщательного контроля АД.
Одним из препаратов, который с успехом зарекомендовал себя в терапии периоперационной АГ, является селективный bадреноблокатор урапидил. Кроме блокады периферических aадренорецепторов, урапидил взаимодействует с серотониновыми 5НТ1Арецепторами сосудистодвигательного центра продолговатого мозга, благодаря чему коррекция АД на фоне его применения не вызывает развития рефлекторной тахикардии. Влияние урапидила на уровень АД и другие гемодинамические показатели у кардиохирургических больных с периоперационной АГ изучали в ряде исследований. Антигипертензивная эффективность урапидила такая же, как у нитропруссида натрия и фентоламина, и лучше, чем у нитроглицерина. Урапидил также с успехом использовали в ряде исследований для лечения периоперационной АГ в общехирургической практике.
Итоги
Приведенный документ является междисциплинарным консенсусом по диагностике и лечению артериальных гипертензивных кризов. Он носит согласующий характер и соответствует современным представлениям различных специалистов по диагностике и лечению этих состояний. Авторы надеются, что он найдет отклик как у врачей общей практики, так и у соответствующих специалистов. Первым признаком принятия и признания практической значимости этого документа следует считать поддержку его Ассоциацией кардиологов Украины — он был согласован и утвержден во время проведения Национального конгресса кардиологов Украины в сентябре 2011 г. Дальнейшее внедрение практических аспектов разработанного документа будет зависеть от усилий специалистов смежных с кардиологией специальностей и его принятия врачами общей практики