Журнал «Медико-социальные проблемы семьи» 1 (том 19) 2014
Вернуться к номеру
Введение в клиническую иммунологию, клинико-лабораторная оценка иммунного статуса (лекция)
Авторы: Майлян Э.А. - Донецкий национальный медицинский университет им. М. Горького
Рубрики: Акушерство и гинекология
Разделы: Справочник специалиста
Версия для печати
Клиническая иммунология — медицинская наука, которая с момента возникновения отличается высокой эффективностью практического использования научных достижений. Изучение клинической иммунологии и использование ее в практической деятельности врачом любой специальности невозможно без знаний основ иммунологии. В лекции представлены основные понятия клинической иммунологии, органы иммунной системы и их функция. На основании современных представлений даны характеристика врожденного и адаптивного иммунитета, биологическая роль и клиническая значимость гуморальных и клеточных факторов иммунитета, основные принципы оценки иммунного статуса человека.
Клінічна імунологія — медична наука, що з моменту виникнення відрізняється високою ефективністю практичного використання наукових досягнень. Вивчення клінічної імунології і використання її у практичній діяльності лікарем будь-якої спеціальності неможливо без знань основ імунології. У лекції наведені основні поняття клінічної імунології, органи імунної системи та їх функція. На підставі сучасних уявлень подані характеристика вродженого й адаптивного імунітету, біологічна роль і клінічна значимість гуморальних і клітинних факторів імунітету, основні принципи оцінки імунного статусу людини.
Clinical immunology — medical science which from the moment of emergence is characterized by the high performance of scientific achievements practical use. Studying of the clinical immunology and its use in practice by the physician of any specialty is impossible without knowledge of immunology fundamentals. The lecture contains general concepts about the clinical immunology, immune system organs and their functions. On the basis of modern representations, the characteristic of congenital and adaptive immunity, a biological role and a clinical significance of humoral and cell factors of immunity, general principles of the human immune status assessment have been presented.
органы и факторы иммунитета, иммунная недостаточность, иммунограмма.
органи та фактори імунітету, імунна недостатність, імунограма.
organs and immunity factors, immune failure, immunogram.
Статья опубликована на с. 115-121
Основные понятия. На современном этапе одним из направлений иммунологии является клиническая иммунология. Клиническая иммунология — это клиническая и лабораторная дисциплина, которая занимается обследованием, диагностикой и лечением больных с заболеваниями или патологическими процессами, развивающимися в результате нарушения иммунных механизмов, а также теми случаями, когда иммунологические манипуляции являются важной частью терапии и/или профилактики.
Термин «иммунитет» возник от латинского слова immunitas — освобождение, избавление от чего-либо. Поэтому понятие «иммунитет» подразумевает способность иммунной системы распознавать и нейтрализовать «чужое» и измененное «свое». Биологический смысл иммунитета — обеспечение генетической целостности организма на протяжении его индивидуальной жизни. В настоящее время иммунная система рассматривается как система контроля, обеспечивающая индивидуальность и целостность организма в результате способности отличать собственные структуры организма от генетически чужеродных, а также перерабатывать и элиминировать последние.
Органы иммунной системы. Система иммунитета состоит из лимфоидных органов и тканей, расположенных в различных участках организма, но функционирующих как единое целое. Центральным элементом этой системы является лимфоцит.
Органы иммунной системы разделяют на два типа: центральные (первичные) и периферические (вторичные). К центральным органам иммунной системы человека относят костный мозг и вилочковую железу (тимус). Оба центральных органа являются местами созревания и дифференцировки лимфоцитов. В костном мозге образуются зрелые В-лимфоциты и предшественники Т-клеток. Пре-Т-клетки, поступая в тимус, проходят в нем окончательную дифференцировку в зрелые Т-лимфоциты. Покинув центральные органы иммунной системы, лимфоциты заселяют соответствующие области периферических лимфоидных органов (В-лимфоциты — В-зависимые, а Т-лимфоциты — Т-зависимые).
К периферическим лимфоидным органам относят селезенку, лимфатические узлы, миндалины, лимфоидную ткань, ассоциированную с кишечником, бронхами и кожей. В этих органах иммунной системы происходит взаимодействие между иммунокомпетентными клетками, формируются иммунные реакции в ответ на поступление антигена. В лимфатических узлах улавливаются чужеродные агенты, проникшие в ткани организма, в селезенке контролируется протекающая через нее кровь, а ассоциированная со слизистыми оболочками лимфоидная ткань предотвращает проникновение антигенов в организм.
Типы иммунитета. В реализации защитных, иммунных механизмов организма принимают участие врожденные и приобретенные факторы резистентности. Врожденный иммунитет (естественный, неспецифический) — это система предсуществующих защитных факторов организма, характерных для данного вида, как наследственно обусловленное свойство. Приобретенный иммунитет (адаптивный, специфический) обеспечивает способность организма специфически распознавать и обезвреживать чужеродные антигены и антигенные структуры, поступающие извне или образующиеся в организме.
Факторы врожденного иммунитета в отличие от факторов приобретенного иммунитета существуют с момента рождения, не обладают специфичностью по отношению к микробным антигенам, не усиливаются при повторном контакте с антигеном, не обладают памятью, слабо эффективны при отсутствии приобретенного иммунитета. Важно указать на то, что, имея определенные отличия и особенности, врожденный и приобретенный иммунитет тесно связаны между собой, дополняют друг друга и составляют единое целое в обеспечении антигенного постоянства индивидуума [4].
Врожденный иммунитет. К врожденному иммунитету относят физиологические барьеры, гуморальные и клеточные факторы. Физиологические барьеры представлены кожными покровами и слизистыми, механически препятствующими проникновению микробов и выделяющими вещества, оказывающие бактерицидное действие. К таким веществам относят лизоцим, лактоферрин, кателицидин, эластазу, перфорин, псориазин, кальпротектин, дефензины и ряд других факторов, которые выделяются различными клетками кожи и слизистых (кератиноциты, эпителиальные и тучные клетки, нейтрофилы, макрофаги, Т-лимфоциты) и обладают бактерицидным, антивирусным, противогрибковым действием, участвуют в иммунном ответе [5].
К механической защите относятся также такие физиологические функции, как чихание, рвота, понос. В естественной резистентности участвуют также слюна, слеза, моча, мокрота, способствующие выведению чужеродных агентов. Существенный вклад в обеспечение барьерной защиты вносят нормальная микрофлора слизистых и кожных покровов, кислая среда желудочного сока, сальных выделений, мочи, влагалищного и других секретов.
К гуморальным факторам врожденного иммунитета относят систему комплемента, цитокины, белки острой фазы и др.
Комплемент представляет собой термолабильную систему белковых и гликопротеиновых факторов нормальной сыворотки крови [1, 2]. Насчитывает 9 компонентов и включает более 30 белков (5–10 % от общего количества сывороточных белков). Основной источник — гепатоциты. Все белки системы комплемента имеют буквенное обозначение C (complement) и арабскую цифру, отражающую последовательность открытия белка, но не последовательность его включения в реакцию. В настоящее время установлено 3 пути активации системы комплемента.
1. Классический — инициируется образованием иммунных комплексов с участием антител класса IgG и IgM. Первым ферментом классического пути является белок С1. Для активации системы комплемента по классическому пути требуется время для накопления специфических антител.
2. Альтернативный — развивается сразу после проникновения патогена. Инициатором процесса является фиксация с поверхностью бактериальной клетки компонента С3b.
3. Лектиновый путь — идентичен классическому пути активации комплемента, но запускается независимо от антител. Роль антител и иммунных комплексов при данном пути выполняет маннансвязывающий лектин.
Физиологическая роль комплемента проявляется в разнообразных реакциях врожденного и приобретенного иммунитета, основными из которых являются:
1. Гемолиз, бактериолиз. В результате активации системы комплемента формируется мембраноатакующий комплекс С5b–C9, который погружается в липидный бислой мембраны и приводит к образованию мембранного канала. Вследствие этого в клетки поступает вода, они набухают и лизируются.
2. Нейтрализация вируса. Осуществляется за счет лизиса вируса, его опсонизации, блокады вирусных лигандов для соответствующих рецепторов клеточной мембраны, блокады пенетрации вируса в клетку.
3. Участие в фагоцитозе. Прямое или опосредованное через антитела связывание компонентов комплемента с бактериями является необходимым условием фагоцитоза (опсонизация микроорганизмов).
4. Участие в воспалительном процессе. Продукты активации комплемента (C3a, C5a) являются хемотоксинами и анафилотоксинами, оказывающими выраженное воздействие на фагоциты, обмен веществ, свертываемость крови, вызывают высвобождение гистамина и других биологически активных медиаторов из тучных клеток и базофилов, сокращение гладкой мускулатуры и т.д.
5. Участие в элиминации из организма иммунных комплексов. С3-компонент комплемента обладает свойством фиксироваться на константных участках антител, образующих иммунные комплексы с антигеном; через данный компонент комплемента иммунные комплексы взаимодействуют с рецепторами С3 эритроцитов и других клеток крови, которые транспортируют иммунные комплексы в печень, селезенку и другие ткани, где последние элиминируются макрофагальной системой.
В связи с вышеизложенным становится объяснимым, почему дефекты в системе комплемента могут являться патогенетической основой развития аутоиммунной (иммунокомплексной) патологии (системной красной волчанки и др.), определять повышенную склонность к тяжелым, рецидивирующим и хроническим бактериальным инфекциям, в том числе менингококковой этиологии.
Цитокины представляют собой группу полипептидных медиаторов межклеточного взаимодействия, участвующих главным образом в формировании и регуляции защитных реакций организма при внедрении патогенов и нарушении целостности тканей, а также в регуляции ряда нормальных физиологических функций [7]. В 1979 году для их обозначения и систематизации был предложен термин «интерлейкины», то есть медиаторы, осуществляющие связь между лейкоцитами. Однако очень скоро выяснилось, что биологические эффекты цитокинов распространяются далеко за пределы иммунной системы, и поэтому более приемлемым стал ранее предложенный термин «цитокины», сохранившийся и по сей день. Обеспечивая взаимодействие между клетками иммунной системы, цитокины участвуют и обусловливают разнообразные реакции как врожденного, так и приобретенного иммунитета.
Исходя из структурно-функциональных характеристик цитокинов, в настоящее время их классифицируют на отдельные группы, основными из которых являются следующие:
1. Интерфероны (ИФН-α, -β, -γ, ИЛ-28, ИЛ-29 и др.) — обладают противовирусной активностью, антипролиферативным и иммуномодулирующим действием.
2. Факторы роста гемопоэтических клеток (факторы стволовых клеток, ИЛ-7, -11, -3, -5, эритропоэтин, тромбопоэтин и др.) — стимулируют пролиферацию и дифференцировку различных типов клеток предшественников в костном мозге, активируют процессы кроветворения.
3. Суперсемейство ИЛ-1 (ИЛ-1α и -β, -18, -33 и др.) — обладают провоспалительным действием, активируют специфический иммунитет.
4. Семейство фактора некроза опухолей (ФНО-α и -β и др.) — обладают провоспалительным действием, регулируют апоптоз и межклеточное взаимодействие.
5. Семейство ИЛ-6 (ИЛ-6, -11, -31, онкостатин М, кардиотропин-1 и др.) — обладают провоспалительным и иммунорегуляторным действием.
6. Семейство ИЛ-10 (ИЛ-10, -19, -20, -22, -24, -26) — обеспечивают противовоспалительное, иммуносупрессивное действие.
7. Cемейство ИЛ-12 (ИЛ-12, -23, -27) — участвуют в регуляции дифференцировки Т-хелперов.
8. Цитокины Т-хелперов 1-го типа (ИЛ-2, -15, -21, ИФН-g) — активируют клеточный иммунитет.
9. Цитокины Т-хелперов 2-го типа (ИЛ-4, -5, -10, -13) — активируют гуморальный иммунитет.
10. Цитокины Т-хелперов 17-го типа (ИЛ-17A, B, C, D, E, F) — активируют синтез провоспалительных цитокинов.
Клеточными факторами врожденного иммунитета являются фагоцитирующие клетки, а также киллерные клетки. Фагоциты представляют собой клетки с особо выраженной способностью к фагоцитозу. Под фагоцитозом понимают активное поглощение клетками твердого материала. Выделяют 5 этапов фагоцитарного процесса: а) хемотаксис — целенаправленное движение фагоцитов; б) прикрепление микробов к фагоцитам; в) поглощение микробов и включение их в фагосомы; г) слияние фагосом с лизосомами; д) переваривание поглощенного материала, характеризующее завершенность фагоцитоза.
Нейтрофилы обладают выраженной способностью к фагоцитозу и играют определяющую роль в противоинфекционной защите, которая осуществляется в организме непрерывно. Процесс фагоцитоза нейтрофилами обеспечивается участием антител и комплемента, которые выступают в роли опсонинов. Опсонины — это ингредиенты сыворотки крови и других биологических жидкостей, которые служат посредниками между объектом фагоцитоза и фагоцитирующей клеткой. Опсонизация — это кооперативный процесс, в котором участвуют объект фагоцитоза, опсонины и сам фагоцит.
Эозинофилы в норме в 1 мкл крови человека содержатся в количестве 150–200 (до 4–5 % среди лейкоцитов). Их число значительно увеличивается при аллергических (атопических) заболеваниях и гельминтозах. Эозинофилы выполняют важную роль в защите от гельминтов, наделены способностью к фагоцитозу и киллингу чужеродных клеток, а также являются свидетелями аллергизации, разрушая гистамин, способствуя расщеплению лейкотриенов.
Базофилы — самая малочисленная популяция гранулоцитов крови (до 1 % всех лейкоцитов). Их тканевые формы (тучные клетки) располагаются преимущественно в слизистых оболочках и коже. После агрегации комплекса IgE + антиген на поверхности тучной клетки происходит их дегрануляция, заключающаяся в выбросе биологически активных веществ (гистамина, серотонина, протеолитических ферментов и др.), которые участвуют в формировании очага воспаления.
Мононуклеарные фагоциты включают костномозговые предшественники (монобласты, промоноциты), циркулирующие в крови моноциты и тканевые их формы — макрофаги: гистиоциты соединительной ткани, альвеолярные макрофаги легких, купферовские клетки печени, остеокласты кости, клетки Лангерганса кожи, клетки микроглии центральной нервной системы и др.
Помимо обеспечения фагоцитарной функции, макрофаги играют существенную роль в регуляции состава соединительной ткани и опорных волокон. Синтезируют ряд факторов системы комплемента, интерферон, фактор некроза опухолей, простагландины и т.д. Особое значение для иммунной системы имеет функция клеток макрофагальной системы, заключающаяся в переработке и представлении (презентации) антигена Т–лимфоцитам, что свидетельствует о важной роли макрофагов в механизмах адаптивного иммунитета. Благодаря своим свойствам макрофагальная система занимает центральное место в обеспечении противобактериальной, противовирусной и противоопухолевой защиты.
Киллерные клетки (не В- и не Т-клетки, нулевые клетки) — данное понятие объединяет популяцию лимфоцитов, которые не имеют мембранных иммуноглобулинов В-лимфоцитов, рецепторов Т-лимфоцитов и морфологически (большие гранулярные лимфоциты) существенно отличаются от других лимфоидных клеток. Данный тип клеток составляют от 5 до 20 % лимфоцитов периферической крови и представлен гетерогенным клеточным пулом, включающим естественные киллеры, просто киллеры и лимфокинактивированные киллеры.
Киллерные клетки играют важную роль в естественном иммунитете к микробным инфекциям, регуляции гемопоэза, являются первичным барьером вирусных инфекций, лизируя аутологичные клетки, инфицированные вирусами. Обеспечивают баланс в иммунной системе. К настоящему времени доказано, что киллерные клетки играют значительную роль в иммунологическом надзоре против опухолевых клеток и трансплантатов.
При помощи моноклональных антител удалось выявить некоторые маркеры, пригодные для идентификации не В- и не Т-лимфоцитов (натуральных киллеров). Основными из них являются CD16 и CD56.
Приобретенный иммунитет. Приобретенный, или адаптивный, иммунитет в отличие от врожденного формируется в течение всей жизни организма и представляет собой результат работы системы высокоспециализированных клеток — лимфоцитов [4]. Факторы приобретенного иммунитета развивают защитную реакцию сугубо специфически на определенный антиген.
Антигены — это вещества, которые способны специфично реагировать с антителами или клетками, которые образуются на введение данных молекул. Антигены могут быть полными, которые самостоятельно способны вызывать развитие иммунного ответа, или гаптенами, приобретающими иммуногенные свойства в комплексе с белками. По отношению к организму антигены могут быть как внешнего (экзогенные антигены), так и внутреннего (аутоантигены) происхождения.
Антигенные свойства молекул определяются эпитопами. Эпитоп (антигенная детерминанта) — это часть антигена, которая специфически реагирует с антителом. Как правило, антиген имеет более чем один эпитоп, т.е. способен вызывать образование антител к различным своим участкам — детерминантам. Антигенность молекул характеризуется аффинитетом и авидностью. Аффинитет определяет прочность связи между одним эпитопом и соответствующей молекулой антитела. Авидность — суммарная сила связей всех эпитопов антигена с образующимися к ним антителами.
Виды приобретенного иммунитета предполагают классификацию его на активный и пассивный. Активный приобретенный иммунитет развивается при контакте с антигеном в результате естественной ситуации после перенесенного инфекционного заболевания или может быть создан искусственно после введения в организм вакцины. Активный иммунитет чаще всего образуется через 1–2 недели и сохраняется годами или десятками лет.
Пассивный приобретенный иммунитет предполагает поступление в организм человека не антигена, а готовых антител, при этом длительность защиты, как правило, не превышает нескольких недель или месяцев. Пассивный иммунитет также может быть естественным или искусственным. Примером пассивного естественно приобретенного иммунитета является защита от инфекций ребенка за счет поступивших антител от матери через плаценту или с грудным молоком. Пассивный иммунитет можно создать и искусственно, вводя в организм иммунные сыворотки, содержащие антитела против инфекционных агентов или токсинов.
Факторы приобретенного иммунитета подразделяются на гуморальные и клеточные.
Гуморальные факторы приобретенного иммунитета. Включают В-лимфоциты, их высокоспециализированные формы — плазматические клетки, а также антитела пяти классов — IgM, IgG, IgM, IgE, IgD [6].
В-лимфоциты можно однозначно отделить от других типов клеток благодаря их способности синтезировать иммуноглобулины. Лимфоциты В-ряда, помимо мембранных иммуноглобулинов, на своей поверхности несут HLA II класса и ряд дифференцировочных антигенов — кластеров дифференцировки (CD). Известно 4 pan-B-клеточных антигена, которые выявляются на большинстве зрелых клеток этой популяции, — CD19, CD20, CD24, CD37. Помимо pan-специфичностей, В-лимфоциты экспрессируют и другие маркеры, которые определяются на разных стадиях В-клеточной дифференцировки и являются стадиеспецифическими. К ним относятся CD9 и CD10 (определяются на пре-В-лимфоцитах), CD21 (представлен на В-клетках в лимфоидных органах, значительно слабее — на В-лимфоцитах периферической крови), CD22 (исчезает с мембраны при активации В-лимфоцитов), CD38 (экспрессируется на мембране В-бластов).
Иммуноглобулины, согласно номенклатуре Всемирной организации здравоохранения, подразделяются на 5 классов: IgG, IgA, IgM, IgD, IgE. Они обладают свойствами антител, синтезируются и секретируются В-лимфоцитами и их высокоспециализированными формами — плазматическими клетками. Антитела обеспечивают защиту против бактериальных инфекций; нейтрализуют вирусы; служат барьером в желудочно-кишечном и респираторном трактах; выполняют опсонизирующую функцию; высвобождают вазоактивные амины из тучных клеток и базофилов; активно лизируют клетки аутологичного происхождения; участвуют в патогенезе аутоиммунных заболеваний.
Иммуноглобулины класса М — филогенетически и онтогенетически наиболее ранний класс иммуноглобулинов. С синтеза антител класса IgM начинается иммунный ответ на внедрение многих антигенов. Появляются, как правило, спустя 3–7 дней после антигенного стимула и обнаруживаются в сыворотке крови в течение нескольких недель или месяцев после элиминации антигена.
Иммуноглобулин класса G начинает синтезироваться плазматическими клетками спустя несколько дней после появления IgM-антител. В отличие от IgM-антител сохраняются в крови в течение нескольких лет или десятилетий, а в ряде случаев обеспечивают пожизненный иммунитет. Более высокая эффективность IgG-антител объясняется их способностью проникать в ткани, плаценту. Кроме того, нейтрализующая способность IgG по отношению к токсинам в сотни раз выше, чем IgM. Антитела класса IgG способны нейтрализовать вирусы, оказывают опсонизирующее действие на бактерии, связывают комплемент. Следует выделить 4-й субкласс IgG (IgG4), который не фиксирует комплемент, не связывается с макрофагами, зато, подобно IgE, фиксируется на базофилах и, связываясь с антигеном, вызывает их дегрануляцию.
Иммуноглобулин класса А существует в организме в виде сывороточных форм и секреторного IgA. Секреторный IgA является основным иммуноглобулином, выделяющимся на поверхность слизистых оболочек и содержащимся в слюне, кишечном соке и других секретах. Секреторный IgA обладает высокой бактерицидной и противовирусной активностью. Дефицит IgA способствует развитию инфекций слизистых (дыхательных путей, пищеварительного тракта и т.д.); он часто сочетается с избытком IgE, что приводит к развитию атопических заболеваний. Сочетание дефицита данного иммуноглобулина и функциональной недостаточности пищеварения приводит к развитию пищевой аллергии.
Иммуноглобулин класса Е по сравнению с другими иммуноглобулинами присутствует в сыворотке крови в наименьшей концентрации. Однако значение антител этого класса в организме очень велико, так как именно с ним связана реагиновая активность. Накапливается IgE в тканях слизистых оболочек и кожи, прикрепляясь к поверхности тучных клеток. При соединении молекул IgE, фиксированных на тучных клетках, с антигеном происходит дегрануляция вышеуказанных клеток с выбросом вазоактивных аминов. Это является основным механизмом, обусловливающим проявления аллергии немедленного типа.
Определение концентраций в сыворотке крови уровня общего IgE имеет существенное значение в определении предрасположенности к формированию аллергической патологии (чем выше концентрации IgE, тем выше вероятность развития аллергии), в диагностике и дифференциальной диагностике аллергических заболеваний. Большое значение имеет наблюдение в динамике за уровнем данного иммуноглобулина, что позволяет судить об эффективности проводимой терапии.
Иммуноглобулин класса D не обладает способностью связывать комплемент, не проходит через плаценту. По современным представлениям, IgD может выполнять роль антигенраспознающего рецептора В-лимфоцитов и участвовать в их активации и дифференцировке.
Циркулирующие иммунные комплексы — это высокомолекулярные белковые соединения, образующиеся в результате специфического взаимодействия антигена с антителом. Иммунные комплексы постоянно образуются в организме человека, являясь компонентами эффекторного звена иммунного ответа. В ряде случаев механизмы элиминации иммунных комплексов не срабатывают и возникают патологические реакции на их образование. Клиническая значимость нарушений в системе иммунных комплексов определяется их ключевой ролью в патогенезе целого ряда аутоиммунных заболеваний (системные заболевания соединительной ткани, гломерулонефрит, аутоиммунный гепатит, васкулит, рассеянный склероз, цитопении — тромбоцитопения, гранулоцитопения и т.д.).
Клеточные факторы приобретенного иммунитета. К клеточным факторам приобретенного иммунитета относят Т-лимфоциты, популяция которых содержит эффекторные (цитотоксические Т-лимфоциты) и регуляторные клетки (Т-хелперы) [6]. В отличие от В-лимфоцитов, образование и дифференцировка которых происходит у человека в костном мозге, предшественники Т-клеток для «функционального обучения» поступают из костного мозга в тимус.
Помимо физико-химических и биологических свойств, различные субпопуляции Т-лимфоцитов отличаются присутствием на их наружной мембране антигенных маркеров. К pan-Т-клеточным маркерам, характерным для большинства зрелых Т-лимфоцитов, относят CD2, CD3, CD5, CD6 и CD7.
Помимо вышеуказанных pan-Т-клеточных маркеров, известны и другие кластеры дифференцировки Т-лимфоцитов, которые присутствуют либо на отдельных субпопуляциях клеток, либо характерны для отдельных этапов их дифференцировки. CD1 является маркером ранней фазы созревания клеток в тимусе и выявляется на тимоцитах. CD4 экспрессируется большей частью зрелых Т-лимфоцитов и является рецептором к молекулам HLA II класса. CD4+ Т-клетки функционально характеризуются как хелперы. CD8 выявляется примерно на 1/3 периферических Т-клеток, являясь рецептором к молекулам HLA I класса. CD8 рецептором обладают цитотоксические Т-лимфоциты (Т-киллеры).
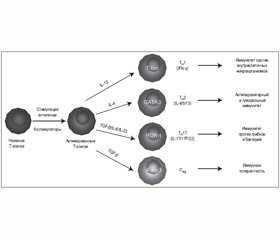
Т-хелперы (от англ. helper — помощник) являются важной составной частью системы адаптивного иммунитета, без которой невозможна трансформация В-лимфоцитов в плазматические клетки и образование антител, они играют регулирующую, усиливающую роль в иммунологических реакциях. Т-хелперы активируют Т-киллеры, В-лимфоциты, моноциты, натуральные киллерные клетки. Выделяют несколько подтипов Т-хелперов (рис. 1):
— Т-хелперы 0 (Th0) — наивные, недифференцированные Т-хелперы;
— Т-хелперы 1-го типа (Th1) — преимущественно способствуют развитию клеточного иммунного ответа, активируя Т-киллеры, основной выделяемый цитокин — интерферон гамма;
— Т-хелперы 2-го типа (Th2) — активируют В-лимфоциты, способствуя развитию гуморального иммунного ответа, продуцируют ИЛ-4, -5, -13;
— Т-хелперы регуляторные (Тreg) — супрессируют иммунный ответ, секретируют ИЛ-10 и трансформирующий фактор роста бета;
— Т-хелперы-17 (Th17) — это хелперные лимфоциты, которые в больших количествах продуцируют провоспалительный цитокин IL-17 и участвуют в защите от внеклеточных патогенов, в регуляции противоопухолевого иммунитета; кроме того, доказана роль Th17 в развитии хронического воспаления, аутоиммунной и аллергической патологии.
Т-супрессоры цитотоксические (CD8+-клетки) лимфоциты играют важную роль в подавлении кислотоустойчивых бактерий, вирусных инфекций уже после их развития, грибковых инфекций, протозойных инвазий, в отторжении трансплантанта, опухоли. Сенсибилизированные CD8+-лимфоциты опосредуют контактный аллергический дерматит.
Оценка иммунного статуса человека. Оценка иммунного статуса человека является одной из важных задач клинической иммунологии. Изучение состояния иммунной системы человека может осуществляться как в норме, так и при различных патологических состояниях.
Оценка иммунного статуса при той или иной патологии проводится с целью:
1) идентификации нарушенного звена иммунной системы;
2) установления характера, степени и интенсивности изменений факторов иммунной системы;
3) определения адекватных схем лечения, коррекции иммунной системы и оценки эффективности терапии.
При оценке состояния иммунной системы пациента необходимо учитывать клинико-анамнестические признаки наличия иммунологической недостаточности и данные лабораторного исследования факторов иммунной системы. Основные клинические доказательства наличия нарушений в иммунном статусе предполагают изменения со стороны органов иммунной системы (тимомегалия, гипо- и аплазия тимуса, лимфадениты и т.д.) и проявления синдромов иммунологической недостаточности. Выделяют 4 синдрома иммунологической недостаточности.
1. Инфекционный синдром. Частые острые респираторно–вирусные инфекции (более 5 раз в год). Рецидивирующие и хронические отиты, пневмонии, бронхиты, тонзиллит. Хронические урогенитальные инфекции. Пиелонефриты. Бактериальные инфекции кожи и подкожной клетчатки (пиодермия, фурункулез, абсцессы, флегмоны и др.). Генерализованные инфекции (сепсис, рецидивирующий менингоэнцефалит и др.). Дисбактериозы. Рецидивирующая герпетическая инфекция. Хронические грибковые инфекции (кандидомикоз и др.) и т.д.
2. Аллергический синдром. Атопический дерматит. Крапивница. Отек Квинке. Бронхиальная астма. Анафилактический шок. Поллиноз и т.д.
3. Аутоиммунный синдром. Системные заболевания соединительной ткани (ревматоидный артрит, дерматомиозит, склеродермия, системная красная волчанка и др.). Ревматизм. Аутоиммунный гепатит. Аутоиммунный тиреоидит и т.д.
4. Пролиферативный синдром. Гиперплазия лимфатических узлов. Лимфома. Лимфосаркома. Лейкоз. Лимфогранулематоз и т.д.
При изучении анамнеза пациента необходимо также обращать внимание на заболевания и состояния, которые сопровождаются вторичным иммунодефицитом:
— вирусные заболевания (хронические вирусные гепатиты В и С, ВИЧ-инфекция, корь, краснуха, грипп, эпидпаротит, инфекционный мононуклеоз и др.);
— бактериальные инфекции (пневмококковые и менингококковые, туберкулез и др.);
— протозойные и глистные инвазии (токсоплазмоз, лямблиоз, аскаридоз и др.);
— прием иммунодепрессантов и кортикостероидов, профессиональные интоксикации;
— белково-энергетическая недостаточность (нарушения питания, гипотрофия, синдром нарушенного кишечного всасывания, нефротический синдром и др.);
— стрессовые состояния, онкологические процессы, ожоговая болезнь, хронические заболевания печени, сахарный диабет, послеоперационные состояния и др.
Наличие у пациента клинических признаков иммунологической недостаточности свидетельствует о необходимости проведения ему соответствующих инструментальных и лабораторных исследований, в том числе иммунологического обследования (иммунограммы).
Лабораторные индикаторы иммунограммы могут выступать доказательством как субклинических, так и клинических проявлений иммунологической недостаточности. Иммунореактивность характеризуют как количественные показатели (абсолютное и относительное число различных клеток, величины гуморальных факторов), так и потенциальные функциональные возможности (способность отдельных клеток или системы в целом отвечать на естественную и искусственную стимуляцию).
Главный принцип изучения функции иммунной системы — использование системного подхода. Это обусловлено тем, что иммунная система при ее патологии вовлекается, как правило, в качестве целостной системы со всеми ее звеньями. Соблюдение этого принципа имеет первостепенное значение как при назначении иммунограммы, так и при ее интерпретации. Иммунограмма должна включать, как минимум, основные показатели врожденного и приобретенного иммунитета, их гуморальные и клеточные факторы. Оценку полученных результатов можно назвать адекватной, если производится их анализ комплексно, сопоставляются количественные и качественные характеристики различных факторов иммунитета, в том числе совместно с данными инструментальных исследований, общелабораторных методов обследования (общий анализ крови, мочи, биохимические анализы), эндокринного профиля и т.д. Неопровержимым является и то, что полноценный анализ иммунограммы проводится только в комплексе с клиническим состоянием больного, особенностями его анамнеза (учитываются профессиональные, экологические, климатогеографические и другие воздействия).
1. Carroll M.V. Complement in health and disease / M.V. Carroll, R.B. Sim // Adv. Drug. Deliv. Rev. — 2011. — Vol. 63, № 12. — Р. 965–975.
2. Gadjeva M. The Complement System: Methods and Protocols / M. Gadjeva. — New York: Springer Science+Business, 2014. — 383 р.
3. Regulation of TH17 cell differentiation by innate immune signals / G. Huang, Y. Wang, H. Chi // Cell. Mol. Immunol. — 2012. — № 4. — Р. 287–295.
4. Crossroads Between Innate and Adaptive Immunity / P.D. Katsikis, S.P. Schoenberger, B. Pulendran. — New York: Springer Science+Business, 2013. — 136 р.
5. Nakatsuji T. Antimicrobial peptides: old molecules with new ideas / T. Nakatsuji, R.L. Gallo // J. Invest. Dermatol. — 2012. — Vol. 132, № 3. — Р. 887–895.
6. Todd I. Lecture Notes: Immunology, 6th еdition / I. Todd, G. Spickett. — Wiley-Blackwell, 2010. — 232 p.
7. Yoshimoto T. Cytokine Frontiers: Regulation of Immune Responses in Health and Disease / T. Yoshimoto, T. Yoshimoto. — Springer Japan, 2014. — 396 p.

/120/120.jpg)