Газета «Новости медицины и фармации» 9-10 (503-504) 2014
Вернуться к номеру
Что такое рациональная комбинированная антигипертензивная терапия, и остается ли таковой комбинация ингибитора АПФ и диуретика?
Авторы: Радченко А.Д. - ГУ «ННЦ «Институт кардиологии имени академика Н.Д. Стражеско» НАМН Украины
Рубрики: Семейная медицина/Терапия, Кардиология
Версия для печати
Статья опубликована на с. 24-29 (Укр.)
Почему комбинированная терапия? Еще 10 лет назад на конференциях, посвященных проблемам лечения артериальной гипертензии (АГ), говорили о том, что частота достижения целевого артериального давления (АД) остается низкой во всем мире (от 2,5 % в Заире, 6 % в Англии, 7 % в Австралии до 27 % во Франции и США), несмотря на существующие эффективные антигипертензивные препараты [18, 20, 41]. Однако за 10 лет все изменилось. Так, в европейских странах, по данным исследования EURIKA, АД контролируется у 36,3 % гипертензивных пациентов в Германии, у 41 % — в Испании, у 42,8 % — в Великобритании, у 45,5 % — во Франции [14]. В США 46,5 % достигают целевого уровня АД, а среди тех, кто не достигает, 39 % не знают, что у них АГ, 16 % знают, но не принимают препаратов, и только 45 % принимают препараты, но неэффективно. [37]. В Украине же, по данным эпидемиологических исследований, контроль АД существенно не улучшился — в среднем (включая городскую и сельскую популяцию) 13,4 % в 2005 году и 14 % в 2010 году [3].
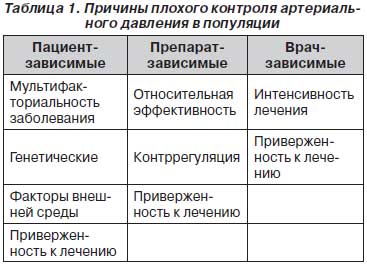
Как известно, причины плохого контроля АД классифицируются на связанные с препаратом, с пациентом и врачом (табл. 1). Идеальный антигипертензивный препарат — это тот, который бы эффективно снижал АД у всех больных, не вызывал побочных реакций, не зависел от факторов внешней среды, был удобен в назначении (не надо тратить время на подбор терапии, что позволило бы экономить время врача) и приеме, действовал на протяжении суток. Если посмотреть на те медикаменты, которые есть сейчас в нашем арсенале, то ни один из современных антигипертензивных препаратов не соответствует данным критериям. И выходом из этой ситуации может быть пока только использование рациональных комбинаций.
Согласно украинским рекомендациям не менее 50–75 % больных АГ нуждаются в назначении комбинированного лечения [5]. Как стартовую комбинированную терапию следует назначать всем пациентам с уровнем АД > 160/100 мм рт.ст. или высокого сердечно-сосудистого риска. Если пациент не входит в данные категории, то можно начинать лечение как с монотерапии, так и с комбинации двух препаратов (предпочтительно в низких дозах и лучше с фиксированных). Многие страны, в которых за последние годы значительно улучшился контроль АД, пошли именно по пути более частого использования комбинированной терапии как стартовой. Так, во Франции, стране с наибольшей частотой достижения целевого АД в Европе, комбинированную антигипертензивную терапию (АГТ) получают 26,7 % пациентов [29]. В США более чем в 1,5 раза увеличилось количество назначений комбинированной АГТ пациентам с впервые диагностированной АГ в 2007 году по сравнению с 2005 [17].
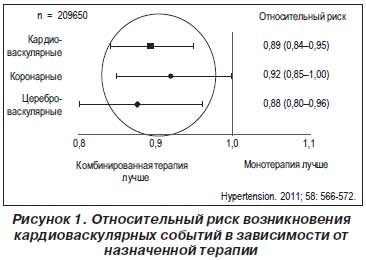
Такая популярность назначения обусловлена появлением результатов многочисленных исследований, продемонстрировавших преимущества комбинированной терапии перед монотерапией как стартовой. По данным итальянского исследования, которое включало более 200 тыс. пациентов с АГ, назначение стартовой комбинированной АГТ сопровождалось меньшей частотой возникновения сердечно-сосудистых осложнений (рис. 1), чем назначение стартовой монотерапии [21]. По данным американского исследования, контроль АД в группе стартовой комбинированной терапии составил 40,3 %, что было достоверно выше, чем в группе стартовой монотерапии — 30,6 %, и что, в свою очередь, обусловило достоверное снижение частоты кардио-васкулярных осложнений на 34 % [34]. В исследовании VALUE чем раньше снижалось артериальное давление (АД), тем лучше был прогноз у пациентов с АГ [82], а комбинированная терапия как раз и позволяет достичь снижения АД до целевого уровня с первой попытки у 2/3 пациентов, что сокращает время подбора эффективной терапии. Кроме того, уменьшается количество изменений назначений, что способствует улучшению приверженности больного к лечению. По данным метаанализа, эффективность комбинированной АГТ в 5 раз выше, чем монотерпии [81], за счет потенцирования действия одного препарата другим (увеличивается как степень снижения, так и длительность эффекта). Более того, уменьшается вероятность возникновения побочных реакций как за счет возможного применения меньших доз лекарства, так и за счет комбинирования препаратов с контррегуляторным действием: один уменьшает побочные эффекты другого [57]. И конечно же, если используются фиксированные комбинации, то это удобно для пациента и вероятность того, что он продолжит выполнять назначения, увеличивается.
Какие комбинации можно назначать? Согласно рекомендациям Европейского общества гипертензии 2007 и 2013, при использовании двойных комбинаций сочетаются классы АГП первой линии следующим образом (рис. 2): диуретик + ингибитор ангиотензинпревращающего фермента (АПФ), диуретик + блокатор рецепторов ангиотензина II, диуретик + антагонист кальция, антагонист кальция + ингибитор АПФ, антагонист кальция + блокатор рецепторов ангиотензина II [7, 8]. Для тройных комбинаций предпочтений не существует. Украинские рекомендации допускают также назначение комбинации бета-адреноблокаторы + дигидропиридиновые антагонисты кальция.
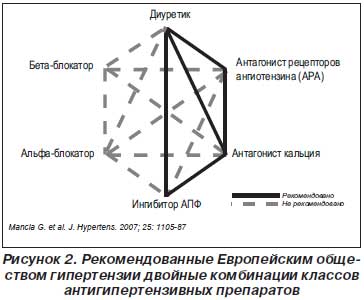
Почему именно эти комбинации? Потому что это рациональные комбинации. Под этим понятием подразумевают комбинации препаратов, которые отвечают определенным требованиям:
1) действуют на различные механизмы повышения АД;
2) не дают долгосрочных побочных явлений;
3) доказали свою эффективность в снижении риска кардиоваскулярных событий в многоцентровых исследованиях;
4) назначаются в оптимальных дозах.
Если, например, мы будем комбинировать бета-блокаторы и ингибиторы ангиотензинпревращающего фермента, то это будет считаться нерациональной комбинацией, так как они одинаково влияют на ренин-ангиотензиновую систему (РАС) и не было долгосрочных исследований, в которых бы изучалась эффективность данной комбинации у больных АГ. Хотя у пациентов с ишемической болезнью сердца (ИБС) применение такой комбинации возможно. Комбинация бета-блокатор + тиазидный диуретик показала свою эффективность в клинических исследованиях, препараты по-разному действуют на звенья патогенеза АГ, но долгосрочное применение данной комбинации сопряжено с увеличением риска возникновения сахарного диабета, поэтому данная комбинация была признана нерациональной. Cуществует также фиксированная комбинация ингибитора АПФ каптоприла (25–50 мг) с гидрохлортиазидом (12,5–25 мг). Производитель утверждает, что продолжительность эффекта значительно превышает 6 часов (4–6 часов — продолжительность действия каптоприла при монотерапии) и даже может достигать 24 часов. Но в клинических исследованиях эффективная доза каптоприла составляла 100–150 мг. Это значит, что для уверенности в положительном (органозащитном) действии каптоприла его надо применять в этой дозе. Тогда необходимо рекомендовать как минимум две таблетки (100 мг каптоприла) этой фиксированной комбинации, что, в свою очередь, приведет к увеличению также дозы диуретика, что нежелательно из-за возможного увеличения частоты побочных реакций. Поэтому, вероятнее всего, такая комбинация будет считаться нерациональной из-за дозировки ее компонентов.
Классическим примером рациональной комбинации может быть сочетание ингибитора АПФ с продолжительностью действия более 12 часов и диуретика в оптимальных дозах. Несмотря на то, что в исследовании ACCOMPLISH было показано, что по влиянию на частоту кардиоваскулярных осложнений у пациентов с АГ такая комбинация несколько уступает комбинации ингибитор АПФ + дигидропиридиновый антагонист кальция, она остается очень популярной. В европейских рекомендациях 2013 г. сказано, что для отказа от такой комбинации необходимо больше доказательств ее меньшей кардиопротективной роли [8]. Сейчас же у нас есть результаты единственного сравнительного исследования ACCOMPLISH, в котором в состав первичной конечной точки входили госпитализация по поводу стенокардии и реваскуляризационные процедуры, при которых, вероятнее всего, и было преимущество антагониста кальция перед диуретиком (антагонисты кальция относятся к антиангинальным препаратам) [40]. По влиянию на частоту возникновения инсульта и смерти достоверной разницы между группами не было.
Диуретики и ингибиторы АПФ по-разному влияют на системы, участвующие в регуляции АД. Так, диуретики повышают активность РАС, а ингибиторы АПФ, наоборот, увеличивают. В результате диуретики значительно потенцируют антигипертензивное действие ингибиторов АПФ, у которых в результате применения диуретиков появляется субстрат для подавления — РАС. Это особенно важно для пожилых пациентов, у которых, как правило, исходная активность РАС снижена и ингибиторы АПФ в этой ситуации менее эффективны. Назначение ингибиторов АПФ совместно с диуретиками приводит к хорошему и стойкому снижению АД. Кроме того, разнонаправленное действие на системы организма позволяет уменьшить частоту побочных эффектов на фоне использования комбинации. Так, одним из побочных эффектов диуретиков является гипокалиемия, а ингибиторов АПФ, наоборот, — гиперкалиемия. Совместное применение диуретика и ингибитора АПФ редко приводит к нарушению обмена калия.
Ингибиторы АПФ — это класс препаратов, которые продемонстрировали свое положительное влияние на частоту возникновения кардиоваскулярных осложнений в различных клинических ситуациях. В кардиологии практически нет состояний, при которых бы не исследовался данный класс препаратов (рис. 3).

В последнее время высказываются идеи, что необходимо забыть о так называемых старых ингибиторах АПФ и назначать только новые, которые являются универсальными и подходят пациентам с любой кардиоваскулярной патологией. Эти идеи являются неправильными хотя бы потому, что количество доказательств эффективности, полученных в рандомизированных исследованиях с так называемыми старыми препаратами, совсем не меньше, чем с новыми (рис. 3).
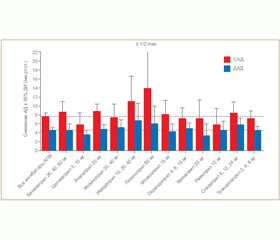
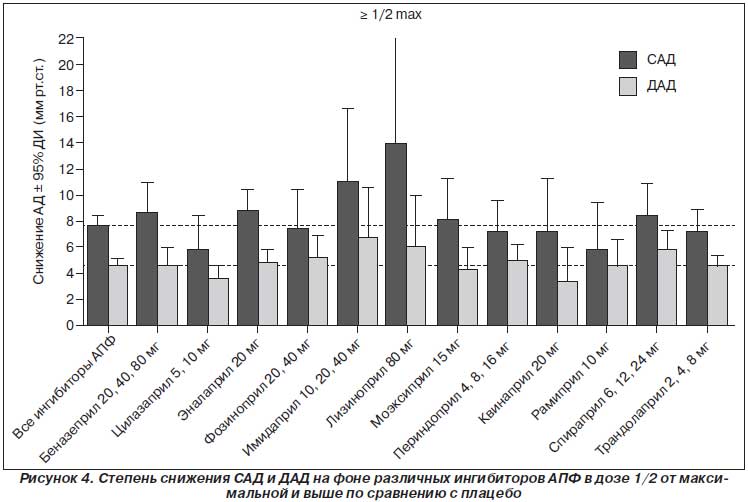
Есть ли разница между ингибиторами АПФ? Конечно же, представители класса ингибиторов АПФ отличаются друг от друга по своим фармакокинетическим и фармакодинамическим свойствам, благодаря которым их можно применять при различных клинических ситуациях. Однако не существует каких-либо универсальных ингибиторов АПФ, которые были бы идеальными при всех клинических состояниях. Единственное, о чем можно говорить, так это о том, что короткодействующие ингибиторы АПФ не могут применяться в качестве долговременной терапии, т.к. большая кратность приема (каптоприл нужно назначать как минимум три раза в день) снижает приверженность пациента к лечению. При почечной или печеночной недостаточности следует отдавать предпочтение препаратам с альтернативным путем выведения. По степени снижения АД достоверной разницы между различными ингибиторами АПФ нет, что подтверждают данные метаанализа Cochrane Collaboration 2009 [36]. В этот анализ вошли результаты 92 исследований, в которых изучали эффективность монотерапии различными ингибиторами АПФ. В целом 12 954 пациентов cо средним возрастом 54,4 года и средним уровнем АД 157,1/101,2 мм рт.ст. принимали участие в этих исследованиях. Длительность лечения различными ингибиторами АПФ в среднем составила 6,2 недели. Эффективность ингибиторов АПФ сравнивали с плацебо, поэтому степень снижения АД на препаратах рассчитывалась как (снижение АД на фоне ингибитора АПФ) – (снижение АД на фоне плацебо). В среднем на фоне плацебо систолическое АД (САД) снизилось на 3,2 мм рт.ст., диастолическое АД (ДАД) — на 3,7 мм рт.ст.
На рис. 4 представлено сравнение различных ингибиторов АПФ в сопоставимых дозах. Как видно на рис. 4, в дозе ≥ 1/2 от максимальной наиболее эффективными были лизиноприл, эналаприл, беназеприл и имидаприл, наименее эффективным — рамиприл. Однако разница была недостоверной, что говорит о приблизительно одинаковой антигипертензивной эффективности и старых, и новых ингибиторов АПФ.
Следует также отметить, что в отдельных исследованиях эффективность различных ингибиторов АПФ была значительно выше или ниже. Однако в среднем можно говорить, что способность представителей данного класса снижать АД одинакова и на первый план должна выходить не степень снижения АД, а такие показатели, как соотношение пик/корыто, вариабельность АД, длительность антигипертензивного эффекта. Поэтому, безусловно, препараты с длительностью действия 24 часа и соотношением пик/корыто более 50 % имеют преимущества, так как позволяют увеличить приверженность пациента к лечению и снизить вариабельность АД. Среди таких препаратов есть и старые (лизиноприл), и новые (рамиприл, периндоприл, трандолаприл).
Между ингибиторами АПФ существует разница в способности проникать внутрь клетки и влиять на внутриклеточную РАС. Некоторые исследователи и фармацевтические компании превозносят эти свойства, определяя их как нечто особенное, делающее уникальными некоторые препараты. Но большинство липофильных ингибиторов АПФ должны обладать способностью легко проникать в клетку. Так, известно, что активный метаболит фозиноприла имеет индекс липофильности 2,0 ЕД, в то время как у периндоприлата он равен 0,872 ЕД, у эналаприлата — 0,108 ЕД [4]. Это значит, что он должен легче проникать во все органы и ткани организма. В эксперименте показано, что фозиноприлат подавляет активность АПФ в сердечной мышце в большей степени, чем рамиприлат и эналаприлат [38], что, согласно утверждению исследователей, может лежать в основе более выраженного (по сравнению с другими препаратами группы) кардиопротективного потенциала. Однако в клинических исследованиях оказалось, что нелипофильный лизиноприл достоверно снижает смертность и риск госпитализаций при СН [78]. Не слишком липофильные каптоприл, эналаприл и рамиприл также вошли в руководства по лечению СН [77]. В настоящее время мы не можем говорить, что один ингибитор АПФ лучше по каким-то свойствам, чем другой, только на основании данных экспериментальных исследований.
В некоторых исследованиях было показано, что антигипертензивные препараты, одинаково снижая САД и ДАД на плечевой артерии, по-разному влияют на уровень пульсового и центрального (аортального) АД. Так, в исследовании LIFE существовала достоверная разница между группами атенолола и лозартана по уровню пульсового АД в конце исследования [22]. А в исследовании К. Hirata с соавторами рамиприл на 5 мм рт.ст. больше снижал АД в аорте, чем атенолол [36]. В исследовании ASCOT комбинация амлодипин + периндоприл оказалась более эффективной в снижении аортального давления, чем комбинация атенолол + тиазид: разница по аортальному САД составила 4,4 мм рт.ст. [64, 75]. При этом именно лозартан, рамиприл и комбинация амлодипин + периндоприл в исследованиях LIFE, НОРЕ и ASCOT обеспечивали достоверное снижение частоты развития конечных точек, что, вполне вероятно, было связано с их положительным влиянием на уровень именно центрального АД. Безусловно, это не уменьшает достоинства этих препаратов или комбинаций, однако при существовании разницы по уровню АД нельзя говорить, что эти препараты улучшают прогноз вне зависимости от их влияния на уровень АД.
В настоящее время не существует клинических доказательств того, что какие-либо особенности действия тех или иных ингибиторов АПФ, за исключением их способности снижать АД, обеспечивают им первенство в назначении. Безусловно, «отсутствие доказательств — это не доказательство отсутствия», но на настоящий момент нам нужны прямые рандомизированные сравнительные исследования с сопоставлением по уровню АД для того, чтобы мы говорили о преимуществах каких-либо ингибиторов АПФ. Однако фармацевтические компании не спешат их проводить.
Особый интерес представляет применение ингибиторов АПФ у пациентов с ИБС. Именно при данной патологии больше исследовались так называемые новые ингибиторы АПФ. ИБС часто сочетается с АГ и на этом основывается активное продвижение новых ингибиторов АПФ. Мотивировка звучит так: при назначении новых ингибиторов АПФ убивается сразу два зайца — лечится и ИБС, и АГ. Но проблема заключается в том, что не всегда наличие АГ подразумевает наличие ИБС. Пациентов с АГ без ИБС значительно больше. В США ИБС имеют 16 млн взрослого населения, а АГ — 65 млн. То есть соотношение АГ и ИБС составляет 4,06. В Украине же существует гипердиагностика ИБС, когда диагноз ставится исходя из возраста пациента, наличия любых болей в области сердца без проведения нагрузочных тестов или коронарографии. В Украине в 2009 году было зарегистрировано 11,9 млн больных с АГ и 8,7 млн больных с ИБС, то есть соотношение составляет 1,4. Получается, что в Украине распространенность ИБС значительно выше, чем в США. Можно предполагать, что выявление АГ в Украине хуже, однако эпидемиологические исследования говорят, что 33 % украинцев страдают АГ, что очень близко к данным официальной статистики — 31 %. Можно также говорить о расовых различиях: в США большая доля афроамериканцев, которые меньше страдают ИБС и больше — АГ. Однако маловероятно, что это даст уж очень большую разницу в распространенности ИБС. Или можно утверждать, что в Украине живут особенные люди с большим количеством факторов риска ИБС, что сомнительно. Однако можно также говорить, что диагностика ИБС в Украине оставляет желать лучшего и реально распространенность ИБС значительно ниже. Поэтому мотивировка, что большее количество пациентов с АГ имеют ИБС и поэтому им нужно «на всякий случай» назначать только новые ингибиторы АПФ, не должна существовать.
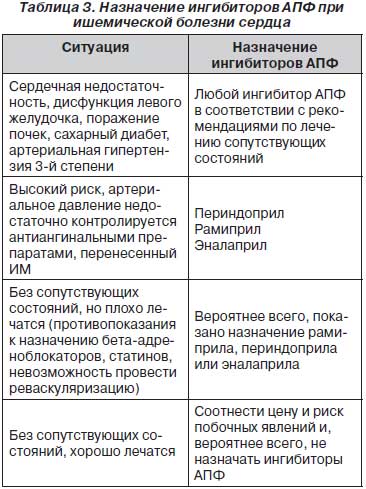
Если же ИБС четко верифицирована, то с назначением ингибиторов АПФ не так все просто. Во-первых, следует различать ситуации лечения острого инфаркта миокарда и хронической ИБС, в том числе после перенесенного инфаркта. При остром инфаркте миокарда показано назначение ингибиторов АПФ при передней локализации инфаркта, обширном поражении, отсутствии реперфузии, систолической дисфункции левого желудочка или клинических проявлениях сердечной недостаточности, сахарном диабете, поражении почек [33, 39, 43, 45, 46, 50, 80, 86]. Во-вторых, существуют исследования, которые показали эффективность ингибиторов АПФ при их назначении в первые сутки инфаркта миокарда и в более позднем периоде. При раннем (первые 24–36 часов) краткосрочном назначении отмечалось незначительное благоприятное влияние на смертность у пациентов, которые включались в исследование неселективно. Так, в исследовании ISIS-4 58 050 пациентам с острым инфарктом миокарда давали или каптоприл, или плацебо [26, 39]. На протяжении 5 недель достоверно смертность была ниже в группе каптоприла — на 4,9 смерти меньше на 1000 пациентов. У пациентов с перенесенным ранее инфарктом или клиническими проявлениями сердечной недостаточности эффективность каптоприла была выше — соответственно на 18 и 14 смертей меньше на 1000 пациентов. При иной, чем передняя, локализации инфаркта преимуществ каптоприла не отмечено. В исследование GISSI-3 было включено 19 394 пациента, которые были рандомизированы получать лизиноприл или плацебо [30, 31, 33, 60]. Смертность к 6-й неделе приема была ниже в группе лизиноприла. Разница сохранялась и на этапе 6 месяцев. В исследовании SMILE зофеноприл показал снижение смертности или возникновения тяжелой сердечной недостаточности при передней локализации инфаркта миокарда [12]. Метаанализ Myocardial Infarction Collaborative Group подтвердил преимущества раннего назначения ингибиторов АПФ при остром инфаркте в группах высокого риска (перед-няя локализация, сердечная недостаточность, диабет и др.) [9]. При этом наибольшее количество жизней cпасается уже на протяжении первой недели назначения ингибиторов АПФ [13].
Благоприятное воздействие ингибиторов АПФ при назначении их в более поздние (3-и — 10-е cутки) сроки после инфаркта миокарда доказано для каптоприла (исследование SAVE) и трандолаприла (исследование TRACE) у пациентов с систолической дисфункцией левого желудочка и для рамиприла (исследование AIRE) — у пациентов с клиническими проявлениями сердечной недостаточности.
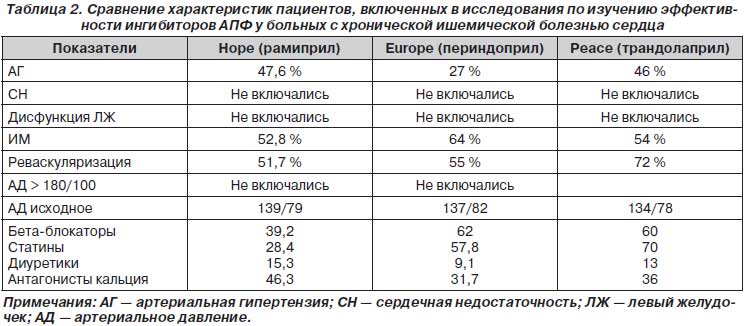
При стабильной ИБС изучалось влияние и новых рамиприла, периндоприла, квинаприла, трандолаприла, и старого эналаприла. Периндоприл продемонстрировал эффективность у пациентов с хронической ИБС с относительно низким сердечно-сосудистым риском в исследовании EUROPА — достаточно пролечить 50 пациентов на протяжении 4,2 года для того, чтобы предупредить одно сердечно-сосудистое событие (кардиоваскулярная смерть, инфаркт миокарда или внезапная смерть) [23, 27]. При этом в данное исследование (табл. 2) включались пациенты без дисфункции левого желудочка и клинических признаков сердечной недостаточности (средний возраст 60 лет). АГ имели только 27 % пациентов, уровень АД хорошо контролировался исходно (в среднем составил 137/82 мм рт.ст.), не включались пациенты с уровнем АД > 180/100 мм рт.ст., большинство из включенных были мужчинами — 85 %, сахарный диабет был лишь у 11 %, большая половина (64 %) из них перенесли инфаркт миокарда, и у 61 % ИБС была подтверждена ангиографически. Это означает, что результаты данного исследования касаются пациентов с ИБС, а не с АГ. Их нельзя полностью переносить и на всех пациентов с АГ и ИБС, а только на лиц со стабильной ИБС без сердечной недостаточности, перенесших инфаркт миокарда или имеющих ангиографически доказанное поражение коронарных артерий, с относительно хорошо контролируемым исходным АД. При наличии же клинических проявлений сердечной недостаточности или тяжелой АГ результаты исследования EUROPА вообще неприменимы, так как такие пациенты исключались из исследования.
Безусловно, сердечная недостаточность не исключает возможности назначения периндоприла, который показал эффективность у пожилых пациентов [19]. Однако при этом нельзя a priorі отвергать другие иАПФ, которые доказали благоприятное влияние на прогноз при данной патологии и рекомендованы руководствами [74].
Необходимо также помнить, что для больных с АГ (в том числе и с ИБС) улучшение прогноза связано прежде всего со снижением АД [7, 8]. В исследовании EUROPA периндоприл достоверно снижал уровень АД: разница с группой плацебо составила 5/2 мм рт.ст. у всех пациентов, и она была больше в некоторых подгруппах, что не позволяет говорить о том, что эффективность периндоприла не зависела от его антигипертензивного эффекта.
Несколько отличается от исследования EUROPA исследование НОРЕ [73, 84, 85]. В него включались больные более высокого риска развития сердечно-сосудистых осложнений как с ИБС, так и без ИБС, но с сахарным диабетом или перенесенным инсультом или с заболеваниями периферических артерий в возрасте старше 55 лет, которым назначали или рамиприл, или плацебо. Это исследование было спланировано не для изучения антигипертензивного влияния рамиприла, а для оценки возможностей назначения антигипертензивного препарата у пациентов высокого риска. Было показано снижение частоты возникновения первичной конечной точки (инсульт + инфаркт миокарда ++ другая сердечно-сосудистая смертность) на 22 %, а при сахарном диабете — на 25 % по сравнению с плацебо. При этом в группе рамиприла отмечалось большее снижение АД: разница составляла от 4/2 до 2/1 мм рт.ст. на различных этапах исследования, что, безусловно, могло играть ведущую роль в уменьшении частоты развития осложнений [73]. В группе пациентов с сахарным диабетом разница по диастолическому АД составила 4 мм рт.ст., что обеспечило снижение частоты возникновения первичной конечной точки на 50 %. Основным выводом данного исследования было то, что дополнительное снижение АД на фоне назначения антигипертензивного препарата обеспечивает у пациентов высокого сердечно-сосудистого риска снижение частоты развития кардиоваскулярных осложнений. Выводы об уникальности рамиприла не имеют достаточного подтверждения при наличии разницы по уровню АД. В исследовании ONTARGET у такой же категории пациентов высокого риска телмисартан по влиянию на конечные точки оказался таким же эффективным, как и «универсальный» рамиприл [84]. Но в то же время в исследовании TRANSCEND телмисартан у той же категории пациентов не отличался от плацебо. Иными словами, у пациентов высокого риска рамиприл так же эффективен, как и телмисартан, а телмисартан — как и плацебо.
Более того, если сравнивать данные об эффективности рамиприла у пациентов с сердечной недостаточностью, то среди 7105 пациентов, которые приняли участие в рандомизированных исследованиях, в которых была показана эффективность ингибиторов АПФ, только 17,2 % принимали рамиприл, а остальные — другие ингибиторы АПФ [61]. Из 100 000 пациентов в остром периоде инфаркта миокарда, которым назначали ингибиторы АПФ, рамиприл не получал ни один. В исследовании НОРЕ, так же как и в исследовании EUROPE, сердечная недостаточность была критерием исключения, а срок после перенесенного инфаркта миокарда составлял в среднем один год. Таким образом, на основании результатов исследования НОРЕ нельзя говорить об эффективности рамиприла у всех специфических категорий пациентов без исключения. Для этого нужны спланированные исследования. Конечно, для врачей удобно иметь универсальный препарат, который можно назначить пациенту с любой кардиальной патологией, но исследование НОРЕ не позволяет говорить, что рамиприл является именно таким препаратом. Безусловно, рамиприл продемонстрировал эффективность у больных с сердечной недостаточностью в поздние сроки инфаркта миокарда (исследование AIRE), у пациентов с диабетической и недиабетической нефропатией (исследования ASSK, REIN). Однако нельзя отвергать эффективность и других ингибиторов АПФ или блокаторов рецепторов ангиотензина II при тех же патологиях и возможность их назначения, в отличие от рамиприла, в первые сутки инфаркта миокарда (лизиноприл, каптоприл, валсартан, зофеноприл). Один из исследователей в своей статье «Нуре or hope» («Назойливая реклама или надежда») так прокомментировал данные о том, что в Канаде значительно выросло назначение рамиприла после публикации результатов исследования НОРЕ: «…это больше пускание пыли в глаза, чем действительно результаты НОРЕ, увеличение числа назначений непропорционально данным, поддерживающим использование этого препарата, и в основном является результатом интенсивного маркетинга» [61].
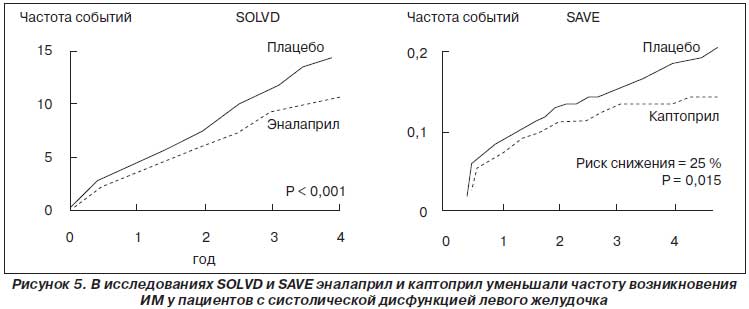
В исследованиях SAVE и SOLVD назначение старых каптоприла и эналаприла пациентам с систолической дисфункцией левого желудочка, обусловленной в основном ИБС (в исследование SAVE включались только больные после инфаркта миокарда, а в исследовании SOLVD большинство имели ИБС), приводило к достоверному и значительному снижению частоты возникновения инфаркта миокарда (рис. 5) и нестабильной стенокардии, что позволяет назначать эти препараты больным данной категории для профилактики коронарных событий. Иными словами, так называемые старые ингибиторы АПФ также обладают способностью предупреждать возникновение коронарных событий у пациентов, уже имеющих ИБС и сердечную недостаточность или дисфункцию левого желудочка.
В исследованиях PEACE и QUITE изучали влияние трандолаприла и квинаприла на частоту развития сердечно-сосудистых событий у пациентов с ИБС без сердечной недостаточности [62, 76]. Оказалось, что в целом частота развития осложнений у данной категории пациентов очень низкая. Что объяснялось, прежде всего, включением менее тяжелой категории больных, чем в исследованиях НОРЕ и EUROPA (табл. 2), из-за того, что их значительно лучше лечили — проводили полноценную антиангинальную, антигипертензивную (исходный уровень АД был 134/78 мм рт.ст.), липидснижающую, антитромбоцитарную терапию и реваскуляризирующие вмешательства (более 70 %). Поэтому добавление ингибитора АПФ не привело к дополнительному благоприятному воздействию. Аналогично в исследовании TRANSCEND дополнительное назначение телмисартана пациентам высокого риска, которые не переносили ингибиторы АПФ, также не привело к положительному воздействию на частоту возникновения кардиоваскулярных осложнений. Исследователи объясняли это тем, что по сравнению с исследованием НОРЕ пациентов хорошо лечили (в исследовании НОРЕ только 39 % получали бета-блокаторы, и только 28 % — статины, в то время как в исследовании TRANSCEND 58 и 55 % соответственно принимали данные препараты).
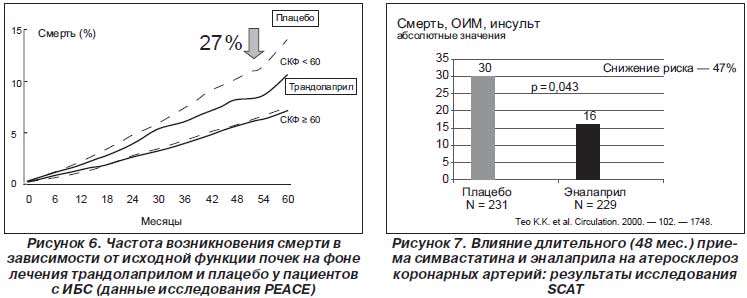
В дальнейшем исследователи PEACE оценили частоту развития фатальных событий в зависимости от исходной функции почек (рис. 6), и оказалось, что трандолаприл обеспечивал снижение смертности на 27 % по сравнению с плацебо у пациентов со скоростью клубочковой фильтрации менее 60 мл/мин [71]. Это означает, что в специфической когорте пациентов (со сниженной функцией почек) с ИБС трандолаприл так же эффективен, как и другие новые ингибиторы АПФ. В другом исследовании — SCAT (рис. 7) назначение старого эналаприла совместно с симвастатином пациентам с ангиографически подтвержденной ИБС и сахарным диабетом, которым не требовалось проведение реваскуляризации, приводило к снижению риска смерти на 47 %. В post hoc анализе исследования САMELOT было показано, что у пациентов со стабильной стенокардией (60 % имели АГ, исходное АД 129/78 мм рт.ст.) и с ангиографически подтвержденным коронарным атеросклерозом, не требующим реваскуляризации, которые были рандомизированы получать амлодипин, эналаприл или плацебо на протяжении 2 лет наряду с основной терапией (83 % получали статины, 75 % — бета-адреноблокаторы, 95 % — аспирин), эналаприл, так же как и амлодипин, уменьшал вероятность возникновения комбинированной конечной точки (кардиоваскулярная смерть или инсульт или инфаркт миокарда) на 29 %. При этом существовала зависимость между прогрессированием атеросклеротической бляшки и снижением АД [59].
Следует отметить, что у пациентов с АГ (особенно высокого риска) назначение старых ингибиторов АПФ приводило к снижению частоты развития коронарных событий, и прежде всего инфаркта миокарда. Так, в исследовании АNВP-2 эналаприл, по сравнению с диуретиком, достоверно уменьшал вероятность развития первого инфаркта миокарда на 32 % (Р = 0,04) [83]. В исследование ALLHAT включались пациенты с АГ и одним из факторов риска развития ИБС. Оказалось, что лизиноприл был таким же эффективным в предупреждении первичной конечной точки (инфаркт миокарда или смертность от ИБС), как и амлодипин и хлорталидон [11]. Иными словами, если пациент имеет АГ без ИБС, то ему вполне можно назначать старый ингибитор АПФ эналаприл или лизиноприл.
Таким образом, при ИБС, с АГ или без нее, ингибиторы АПФ (и старые, и новые) обязательно следует назначать (уровень доказательности А) при сопутствующих состояниях (сахарный диабет, неконтролируемая АГ, сердечная недостаточность, асимптомная дисфункция левого желудочка, постинфарктный кардиосклероз, поражение почек). Во всех других ситуациях назначение ингибиторов АПФ имеет уровень доказательности В. Это прописано в действующих рекомендациях Американской ассоциации сердца 2011 и в рекомендациях Европейского общества кардиологов 2013 [28, 70]. В ситуациях без сопутствующих состояний можно предполагать следующие варианты. Если сопутствующих состояний нет, но пациент перенес инфаркт миокарда и/или его АД недостаточно контролируется антиангинальными препаратами (бета-блокаторами, антагонистами кальция), и/или он не может принимать терапию для лечения ИБС в полном объеме, то тогда лучше назначить препараты, доказавшие эффективность в рандомизированных исследованиях, — периндоприл, рамиприл, эналаприл (табл. 3). Если же АД контролируется, сопутствующих состояний нет, пациенту провели реваскуляризирующие процедуры, он получает антиангинальную, гиполипидемическую, антиагрегантную терапию в полном объеме, то, вероятнее всего, не нужно вообще назначать ингибиторы АПФ, так как соотношение стоимость лечения + побочные явления/польза от приема может оказаться очень высоким.
При наличии АГ без верифицированной ИБС вероятно, что любые ингибиторы АПФ, снижая АД, будут эффективны для предупреждения возникновения коронарных событий.
С какими диуретиками лучше сочетать ингибиторы АПФ? Как уже говорилось выше, тиазидные и тиазидоподобные диуретики хорошо сочетаются с ингибиторами АПФ, представляя собой рациональную комбинацию. Во многих исследованиях использовалась такая комбинация. При этом либо диуретик добавлялся вторым препаратом, либо к диуретику добавляли ингибитор АПФ. В 2011 году вышли рекомендации Национального британского института клинического великолепия (NICE) по лечению АГ. В них указывалось, что длительное использование тиазидоподобных диуретиков (индапамид, хлорталидон) является более привлекательным, чем тиазидов (гидрохлортиазид, бендрофлуметиазид) [47]. Аргументов для такого утверждения было несколько.
Во-первых, в большинстве исследований, в которых эффективными оказались диуретики, они использовались или в сочетании с калийсберегающими диуретиками (табл. 4), или это были тиазидоподобные диуретики [56]. Следовательно, нельзя говорить, что именно тиазиды эффективны.
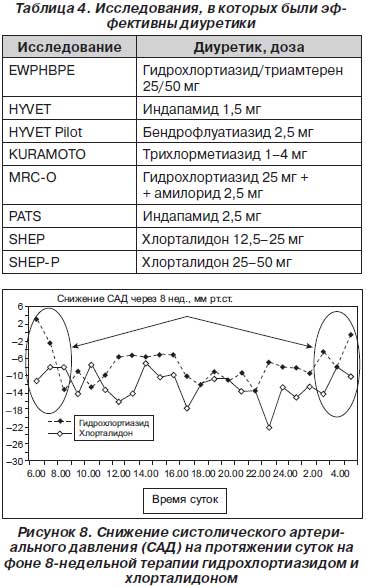
Во-вторых, тиазидоподобные диуретики отличаются от тиазидных по своему антигипертензивному действию. Так, в исследовании M.E. Ernst с соавторами хлорталидон через 8 недель лечения обеспечивал равномерное снижение САД на протяжении суток (рис. 8). В то же время при приеме гидрохлортиазида наблюдалось резкое снижение САД в первые часы после приема дозы (на рис. 8 показано стрелкой) и значимое по сравнению с хлорталидоном ослабление гипотензивного эффекта к моменту принятия следующей дозы препарата [25]. Как показывают наблюдения [16, 44, 66], такие большие колебания (вариабельность) АД могут в дальнейшем привести к увеличению риска развития кардиоваскулярных осложнений.
В-третьих, как известно, диуретики не слишком хорошо влияют на обменные процессы и, в частности, повышая уровень глюкозы, увеличивают риск возникновения сахарного диабета. Некоторые исследователи считают, что сахарный диабет на фоне диуретиков — это не совсем тот сахарный диабет, который обусловлен генетическими механизмами, и риск возникновения осложнений невысок [35]. Другие, наоборот, демонстрируют, что частота кардиоваскулярных осложнений увеличивается при диабете, индуцированном диуретиками [79].
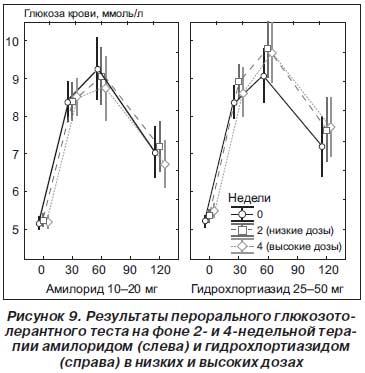
Механизм возникновения сахарного диабета на фоне диуретиков недостаточно ясен. Одной из версий является следующая: диуретики вызывают гипокалиемию, и в таких условиях мышцы, основные потребители глюкозы, становятся нечувствительными к инсулину и не усваивают глюкозу, уровень глюкозы в крови повышается. Это наиболее часто наблюдается при употреблении высоких доз тиазидных диуретиков [10, 49, 63]. В исследовании A.J. Stears с соавторами было показано, что применение гидрохлортиазида на протяжении 4 недель и в низких, и в высоких дозах приводило к достоверному повышению уровня глюкозы на 60-й и 120-й минутах глюкозо-толерантного теста по сравнению с амилоридом, что свидетельствовало об ухудшении толерантности к глюкозе при использовании только некалийсберегающего диуретика [72].
Подтверждает предположения о роли гипокалиемии в повышении риска сахарного диабета и анализ данных исследования SHEP, в котором показано, что снижение уровня калия на 0,5 mEq/L через год лечения диуретиком ассоциировалось с 45% увеличением риска возникновения сахарного диабета [67]. В такой ситуации повышение уровня глюкозы можно рассматривать не как истинный сахарный диабет, а как побочное действие препарата. Для предотвращения этого побочного действия возможно совместно с диуретиком использовать калийсберегающий препарат. Таким препаратом может быть калийсберегающий диуретик (например, спиролактон) или ингибитор АПФ [41, 68].
Практически во всех исследованиях, где тиазидный диуретик использовался совместно с блокаторами ренин-ангиотензиновой системы, повышения риска возникновения сахарного диабета не было. И даже при сравнении двух комбинаций — ингибитор АПФ + диуретик против ингибитор АПФ + антагонист кальция в исследовании ACCOMPLISH о повышении уровня глюкозы при каком-либо лечении не сообщалось [40]. В основном сообщения о продиабетическом действии диуретиков касались тех ситуаций, когда диуретик назначали совместно с бета-блокаторами. В исследовании Atherosclerosis Risk in Communities (ARIC) длительное лечение только тиазидным диуретиком 12 550 пациентов без исходного сахарного диабета на протяжении 3 и 6 лет не увеличивало риск нарушения метаболизма глюкозы по сравнению с лицами, которые не принимали какой-либо антигипертензивной терапии [35].
Однако, несмотря на то, что есть много оправданий для тиазидных диуретиков в отношении их отрицательного влияния на обмен глюкозы, следует помнить, что тиазидоподобные диуретики в этом плане более надежны. Они значительно реже вызывают гипокалиемию и реже повышают уровень глюкозы. В исследовании G. Leonetti с соавторами двухлетнее применение индапамида не ухудшало толерантность к глюкозе [51]. В исследовании ALLHAT хотя на фоне хлорталидона (часто использовался совместно с бета-блокаторами) и отмечалось повышение уровня глюкозы, но это не было сопряжено с увеличением риска возникновения коронарных событий, инсульта, кардиоваскулярных заболеваний или поражения почек [15]. В то же время еще в 1994 г. было показано, что гипокалиемические изменения на фоне гидрохлортиазида могут приводить к увеличению риска остановки сердца [69]. Так, использование дозы 50 мг по сравнению с дозой 25 мг/сут увеличивало риск кардиального ареста на 70 % (доверительный интервал 0,7–4,5), а дозы 100 мг/сут — в 3,6 раза (доверительный интервал 1,2–10,3), Р = 0,02 для тенденции. Поэтому если есть необходимость, то для длительной терапии нужно использовать гидрохлортиазид в дозах, не превышающих 25 мг. При этом, вероятнее всего, если у пациента повышен риск возникновения сахарного диабета (например, при метаболическом синдроме) и ему необходимо назначать диуретики на длительный прием, то предпочтение следует отдавать тиазидоподобным диуретикам. Если же пациент до этого длительное время принимал гидрохлортиазид и у него не отмечалось никаких побочных эффектов, то такого пациента можно не переводить на тиазидоподобный диуретик, но более тщательно следить за уровнем глюкозы и калия.
В-четвертых, есть данные, что тиазидные диуретики не так хороши в предупреждении кардиоваскулярных событий и поражения органов-мишеней, как тиазидоподобные. Так, в исследовании MRFIT, проведенном еще в 1990 году, было показано, что в шести клиниках, где в основном использовали хлорталидон для лечения АГ, смертность от коронарных причин была ниже, чем в клиниках, где чаще для стартового лечения АГ использовали гидрохлортиазид [58]. В группе пациентов интенсивного лечения, которое включало антигипертензивную терапию и модификацию образа жизни, смертность на гидрохлортиазиде была на 46 % выше, чем в группе обычного лечения. И наоборот, на 58 % ниже на хлорталидоне. При переходе пациента с хлорталидона на гидрохлортиазид в группе интенсивного лечения на 28 % увеличивалась кардиоваскулярная смертность по сравнению с группой обычного лечения.
В дальнейшем был проведен ретроспективный анализ кардиоваскулярных событий у пациентов, которые принимали участие в исследовании MRFIT [24]. Оказалось, что продолжение лечения диуретиками (и хлорталидоном, и гидрохлортиазидом) (рис. 10), сопровождалось лучшей выживаемостью без событий по сравнению с группой прекративших прием препаратов. Однако при сравнении группы хлорталидона и группы гидрохлортиазида оказалось, что на 21 % лучше выживаемость без событий была в группе хлорталидона (Р = 0,0016), в основном за счет влияния на частоту развития инфаркта миокарда, аортокоронарного шунтирования и заболеваний периферических артерий. Исследователи сделали вывод, что для длительного приема, вероятно, предпочтение следует отдавать тиазидоподобным диуретикам.
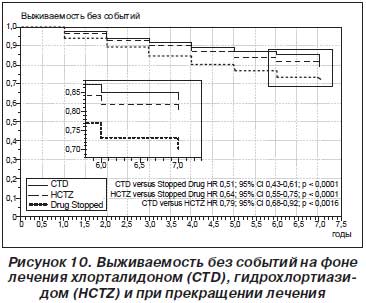
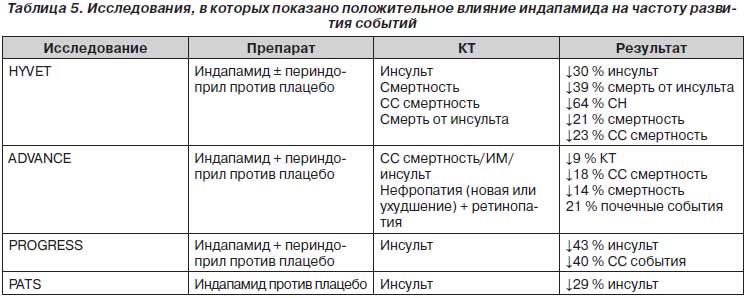
Если говорить об индапамиде, то этот тиазидоподобный диуретик показал себя эффективным в предупреждении кардиоваскулярных осложнений во многих исследованиях (табл. 5). Фактически это диуретик, не проигравший ни одного исследования. При этом в одних наблюдениях он применялся как стартовый препарат (HYVET, PATS), в других — добавлялся к ранее назначенному лечению (PROGRESS), в третьих — сразу назначался в составе комбинации (ADVANCE). Примечательно, что в исследовании PROGRESS на фоне терапии периндоприлом частота снижения повторного нарушения мозгового кровообращения составила 7 %, а в комбинации с индапамидом — уже 44 % [65].
В исследовании NESTOR сравнивали влияние на альбуминурию индапамида и эналаприла у пациентов с сахарным диабетом [54, 55]. Оказалось, что диуретик не уступал ингибитору АПФ в уменьшении альбуминурии. В наблюдении же LIVE индапамид превосходил эналаприл в уменьшении гипертрофии левого желудочка [32]. При сравнении влияния индапамида и гидрохлортиазида на скорость клубочковой фильтрации у пациентов с исходно сниженной функцией оказалось, что при одинаковом контроле АД на протяжении 2 лет на фоне индапамида наблюдалось увеличение скорости клубочковой фильтрации на 28,5 ± 4,4 %, в то время как на фоне гидрохлортиазида этот показатель, наоборот, уменьшился на 17,4 ± 3,0 %, что свидетельствовало о дополнительном нефропротекторном действии индапамида [52].
Применительно к почкам следует отметить, что тиазидные диуретки теряют свою эффективность при скорости клубочковой фильтрации менее 60 мл/мин, в то время как тиазидоподобные диуретики ее сохраняют при величине данного показателя в пределах 30–60 мл/мин. Поэтому при сниженной функции почек предпочтительней использовать тиазидоподобные или петлевые диуретики.
В-пятых, не все диуретики одинаково хорошо переносятся. Общепринято, что диуретики в низких дозах хорошо переносятся пациентами, и это записано в рекомендациях. Однако все же они значительно уступают в приверженности к лечению другим антигипертензивным препаратам [53]. Через год остаются на терапии диуретиками 20,8 % пациентов, через 4 года — 16,4 %, что в два раза ниже, чем на бета-блокаторах. Эти данные подтверждаются и результатами метаанализа I. Kronish с соавторами, в котором было продемонстрировано, что наихудшая приверженность у диуретиков и бета-блокаторов [48]. В то же время рандомизированные исследования говорят о том, что тиазидоподобные диуретики действительно имеют хорошую переносимость и высокую приверженность.
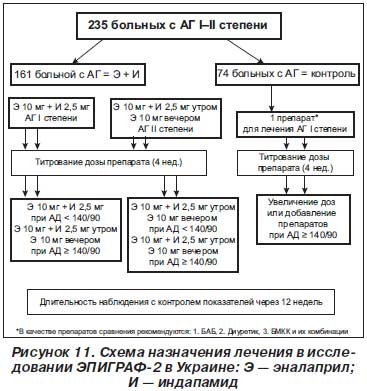
С учетом положительных данных для эналаприла и индапамида были проведены исследования по их комбинированному использованию в двух многоцентровых исследованиях: ЭПИГРАФ-1 и ЭПИГРАФ-2 [1, 2]. Исследование ЭПИГРАФ-2 проводилось и в России, и в Украине. В Украине в нем принимало участие 7 центров [6]. Пациенты с эссенциальной АГ были рандомизированы в соотношении 2 : 1 получать или отдельный препарат, или данную комбинацию (в зависимости от исходного АД назначали или эналаприл 10 мг + индапамид 2,5 мг, или эналаприл 10 мг + индапамид 2,5 мг утром и эналаприл 10 мг вечером), или любую антигипертензивную терапию, которая не включала ингибиторы АПФ (рис. 11). Увеличение дозы проводили с интервалом 4 недели. Основным условием лечения группы контроля было достижение целевого АД. Исходно группы достоверно не отличались по основным характеристикам.
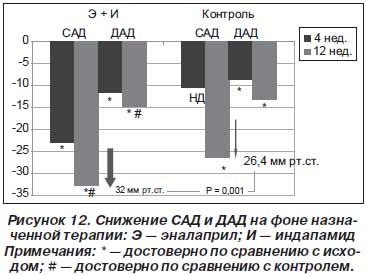
На фоне назначенной терапии снижение АД наблюдалось в обеих группах (рис. 12). Однако в группе комбинации эналаприл + индапамид САД достоверно снизилось уже на 4-й неделе лечения, и в конце наблюдения имелась достоверная разница по степени снижения САД в пользу изучаемой комбинации. Иными словами, комбинация обеспечивала более раннее и более сильное антигипертензивное действие. Это подтверждалось и данными суточного мониторирования АД: достоверное снижение дневного САД/ДАД на 20,1/10,6 мм рт.ст. в группе комбинации и 15,3/6,8 мм рт.ст. в группе контроля (Р = 0,041/0,016).
Обе схемы лечения переносились хорошо, но частота побочных явлений была почти в два раза меньше в группе эналаприл + индапамид — 3,1 против 6,8 %, что и следовало ожидать от использования рациональной комбинации.
Таким образом, ингибитор АПФ + диуретик остается рациональной комбинацией. Среди ингибиторов АПФ у пациентов с АГ могут применяться и так называемые старые, и новые. Предпочтительным является применение тиазидопобных, а не тиазидных диуретиков.

1. Беленков Ю.Н., Мареев В.Ю. От имени рабочей группы исследования ЭПИГРАФ. Эналаприл плюс индапамид в лечении стабильной артериальной гипертонии: оценка эффективности и безопасности рациональной комбинированной фармакотерапии (Эпиграф). Первые результаты Российского многоцентрового исследования // Сердце. — 2005. — Т. 2, № 4. — С. 3-10.
2. Беленков Ю.Н. и рабочая группа исследования ЭПИГРАФ-2. Эналаприл плюс Индапамид в лечении АГ: оценка эффективности и безопасности рациональной фармакотерапии. Применение нефиксированной комбинации Эналаприла и Индапамида (Энзикс). Дизайн и основные результаты исследования ЭПИГРАФ-2 // Сердце. — 2005. — Т. 4, № 5. — С. 277-286.
3. Горбась І.М. Програма профілактики і лікування артеріальної гіпертензії в Україні: підсумки виконання // Здоров’я України. Тематичний номер. — 2011. — № 3. — С. 32-34.
4. Корзун А.И., Кириллова М.В. Сравнительная характеристика ингибиторов АПФ. — Санкт-Петербург: ВМедА, 2003. — 24 с.
5. Настанова та клінічний протокол надання медичної допомоги «Артеріальна гіпертензія». Наказ МОЗ України № 384 від 24.05.2012. — Київ, 2012. — 107 с.
6. Сіренко Ю.М., Радченко Г.Д., Поліщук С.А. від імені учасників багатоцентрового дослідження Еналаприл плюс індапамід при лікуванні артеріальної гіпертензії: оцінка ефективності та безпеки раціональної фармакотерапії застосування нефіксованої комбінації еналаприлу і індапаміду (ЕНЗИКС) (результати багатоцентрового дослідження ЕПІГРАФ-2 в Україні) // Укр. мед. часопис. — 2007. — № 3. — С. 61-70.
7. 2007 European Society of Hypertension — European Society of Cardiology guidelines for management of arterial hypertension // J. Hypertension. — 2007. — Vol. 25. — P. 1105-1187.
8. 2013 ESH/ESC Guidelines for the management of arterial hypertension TheTask Force for the management ofarterial hypertension of the European Society ofHypertension (ESH) and of the European Society of Cardiology (ESC) // Journal of Hypertension. — 2013. — Vol. 31. — P. 1281-1357.
9. ACE Inhibitor Myocardial Infarction Collaborative Group. Indications for ACE inhibitors in the early treatment of acute myocardial infarction: systematic overview of individual data from 100 000 patients in randomized trials // Circulation. — 1998. — Vol. 97. — Р. 2202-2210.
10. Amery A., Berthaux P., Bulpitt C. et al. Glucose intolerance during diuretic therapy: results of trial by the European Working Party on Hypertension in the Elderly // Lancet. — 1978. — Vol. 1. — P. 681-683.
11. ALLHAT Officers and Coordinators for the ALLHAT Collaborative Research Group Major outcomes in high-risk hypertensive patients randomized to angiotensin-converting enzyme inhibitor or calcium channel blocker vs diuretic: The Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial (ALLHAT) // JAMA. — 2002. — Vol. 288. — P. 2981-2997.
12. Ambrosioni E., Borghi C., Magnani B. The effect of the angiotensin-converting-enzyme inhibitor zofenopril on mortality and morbidity after anterior myocardial infarction. The Survival of Myocardial Infarction Long-Term Evaluation (SMILE) Study Investigators // N. Engl. J. Med. — 1995. — Vol. 332. — P. 80-85
13. Ball S., Hall A., Murray G. Angiotensin-converting enzyme inhibitors after myocardial infarction: indications and timing // J. Am. Coll. Cardiol. — 1995. — Vol. 25. — S42-S46.
14. Banegas J., Esther Lopez-Garcia E., Dallongeville J. et al. Achievement of treatment goals for primary prevention of cardiovascular disease in clinical practice across Europe: the EURIKA study //European Heart Journal. — 2011. — Vol. 32. — P. 2143-2152.
15. Barzilay J.I., Davis B.R., Cutler J.A. et al. Fasting glucose levels and incident di abetesmellitus in older nondiabetic adults randomized to receive 3 different classes of antihypertensive treatment: a report from the Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial (ALLHAT) // Arch Intern Med. — 2006. — Vol. 166. — P. 2191-2201.
16. Bjorklund K., Lind L., Zethelius B., Berglund L., Lithell H. Prognostic significance of 24-h ambulatory blood pressure characteristics for cardiovascular morbidity in a population of elderly men // J. Hypertens. — 2004. — Vol. 22. — P. 1691-1697.
17. Byrd J.B., Zeng C., Tavel H.M. et al. Combination therapy as initial treatment for newly diagnosed hypertension // Am. Heart J. — 2011. — Vol. 162 (2). — P. 340-346.
18. Chockalingham A., Fodor J.G. Treatment of raised blood pressure in the population. The Canadian experience // Am. J. Hypertens. — 1998. — Vol. 11. — P. 747-749.
19. Cleland J.G., Tendera M., Adamus J. et al. The perindopril in elderly people with chronic heart failure (PEP-CHF) study // Eur. Heart J. — 2006. — Vol. 27 (19). — P. 2338-2345.
20. Colhoun H.M., Dong W., Poulter N.R. Blood pressure screening, management and control in England: results from the health survey for England 1994 // J. Hypertens. — 1998. — Vol. 16. — P. 747-752.
21. Corrao G., Nicotra F., Parodi A. et al. Cardiovascular Protection by Initial and Subsequent Combination of Antihypertensive Drugs in Daily Life Practice // Hypertension. — 2011. — Vol. 58. — P. 566-572.
22. Dahloеf B., Devereux R.B., Kjeldsen S.E., Julius S., Beevers G., de Faire U et al. Cardiovascular morbidity and mortality in the Losartan Intervention for Endpoint reduction in hypertension study (LIFE): a randomized trial against atenolol // Lancet. — 2002. — Vol. 359. — P. 995-1003.
23. Daly C., Fox K., Remme W. еt al. The effect of perindopril on cardiovascular morbidity and mortality in patients with diabetes in the EUROPA study: results from the PERSUADE substudy // Eur. Heart J. — 2005. — Vol. 26. — P. 1369-1378.
24. Dorsh M., Gillespie B., Erikson S. et al. Chlorthalidone reduces cardiovascular events compared with Hydrochlorthiazide: a retrospective cohort analysis // Hypertension. — 2011. — Vol. 57. — P. 689-694.
25. Ernst M.E., Carter B.L., Goerdt C.J. et al. Comparative antihypertensive effects of hydrochlorothiazide and chlorthalidone on ambulatory and office blood pressure // Hypertension. — 2006. — Vol. 47. — Р. 352-358.
26. Fourth International Study of Infarct Survival Collaborative Group. ISIS-IV: a randomised factorial trial assessing early oral captopril. Oral mononitrate and intravenous magnesium sulphate in 58050 patients with suspected acute myocardial infarction // Lancet. — 1995. — Vol. 345. — P. 669-685.
27. Fox K.M. EURopean trial оn reduction of cardiac events with Perindopril in stable coronary Artery disease Investigators. Efficacy of perindopril in reduction of cardiovascular events among patients with stable coronary artery disease: randomised, double-blind, placebo-controlled, multicentre trial (the EUROPA study) // Lancet. — 2003. — Vol. 362. — P. 782-788.
28. Guidelines on the management of stable angina pectoris. The Task Force on the management of stable angina pectoris of the European Society of Cardiology // Eur. Heart J. — 2013. — doi:10.1093/eurheartj/eht296
29. Girerd X. et al. / Analysis of the use of antihypertensive drugs in five European countries in 2010 / ESH London 29th April.
30. GISSI-3 Investigators (1994) GISSI-3: effects of lisinopril and transdermal glyceryl trinitrate singly and together on 6-week mortality and ventricular function after acute myocardial infarction. Gruppo Italiano per lo Studio della Sopravvivenza nell’infarto Miocardico // Lancet. — 1994. — Vol. 343. — P. 1115-1122.
31. Goa K.L., Balfour J.A., Zuanetti G. (1996) Lisinopril. A review of its pharmacology and clinical efficacy in the early management of acute myocardial infarction // Drugs. — 1996. — Vol. 52 (4). — P. 564-588.
32. Gosse P., Sheridan D.J., Zannad F. et al. Regression of left ventricular hypertrophy in hypertensive patiens treated with indapamide SR 1,5mg versus enalapril 20 mg: the LIVE study // J. Hypertens. — 2000. — Vol. 18 (10). — P. 1465-1475.
33. Gottlieb S., Leor J., Shotan A. et al. Comparison of effectiveness of angiotensin-converting enzyme inhibitors after acute myocardial infarction in diabetic versus nondiabetic patients // Am. J. Cardiol. — 2003. — Vol. 92. — P. 1020-1025.
34. Gradman A.H., Parise H., Lefebvre P. et al. Initial combination therapy reduces the risk of cardiovascular events in hypertensive patients: a matched cohort study // Hypertension. — 2013. — Vol. 61 (2). — P. 309-318.
35. Gress T.W., Nieto F.J., Shahar E., Wofford M.R., Brancati F.L. Hypertension and antihypertensive therapy as risk factors for type 2 diabetes mellitus: Atherosclerosis Risk in Communities Study // N. Engl. J. Med. — 2000. — Vol. 342. — P. 905-912.
36. Hirata K., Vlachopoulos C., Adji A., O’Rourke M.F. Benefits from angiotensin-converting enzyme inhibitor «beyond blood pressure lowering»: beyond blood pressure or beyond the brachial artery? [published correction appears in J. Hypertens. 2005; 23: 903-904] // J. Hypertens. — 2005. — Vol. 23. — P. 551-556.
37. http://www.theheart.org/article/1443111.do
38. Huang K., Dai G. The effect and mechanism of forsinopril on ventricular hypertrophy of SHR and left ventricular pressure overloading rat // J. Huazriong. Univ. Sci Technolog. Med. Sci. — 2002. — Vol. 22. — P. 17-20.
39. ISIS-4 (Fourth International Study of Infarct Survival) Collaborative Group ISIS-4: a randomised factorial trial assessing early oral captopril, oral mononitrate, and intravenous magnesium sulphate in 58,050 patients with suspected acute myocardial infarction // Lancet. — 1995. — Vol. 345. — P. 669-685.
40. Jamerson K., Weber M.A., Bakris G.L. et al. Benazepril plus amlodipine or hydrochlorothiazide for hypertension in highrisk patients // N. Engl. J. Med. — 2008. — Vol. 359. — P. 2417-2428.
41. Jeunemaitre X., Charru A., Chatellier G. et al. Long-term metabolic effects of spironolactone and thiazides combined with potassium-sparing agents for treatment of essential hypertension // Am. J. Cardiol. — 1988. — Vol. 62. — P. 1072-1077.
42. Joint National Committee on Prevention, Detection, Evaluation and Treatment of High Blood Pressure. The sixth Report of the Joint National Committee on Prevention, Detection, Evaluation and Treatment of High Blood Pressure (JNC VI) // Arch. Intern. Med. — 1997. — Vol. 157. — P. 2413-2465.
43. Keber L., Torp-Pedersen C. Clinical characteristics and mortality of patients screened for entry into the Trandolapril Cardiac Evaluation (TRACE) study // Am. J. Cardiol. — 1995. — Vol. 76 (1). — P. 1-5.
44. Kikuya M., Hozava A., Ohokubo T. et al. Prognostic Significance of Blood Pressure and Heart Rate Variabilities // Hypertension. — 2000. — Vol. 36. — P. 901-906.
45. Kingma J.H., van Gilst W.H., Peels C.H. et al. (1994) Acute intervention with captopril during thrombolysis in patients with first anterior myocardial infarction. Results from the Captopril and Thrombolysis Study (CATS) // Eur. Heart J. — 1994. — Vol. 15 (7). — P. 898-907.
46. Kober L., Torp-Pedersen C., Carlsen J.E. et al. For the trandolapril cardiac evaluation (TRACE) study group: a clinical trial of the angiotensin converting enzyme inhibitor trandolapril in patients with left ventricular dysfunction after myocardial infarction // N. Engl. J. Med. — 1995. — Vol. 33. — P. 1670-1676.
47. Krause T., Lovibond K., Caulfield M. et al. Management of hypertension: summary of NICE guildance // BMJ. — 2011. — Vol. 343. — P. 4891.
48. Kronish I., Woodward M., Sergie Z. et al. Meta-Analysis Impact of Drug Class on Adherence to Antihypertensives Circulation. — 2011. — Vol. 123. — P. 1611-1621.
49. Langford H.G., Cutter G., Oberman A., Kansal P., Russell G. The effect of thiazide therapy on glucose, insulin and cholesterol metabolism and of glucose on potassium: results of a cross-sectional study in patients from the Hypertension Detection and Follow-up Program // J. Hum. Hypertens. — 1990. — Vol. 4. — P. 491-500.
50. Latini R., Maggioni A.P., Flather M. et al. ACE inhibitor use in patients with myocardial infarction. Summary of evidence from clinical trials // Circulation. — 1995. — Vol. 92 (10). — P. 3132-3137.
51. Leonetti G., Rappelli A., Salvetti A., Scapellato L. Long-term effects of indapamide: final results of a two-year Italianmulticenter study in systemic hypertension // Am. J. Cardiol. — 1990. — Vol. 65. — P. 67H-71H.
52. Madkour H., Gadallah M., Riveline B. et al. Indapamide is superior to thiazide in the preservation of renal function in patients with renal insufficiency and systemic hypertension // Am. J. Cardiol. — 1996. — Vol. 77. — P. 23-25B.
53. Mancia G., Seravalle G., Grassi G. Tolerability and treatment compliance with angiotensin II receptor antagonists // Am. J. Hypertens. — 2003. — Vol. 16. — P. 1066-1073.
54. Marre M., Garcia Puig J., Kokot F. et al. Effect of indapamide SR on microalbuminuria — the NESTOR study (Natrilix SR versus Enalapril Study in Type 2 diabetic hypertensives with micrOalbuminuRia) — rationale and protocol for the main trial // J. Hypertens Suppl. — 2003. — Vol. 21 (1). — P. 19-24S.
55. Marre M., Garcia-Puig J., Kokot F. et al. Equivalence of indapamide SR and enalapril on microalbuminuria reduction hypertensive patients with type 2 diabetic: the NESTOR study // J. Hypertens. — 2004. — Vol. 22. — P. 1613-1622.
56. Messerli F., Bangalore S. Half a Century of Hydrochlorothiazide: Facts, Fads, Fiction and Follies // Am. J. Med. — 2011. — Vol. 124. — P. 896-899.
57. Mourad J.J., Waeber B., Zannad F. et al. Investigators of the STRATHE trial. Comparison of different therapeutic strategies in hypertension: a low-dose combination of perindopril/indapamide versus a sequential monotherapy or a stepped-care approach // J. Hypertens. — 2004. — № 22. — 2379-2386.
58. Multiple Risk Factor Intervention Trial Research Group. Mortality After 101/2 Years for Hypertensive Participants in the Multiple Risk Factor Intervention Trial // Circulation. — 1990. — Vol. 82. — P. 1616-1628.
59. Nissen S., Tuzcu E., Libby P. et al. Effect of antihypertensive agents on cardiovascular events in patients with coronary disease and normal blood pressure: the CAMELOT study: a randomized controlled trail // JAMA. — 2004. — Vol. 292. — P. 2217-2225.
60. Pedrazzini G., Santoro E., Latini R. et al. GISSI-3 Investigators Causes of death in patients with acute myocardial infarction treated with angiotensin-converting enzyme inhibitors: findings from the Gruppo Italiano per lo Studio della Sopravvivenza nell’Infarto (GISSI)-3 trial // Am. Heart J. — 2008. — Vol. 155 (2). — P. 388-394.
61. Pilote L. Ramipril use in Canada: HOPE or HYPE? // JAMC. — 2003. — Vol. 168. — P. 568-569.
62. Pitt B., O’Neill B., Feldman R. et al. The QUinapril Ischemic Event Trial (QUIET): evaluation of chronic ACE inhibitor therapy in patients with ischemic heart disease and preserved left ventricular function // Am. J. Cardiol. — 2001. — Vol. 87 (9). — P. 1058-63.
63. Plavinik F.L., Rodrigues C.I., Zanella M.T., Ribeiro A.B. Hypokalemia, glucose intolerance, and hyperinsulinemia during diuretic therapy // Hypertension. — 1992. — Vol. 19. — P. II26-II29.
64. Poulter N., Wedel H., Dahlof B. et al. Role of blood pressure and other variables in the differential cardiovascular event rates noted in the Anglo-Scandinavian Cardiac Outcomes Trail-Blood Pressure Lowering Arm // Lancet. — 2005. — Vol. 366. —P. 907-913.
65. PROGRESS Collaborative Group. Randomized trial of a perindopril-based blood-pressure-lowering regimen among 6105 individuals with previous stroke or trancient ischaemic attack // Lancet. — 2001. — Vol. 358. — P. 1033-1041.
66. Rothwell P. Limitations of the usual blood-pressure hypothesis and importance of variability, instability, and episodic hypertension // The Lancet. — 2010. — Vol. 375. — P. 938-948.
67. Shafi T., Appel L.J., Miller E.R. 3rd, Klag M.J., Parekh R.S. Changes in serum potassium mediate thiazide-induced diabetes // Hypertension. — 2008. — Vol. 52. — P. 1022-1029.
68. Sharabi Y., Adler E., Shamis A., Nussinovitch N., Markovitz A., Grossman E. Efficacy of addon aldosterone receptor blocker in uncontrolled hypertension // Am. J. Hypertens. — 2006. — Vol. 19. — P. 750-755.
69. Siscovick D., Raghunathan T., Psaty B. et al. Diuretic Therapy for Hypertension and the Risk of Primary Cardiac Arrest // N. Engl. J. Med. — 1994. — Vol. 330. — P. 1852-1857.
70. Smithe S., Benjamin A., Bonow R. et al. AHA/ACCF Secondary Prevention and risk Reduction Therapy for patients with coronary and other atherosclerotic vascular disease: 2011 update: a guildeline from the American Heart Association and American College of Cardiology Foundation // Circulation. — 2011. — Vol. 124. — P. 00-00.
71. Solomon S.D., Rice M.M., A Jablonski K. et al. Renal function and effectiveness of angiotensin-converting enzyme inhibitor therapy in patients with chronic stable coronary disease in the Prevention of Events with ACE inhibition (PEACE) trial // Circulation. — 2006. — Vol. 114. — P. 26-31.
72. Stears A.J., Woods S.H., Watts M.M. et al. A double-blind, placebo-controlled, crossover trial comparing the effects of amiloride and hydrochlorothiazide on glucose tolerance in patients with essential hypertension // Hypertens. — 2012. — Vol. 59. — P. 934-942.
73. Svensson P., de Faire U., Sleight P. Comparative effects of ramipril on ambulatory and office blood pressure: a HOPE substudy // Hypertension. — 2001. — Vol. 38. — P. 28-32.
74. Task Force Members. The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2008 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association of the ESC (HFA) and endorsed by the European Society of Intensive Care Medicine (ESICM) // European Heart Journal. — 2008. — Vol. 29. — P. 2388-2442.
75. The CAFE Investigators, for the Anglo-Scandinavian Cardiac Outcomes Trail (ASCOT) Investigators, CAFE Steering Committee and Writing Committee. Differential Impact of Blood Pressure-Lowering Drugs on Cantral aortic Pressure and Clinical Outcomes: Principal Results of the Conduit Artery Function Evaluation (CAFE) Study // Circulation. — 2006. — Vol. 113. — P. 1213-1225.
76. The PEACE Trial Investigators. Angiotensin-converting–enzyme inhibition in stable coronary artery disease // N. Engl. J. Med. — 2004. — 351. — 2058-2068.
77. The Task Force on ACE-inhibitors of the European Society of Cardiology. Expert consensus document on angiotensin converting enzyme inhibitors in cardiovascular disease // European Heart Journal. — 2004. — Vol. 25. — P. 1454-1470.
78. The Task force on the Management of Stable Angina Pectoris of the European Society of Cardiology. Guildelines on the management of stable angina pectoris // European Heart Journal. doi:10.1093/eurheartj/ehj001
79. Verdecchia P., Reboldi G., Angeli F. et al.Adverse prognostic significance of new diabetes in treated hypertensive subjects // Hypertension. — 2004. — Vol. 43. — P. 963-969.
80. Vermes E., Ducharme A., Bourassa M.G. et al. Enalapril reduces the incidence of diabetes in patients with chronic heart failure. Insight from the studies of left ventricular dysfunction (SOLVD) // Circulation. — 2003. — Vol. 107. — P. 1291-1296.
81. Wald D., Law M., Morris J. et al. Combination Therapy Versus Monotherapy in Reducing Blood Pressure: Meta-analysis on 11,000 Participants from 42 Trials // Am. J. Med. — 2009. — Vol. 122. — P. 290-300.
82. Weber M.A., Julius S., Kjeldsen S.E. et al. Blood pressure dependent and independent effects of antihypertensive treatment on clinical values in the VALUE trial // Lancet. — 2004. — Vol. 363. — P. 2047-2049.
83. Wing L.M., Reid C.M., Ryan P. et al. A comparison of outcomes with angiotensin-converting-enzyme inhibitors and diuretics for hypertension in the elderly // N. Engl. J. Med. — 2003. — Vol. 348. — P. 583-592.
84. Yusuf S. From the HOPE to the ONTARGET and the TRANSCEND studies: challenges in improving prognosis // Am. J. Cardiol. — 2002. — Vol. 89. — P. 18A-25A.
85. Yusuf S., Sleight P., Pogue J. et al. Effects of an angiotensin-converting-enzyme inhibitor, ramipril on cardiovascular events in high-risk patients. The Heart Outcomes Prevention Evaluation Study Investigators // New Engl. J. Med. — 2000. — Vol. 342. — P. 145-153.
86. Zuanetti G., Latini R., Maggioni A.P. et al. Effect of the ACE inhibitor lisinopril on mortality in diabetic patients with acute myocardial infarction: data from the GISSI-3 study // Circulation. — 1997. — Vol. 96. — P. 4239-4245.