Журнал «Медицина неотложных состояний» 6 (61) 2014
Вернуться к номеру
Современные позиции применения холинергической терапии в анестезиологии и реаниматологии
Авторы: Галина Бут
Рубрики: Медицина неотложных состояний
Разделы: Медицинские форумы
Версия для печати
Статья опубликована на с. 55-60
2–4 октября в санаторном комплексе «Пуща-Озерная» состоялась научно-практическая конференция «Актуальные вопросы анестезиологии и интенсивной терапии», посвященная 40-летию создания кафедры анестезиологии и интенсивной терапии Национального медицинского университета имени А.А. Богомольца.
В ходе конференции широко освещались и обсуждались перспективы применения холинергической терапии. Коррекции холинергической недостаточности при нарушении функции мозга был посвящен доклад член-корреспондента НАМН Украины, заведующего кафедрой анестезиологии, интенсивной терапии, медицины неотложных состояний Донецкого национального медицинского университета им. М. Горького, доктора медицинских наук, профессора В.И. Черния.
Холинергическая система в организме человека обеспечивает ряд жизненно необходимых функций, и поэтому в настоящее время холинергическую недостаточность рассматривают как основную причину развития когнитивных нарушений и деменции. Снижение концентрации ацетилхолина ведет к ремоделированию синапсов, уменьшению плотности рецепторов, дегенерации структур головного мозга, прогрессированию когнитивной дисфункции. Снижение выработки ацетилхолина и блокада синтеза фосфатидилхолина может привести к гибели клетки. Потеря 10 % клеточной мембраны опасна для жизнеспособности клеток (Klein J. // J. Neural Transm., 2000).
Для коррекции холинергической недостаточности на сегодняшний день активно применяют препараты, действие которых направлено на преодоление последней. К таким препаратам относятся предшественники холина — лецитин, цитиколин и холина альфосцерат (Глиатилин). Предшественники холина используются в лечении многих неврологических заболеваний, включая ишемический и геморрагический инсульт, черепно-мозговую травму. Накоплена крупнейшая доказательная база в отношении применения препаратов данной группы (Saver J.L., UCLA Stroke Center and Department of Neurology, David Geffen School of Medicine at UCLA, Los Angeles, CA, USA, 2010).
Глиатилин обладает несомненным преимуществом, так как не имеет равных в восстановлении уровня ацетилхолина в головном мозге (Parnetti L., 2001). Принципиальным отличием холина альфосцерата от всех других предшественников холина является способность нормализовать уровень ацетилхолина в острой ситуации — от холина Глиатилин отделяет одна неэнергозатратная реакция, в то время как цитиколин — пять энергозатратных. Именно потому центральный холинергический препарат Глиатилин обладает не только мембраностабилизирующими и противоотечными свойствами, но и пробуждающим эффектом у пациентов в коматозных состояниях.
Глиатилин широко применяется при нарушениях сознания (оглушение — кома), острой церебральной патологии, в частности при остром нарушении мозгового кровообращения (инсульт, транзиторные ишемические атаки), черепно-мозговой травме, остром токсическом повреждении головного мозга, при хронической церебральной патологии: хронической цереброваскулярной недостаточности (энцефалопатии и деменции различного генеза), сдавлении головного мозга. Спектр применения препарата Глиатилин включает и ятрогенные состояния, к которым относят интраоперационную ишемию головного мозга и наркоз, а также патологию периферической нервной системы.
В 2014 году опубликованы данные первых двух лет терапии исследования ASCOMALVA. В нем приняло участие 210 пациентов с ишемическим поражением головного мозга и болезнью Альцгеймера. Пациенты основной группы получали донепезил в дозе 10 мг/сут и холина альфосцерат в дозе 1200 мг/сут, в группе сравнения назначали донепезил в дозе 10 мг/сут. Критериями включения в исследование были возраст 56–91 год (средний возраст — 75 лет), показатели по шкалам MMSE 15–24 балла и ARWMC > 2 баллов, а также наличие по меньшей мере двух факторов сосудистого риска (артериальная гипертензия, сахарный диабет, ожирение, ишемическая болезнь сердца, наличие в семейном анамнезе случаев кардио- или цереброваскулярных заболеваний).
Показатели психометрических тестов по шкалам MMSE и ADAS-cog уже на 3-м месяце исследования продемонстрировали существенное расхождение в полученных данных между группами. В группе пациентов, получавших терапию донепезилом, отмечено динамическое ухудшение показателей, тогда как лечение в основной группе препятствовало ухудшению оценок по шкалам MMSE и ADAS-cog. Эффект лечения на основе препарата Глиатилин в отношении показателей психометрических тестов характеризовался статистической значимостью как после года, так и после двух лет терапии.
При этом по показателям нейропсихиатрического опросника, который определяет степень тяжести состояния пациента (NPI-F), выявлено достоверное улучшение в группе препарата Глиатилин. Полученные в исследовании ASCOMALVA данные позволили сделать выводы о том, что восстановление холинергических связей играет важную роль в реабилитации пациентов с цереброваскулярной патологией. Данное исследование доказало положительное влияние препарата Глиатилин на неврологический дефицит после инсульта, даже у пациентов с исходным когнитивным дефицитом, на способность сохранять речь, мышление и движение, восстанавливать социальную активность и способность к самообслуживанию после перенесенного инсульта (рис. 1).
На базе Донецкого национального медицинского университета им. М. Горького и КМУ «Клиническая Рудничная больница» проведено исследование, целью которого было изучение пробуждающего эффекта препарата Глиатилин (холина альфосцерат) у пациентов с полиэтиологическим поражением центральной нервной системы (ЦНС). Были выбраны три группы пациентов: с острым нарушением мозгового кровообращения по ишемическому типу, тяжелой черепно-мозговой травмой и токсическим поражением ЦНС.
В первую клиническую группу вошли 75 пациентов (38 женщин и 37 мужчин) в возрасте от 58 до 74 лет (средний возраст 65,9 ± 4,1 года), которые находились в отделении анестезиологии и интенсивной терапии (ОАиИТ) с диагнозом острого нарушения мозгового кровообращения по ишемическому типу. Вторую клиническую группу составили больные (n = 51, 30 мужчин и 21 женщина) в возрасте от 37 до 54 лет (средний возраст 42,0 ± 5,7 года), которые находились в ОАиИТ с диагнозом тяжелой черепно-мозговой травмы. В третью клиническую группу были включены 66 пациентов (22 женщины и 44 мужчины) в возрасте от 21 до 58 лет (средний возраст 40,2 ± 6,8 года), которые находились в ОАиИТ с диагнозом острого бытового отравления неустановленным веществом (алкоголь, суррогаты алкоголя). В каждой группе была проведена рандомизация слепым методом по виду терапии на подгруппы. В подгруппе А (1, 2, 3) проводилось протокольное лечение согласно приказам Министерства здравоохранения Украины, а в подгруппе В (1, 2, 3) к стандартной терапии добавляли холина альфосцерат в дозе 1000 мг 2 раза в сутки.
Верификация диагноза проводилась по данным нейровизуализации на компьютерном томографе Siemens Somatom Spirit и по данным транскраниальной допплерографии на аппарате EZdop. Всем больным выполнялась электрокардиография в динамике, мониторировались показатели артериального давления, частоты дыхания, пульс, температура тела, диурез, уровень гликемии, сатурация капиллярной крови кислородом. Объективизация уровня сознания выполнялась по шкале комы Глазго (ШКГ) и шкале NIHSS.
Результаты данной работы свидетельствуют о том, что включение в стандартную терапию холина альфосцерата достоверно повышает скорость восстановления сознания (ШКГ), скорость регрессии неврологической симптоматики (NIHSS), восстановление линейной скорости кровотока у больных с полиэтиологическим поражением ЦНС (рис. 2).
Клинический интерес представляют данные о применении препарата Глиатилин в анестезиологической практике. Хорошо известно, что длительный выход из анестезии и замедленное восстановление сознания иногда называют послеоперационной комой. Послеоперационные расстройства сознания Дж.К. Денлингер (1985) связывает с тремя основными факторами: длительным действием анестетиков, метаболической энцефалопатией и неврологическими нарушениями. Причинами неврологических изменений, в том числе и длительного восстановления сознания, являются ишемия мозга, внутричерепная гипертензия и отек мозга, внутричерепное кровоизлияние. На сегодняшний день практически все средства для наркоза приводят к изменению перфузии мозга и изменению внутричерепного давления. Труднее всего восстановить сознание после наркоза длительностью более 3 часов, при наличии тяжелой сопутствующей патологии (артериальная гипертензия, ишемическая болезнь сердца, нарушения сердечного ритма, сахарный диабет, гипотиреоз), ожирения и анемии, у пациентов, возраст которых превышает 65 лет.
Введение препарата Глиатилин для ускорения восстановления сознания показано при анестезиях продолжительностью более 3 часов, после выполнения лапароскопических оперативных вмешательств, операций с длительным (более 60–90 мин) вынужденным положением больных (положение Тренделенбурга, положение на боку с опущенным головным концом), после проведения наркоза у пациентов старше 65 лет, а также у больных с тяжелой эндогенной интоксикацией любого генеза.
При сравнении восстановления функций в раннем послеоперационном периоде при комбинированной тотальной внутривенной анестезии (ТВВА) и введении препарата Глиатилин в дозе 2000 мг внутривенно капельно в момент накладывания швов на кожу во время оперативных вмешательств на органах брюшной полости у 55 пациентов в возрасте 75 ± 15 лет показано, что восстановление сознания, дыхания, мышечного тонуса и экстубация пациентов происходили намного раньше, чем в группе ТВВА.
Пробуждающий эффект препарата Глиатилин связан с восстановлением физиологического уровня ацетилхолина, что приводит к восстановлению высших корковых функций (речь, память, мышление), а также обусловлен стимуляцией нервно-мышечной проводимости, способствуя снижению двигательных нарушений (параличи и парезы), улучшением передачи нервного импульса на уровне синаптической щели. Назначение препарата Глиатилин способствует повышению уровня сознания пациента, ранней активации больного, что значительно снижает частоту инвалидизации и повышает способность к самообслуживанию.
Особенности клиники, диагностики и лечения инсульта в вертебробазилярном бассейне обсуждались в докладе доцента кафедры неврологии № 1 НМАПО им. П.Л. Шупика, кандидата медицинских наук М.А. Трещинской.
В настоящее время инсульт является серьезной медико-социальной проблемой, оставаясь одной из причин инвалидизации лиц старческого возраста и основной причиной смертности во всем мире. Особую актуальность представляет инсульт в вертебробазилярном бассейне, симптомы которого зачастую не укладываются в классическую картину инсульта. Причинами развития инсульта в вертебробазилярном бассейне являются атеросклероз, вертеброгенное повреждение и диссекция позвоночной артерии, патология мелких сосудов (диаметром 50–200 µm) — липогиалиноз, который обычно ассоциируется с артериальной гипертензией и приводит к ослаблению сосудистой стенки, а это служит причиной мелких кровоизлияний.
С инсультом в вертебробазилярном бассейне связан ряд факторов риска, таких как возраст, семейный анамнез, раса, инсульт в анамнезе, артериальная гипертензия, коронарогенные и некоронарогенные заболевания сердца, сахарный диабет, курение, ожирение, гиподинамия, алкогольная или лекарственная зависимость (Archer C.R., Horenstein S., 1977).
Клинически инсульты в вертебробазилярном бассейне имеют ряд характеристик, отличающих их от каротидных инсультов. В первую очередь инсульт в вертебробазилярном бассейне проявляется патологией черепно-лицевых нервов, что не характерно для инсультов в других бассейнах. Имеют место клинические проявления поражения черепных нервов или их ядер ипсилатерально очагу и контралатеральное поражение конечностей в результате повреждения кортикоспинального тракта. При инсульте в вертебробазилярном бассейне определяются признаки поражения мозжечка (дисметрия, атаксия), а вовлечение восходящих сенсорных путей приводит к чувствительным нарушениям. Возникают дизартрия и дисфагия, головокружение, тошнота и рвота наряду с нистагмом. При поражении ствола головного мозга возникает унилатеральный синдром Горнера. Очаги в затылочных долях приводят к нарушению полей зрения и зрительно-пространственному дефициту, тогда как корковые нарушения, такие как афазия и выраженный когнитивный дефицит, отсутствуют (Archer C.R., Horenstein S., 1977).
Окклюзия основной артерии при инсульте в вертебробазилярном бассейне заканчивается летальным исходом более чем в 75–80 % случаев. При поражении крупных сосудов большинство пациентов, которые выжили, имеют мультисистемную дисфункцию (например, тетраплегию или гемиплегию, атаксию, дисфагию, дизартрию, патологию взора, краниальные нейропатии), тогда как у пациентов с небольшими очагами — доброкачественный прогноз с достаточным функциональным восстановлением (Vladimir Kaye, 2013).
Клинические проявления инсульта в вертебробазилярном бассейне, такие как головокружение, головная боль, тошнота, рвота, нарушение сознания, нарушение глазодвигательных функций (нистагм, диплопия, нарушение зрачковых реакций, отклонение взора в сторону), слабость ипсилатеральных черепных нервов (дизартрия, дисфагия, дисфония, слабость лицевой мускулатуры и языка), нарушение чувствительности (на лице и скальпе), атаксия, контралатеральные двигательные расстройства (гемипарез, квадрипарез), потеря болевой и температурной чувствительности, нарушение полей зрения, центральные боли, нарушение глотания, потливость в области лица и конечностей, должны сочетаться для того, чтобы врач заподозрил неотложное состояние (Schneider J.I., Olshaker J.S., 2012). У более чем 70 % пациентов с инсультом в вертебробазилярном бассейне наблюдаются нарушение сознания, гемипарез или квадрипарез, обычно асимметричный; нарушение зрачковых реакций и глазодвигательных функций, ипсилатеральное отклонение взора в сторону или парез взора; бульбарные нарушения, такие как дисфония, дисфагия, дизартрия и слабость лицевых мышц, развиваются более чем у 40 % пациентов, а также глазной боббинг (периодические быстрые движения глазных яблок вниз и быстрое возвращение их в исходную позицию), свидетельствующий о поражении моста; атаксия, тремор, ассоциирующийся с умеренным гемипарезом.
Таким образом, основными особенностями инсульта в вертебробазилярном бассейне являются нестабильные или флюктуирующие неврологические симптомы, снижение уровня сознания, гемодинамическая нестабильность, а также дыхательные нарушения.
Инсульт в вертебробазилярном бассейне может осложняться аспирационной пневмонией, тромбозом глубоких вен нижних конечностей, развитием тромбоэмболии легочной артерии (ТЭЛА) и инфаркта миокарда.
Дифференциальную диагностику инсульта в вертебробазилярном бассейне проводят с различными несосудистыми патологическими процессами: центральным понтинным миелинолизом, метастазами в головной мозг, субарахноидальным кровоизлиянием, базилярным менингитом, базилярной мигренью, опухолью мостомозжечкового угла, супратенториальным полушарным процессом с масс–эффектом, дислокацией и компрессией ствола мозга.
Лечение инсульта данной локализации в остром периоде заключается в адекватной коррекции гемодинамики, проведении респираторной поддержки, туалета дыхательных путей, профилактике аспирации, мониторинге инфекционных осложнений, контроле базисных показателей (температура тела, уровень глюкозы), профилактике тромбоза вен нижних конечностей и ТЭЛА. Выполнение тромболизиса противопоказано при снижении уровня сознания (сопор — кома), что часто встречается при окклюзии базилярной артерии.
Поэтому на сегодняшний день если такой пациент выживает, то основные реабилитационные мероприятия заключаются в проведении физической терапии (обучение движениям, мобильности в новых условиях; тренировка вестибулярного аппарата, орофарингеальных мышц и т.д.), трудотерапии (подготовка к повседневной активности — купание, одевание и т.д.), восстановлении речи (Speech therapy), курортотерапии (Recreational therapy), а также нейропсихологической реабилитации, которая заключается в выявлении и коррекции депрессии, снижении скорости прогрессирования когнитивных нарушений. На сегодняшний день залогом эффективного восстановительного лечения и реабилитации пациентов с инсультом является воздействие на холинергическую систему.
Холинергическая система, тесно взаимодействуя с дофаминергической, глутаматергической, ГАМК-ергической как по синергическим, так и по антагонистическим принципам, обеспечивает поддержание уровня сознания, спонтанную двигательную активность, эмоциональное поведение, память и волевые акты. Нарушения функции холинергической системы возникают при болезни Альцгеймера, дефиците тиамина, алкогольной интоксикации, наследственном дефиците пируватдегидрогеназы и клинически проявляются психоневрологической симптоматикой (агнозия, апраксия, афазия), повышенной возбудимостью (судорожный синдром, атаксия), мышечной слабостью и нарушениями чувствительности. Маркерами поражения холинергической системы являются изменение концентрации холинацетилтрансферазы (choline acetyltransferase), повышение захвата холина и изменение плотности рецепторов к ацетилхолину в пораженных зонах головного мозга. Классический механизм развития холинергической недостаточности укладывается в патогенез гипоксии, когда происходит снижение утилизации глюкозы и угнетение метаболизма кислорода в головном мозге, что приводит к недостаточной продукции ацетил-КоА, необходимого не только для образования энергии, но и для синтеза ацетилхолина — одного из важнейших медиаторов нервной системы, обеспечивающего передачу импульса с нерва на мышечное волокно, а также обязательного медиатора ретикулярной формации, что обеспечивает потенциацию коры головного мозга. Именно поэтому восстановление синтеза ацетилхолина в организме пациента, находящегося в критическом состоянии, путем введения экзогенного холина будет способствовать нормализации содержания ацетилхолина, восстановлению нейротрансмиссии в очаге поражения, а также препятствовать разрушению клеточных мембран. Именно поэтому в данном аспекте наиболее интересен Глиатилин, который восполняет дефицит ацетилхолина, оказывает положительное воздействие на мембранную эластичность и функцию рецепторов, что улучшает синаптическую трансмиссию. Благодаря стабилизирующему действию на мембраны и нейрорецепторы Глиатилин обладает противоотечными свойствами и уменьшает отек мозга.
В течение последних двух десятков лет клиническая эффективность и переносимость препарата Глиатилин были изучены в целом ряде клинических исследований, наиболее крупным из которых является многоцентровое исследование с участием 2058 пациентов, проведенное S.G. Barbagallo et al. Терапия начиналась не позднее 10 дней после инсульта или транзиторной ишемической атаки. Достоверное уменьшение когнитивных и двигательных нарушений наблюдалось уже после первого месяца терапии препаратом Глиатилин, и по мере продолжения лечения эффективность препарата Глиатилин возрастала (рис. 3).
/58/58.jpg)
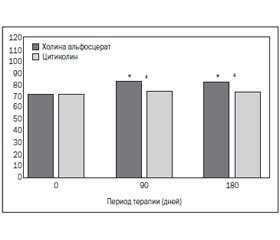
В Италии было проведено многоцентровое открытое рандомизированное контролируемое клиническое исследование (Muratorio А. et al., 1992) с целью сравнительной оценки эффективности и переносимости предшественников холина — холина альфосцерата и цитиколина, используемых в дозе 1 г/сут внутримышечно, у 112 пациентов, страдающих мультиинфарктной деменцией. После 90-дневного периода лечения пациенты находились под наблюдением в течение еще 90 дней без терапии для контроля продолжительности сохранения результатов. Исследование определило, что лечение холина альфосцератом было значительно эффективнее, чем терапия цитиколином. Глиатилин обладает лучшим нейромедиаторным действием и оказывает положительное влияние на память, когнитивные и поведенческие функции. Результаты терапии сохранялись по истечении 3-месячного периода после прекращения терапии в отличие от таковых при использовании цитиколина (рис. 4–7).
Таким образом, Глиатилин улучшает синаптическую нейротрансмиссию, защищает мозг от повреждения и улучшает состояние при когнитивных, сенситивных и двигательных расстройствах.
Возможности холинергической стратегии в практике интенсивной терапии и анестезиологии были представлены в докладе заведующего отделением анестезиологии и интенсивной терапии клинической больницы «Феофания» Г.П. Пасечника.
Известно, что ацетилхолин был открыт в 1914 году Генри Халлетом Дейлом по его воздействию на миокард. Отто Леви подтвердил нейротрансмиттерное действие ацетилхолина и дал ему название «вагусштоф» (vagusstoff). Оба ученых получили Нобелевскую премию по медицине за свою работу в 1936 году. Ацетилхолин синтезируется в цитоплазме окончаний холинергических нейронов. Он образуется из холина и ацетил-коэнзима А (митохондриального происхождения) при участии цитоплазматического фермента холинацетилтрансферазы. На долю ацетилхолина в ткани мозга как нейромедиатора приходится 10 %.
Предшественниками холина являются лецитин, холина альфосцерат и цитиколин. Глиатилин содержит более 40 % метаболически защищенного холина, который проникает через гематоэнцефалический барьер и служит основным источником для синтеза ацетилхолина в нейронах мозга. Благодаря свойству препарата устранять холинергическую недостаточность Глиатилин широко применяется при таких патологических состояниях, как нарушения сознания (сопор, кома), инсульт и черепно-мозговая травма.
В отделении реанимации и интенсивной терапии клинической больницы «Феофания» Глиатилин применяется при стволовом инсульте, в период восстановительной терапии острого нарушения мозгового кровообращения после проведения тромболитической терапии, в восстановительном периоде тяжелой черепно-мозговой травмы, при длительной общей анестезии во время нейрохирургического оперативного вмешательства, а также в лечении постреанимационной болезни. При восстановительной терапии острого нарушения мозгового кровообращения препарат назначается со 2-х суток после проведения тромболитической терапии.
Согласно результатам исследования International Study of Postoperative Cognitive Dysfunction, проведенного в 2 этапа (1994–1998 и 1998–2000 гг.), в котором анализировались случаи оперативных вмешательств под наркозом, в том числе нейрохирургические оперативные вмешательства, ранняя послеоперационная когнитивная дисфункция наблюдалась у 35 % больных младше 40 лет и у 69 % больных старше 60 лет. При этом устойчивая когнитивная дисфункция отмечена у 67 % лиц молодого и 24 % — пожилого возраста.
По данным Н.А. Шнайдер (2007), при проведении у 20 здоровых добровольцев магнитно-резонансной томографии под наркозом без оперативного вмешательства было выявлено снижение перфузии крови во фронтальной коре, височной доле и гиппокампе. Поэтому при длительных оперативных вмешательствах пациентам рекомендовано: после завершения операции непосредственно перед экстубацией введение препарата Глиатилин в дозе 1 г внутривенно, в раннем послеоперационном периоде введение препарата в дозе 1 г повторяют, при переводе пациента в отделение рекомендуется переход на пероральный прием препарата в течение 3–6 месяцев.
Эффект восстановления сознания связан со способностью препарата Глиатилин стимулировать выделение ацетилхолина из пресинаптических терминалей уже в первые минуты после введения. Применение препарата Глиатилин при коматозных состояниях, особенно при стволовых поражениях мозга, способствует не только повышению уровня сознания и ускорению выхода больных из комы, но и восстановлению высших корковых функций: мышления, памяти, речи (рис. 8).
В метаанализе 14 клинических исследований с участием 4315 пациентов (Amenta F., 2010) степень выраженности побочных эффектов препарата Глиатилин была определена как отсутствие значимых неблагоприятных событий. Терапевтические эффекты препарата Глиатилин направлены на коррекцию нарушений высших корковых функций. Эти эффекты включают восстановление концентрации внимания и памяти, улучшение умственной и физической работоспособности, эмоционального состояния больных, улучшение когнитивных функций.
Таким образом, холина альфосцерат (Глиатилин) является непосредственным участником процессов передачи нервных импульсов в холинергических нейронах головного мозга, ускоряет восстановление ткани головного мозга, улучшает метаболизм. Клинически Глиатилин оказывает пробуждающий эффект, улучшает когнитивные, эмоциональные и поведенческие функции. Препарат восстанавливает сниженный уровень сознания у пациентов в анестезиологической и реанимационной практике.

/56/56.jpg)
/59/59.jpg)
/60/60.jpg)