Журнал "Гастроэнтерология" 4 (54) 2014
Вернуться к номеру
Стеатоз печени и стеатогепатит — неизбежность смешанного генеза
Авторы: Степанов Ю.М. - ГУ «Институт гастроэнтерологии НАМН Украины», г. Днепропетровск
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
Представлен анализ этиологических и патогенетических механизмов формирования стеатоза и стеатогепатита смешанного генеза. Показано, что одним из основных этиопатогенетических факторов развития стеатоза печени и стеатогепатита остается алкоголь, роль которого прослеживается у 46–65 % пациентов. Накоплены убедительные данные, свидетельствующие о том, что ожирение, инсулинорезистентность представляют собой факторы прогрессирования стеатоза и стеатогепатита алкогольной, неалкогольной и смешанной этиологии. Одновременное влияние нескольких этиологических факторов приводит к незамедлительному развитию стеатоза и стеатогепатита у 95 % пациентов. Многие триггерные факторы можно рассматривать как взаимодополняющие факторы поражения печени смешанного генеза. Приведены общие подходы к диагностике, лечению, представлены основные группы лекарственных препаратов для коррекции стеатоза и стеатогепатита смешанного генеза.
Наведений аналіз етіологічних і патогенетичних механізмів формування стеатозу і стеатогепатиту змішаного генезу. Показано, що одним з основних етіопатогенетичних факторів розвитку стеатозу печінки і стеатогепатиту залишається алкоголь, роль якого простежується у 46–65 % пацієнтів. Накопичені переконливі дані, які свідчать про те, що ожиріння, інсулінорезистентність є факторами прогресування стеатозу і стеатогепатиту алкогольної, неалкогольної і змішаної етіології. Одночасний вплив декількох етіологічних факторів приводить до негайного розвитку стеатозу і стеатогепатиту у 95 % пацієнтів. Багато тригерних факторів можливо розглядати як взаємодоповнюючі чинники ураження печінки змішаного генезу. Наведені загальні підходи до діагностики, лікування, подані основні групи лікарських препаратів для корекції стеатозу і стеатогепатиту змішаного генезу.
The analysis of the etiological and pathogenetic mechanisms of formation steatosis and steatohepatitis of mixed genesis is presented. It is shown that alcohol remains one of the main etiopathogenetic factors in the development of the hepatic steatosis and steatohepatitis, the role of which is observed in 46–65 % patients. There are strong evidence confirming that the obesity and insulin resistance are the independent factors of progression of steatosis and steatohepatitis of alcoholic, non-alcoholic and mixed etiology. The simultaneous influence of several etiological factors leads to the immediate development of steatosis and steatohepatitis in 95 % patients. Many trigger factors can be considered as complementary factors of liver damage of mixed genesis. Common approaches to the diagnosis, treatment, and the main group of drugs for the correction of steatosis and steatohepatitis of mixed origin are presented.
стеатоз, стеатогепатит, алкоголь, ожирение, инсулинорезистентность, этиопатогенез, диагностика, коррекция.
стеатоз, стеатогепатит, алкоголь, ожиріння, інсулінорезистентність, етіопатогенез, діагностика, корекція.
steatosis, steatohepatitis, alcohol, obesity, insulin resistance, etiopathogenesis, diagnosis, correction.
Статья опубликована на с. 136-142
/136/136.jpg)
Термины «стеатоз печени» (СП) и «стеатогепатит» (СГ) в настоящее время все чаще употребляются для описания гетерогенной группы патологических изменений печени, характеризующихся жировой дистрофией гепатоцитов или воспалительной инфильтрацией на фоне жировой дистрофии гепатоцитов. Основным этиопатогенетическим фактором развития стеатоза печени и стеатогепатита остается алкоголь, роль которого прослеживается у 46–65 % пациентов. Накоплены убедительные данные, свидетельствующие о том, что ожирение, инсулинорезистентность представляют собой факторы прогрессирования СП и СГ алкогольной и неалкогольной этиологии. Ожирению в развитии стеатогепатитов отводят около 76 % [1, 3, 22, 27, 36]. Одновременное влияние нескольких факторов, таких как алкоголь и ожирение, приводит к незамедлительному развитию СП и СГ у 95 % пациентов. В связи с этим сегодня алкоголь, ожирение, инсулинорезистентность рассматривают как взаимодополняющие факторы поражения печени смешанного генеза [2, 6].
Данных о распространенности СП и СГ смешанной этиологии на сегодняшний день нет. Одинаково актуальными и достаточно распространенными являются и алкогольные, и неалкогольные поражения печени. Имеющиеся в литературе сведения о распространенности этих диффузных патологических процессов являются вариабельными. Распространенность неалкогольных СП и СГ в странах Западной Европы составляет 20–30 %, в странах Азии — 15 % [7, 19, 25]. Алкогольные гепатиты, начальным этапом которых является стеатоз, составляют до 50 % всех случаев цирроза печени [32, 37, 41]. В то же время, по статистическим данным, до 40 % циррозов печени классифицируются как криптогенные [8, 20]. О том, что криптогенный цирроз — результат неалкогольного СГ, может свидетельствовать сопутствующее ожирение, сахарный диабет 2–го типа и дислипидемия [4, 9, 12, 16, 33]. Частота развития цирроза печени при неалкогольном СГ меньше, чем при алкогольном, и составляет примерно 5–13 % от всех считающихся криптогенными циррозов печени [26, 40].
Граница между метаболическим (неалкогольным) и алкогольным стеатогепатитом четко не определяется [1, 2]. Это связано со многими факторами:
— гепатотоксическая доза этанола вариабельна (20–80 г этанола в сутки);
— сообщаемое количество употребляемого алкоголя может быть в несколько раз меньше реального;
— проявления гепатотоксического действия алкоголя зависят от факторов прогрессирования неалкогольного (метаболического) стеатогепатита.
Понятия СП и СГ являются этиологически неоднородными. Выделяют случаи первичного и вторичного СП и СГ. Первичные СП и СГ наиболее часто ассоциированы с эндогенными нарушениями липидного и углеводного обмена (ожирение, сахарный диабет 2-го типа, гиперлипидемия). Вторичные СП и СГ индуцируются внешними воздействиями и развиваются в результате некоторых врожденных метаболических расстройств, злоупотребления алкоголем, приема ряда медикаментов, синдрома мальабсорбции, длительного парентерального питания, голодания, синдрома избыточного бактериального роста, липодистрофии [8, 24].
Важно помнить, что у одного пациента могут присутствовать одновременно несколько первичных и вторичных факторов риска СГ. Наиболее часто к этим факторам относят алкоголь и этиопатогенетические факторы неалкогольного СГ, при этом оценить относительный вклад каждого из факторов представляется возможным далеко не всегда (рис. 1).
Одновременно при СП алкогольного генеза и неалкогольной жировой дистрофии печени четко прослеживается патологическая негативная динамика патологических процессов: СП переходит в СГ, потом в фиброз, а затем в цирроз печени [18, 23, 28].
Течение и прогноз СП и СГ смешанного генеза во многом определяет наличие факторов прогрессирования:
— высокая степень ожирения;
— гипертриглицеридемия;
— декомпенсация сахарного диабета;
— повышение активности печеночных ферментов крови;
— пожилой возраст.
Механизм трансформации стеатоза в стеатогепатит включает ряд патогенетических звеньев, которые имеют много общего как при алкогольном, так и при неалкогольном поражении. В качестве модели патогенеза СП и СГ предложена теория «двух ударов» [31, 39] (рис. 2).
При ожирении, особенно висцеральном, увеличивается поступление в печень свободных жирных кислот (СЖК) и формируется СП, что рассматривается как «первый удар». Избыток СЖК блокирует связывание инсулина гепатоцитами и приводит к развитию инсулинорезистентности на уровне печени. Высокие концентрации СЖК стимулируют липогенез в клетках печени с чрезмерным образованием триглицеридов (ТГ) и синтезом липопротеинов очень низкой плотности. В результате формируется атерогенная дислипидемия с повышением уровня ТГ, мелких плотных липопротеинов низкой плотности и снижением антиатерогенных липопротеинов высокой плотности [12, 31]. Последовательно или одновременно развивается оксидативный стресс — «второй удар» — как следствие разобщения процессов окисления и фосфорилирования под влиянием СЖК, провоспалительных цитокинов. В последние годы сами авторы теории «двух ударов» свидетельствуют о том, что теория устарела. У большинства пациентов «первый удар» так и остается единственным с развитием СП без признаков воспаления, и в этом случае имеет место непрогрессирующий вариант СП [15]. В свою очередь, у больных с СГ оба процесса — стеатоз и воспаление — протекают одновременно. На фоне уменьшения стеатоза могут нарастать признаки гепатита, например, на фоне снижения массы тела. Необходимо учитывать факт, что среди пациентов с СП и СГ, которые не страдают сахарным диабетом, но находятся в состоянии инсулинорезистентности, могут быть больные, которые не имеют избыточной массы тела и не соответствуют минимальным критериям метаболического синдрома [31].
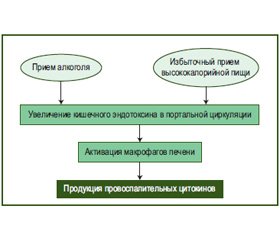
При развитии СП и СГ смешанного генеза необходимо учитывать влияние кишечных эндотоксинов (рис. 3). Вследствие портального кровотока печень получает из кишечника не только нутриенты, но и микробные компоненты: эндотоксины, липополисахариды из бактериальной стенки грамотрицательных бактерий. Активация купферовских клеток липополисахаридами приводит к запуску воспалительного каскада [22].
/138/138.jpg)
Современная патофизиологическая концепция расширяет понимание зоны поражения печени в гепатоците от уже известного повреждения мембраны клетки в целом до появления конкретных дефектов мембран самих клеточных структур. Кроме клеточной мембраны повреждаются мембранные структуры митохондрий. Наиболее изучено повреждение мембран митохондрий при алкогольной болезни печени. Под влиянием этанола и провоспалительных субстанций в митохондриях происходит разобщение окисления и фосфорилирования, значительно нарастает выработка активных форм кислорода. Алкогольиндуцированная продукция цитохрома Р450 2Е1 способствует генерации этих агрессивных молекул [21, 30]. Существуют основания полагать, что митохондриальная дисфункция играет ключевую роль в развитии стеатогепатитов различной этиологии. Развивается порочный круг, который включает в себя процессы перекисного окисления липидов, поражение митохондрий, формирование супероксид-радикалов, истощение антиоксидантной системы и высвобождение цитокинов. Все это, в конечном счете, приводит к некротическому воспалению и фиброгенезу у генетически восприимчивых пациентов [15, 28].
Больные СП и СГ смешанного генеза жалоб, характерных для патологии печени, обычно не предъявляют. Чаще эти пациенты предъявляют жалобы, обусловленные сопутствующей патологией билиарного и желудочно-кишечного трактов [10, 13, 14]. Следует отметить, что у пациентов с СП и СГ смешанного генеза имеются жалобы, которые прежде всего связаны с астеноневротическими проявлениями (общая слабость, повышенная утомляемость, психоэмоциональная лабильность), в последующем могут появляться жалобы диспепсического характера и жалобы на боли в верхних отделах живота, больше выраженные в области правого подреберья [2, 13] (табл. 1). Гепатомегалия определяется в 80–86 %. При СП и СГ смешанного генеза пациенты предъявляют жалобы, обусловленные чаще всего дискинезией желчного пузыря, и жалобы, характерные для функциональной желудочной и кишечной диспепсии.
При СГ смешанного генеза печень умеренно плотная, пальпация ее края вызывает легкую болезненность, воздержание от алкоголя приводит к нормализации размеров. Результаты лабораторных исследований позволяют определить активность цитолитического синдрома, биохимических показателей холестаза, исключить вирусную этиологию. Лабораторные показатели при СГ смешанного генеза зависят от времени, прошедшего с момента употребления алкоголя, и от выраженности печеночного цитолиза. Активность аспартатаминотрансферазы (АсАТ) и аланинаминотрансферазы (АлАТ) может превышать норму в 3–5 раз, увеличиваются уровни гамма-глутамилтранспептидазы (ГГТП) и щелочной фосфатазы (ЩФ). Гипербилирубинемия наблюдается у 20–25 % [8, 31].
Обязательным при постановке диагноза является ультразвуковое исследование (УЗИ). В настоящее время УЗИ печени, помимо размеров, структуры, характера паренхимы, с применением специальной аппаратуры позволяет определить степень жировой инфильтрации и фиброза. Пункционная биопсия позволяет выявить этиологию, определить степень активности воспалительного процесса, определить стадии прогрессирования фиброза, провести верификацию цирроза, оценить эффективность лечения. Морфологические проявления СГ смешанного генеза зависят от превалирования алкогольных или неалкогольных факторов [14] (табл. 2).
Сегодня определены общие подходы к лечению стеатозов и стеатогепатитов смешанного генеза. Какого-либо идеального гепатопротектора до настоящего времени не существует. Доказанной в различной степени эффективностью обладают такие гепатопротекторы, как урсодезоксихолевая кислота (УДХК), эссенциальные фосфолипиды (ЭФЛ), препараты аминокислот (адеметионин, орнитина аспартат) [5, 11, 17, 38].
Основные подходы в лечении СП и СГ смешанного генеза
1. Модификация образа жизни: прекращение или сокращение употребления алкоголя, диетическая коррекция массы тела с применением сбалансированной диеты, снижение калорийности пищи и уменьшение ее объема, повышение двигательной активности (30–40 минут интенсивных физических упражнений или ходьбы в быстром темпе не менее 5–6 раз в неделю).
2. Коррекция трофологического статуса (контроль массы тела, обеспечение организма эссенциальными (незаменимыми) нутриентами — белками, жирами, углеводами, витаминами, которые участвуют во всех жизненно важных процессах организма и в поддержании должного метаболического гомеостаза).
3. Коррекция инсулинорезистентности с применением метформина (группа бигуанидов) и розиглитазона (инсулиновые сенситайзеры). Метформин обеспечивает подавление в печени процесса образования глюкозы с последующим ее выходом в кровяное русло. Розиглитазон уменьшает инсулинорезистентность тканей и устраняет дисфункцию b-клеток поджелудочной железы, секретирующих инсулин [29].
4. Коррекция оксидативного стресса (антиоксиданты, УДКХ, антицитокиновые препараты, гиполипидемические препараты).
5. Коррекция атерогенной дислипидемии (статины, УДКХ). Статины являются наиболее сильнодействующими препаратами, снижающими уровень холестерина. Подавляя синтез холестерина за счет блокады ключевого фермента — ГМГ-КоА-редуктазы, препараты понижают концентрацию холестерина в гепатоцитах. Доказан липидмодифицирующий потенциал наиболее часто применяемых статинов (симвастатина, аторвастатина, розувастатина и питавостатинов). Влияние УДХК на обмен холестерина дает возможность рассматривать ее применение для коррекции липидных нарушений у пациентов с СП и СГ смешанного генеза. Гипохолестеринемический эффект УДХК обеспечивается за счет снижения всасывания холестерина в кишечнике, синтеза холестерина в печени, экскреции холестерина в желчь [12, 34, 35].
При выборе гепатопротекторов в лечении СП и СГ смешанного генеза необходимо выделить несколько основных факторов и этапов.
Основные факторы, которые необходимо учитывать при выборе гепатопротектора:
— причины поражения печени (алкогольные, неалкогольные, смешанные);
— проявления холестатического синдрома (при изменениях уровней ГГТП, АсАт, ЩФ);
— степень активности заболевания (при увеличении АлАТ);
— необходимость проведения антифибротической терапии на протяжении более 6 месяцев.
Основные этапы при выборе гепатопротектора в лечении пациентов с СП и СГ смешанного генеза
Первый этап: установить этиологию поражения печени.
Пациентам с неалкогольными (метаболическими) СП и СГ назначают терапию препаратами a-липоевой кислоты по 600 мг/сутки курсом 1–2 месяца с последующим переходом на УДХК по 10–15 мг/кг массы тела в сутки курсом от 3 до 6 месяцев.
При превалировании алкогольной этиологии у пациентов со смешанным генезом СП и СГ при наличии низкой и умеренной активности процесса применяют УДКХ по 10 мг/кг массы тела 3–4 раза в сутки в течение 3 месяцев в сочетании с внутривенным введением адеметионина или препаратов a-липоевой кислоты на протяжении 10–14 дней. При наличии высокой активности процесса показаны глюкокортикостероиды (преднизолон 30–40 мг с постепенным снижением дозы, возможно сочетание с УДКХ по вышеописанной схеме).
Второй этап: установить наличие или отсутствие синдрома холестаза.
При наличии холестаза назначают адеметионин или УДКХ. При повышении уровня ГГТП и ЩФ лечение начинают с назначения УДХК. Возможно сочетание двух препаратов, которое определяется степенью активности патологического процесса.
Третий этап: определение степени активности процесса.
При сочетании с холестазом назначают адеметионин внутривенно в течение 10–15 дней в сочетании с УДХК в дозе 15 мг/кг массы тела в сутки, затем прием УДКХ продолжают до разрешения цитолиза и холестаза. При отсутствии холестаза на фоне умеренной активности процесса (повышение уровня АлАТ более 3–5 раз по сравнению с нормой) для курсового лечения парентерально применяют ЭФЛ, адеметионин или препараты a-липоевой кислоты. По окончании вышеуказанной терапии для длительного лечения применяют УДКХ 10–15 мг/кг/сутки или ЭФЛ (окончание курса терапии рекомендуется через 1 месяц после нормализации показателей цитолитического синдрома). При высокой активности процесса, особенно в случаях сочетанного генеза, когда имеются одновременно факторы алкогольного и неалкогольного поражения печени, назначают преднизолон 30–40 мг, снижая дозу по 5 мг еженедельно с одновременным применением со 2-й недели УДКХ в дозе 10–15 мг/кг/сутки курсом до 3 месяцев.
Четвертый этап: проведение антифибротической терапии.
Применение антиоксидантов, которые способны ингибировать активацию звездчатых клеток, клеток Купффера, уменьшать активность процессов апоптоза в гепатоцитах. Применяют a-токоферола ацетат 8–10 мг/сутки, УДХК 10 мг/кг/сутки или ЭФЛ курсом до 6 месяцев.
Оценка эффективности этиопатогенетической терапии при стеатозах и стеатогепатитах смешанного генеза должна проводиться комплексно — с применением клинических, лабораторных, инструментальных и в отдельных случаях морфологических методов исследования.
Таким образом, для повышения эффективности диагностики и лечения необходимо владеть современными знаниями о СП и СГ смешанного генеза. Несмотря на многолетнее изучение различных аспектов алкогольной и неалкогольной жировой болезни печени, многое остается неясным. Данная патология является широко распространенной проблемой с многофакторным этиопатогенезом, имеющим патогенетические особенности, которые необходимо учитывать при составлении программы обследования, при назначении этиопатогенетической терапии. Будущие исследования помогут выявить другие, возможно, более значимые факторы патогенеза стеатозов и стеатогепатитов смешанного генеза.
1. Богомолов П.О. Многофакторный генез жировой болезни печени / П.О. Богомолов, А.О. Буеверов // Гепатологический форум. — 2006. — № 4.
2. Буеверов А.О. Многоликий стеатогепатит / А.О. Буеверов // Клинические перспективы в гастроэнтерологии, гепатологии. — 2012. — № 3. — С. 3–9.
3. Буеверов А.О. Патогенетическое лечение неалкогольного стеатогепатита: обоснование, эффективность, безопасность / А.О. Буеверов, П.О. Богомолов, М.В. Маевская // Тер. архив. — 2007. — № 8.
4. Вовк Е.И. Лечение неалкогольной жировой болезни печени в практике терапевта: Что? Где? Когда? / Е.И. Вовк // Русск. мед. журн. — 2011. — Т. 19, № 11. — С. 1038–1046.
5. Гептрал как гепатопротектор выбора в терапии пациентов с заболеваниями печени (по материалам конференции по гастроэнтерологии и гепатологии, 13–15 мая, Италия) // Здоров’я України. — 2011. — № 15–16(268–269). — С. 10–12.
6. Ивашкин В.Т. Эссенциальные фосфолипиды в комплексной терапии стеатогепатита смешанного генеза / В.Т. Ивашкин, А.О. Буеверов, М.В. Маевская, В.С. Ешану // Клинические перспективы в гастроэнтерологии, гепатологии. — 2008. — № 1. — С. 17–22.
7. Павлов Ч. Структура хронических заболеваний печени по данным биопсии и морфологические исследования ее ткани / Ч. Павлов, В.Б. Золотаревский, В.Т. Ивашкин // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. — 2007. — № 1. — С. 90–95.
8. Полунина Т.Е. Неалкогольная жировая болезнь печени: эпидемиология, патогенез, диагностика, лечение / Т.Е. Полунина, И.В. Маев // Consilium medicum. Гастроэнтерология. — 2012. — № 1. — С. 35–40.
9. Семендяева М.Е. Неалкогольная жировая болезнь печени как медицинская и социальная проблема / М.Е. Семендяева // Клин. практика. — 2012. — № 2. — С. 71–80.
10. Степанов Ю.М. Клинические особенности течения неалкогольного стеатогепатита в зависимости от сопутствующих заболеваний / Ю.М. Степанов, А.Ю. Филиппова // Сучасна гастроентерологія. — 2006. — № 3(29). — С. 4–7.
11. Степанов Ю.М. Место «эссенциале форте Н» в терапии неалкогольных стеатогепатитов / Ю.М. Степанов, А.Ю. Филиппова // Сучасна гастроентерологія. — 2006. — № 6(32). — С. 68–73.
12. Степанов Ю.М. Дислипидемия у пациентов с неалкогольным стеатозом печени и билиарной патологией и пути ее коррекции / Ю.М. Степанов, А.Ю. Филиппова // Сучасна гастроентерологія. — 2010. — № 4(54). — С. 46–51.
13. Степанов Ю.М. Особливості перебігу стеатозу печінки та стеатогепатиту неалкогольного та алкогольного ґенезу у хворих із патологією біліарного тракту / Ю.М. Степанов, О.Ю. Філіппова // Український терапевтичний журнал. — 2011. — № 2. — С. 38–44.
14. Степанов Ю.М. Клініко-морфологічні особливості стеатозу печінки та стеатогепатиту неалкогольного та алкогольного ґенезу у хворих із патологією біліарного тракту / Ю.М. Степанов, А.Ю. Филиппова // Новости медицины и фармации. — 2011. — № 367. — С. 7–8.
15. Степанов Ю.М. Стеатоз і стеатогепатит — тригери печінкового фіброгенезу / Ю.М. Степанов, О.Ю. Філіппова // Гастроентерологія. — № 2(48). — 2013. — С. 98–106.
16. Степанов Ю.М. Неалкогольна жирова хвороба печінки і атерогенна дисліпідемія (сучасні підходи до діагностики і лікування) / Ю.М. Степанов, О.Ю. Філіппова // Методичні рекомендації МОЗ України. — Київ, 2013. — С. 36.
17. Федоськина Е.А. Применение урсодезоксихолевой кислоты при неалкогольном и алкогольном стеатогепатите / Е.А. Федоськина, М.В. Маевская // Рос. журн. гастроэнтерол., гепатол., колопроктол. — 2010. — № 3. — С. 1–7.
18. Хомерики С.Г. Алкогольная болезнь печени: механизмы развития, морфологические проявления, дифференциальная диагностика и патогенетические подходы к терапии / С.Г. Хомерики, Н.М. Хомерики // Consilium medicum. Гастроэнтерология. — 2012. — № 1. — С. 27–34.
19. Цуканов В.В. Распространенность и факторы риска развития неалкогольной жировой болезни печени у взрослого городского населения Сибири (Результаты открытого многоцентрового проспективного исследования DIREG_L_01903) / В.В. Цуканов, Э.В. Лукичева, Ю.Л. Тонких и др. // Рос. мед. вести. — 2010. — Т. 15, № 2. — С. 79–83.
20. Alcoholic Liver Disease. Common Gastrointestinal Problems: A Consumer Health Guide. — Arlington, VA: American College of Gastroenterology, 2010.
21. Alcoholic Liver Disease. Johns Hopkins Medicine: Gastroenterology & hepatology. — Baltimor MD: Johns Hopkins Hospital, 2010.
22. Alwis N.M.W. Nonalcoholic fatty liver disease: The mist gradually clears / N.M.W. Alwis, C.P. Day // J. Hepatol. — 2008. — Vol. 48. — P. 104–112.
23. Anderson N. Molecular mechanisms and therapeutic targets in steatosis and steatohepatitis / N. Anderson, J. Borlak // Pharmacological Reviews. — 2008. — Vol. 60, № 3. — P. 311–357.
24. Chen S.H. Relationship between nonalcoholic fatty liver disease and metabolic syndrome / S.H. Chen, F. Hе, H.L. Zhou et al. // Journal of Digestive Diseases. — 2011. — Vol. 12. — P. 125–130.
25. Chalasani N. The diagnosis and management of nonalcoholic fatty liver disease: Practice guideline by the American Gastroenterological Association, American Association for the Study of Liver Diseases, and American College of Gastroenterology / N. Chalasani // Gastroenterology. — 2012. — Vol. 142. — P. 1592–1609.
26. Cortez-Pinto H. Increasing burden of alcoholic liver disease in Europe. Postgraduate coure syllabus. Alcoholic liver disease / Н. Cortez-Pinto // EASL the international liver congress. — 2012. — Р. 11–16.
27. Cotrim H.P. Nonalcoholic fatty liver disease in Brazil. Clinical and histological profile / H.P. Cotrim, E.R. Parise, C.P. Oliveira et al. // Ann. Hepatol. — 2011. — Vol. 10(1). — P. 33–37.
28. Cubero F.J. Alcohol and liver fibrosis / F.J. Cubero, R. Urtasun, N. Nieto // Semin. Liver. Dis. — 2009. — Vol. 29. — P. 211–221.
29. Duseja A. Metformin is effective in achieving biochemical response in patients with nonalcoholic fatty liver disease (NAFLD) not responding to lifestyle interventions / A. Duseja, A. Das, R.K. Dhiman et al. // Ann. Hepatol. — 2007. — Vol. 6. — P. 222–226.
30. Eagon P.K. Alcoholic liver injury: influence of gender and hormones / P.K. Eagon // World J. Gastroenterol. — 2010. — Vol. 16. — P. 1377–1384.
31. Fracanzani A.L. Risk of severe liver disease in nonalcoholic fatty liver disease with normal aminotransferase levels: A role for insulin resistance and diabetes / A.L. Fracanzani // Hepatology. — 2008. — Vol. 48. — P. 792–798.
32. Gao B. Alcoholic liver disease: pathogenesis and new therapeutic targets / B. Gao, R. Bataller // Gastroenterology. — 2011. — Vol. 141. — P. 1572–1585.
33. Gastaldelli A. Fatty liver is associated with insulin resistance, risk of coronary heart disease, and early atherosclerosis in a large European population / A. Gastaldelli // Hepatology. — 2009. — Vol. 49. — P. 1537–1544.
34. Hojo M. Pharmacological therapy of nonalcoholic steatohepatitis / M. Hojo, S. Watanabe // Hepatol Res. — 2011. — Vol. 41(3). — P. 209–216.
35. Lam B. Novel treatment strategies for patients with nonalcoholic fatty liver disease / B. Lam, Z.M. Younossi // Clin. Invest. — 2011. — Vol. 1, № 2. — P. 229–239.
36. Lomonaco R. Effect of adipose tissue insulin resistance on metabolic parameters and liver histology in obese patients with nonalcoholic fatty liver disease / R. Lomonaco // Hepatology. — 2012. — Vol. 55. — P. 1389–1397.
37. Lucey M. Alcoholic hepatitis / M. Lucey, P. Mathurin, T.R. Morgan // N. Engl. J. Med. — 2009. — Vol. 360. — P. 2758–2769.
38. Ohbayashi H. The therapeutic effect of polyenephosphatidilcholine (EFL) on NASH / Ohbayashi H. // Liver, Bile and Pancreas. — 2006. — Vol. 52. — P. 637–642.
39. Pacifico L. Functional and morphologicalvascular changes in pediatric nonalcoholic fatty liver disease / L. Pacifico, C. Anania, F. Martino // Hepatology. — 2010. — № 52(5). — Р. 1643–1651.
40. Randomized controlled trial testing the effects of weight loss on nonalcoholic steatohepatitis / K. Promrat, D.E. Kleiner, H.M. Niemeier [et al.] // Hepatology. — 2010. — Vol. 51. — P. 121–129.
41. Do alcohol-metabolizing enzyme gene polymorphisms increase the risk of alcoholism and alcoholic liver disease? / E. Zintzaras, I. Stefanidis, M. Santos, F. Vidal // Hepatology. — 2006. — Vol. 43. — P. 352–361.

/137/137.jpg)
/138/138_2.jpg)
/139/139.jpg)