Журнал «» 5 (37) 2014
Вернуться к номеру
Статины в профилактике сердечно-сосудистых осложнений при сахарном диабете и метаболическом синдроме: «за» и «против»
Авторы: Татьяна Чистик
Рубрики: Кардиология
Разделы: Медицинские форумы
Версия для печати
Статья опубликована на с. 91-96
В начале третьего тысячелетия для человечества, преодолевшего на протяжении многовековой истории эпидемии жизненно опасных инфекций, на первое место по актуальности среди всех причин заболеваемости и смертности вышла проблема сердечно-сосудистых заболеваний (ССЗ). Существенную роль в этом сыграла модификация образа жизни, связанная с ограничением физической активности, увеличением калорийности пищевых продуктов и неустанным ростом эмоционально-стрессовых нагрузок. Все это потенцировало основные модифицируемые факторы риска возникновения ССЗ, явившиеся «отрицательным достоянием прогресса», такие как повышение артериального давления, дислипидемия, сахарный диабет (СД) и ожирение.
Неуклонное прогрессирование всемирной эпидемии диабета и метаболического синдрома привело мировую медицинскую общественность к мнению, что только полисистемный подход к решению данной задачи может увенчаться успехом, поскольку СД и заболевания сердечно-сосудистой системы часто представляют собой две стороны одной медали: с одной стороны, СД может расцениваться как состояние, способствующее развитию ишемической болезни сердца (ИБС), а с другой — многие пациенты с ИБС страдают СД или предиабетическими состояниями. Таким образом, давно назрела необходимость выработать совместный подход к этой проблеме, что позволит общими усилиями кардиологов и эндокринологов улучшить качество оказания медицинской помощи миллионам пациентов, имеющим сочетанные сердечно-сосудистые и метаболические заболевания.
23–25 сентября в НСК «Олимпийский» при поддержке Национальной академии медицинских наук Украины, Министерства здравоохранения Украины, Национального научного центра «Институт кардиологии им. Н.Д. Стражеско» состоялся XV Национальный конгресс кардиологов Украины. В рамках мероприятия прошел научно-практический симпозиум «Применение статинов у больных с сахарным диабетом и метаболическим синдромом», посвященный актуальным вопросам профилактики кардиоваскулярного риска при названных патологических состояниях и назначению с этой целью статинов. Поскольку данная тема является междисциплинарной, для участия в симпозиуме были приглашены ведущие специалисты в области кардиологи и эндокринологии.
Точку зрения кардиолога на применение статинов у больных с сахарным диабетом и метаболическим синдромом представила заведующая кафедрой кардиологии и ФД ХМАПО, доктор медицинских наук, профессор Вера Иосифовна Целуйко.
Известно, что СД является фактором риска развития кардиоваскулярных заболеваний и увеличивает вероятность возникновения сосудистых событий и смертельного исхода. Руководства по ведению больных СД рекомендуют применять статины у данной категории больных, причем независимо от базовых уровней липидов:
— при наличии сердечно-сосудистых заболеваний;
— при отсутствии сердечно-сосудистых заболеваний у пациентов в возрасте старше 40 лет, имеющих один или более из других факторов риска ССЗ (семейный анамнез, гипертензия, курение, дислипидемия или альбуминурия);
— у пациентов низкого риска, кроме указанных выше (например, без явных ССЗ и в возрасте до 40 лет), статины следует рассматривать как дополнение к изменению образа жизни, если уровень холестерина липопротеинов низкой плотности (ЛПНП) остается выше 100 мг/дл, или у пациентов с несколькими факторами риска сердечно-сосудистых заболеваний.
При этом основными целями терапии статинами при сахарном диабете являются:
— у лиц без явных признаков сердечно-сосудистых заболеваний целевой уровень холестерина < 100 мг/дл (2,6 ммоль/л);
— у лиц с выраженными сердечно-сосудистыми заболеваниями достижение более низкого целевого уровня холестерина ЛПНП < 70 мг/дл (1,8 ммоль/л) при помощи высоких доз статинов является опцией выбора;
— при недостижении вышеуказанных целевых значений при использовании максимально переносимых доз статинов снижение уровня холестерина приблизительно на 30–40 % от исходного является альтернативной терапевтической целью;
— уровни триглицеридов < 150 мг/дл (1,7 ммоль/л) и липопротеинов высокой плотности (ЛПВП) > 40 мг/дл (1,0 ммоль/л) у мужчин и > 50 мг/дл (1,3 ммоль/л) у женщин являются желательными (С). Тем не менее целевой уровень холестерина ЛПНП на основе терапии статинами остается предпочтительной стратегией;
— комбинированная терапия не продемонстрировала дополнительных сердечно-сосудистых преимуществ в сравнении с монотерапией статинами и в большинстве случаев не рекомендуется.
В последние годы сформировалась достаточно большая доказательная база, основанная на результатах, полученных при проведении крупных международных многоцентровых рандомизированных плацебо-контролируемых исследований, данных метаанализа, убедительно доказывающих эффективность статинов в снижении ССЗ и смертности у больных СД при первичной и вторичной профилактике: HPS, ASCOT-LLA, CARE, 4S, LIPID, CARDS. При этом отмечена хорошая переносимость статинов: менее чем в 1 % случаев возможно появление боли в животе, запора, метеоризма, повышения активности трансаминаз и миопатии.
Однако применение статинов может повышать риск развития сахарного диабета, что было показано в крупном рандомизированном двойном слепом исследовани JUPITER. Его участниками стали 17 603 человека без сердечно-сосудистых заболеваний и СД. Они были рандомизированы на две группы: 1-я группа получала 20 мг розувастатина ежесуточно, 2-я группа — плацебо. Период наблюдения составил 5 лет, в течение которых учитывалось достижение первичных конечных точек (инфаркт миокарда, ишемический инсульт, обращения в клинику по поводу нестабильной стенокардии, артериальная реваскуляризация, кардиоваскулярная смерть), а также вторичных параметров, таких как венозная тромбоэмболия, СД, общая смертность. Принимали во внимание также изначальное наличие основных факторов риска развития СД: метаболического синдрома, гипергликемии натощак, индекса массы тела ≥ 30 кг/м2, уровня гликозилированного гемоглобина > 6 %.
Результаты исследования подтвердили, что и на фоне приема статинов лица, имеющие по крайней мере один фактор риска развития СД (n = 11 508), более склонны к развитию СД, чем те, кто не имеет таких факторов (n = 6095). Среди участников с факторами риска наблюдали снижение частоты достижения всех первичных конечных точек в целом на 39 %, тенденцию к снижению риска развития венозной тромбоэмболии на 36 %, общей смертности — на 17 %, при этом риск развития СД повысился на 28 %.
По результатам подсчетов, в группе с наличием факторов риска развития диабета за время наблюдения было предотвращено 134 кардиоваскулярных события или летальных исхода на 54 случая диагностики СД.
Для участников без основных факторов риска развития СД применение статинов ассоциировалось со снижением частоты достижения первичных конечных точек на 52 %, тенденцией к снижению риска развития венозной тромбоэмболии на 53 %, общей смертности — на 22 %. При этом риск развития сахарного диабета на фоне приема статинов не изменился. Для этой группы в целом было предотвращено 86 кардиоваскулярных событий или летальных исходов без диагностики новых случаев СД.
Всего за время исследования диагностировано 486 случаев СД, из них 270 — в группе розувастатина и 216 — в группе плацебо (относительный риск (ОР) 1,25; 95% доверительный интервал (ДИ) 1,05–1,49; p = 0,01). По сравнению с группой плацебо в группе розувастатина СД был диагностирован в среднем на 5,4 нед. раньше (84,3 нед. против 89,7 нед. соответственно). Для этих пациентов применение статинов также было ассоциировано со снижением кардиоваскулярного риска, сопоставимым с общими показателями для всех участников.
Напротив, в рандомизированном плацебо-контролируемом исследовании WOSCOP с участием 5974 пациентов было показано, что применение правастатина в дозе 40 мг/сут сопровождается уменьшением риска развития СД на 30 % (ОР 0,7; 95% ДИ 0,5–0,99).
В 2010 году был опубликован метаанализ 13 клинических исследований (Sattar N. еt al.), включавший более 90 000 участников, среди которых было 4275 больных СД 2-го типа. 2226 из них в течение 4 лет получали статины, а 2052 не получали препараты данной группы. Оказалось, что риск развития впервые выявленного СД при получении статинов особенно выражен у больных пожилого возраста. Причем один дополнительный случай заболевания СД 2–го типа за 4 года приема статинов отмечался при лечении 255 больных, не страдавших исходно данной патологией.
Дальнейший анализ этих исследований выявил, что самый высокий риск развития СД был у розувастатина — 18 %, аторвастатина — 14 % и симвастатина — 11 % (табл. 1).
/92/92.jpg)
В 2011 году Waters et al. изучали риск развития СД среди пациентов, получавших аторвастатин, на основании результатов трех крупных исследований — TNT (аторвастатин 80 мг/сут vs аторвастатин 10 мг/сут) у пациентов c ИБС; IDEAL (аторвастатин 80 мг/сут vs симвастатин 20 мг/сут) у пациентов, перенесших инфаркт миокарда (ИМ), и SPARCL (аторвастатин vs плацебо) у пациентов с недавно перенесенным мозговым инсультом или транзиторной ишемической атакой. В соответствии с данными анализа прием аторвастатина в дозе 80 мг/сут сопровождался повышенным риском развития СД по сравнению с группой плацебо в исследовании SPARCL. В двух других исследованиях также прослеживалась тенденция к увеличению количества случаев впервые выявленного СД на фоне терапии аторвастатином в дозе 80 мг/сут по сравнению с приемом аторвастатина или симвастатина в более низких дозах (табл. 2).
Таким образом, полученные результаты подтверждают данные метаанализа и показывают, что риск развития СД на фоне лечения статинами увеличивается не только с возрастом, но и при приеме препаратов в более высокой дозе, а также при терапии более мощными статинами.
В результате этого естественен вопрос: существует ли статин, способный снизить риск сердечно-сосудистого заболевания без увеличения риска возникновения сахарного диабета?
На сегодняшний день таким препаратом является питавастатин (Ливазо), разработанный японскими исследователями и произведенный итальянской компанией Recordati group (Италия).
Питавастатин представляет собой новый мощный синтетический ингибитор ГМГ-КоА-редуктазы четвертого поколения c уникальной структурой молекулы, которая включает в себя группу циклопропила и обеспечивает улучшенную фармакокинетику, увеличение системной биодоступности, высокий уровень пероральной абсорбции, эффективное снижение ЛПНП при применении низких доз и выраженное влияние на холестерин липопротеидов высокой плотности (ХС ЛПВП).
В экспериментальных исследованиях было установлено, что питавастатин:
1. Ослабляет экспрессию белка аР2, который связывают с ожирением, инсулинорезистентностью и атерогенной дислипидемией.
2. Достоверно на 16 % уменьшает содержание гипертрофированных адипоцитов в жировых слоях параметрия, не влияя при этом на массу тела.
3. У мышей, которым вводили питавастатин, отмечали достоверно более высокий уровень адипонектина (инсулинорезистентность) в плазме крови — соответственно 12,5 ± 3,8 мкг/мл и 8,3 ± 1,5 мкг/мл (р < 0,05) и уменьшение на 16 % площади, ограниченной кривой «концентрация глюкозы — время после интраперитонеального введения инсулина» (р < 0,05).
В исследовании LIVES с участием 20 279 пациентов с гиперхолестеринемией было показано, что питавастатин при применении в дозах 1–4 мг/сут не только не повышает уровень гликозилированного гемоглобина, но и способствует его снижению на 0,28 % за 104 нед. лечения. (рис. 1).
/93/93_2.jpg)
Установлено достоверное снижение риска возникновения сердечно-сосудистых и цереброваскулярных заболеваний, а также риска внезапной сердечной смерти при достижении целевого уровня ХС ЛПНП и ХС ЛПВП.
В исследовании OPTIMAL терапия питавастатином в дозе 4 мг/сут на протяжении 9 мес. у пациентов со стабильной стенокардией приводила к снижению уровня ХС ЛПНП < 40 % и увеличению уровня ХС ЛПВП > 10 %. Благодаря использованию современных визуализирующих методик в этом исследовании удалось оценить влияние питавастатина на различные характеристики атеросклеротической бляшки. В частности, терапия питавастатином, помимо выраженного гиполипидемического действия, оказывала значимое положительное влияние на количественные и качественные характеристики атеросклеротической бляшки. На основании результатов этого исследования сделан вывод, что терапия питавастатином приводит к значительному регрессу и стабилизации атеросклеротической бляшки за счет уменьшения доли липидного компонента и увеличения фиброзного.
Исследование PREMIUM у пациентов с метаболическим синдромом продемонстрировало, что питавастатин способен повышать чувствительность к инсулину у больных с ожирением вследствие предупреждения гипертрофии адипоцитов, что способствует снижению риска возникновения сердечно-сосудистых и других осложнений, связанных с ожирением.
Таким образом, с питавастатином кардиологи связывают определенные позитивные надежды в плане обеспечения нового подхода к лечению дислипидемии с низким риском развития межлекарственных взаимодействий, побочных эффектов, что в сочетании с эффективностью препарата в отношении снижения ЛПНП поможет врачам индивидуализировать гиполипидемическую терапию у пациентов с метаболическими факторами риска.
Взгляд эндокринолога на проблему статинотерапии у больных сахарным диабетом и метаболическим синдромом был представлен в докладе члена-корреспондента НАМН Украины, д.м.н., профессора, главного эндокринолога МЗ Украины Бориса Никитича Маньковского.
В соответствии с рекомендациями АТР III (2001) сахарный диабет является эквивалентом ИБС. Именно поэтому при лечении больных СД врач должен проводить максимально активное определение и коррекцию сердечно–сосудистых факторов риска и рассматривать всех пациентов с СД как лиц с высоким или не очень высоким риском развития острого коронарного синдрома, нарушений мозгового кровообращения, даже при отсутствии каких-либо клинических признаков наличия у пациентов сердечно-сосудистых заболеваний.
В больших клинико-эпидемиологических исследованиях было установлено, что заболеваемость ИМ и инсультом в 2–6 раз выше у больных СД. Также было доказано, что СД сам по себе является фактором риска ИМ на фоне установленного диагноза ИБС. Так, исследование ADVANCE (Haffner et al., 1998) продемонстрировало, что риск развития ИМ на протяжении 7 лет составил 3,5 % у лиц, которые не болеют СД, без ИМ в анамнезе; 18,8 % — у лиц, перенесших инфаркт, но не болеющих СД; 20,2 % — у больных СД; 45 % — у больных СД и ИМ в анамнезе. Эти данные позволяют рассматривать всех больных СД как группу высокого риска сердечно-сосудистых заболеваний.
В работе T.K. Schramm et al. (2008), проанализировавших данные регистра Дании, было показано, что сочетание метаболического синдрома и СД увеличивает риск сердечно-сосудистых заболеваний как у мужчин, так и у женщин, и этот риск увеличивается с возрастом пациента.
В крупном клиническом исследовании UKPDS с участием 4209 пациентов (Turner R.C., 1998) было определено, что наиболее значимым фактором риска возникновения ИБС и ее осложнений у больных СД 2-го типа является повышение уровня холестерина липопротеинов низкой плотности. Повышение уровня холестерина на 1 ммоль/л повышало риск сердечно-сосудистых заболеваний на 57 %; уменьшение этого показателя на 1 ммоль/л приводило к снижению указанного риска на 36 %.
В эпидемиологическом исследовании MRFIT (Stamler et al., 1993), в котором приняли участие 12 866 мужчин в возрасте от 35 до 57 лет, при 12-летнем наблюдении абсолютный риск смерти от ИБС в любом возрасте был в 3–4 раза выше у больных СД по сравнению с лицами без диабета.
При этом коррекция факторов риска (гипергликемии — метформином, а дислипидемии — статинами) позволяла снизить риск сердечно-сосудистых заболеваний на 39 и 20–50 % соответственно (Pyorala K. et al., 1997).
Дислипидемии у пациентов с СД имеют свои особенности, такие как возрастание содержания триглицеридов; снижение содержания ЛПВП; увеличение количества мелких, плотных атерогенных ЛПНП; наличие гликозилированных ЛПНП; возрастание содержания аполипопротеинов В.
Основные подходы к коррекции дислипидемии содержатся в следующих рекомендациях:
1. У большинства взрослых пациентов с СД необходимо определять липидные показатели по меньшей мере 1 раз в год; у больных с целевыми показателями липидов — возможно контролировать 1 раз в 2 года.
2. Статины должны быть назначены в дополнение к модификации образа жизни независимо от исходных показателей уровня липидов крови больным с СД с ССЗ в анамнезе и без ССЗ старше 40 лет и имеющим один или более фактор риска сердечно-сосудистых заболеваний.
3. Больным меньшего риска (без ССЗ, моложе 40 лет) назначать статины, если уровень ЛПНП остается выше 100 мг/дл, несмотря на модификацию образа жизни, а также имеющим множественные факторы риска.
Данные крупных рандомизированных плацебо-контролируемых исследований показывают, что применение статинов приносит пользу больным диабетом по меньшей мере в такой же степени, как и пациентам без него. В крупнейшем на сегодняшний день исследовании HPS (Heart Protection Study), в котором применяли терапию статинами при СД, 5963 пациента в возрасте 40–80 лет, имеющих диабет, и 14 573 пациента с окклюзионной болезнью артерий (без диагностированного диабета) были рандомизированы для ежедневного приема 40 мг симвастатина или плацебо. Первичными конечными точками служили первое большое коронарное событие (нефатальный ИМ или коронарная смерть) и первое большое васкулярное событие (инсульт или реваскуляризация). Полученные в исследовании данные подтвердили эффективность симвастатина 40 мг в сравнении с плацебо: риск первого васкулярного события снижался на 27 %, инсульта — на 24 % и реваскуляризации — на 17 %.
В 1996 году были опубликованы результаты вторичной профилактики коронарных событий (смерть, нефатальный ИМ, а также ряд менее строгих жестких точек) с помощью правастатина у лиц, перенесших ИМ, с умеренной гиперхолестеринемией (The Cholesterol and Recurrent Events Trial — CARE). В этом рандомизированном двойном слепом проспективном 5-летнем исследовании приняли участие 4159 больных, перенесших ИМ за 3–20 месяцев до включения в исследование, в возрасте до 75 лет. Главным критерием, отличающим исследование CARE, было включение пациентов при уровне ХС до 6,2 ммоль/л (240 мг/дл). Основную группу составили 2078 пациентов, получавших 40 мг правастатина, контрольную — 2081 больной, получавший плацебо. Основная конечная точка — смерть от ИБС или нефатальный ИМ — отмечена у 13,2 % больных контрольной и у 10,2 % пациентов основной группы (снижение риска у получавших правастатин — на 24 %, p < 0,003). Подгрупповой анализ исследования CARE продемонстрировал снижение относительного риска повторных коронарных событий на 14,1 % у 586 больных СД 2-го типа.
Рандомизированное двойное слепое плацебо-контролируемое исследование CARDS (Collaborative Atorvastatin Diabetes Study), в котором изучали первичную профилактику атеросклероза, включало 2838 пациентов в возрасте 40–74 лет, которые проходили лечение в 132 центрах Великобритании и Ирландии.
В исследовании было показано, что ежедневный прием аторвастатина в дозе 10 мг снижал вероятность больших кардиоваскулярных событий (острый ИМ, инсульт, стенокардия и реваскуляризация) на 37 % по сравнению с контрольной группой. Важно отметить тот факт, что инсульт развивался на 48 % реже у пациентов, получавших аторвастатин, чем в группе плацебо, смертность от всех причин — на 27 % ниже в группе активного лечения по сравнению с контрольной. Ожидалось, что лечение предотвратит 37 больших васкулярных событий на 1000 пациентов, которые получали терапию в течение четырех лет.
Снижение кардиоваскулярного риска у пациентов с СД было продемонстрировано и в других исследованиях: 4S, LIPID, TNT и др.
В 2006 году Costa et al. был проведен метаанализ 12 исследований эффективности гиполипидемических препаратов у лиц, болеющих и не болеющих СД. На его основании был сделан вывод, что терапия статинами снижает риск развития больших коронарных событий приблизительно на 20 % независимо от наличия или отсутствия СД. Эффективность статинов сопоставима как при первичной, так и при вторичной профилактике ССЗ. Применение статинов обеспечивало большее абсолютное количество предотвращенных сердечно-сосудистых событий у больных СД.
Для статинов характерен хороший профиль безопасности и переносимости, однако в процессе лечения, особенно при назначении максимальной суточной дозы, важным аспектом явлется мониторирование побочных эффектов. В 2006 году A. Kashani et al. провели систематический обзор 34 рандомизированных контролируемых испытаний с участием более 74 000 пациентов по оценке риска мышечных, почечных и печеночных осложнений, связанных с терапией статинами. Было выявлено отсутствие в группе статинов достоверного возрастания риска миалгии, повышения уровня креатинкиназы и рабдомиолиза, но риск увеличения трансаминаз был несколько выше — 4,2 на 1000 пациентов.
Также следует отметить, что в последние несколько лет стали достаточно настойчиво обсуждаться случаи неблагоприятного воздействия статинов на показатели углеводного обмена как у больных СД, так и у лиц, не страдающих данным заболеванием. В 2010 году на основании метаанализа, включающего 13 рандомизированных контролируемых исследований по изучению исходов сердечно-сосудистых заболеваний с участием более 1 тыс. пациентов и периодом динамического наблюдения более 1 года каждое (всего 91 140 пациентов), было показано, что на фоне терапии статинами риск развития СД 2-го типа увеличивается на 9 %.
Результаты другого метаанализа (Preiss et al., 2011), включающего 5 исследований и 32 752 пациента, продемонстрировали, что этот риск увеличивается при назначении агрессивных доз статинов.
В ситуации, когда требуется дополнительное снижение ХС ЛПНП, для усиления эффекта могут быть добавлены другие гиполипидемические средства. Эзетимиб является селективным представителем нового класса гиполипидемических лекарственных средств, которые снижают абсорбцию ХС в кишечнике, а также, подобно статинам, увеличивают уровень инсулина натощак и индекс НОМА. Исследование с розувастатином, симвастатином и комбинацией симвастатин 10 мг + эзетимиб 10 мг в течение 12 недель выявило повышение фастингового инсулина и индекса НОМА во всех случаях, однако максимальным оно было при назначении комбинации препаратов — на 36,4 и 50 % соответственно.
В исследовании, в котором в течение 4 лет сравнивалось назначение розувастатина в различных дозировках — 10 мг (n = 24), 20 мг (n = 25) и 40 мг (n = 23), было установлено, что его применение приводит к дозозависимой инсулинорезистентности у пациентов как с факторами риска, так и без них. Поэтому FDA (Федеральное управление по контролю качества пищевых продуктов и лекарственных препаратов США) в феврале 2012 г. внесло определенные поправки в аннотацию по использованию этой группы препаратов:
1. Имеются исследования, показывающие, что пациенты, получающие статины, могут иметь несколько более высокий риск повышения уровня сахара в крови и вероятность развития СД 2-го типа.
2. В инструкциях к препаратам будет содержаться предупреждение для медицинских работников и пациентов об этом потенциальном риске.
3. По-прежнему считается, что благоприятные сердечно–сосудистые эффекты статинов перевешивают это повышение риска.
Питавастатин является относительно новым членом семьи статинов. Препарат впервые введен в клиническую практику в 2003 году в Японии для лечения первичной гиперлипидемии или смешанной дислипидемии. В последующем питавастатин был разрешен к применению в 13 странах мира, в том числе в США, Германии, Испании, Японии, Китае. Недавно питавастатин был одобрен для использования также в Великобритании, Австралии и Франции. В 2013 году питавастатин зарегистрирован в Украине под торговым названием Ливазо (Recordati group, Италия).
Согласно данным T. Tеratomo et al. (2011), питавастатин обладает выраженным влиянием на уровень ХС липопротеинов высокой плотности, повышая его почти на 30 %, стабилизирует атеросклеротические бляшки и обеспечивает их регресс, обладает низким риском лекарственных взаимодействий и высоким профилем безопасности.
В исследовании, проведенном Meikle et al. (2014), было показано, что питавастатин не влияет на параметры метаболизма глюкозы у пациентов с сахарным диабетом и метаболическим синдромом. При назначении питавастатина 4 мг/день в течение 6 месяцев отмечался выраженный гиполипидемический эффект и безопасный уровень глюкозы.
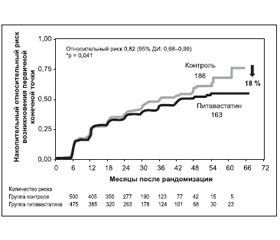
В крупном клиническом исследовании J-PREDICT изучалось влияние питавастатина на частоту развития сахарного диабета у 1269 пациентов с нарушенной толерантностью к глюкозе. Сравнивали два режима лечения: модификацию образа жизни + питавастатин в низкой или умеренной дозе 1–2 мг и только модификацию образа жизни.
Конечные точки: каждые 6 месяцев проводили тест на толерантность к глюкозе, а также другие стандартные лабораторные тесты.
Первичной конечной точкой была частота новых случаев СД, определявшаяся по увеличению глюкозы в плазме крови через 2 часа после еды ≥ 200 мг/дл и глюкозы натощак ≥ 126 мг/дл, отмечающемуся хотя бы один раз на протяжении исследования.
Через 72 месяца наблюдения было установлено, что показатели заболеваемости СД составили 163 случая для группы питавастатина и 186 — для группы контроля на 1000 человеко-лет. Относительный риск 0,82 (95% ДИ 0,68–0,99), р = 0,041. Значение р было рассчитано с использованием логарифмически-рангового критерия, который был стратифицирован по 5 факторам: пол, возраст, индекс массы тела, 2-часовая глюкоза плазмы крови и наличие артериальной гипертензии. Исследование показало, что прием питавастатина снижает заболеваемость СД у пациентов высокого риска на 18 % (относительный риск 0,65; 95% ДИ 0,50–0,84; р = 0,01) (рис. 2).
/96/96.jpg)
Таким образом, питавастатин обладает достаточно большой доказательной базой, демонстрирующей, что он является оптимальным статином для назначения пациентам с метаболическим синдромом и сахарным диабетом.

/93/93.jpg)