Газета «Новости медицины и фармации» 20 (522) 2014
Вернуться к номеру
Особливості перебігу та лікування артеріальної гіпертензії
Авторы: Соломенчук Т.М. - д.м.н., професор, Восух О.В. - Кафедра сімейної медицини ФПДО Львівського національного медичного університету ім. Данила Галицького
Рубрики: Семейная медицина/Терапия
Разделы: Справочник специалиста
Версия для печати
Статья опубликована на с. 14-16 (Мир)
Пацієнти з артеріальною гіпертензією (АГ) становлять одну з найбільших груп осіб, які звертаються по медичну допомогу з приводу хронічних неінфекційних захворювань. Це одне з найпоширеніших серцево-судинних захворювань (ССЗ) та водночас найпотужніший фактор розвитку тяжких кардіоваскулярних ускладнень і смерті. Незважаючи на проведення великих рандомізованих досліджень, накопичений значний світовий досвід щодо її лікування та постійне оновлення клінічних рекомендацій, проблема ефективного контролю АГ на практиці до цього часу остаточно не вирішена. При цьому виділяють декілька парадоксальних ситуацій, пов’язаних з АГ: 1) АГ легко діагностувати, але значна частка осіб із підвищеним артеріальним тиском (АТ) залишається невиявленою; 2) АГ можна лікувати, однак більшість гіпертензивних хворих не лікується; 3) у даний час доступний цілий арсенал високоефективних лікарських засобів (ЛЗ), проте близько 70–75 % лікованих пацієнтів не досягають цільових рівнів АТ. Зокрема, за даними дослідження BP-CARE (2011), частка осіб, які на фоні антигіпертензивної терапії досягають цільових рівнів АТ (< 140/90 мм рт.ст.), у країнах Східної Європи досягає лише 27,1 %. Водночас в Україні цей показник є ще нижчим і становить 16,5 %.
Неадекватний контроль АГ пов’язують із трьома основними групами причин. Перша — недоліки роботи лікаря (інертність, незнання рекомендацій, відсутність можливості моніторингу призначень тощо). Друга — недостатня прихильність до терапії з боку хворого (відсутність поінформованості щодо принципів лікування хворих, економічний фактор, небажання тощо). Третя — причини, зумовлені особливостями розвитку й прогресування АГ. Йдеться про коморбідні стани, лікування яких погіршує ефективність антигіпертензивної терапії, або додаткові фактори ризику, що потребують відповідної корекції. Важливе значення також надається індивідуальній гетерогенності патогенетичних механізмів розвитку АГ.
Згідно з сучасними уявленнями патогенез розвитку АГ та її ускладнень пов’язаний насамперед з гіперактивною ренін-ангіотензин-альдостероновою системою (РААС) та надмірним утворенням її гормона — ангіотензину ІІ. Останній здатен не лише безпосередньо підвищувати АТ, але й стимулювати надмірний синтез альдостерону, що сприяє затримці натрію і води, а також норадреналіну — медіатору активності симпатичної нервової системи (СНС). У свою чергу, збільшення продукції катехоламінів робить вагомий внесок у формування резистентного до стандартного лікування гіпертензивного синдрому. Як наслідок збільшується серцевий викид і частота серцевих скорочень, розвивається вазоконстрикція периферичних і ниркових артерій. У результаті відбувається стимуляція синтезу реніну, що призводить до подальшої активізації РААС. Таким чином, порочне коло взаємопосилення активності двох систем — РААС і СНС — замикається, у результаті чого продовжується процес прогресування АГ, прискорення ураження органів-мішеней та розвиток її ускладнень.
Серед факторів, здатних безпосередньо спричиняти й підтримувати гіперактивність СНС, найбільше значення мають метаболічний синдром, цукровий діабет, ожиріння, похилий вік, куріння, клімактерій, а також низка психосоціальних факторів ризику, серед яких стрес, пов’язаний із роботою, низький соціальний статус або недостатня соціальна підтримка, поведінка типу А (ворожість, гнів, агресивність), іншими словами, хронічний стрес із формуванням тривожно-депресивних розладів (ТДР).
У даний час спостерігається значна поширеність психоемоційних порушень у суспільстві. Зокрема, тривожні розлади виявляють у 20–25 % населення європейських країн, а патологічну, необґрунтовану тривогу — у 30–40 % пацієнтів лікарів терапевтичного профілю. Згідно з результатами російського дослідження КООРДИНАТА [6], серед 5038 хворих на ІХС і/або АГ клінічно значима тривожна (≥ 11 балів за HADS) і депресивна симптоматика була верифікована у 30–38 % осіб. У дослідженні КОМПАС майже половина осіб (від 44,7 до 47,4 %), які звертаються до лікарів первинної ланки охорони здоров’я (терапевтів, кардіологів, неврологів), мали прояви тривоги і депресії.
ТДР вважаються незалежними факторами ризику розвитку АГ, ІХС, цереброваскулярної хвороби та їх ускладнень. Результати епідеміологічних досліджень засвідчують, що у хворих із серцево-судинними захворюваннями ТДР реєструється в декілька разів частіше, ніж у середньому в популяції (20–40 проти 2,5–10 %). Найвищі показники їх поширеності відмічаються у хворих із хронічною серцевою недостатністю (61 %), пацієнтів після перенесеного інсульту (59 %) та інфаркту міокарда (ІМ) (54 %), хворих зі стенокардією (55 %) та АГ (52 %). За даними В.Ю. Приходько та співавт., підвищена тривожність спостерігається у трьох із чотирьох хворих на АГ (74 %) за госпітальною шкалою тривоги і депресії (HADS), у 78 % діагностована субклінічна депресія, у 82 % — висока реактивна тривожність [7].
ТДР частіше супроводжують АГ із кризовим перебігом, що ускладнюється розвитком інсульту або ІМ, і є другим після куріння фактором, відповідальним за більше ніж дворазове збільшення ризику смерті при АГ та ІХС [15, 23]. Тривала й надмірна психоемоційна напруга, що виникає в умовах хронічного стресу, відчуття пригніченості й незадоволеності, прогресуюча депресія і тривожність погіршують прогноз та знижують виживання хворих із кардіоваскулярною патологією [4, 7, 18, 29]. Зокрема, ТДР збільшують ризик ускладнень ССЗ у 1,5–2 рази, причому їх ефект дозозалежний: чим вищий рівень тривоги або депресії, тим більші шанси виникнення ІМ чи інсульту. Дослідження INTERHEART (2004) прирівняло ступінь ризику розвитку ІМ при ТДР до такого, що існує при цукровому діабеті чи курінні. Депресія у хворих після перенесеного ІМ збільшує ризик смерті у 3–6 разів порівняно з особами без неї.
Суттєву роль психоемоційних розладів у збільшенні кардіоваскулярного ризику підтверджують експерти Європейського товариства кардіологів (ESC). У рекомендаціях ESC із кардіоваскулярної профілактики (2012) підкреслюється, що конфлікти і хронічний стрес підвищують серцево-судинний ризик у 2,7–4 рази [21, 22]. Депресія, що в 70 % випадків супроводжується також і тривожною симптоматикою, сприяє підвищенню ризику кардіоваскулярних ускладнень в 1,9 раза і погіршує виживання у 2,4 раза.
Крім патофізіологічних механізмів погіршення контролю АТ на фоні ТДР, пов’язаних із гіперактивністю СНС, важливу роль відіграють також і зміни у поведінці хворого: стан гіподинамії, соціальна дезадаптація, недотримання дієти, куріння, небажання виконувати рекомендації лікаря тощо [4, 8]. У пацієнтів із ТДР відмічається гірша прихильність до антигіпертензивної терапії [15] і, відповідно, результати лікування. Внаслідок втрати мотивації до лікування вони часто не виконують настанови лікаря, що сприяє неадекватному контролю АГ.
Як виявляти осіб із ТДР?
Насамперед за характерною симптоматикою. Найчастішими проявами ТДР у хворих на АГ є відчуття неспокою, психологічне напруження і скутість, метушливість і роздратованість, погіршення працездатності та швидка втомлюваність, утруднення засинання й порушення нічного сну. Виділяють також і соматичні клінічні прояви ТДР, зокрема серцево-судинні ефекти (прискорення серцебиття, тахікардія, коливання АТ), неврологічні прояви (запаморочення, біль голови, тремор, напруження та посіпування м’язів), гастроінтестинальні стигми (кольки, проноси або запори, метеоризм, диспепсія), дихальні ознаки (задишка, відчуття кому в горлі) [10, 19].
Для більш об’єктивної ідентифікації осіб із ТДР у загальній лікарській практиці можна використовувати скринінговий метод опитування за шкалою HADS, розробленою A.S. Zigmond і R.P. Snaith [30]. Вона містить по сім запитань, відповіді на які дозволяють верифікувати у хворого стан тривоги і/або стан депресії. При інтерпретації результатів тестування враховується індивідуальний сумарний показник балів за кожною підшкалою окремо. Виділяються три рівні значень: 0–7 балів — «відносна норма», 8–12 — «субклінічна тривога та/або депресія», понад 12 балів (максимум 21 бал) — «клінічно значима тривога та/або депресія». Незважаючи на доволі прості методи виявлення ТДР, згідно з висновками більшості досліджень у 50–75 % пацієнтів вони не виявляються і не коригуються.
У зв’язку з високою поширеністю серед гіпертензивних хворих ТДР і їх потенційно несприятливою дією на контроль основних показників АТ особливої актуальності набуває комплексна терапія АГ із використанням не тільки гіпотензивних лікарських засобів, але й препаратів, здатних усувати чи коригувати симптоми тривоги й депресії. Якщо тяжкі прояви ТДР вимагають призначення транквілізаторів й антидепресантів, то у хворих із помірними та легкими ТДР можна використовувати ЛЗ, створені на основі лікарських рослин, зважаючи на їх структурну близькість до метаболітів організму, збалансовану біологічну активність і низьку токсичність. У загальній лікарській практиці з метою зниження психосоматичних проявів ТДР, покращення сну та зменшення небажаних нейровегетативних проявів при АГ можуть бути використані ЛЗ на основі екстрактів рослин із седативним ефектом: валеріани, пасифлори, пустирника, глоду тощо [4, 11].
Одним із таких комплексних препаратів рослинного походження є Седафітон®, до складу якого входять екстракти валеріани (50 мг), глоду (30 мг) та пустирника (30 мг). Препарати валеріани містять понад сотню біологічно активних хімічних сполук, серед яких найбільше значення мають валеренова кислота, що виявляє анксіолітичні, седативні, антидепресантні, спазмолітичні й міорелаксантні ефекти; а також валеранон та валепотріати, здатні справляти седативну і слабку спазмолітичну дію. Щодо корекції легких форм неврозів, порушень сну неорганічного походження та усунення симптомів тривоги й стресу, екстракт валеріани визнано вагомою альтернативою хіміопрепаратам, зокрема бензодіазепінам та барбітуратам. Окрім протитривожного і снодійного впливу, препарати валеріани справляють вегетотропний ефект, рівномірно впливаючи як на психічні, так і на соматичні симптоми ТДР. М’який снодійний ефект валеріани дозволяє покращувати контроль АТ, коригувати його добовий профіль та зменшувати варіабельність [1, 2, 5, 11, 17]. Щодо препаратів глоду, то найважливішими їх компонентами є кратегова кислота, біофлавоноїди (кверцетин, катехін), сапоніни та проантоціанідини. Вони мають гіпотензивний, гіпохолестеринемічний та водночас легкий вазотонічний і кардіопротективний ефект. В експерименті продемонстрована здатність окремих складових препаратів глоду майже на 80 % збільшувати коронарний кровообіг при одночасному зниженні частоти серцевих скорочень. Вазодилататорні та гіпотензивні ефекти глоду пояснюються здатністю деяких флавоноїдів, ціанідинів і тритерпенів пригнічувати активність ангіотензинперетворюючого ферменту, а також викликати м’який сечогінний ефект. Помірні седативні й антиоксидантні властивості глоду дозволяють нормалізувати сон та поліпшувати загальний стан хворих, що істотно покращує результати лікування пацієнтів з АГ [3, 11, 16, 17, 26–28]. Трава пустирника, до складу якої входять флавоноїди, іридоїди, стероїди, леонорин, глюкорамнозид та інші біоактивні речовини, має спазмолітичну й седативну дію, що у 2–3 рази перевищує таку ж дію валеріани, м’який гіпотензивний та сечогінний ефекти [11, 16, 17, 26]. Внаслідок цього пустирник зменшує прояви ТДР, здатен сповільнювати серцевий ритм та знижувати АТ (ймовірно, діючи на повільні кальцієві канали L-типу), сприяти корекції його варіабельності та добового ритму.
Гіпотеза про те, що застосування в комплексній терапії АГ фітопрепаратів на основі екстрактів валеріани, глоду та пустирника (Седафітон®) дозволяє не лише зменшувати психосоматичні прояви ТДР у хворих на АГ, але й покращувати контроль більшості параметрів АТ та його добового ритму, була підтверджена під час спеціально спланованого нами дослідження, у якому взяли участь 62 хворі на АГ 1–2-го ступеня, І–ІІ стадії з нетяжкими проявами ТДР (8–12 балів за шкалою HADS). Всі вони отримували регулярну стандартну (переважно комбіновану) антигіпертензивну терапію на основі інгібіторів ренін-ангіотензин-альдостеронової системи. На початку і наприкінці дослідження (тобто через 12 тижнів) у всіх пацієнтів проводилось тестування за допомогою госпітальної шкали тривоги і депресії HADS, а також добове моніторування АТ (ДМАТ). Серед іншого метод ДМАТ дозволяє виявляти й визначати ступінь впливу підвищеної симпатичної активності (у тому числі на ґрунті ТДР) на різні параметри контролю АТ, а також на ефективність антигіпертензивної фармакотерапії. Мета дослідження полягала у вивченні 12-тижневої динаміки середньодобового, середньоденного, середньонічного систолічного АТ (САТ), діастолічного АТ (ДАТ) і пульсового АТ (ПАТ); ступеня нічного зниження АТ за добовим індексом (ДІ); індексу часу (ІЧ) та варіабельності (вар.) АТ (окремо для нічного та денного періоду) на фоні двох схем лікування: пацієнти І групи отримували стандартну антигіпертензивну терапію і додатково препарат Седафітон® по 1 таблетці 2 рази на день, пацієнти ІІ групи — лише антигіпертензивні ЛЗ.
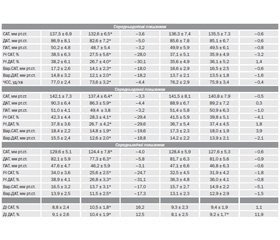
У результаті встановлено, що на початку дослідження у хворих двох груп рівні тривожності (HADS-Т) і депресії (HADS-D) вірогідно не відрізнялись і становили відповідно: HADS-Т — 9,58 ± 0,31 бала у І групі та 9,25 ± 0,24 бала у ІІ групі (р > 0,05), HADS-D — 9,03 ± 0,27 бала (І група) та 8,68 ± 0,35 бала (ІІ група), р > 0,05 (табл. 1).
Аналіз основних показників ДМАТ продемонстрував, що ТДР є вагомим фактором поганого контролю АТ навіть на фоні лікування. На момент початку дослідження включені до нього пацієнти вже отримували гіпотензивну фармакотерапію впродовж не менше ніж 8 тижнів, однак середні рівні АТ за даними ДМАТ в обох групах хворих не досягали рівня цільових значень [14, 21]. Зокрема, середньодобові рівні САТ/ДАТ у І і ІІ групі становили відповідно 137,5 ± 6,9/86,9 ± 8,1 (І) мм рт.ст. та 136,3 ± 7,4/85,6 ± 7,8 (ІІ) мм рт.ст. (цільовий рівень — 130/80 мм рт.ст.), середньоденні — 142,1 ± 7,3/90,3 ± 6,4 (І) мм рт.ст. та 141,5 ± 8,1/88,9 ± 6,7 (ІІ) мм рт.ст. (цільовий рівень — 135/85 мм рт.ст.) та середньонічні — 129,6 ± 5,1/82,1 ± 5,9 (І) мм рт.ст. та 128,4 ± 5,9/81,7 ± 6,3 (ІІ) мм рт.ст. (цільовий — 120/70 мм рт.ст.).
Істотно збільшеними у двох групах виявилися і стартові значення ІЧ — показника, що характеризує тривалість підвищення САТ і ДАТ упродовж доби або так зване навантаження тиском, що є важливим предиктором виникнення серцево-судинних ускладнень [20]. На початку дослідження ІЧ становив відповідно 34,0 ± 3,6 % для САТ і 38,9 ± 4,1 % для ДАТ у І групі та 32,5 ± 4,5 % і 36,3 ± 4,8 % у ІІ групі при нормі < 25 % [9, 13]. Згідно з сучасними критеріями, перевищення ІЧ понад 25 % у лікованих хворих є показником недостатньо ефективної антигіпертензивної терапії, однією з причин якої є підвищення активності СНС на ґрунті ТДР (табл. 2).
Вищими за припустимі значення (у середньому на 2–3 мм рт.ст.) виявились також початкові рівні варіабельності АТ на старті дослідження. У 9 осіб (28,1 %) І групи та 7 хворих (23,3 %) ІІ групи навіть на фоні лікування залишалась підвищена вихідна денна і нічна варіабельність САТ (> 15 мм рт.ст.) і ДАТ (відповідно > 14 і 12 мм рт.ст.) [9, 13], що є характерною ознакою гіперактивності СНС при ТДР. Доведено, що зі зростанням варіабельності АТ упродовж доби істотно зростає ризик серцево-судинних ускладнень та збільшується інтенсивність ураження органів-мішеней [20, 25].
Наприкінці дослідження (через 12 тижнів спостереження і лікування за двома різними схемами) повторне тестування, проведене за допомогою госпітальної шкали тривоги і депресії HADS, засвідчило покращення самопочуття та зменшення вираженості ТДР у пацієнтів двох груп. Однак в осіб ІІ групи відмічалась лише тенденція до зниження рівня тривожності (HADS-Т) на 2,6 % (до 9,01 ± 0,31 бала) і депресії (HADS-D) на 1,5 % (до 8,55 ± 0,32 бала), у той час як у пацієнтів І групи констатовано суттєве зниження вираженості ТДР на фоні 12-тижневого додаткового прийому фітопрепарату Седафітон®. Поряд зі зменшенням відчуття пригніченості, тривожності, неспокою та напруги, нормалізацією настрою та покращенням сну в осіб І групи констатовано вірогідне зменшення рівня тривоги (HADS-Т) на 27,6 % (до 6,94 ± 0,23, р < 0,001) і депресії (HADS-D) — на 20,7 % (до 7,16 ± 0,17, р < 0,001) (табл. 1). Пацієнти цієї групи відмічали також спокійніші реакції на різні психотравмуючі ситуації, зниження дратівливості й збудливості, а також відчуття млявості і втомлюваності.
Аналіз показників ДМАТ через 12 тижнів засвідчив істотне покращення контролю всіх основних параметрів АТ, насамперед серед хворих, які додаткового приймали Седафітон® (І група). Зокрема, середньодобовий рівень САТ і ДАТ у цій групі знизився на 3,6–5,0 % — відповідно до 132,6 ± 6,5 мм рт.ст. і 82,6 ± 7,2 мм рт.ст., у той час як у ІІ групі не спостерігалось відчутних змін цих показників (табл. 2). Поліпшення контролю АТ відбувалось за рахунок зниження як денного САТ і ДАТ (відповідно на 3,3 і 4,4 %), так і нічного АТ (відповідно на 4,0 і 5,8 %) (табл. 2).
На фоні фітотерапії (І група) зареєстровано також і більш суттєвий регрес середньодобового, середньоденного і середньонічного ІЧ — приблизно на третину, з досягненням їх рівнів у межах 25,6–28,3 %, тобто майже до норми, що свідчило про покращення результатів призначеного комплексного антигіпертензивного лікування. Водночас у ІІ групі подібної позитивної динаміки цих показників не спостерігалось (табл. 2).
Седативний, протитривожний та легкий снодійний ефект препарату Седафітон® сприяв покращенню добового профілю АТ. Відомо, що порушення сну, яке є одним із найбільш характерних проявів ТДР, може призводити до збільшення середньодобового АТ, у першу чергу за рахунок його нічної складової. У таких осіб подовжується період неспання з відповідно вищими рівнями АТ, що супроводжується суттєвим зростанням середньодобового АТ наступного дня, зменшенням ступеня нічного зниження АТ, стабілізації нічної АГ, появою патологічного типу добової кривої АТ, а іноді й рефрактерної АГ [2, 5]. Дослідження останніх років підтвердили, що зниження АТ у нічні години менше ніж на 10 % порівняно з денним АТ (non-dipper) вважається потужним незалежним фактором ризику смерті від серцево-судинних захворювань. Збільшення співвідношення «ніч/день» для САТ і/або ДАТ на кожні 5 % асоціюється зі зростанням ризику смерті на 20 % навіть у тих випадках, коли середньодобові значення АТ не перевищують рівня 135/80 мм рт.ст. [20, 21, 24]. Якщо ДІ — показник, що характеризує ступінь нічного зниження АТ, на початку дослідження суттєво не відрізнявся між групами і становив у І групі 8,8 ± 2,4 % (САТ) і 9,1 ± 2,6 % (ДАТ), у ІІ групі відповідно — 9,3 ± 2,3 % і 8,1 ± 2,5 %, то через 12 тижнів лікування у хворих І групи середній ДІ збільшився до 10,4–10,5 %, у той час як у ІІ групі він залишився на початковому рівні. При цьому частка хворих із диспропорційністю циркадного ритму АТ на фоні фітотерапії (І група) також істотно зменшилась до 12,5 % на відміну від хворих ІІ групи (табл. 2).
Щодо варіабельності АТ, то включення в комплекс лікування препарату Седафітон® супроводжувалось зниженням її амплітуди у хворих І групи: добова, денна та нічна варіабельність САТ і ДАТ зменшились приблизно на 17–19 % і наблизились до припустимих значень. У пацієнтів ІІ групи динаміка варіабельності виявилась незначною.
Таким чином, додаткове застосування фітопрепарату Седафітон®, до складу якого входять екстракти валеріани і пустирника, що мають помірний гіпотензивний, седативний і снодійний ефект, дозволяє зменшити відчуття тривожності й покращити сон у хворих на АГ із помірними ТДР, покращити контроль основних параметрів добового, денного й нічного САТ і ДАТ, знизити навантаження тиском і його варіабельність, відрегулювати добовий профіль і зменшити частку осіб із диспропорційністю добового ритму АТ.
Висновки
1. Незважаючи на тривалу стандартну гіпотензивну терапію, у хворих на АГ із помірними ТДР переважно не досягається оптимальний контроль основних параметрів АТ: реєструються вищі за цільові середні рівні АТ та ІЧ, надмірна варіабельність АТ і диспропорційність добового ритму з недостатнім нічним зниженням АТ.
2. Застосування фітопрепарату Седафітон® у комплексному лікуванні хворих на АГ із помірними ТДР упродовж 12 тижнів супроводжується вірогідним зниженням у них проявів тривоги і депресії за шкалою HADS на 27,6 і 20,7 % відповідно.
3. Фітотерапія на основі валеріани, глоду та пустирника (Седафітон®) сприяє покращенню контролю середніх рівнів добового, денного та нічного АТ, корекції циркадного ритму АТ та зниженню варіабельності АТ, пов’язаної з проявами ТДР, враховуючи її м’який протитривожний, седативний та снодійний ефект, а також позитивні кардіо- й ангіопротективні властивості.

/16_m/16_m.jpg)