Журнал «Медицина неотложных состояний» 7 (62) 2014
Вернуться к номеру
Коррекция холинергической недостаточности как направление нейропротекторной терапии у пациентов с ишемическим инсультом и тяжелой черепно-мозговой травмой
Авторы: Татьяна Чистик
Рубрики: Медицина неотложных состояний
Разделы: Медицинские форумы
Версия для печати
Статья опубликована на с. 100-106
25–27 сентября в Одессе состоялся международный конгресс по гемостазиологии, анестезиологии и интенсивной терапии «Black Sea Pearl», в рамках которого рассматривались актуальные вопросы диагностики и нейропротекторного лечения ишемического инсульта и черепно-мозговой травмы.
С докладом «Эволюция стратегии нейропротекции. Рациональная нейропротекция» выступил член-корреспондент НАМН Украины, заведующий кафедрой анестезиологии, интенсивной терапии, медицины неотложных состояний и лабораторной диагностики факультета последипломного образования ДонНМУ им. М. Горького доктор медицинских наук, профессор Владимир Ильич Черний.
Острые нарушения мозгового кровообращения и черепно–мозговые травмы (ЧМТ) являются одними из ведущих причин летальности и инвалидизации больных. По данным ВОЗ, ежегодно регистрируется около 7 млн случаев инсультов и 1,4 млн черепно–мозговых травм. Среди лиц, выживших при этих видах патологии, только 10 % могут вернуться к прежней работе. И только 2 % людей, перенесших инсульт и черепно–мозговую травму, довольны качеством жизни. Поэтому совершенствование диагностики и поиск новых эффективных методов лечения данных патологий входят в число важнейших задач современной науки и практики.
На сегодняшний день основными направлениями патогенетической терапии ишемии головного мозга являются восстановление нарушенного кровотока в ишемизированном участке и нейропротекция. Сущность нейропротекции заключается в обеспечении метаболической защиты мозга, предупреждении развития фокальной ишемии на клеточном и молекулярном уровнях и коррекции ее последствий. Свое–временное применение нейропротекции позволяет увеличить длительность периода выживания нейронов в условиях ишемического поражения головного мозга, а также добиться торможения механизмов реакций ишемического каскада, приводящих к гибели клетки (Верещагин Е.И., 2006).
Нейропротекторная терапия включает в себя гипотермию, лазерную терапию в инфракрасном диапазоне, гипербарическую оксигенацию и фармакологические методы воздействия. Среди фармакологических средств в настоящее время известны более 1000 препаратов, ставших объектами более 100 клинических исследований, однако в большинстве случаев не подтвердивших свою эффективность, что объясняется сложностью адаптации методов доказательной медицины к мультифакторным заболеваниям. Было установлено, что нейропротекторы, обладающие трофическими и модуляторными свойствами, оказывают и регенераторно–репаративное действие, способствуя восстановлению нарушенных функций. Н.Е. Иванова и В.С. Панунцев указывают на то, что уровень трофического обеспечения вещества мозга влияет на механизмы некротических и репаративных процессов. Даже при сформировавшемся очаге ишемии высокий уровень трофического обеспечения способствует регрессу неврологического дефицита.
В материалах IV Всемирного конгресса по вопросам нейропротекции и нейрорегенерации, проходившего в Германии 14–16 марта 2007 г., сделаны выводы о том, что нейротрофика, нейропротекция, нейропластичность и нейрогенез — это фундаментальные процессы, которые заложены природой и постоянно происходят в нервной системе. Невозможно терапевтически контролировать патофизиологический каскад с помощью применения только одного нейропротектора, имеющего только один механизм воздействия на патологический процесс. Нейропротекция будущего — это комбинированная терапия. Поэтому в настоящее время развиваются различные стратегии для разных видов патологии с применением комбинации молекул, каждая из которых действует на конкретное патологическое звено.
Эффективность комбинированной нейропротекции в сравнении с мононейропротекцией при оценке исходов черепно–мозговых травм была доказана в открытом ретроспективном рандомизированном исследовании, проведенном на базе кафедры анестезиологии, интенсивной терапии, медицины неотложных состояний и лабораторной диагностики факультета последипломного образования ДонНМУ им. М. Горького.
Для исследования использовались доступные методы нейросетевого моделирования и интегральный количественный анализ электроэнцефалограмм (ЭЭГ). Целью исследовательской работы была разработка методов прогнозирования исходов тяжелой ЧМТ и оценка эффективности лечения данного заболевания с применением церебропротекторных средств.
Всего было обследовано 1030 пациентов (646 мужчин и 384 женщины) в возрасте от 21 года до 68 лет, перенесших тяжелую ЧМТ в период с 1992 по 2006 год. Летальность через 1 год с момента травмы составила 36,9 % (436 человек). Все пациенты, лечившиеся в нейрореанимационном отделении в течение 14 лет, были рандомизированы в две группы, получавшие восемь различных комплексов терапии (Х1–Х8). В первой группе проводилась поддержка экстрацеребрального гомеостаза (комплексы терапии Х1, Х2): снижение внутричерепного давления (умеренная гипервентиляция, петлевые диуретики, 10–20% раствор альбумина или свежезамороженная плазма); создание охранительного торможения (бензодиазепиновые транквилизаторы).
Во второй группе осуществлялась интра– и экстрацеребральная поддержка с воздействием на все патогенетические звенья. Комплексы терапии Х3–Х8 включали дополнительно препараты, восстанавливающие мозговой кровоток и метаболизм (актовегин, пентоксифиллин, пирацетам, винпоцетин).
В результате выживаемость больных с тяжелой ЧМТ (общее состояние по шкале комы Глазго — менее 6 баллов) была намного выше в группах, получавших нейропротекторы. Также у этих пациентов прогноз выживаемости значительно превышал прогноз летальности при условии соблюдения принципа терапевтического интервала.
Второй этап заключался в исследовании эффективности комплекса первичной и вторичной нейропротекции при экспериментальном моделировании ЧМТ и мозгового инсульта (МИ) на животных. Первичная нейропротекция (ПН) была направлена на восстановление реологических свойств крови, микроциркуляции, эндотелиальной функции, функционального состояния нейроглии и гематоэнцефалического барьера (ГЭБ). Вторичная нейропротекция (ВН) улучшала регенераторно–репаративные процессы в нейроцитах и клетках глии. Препараты, которые использовались для ПН: L–лизина эсцинат, реосорбилакт, гекодез, пентоксифиллин, парекоксиб, а для ВН — актовегин, цитиколин и Глиатилин.
Моделирование ЧМТ проводили на белых беспородных крысах–самцах возрастом 3,0–4,5 мес. и весом 180–240 г, наркотизированных эфиром. Общее количество животных составляло 210 особей. Также было сформировано пять серий крыс:
— серия 0 (10 животных) — интактная;
— серия 1 (50 животных) — контрольная (без лечения);
— серия 2 (50 животных) — ПН;
— серия 3 (50 животных) — ВН;
— серия 4 (50 животных) — ПН + ВН.
Через 3 ч после нанесения ЧМТ нейропротекторы вводили внутрибрюшинно, капельно, струйно. Повторно препараты применяли через сутки в зависимости от сроков выведения животных из эксперимента. В конечном итоге было выяснено, что доля структурно сохранных нейронов в коре головного мозга крыс при ЧМТ в 4–й серии животных была намного выше в отличие от контрольной. Также комбинированная нейропротекция способствовала самой низкой летальности в 4–й серии крыс.
Нарушение мозгового кровообращения моделировали путем необратимой односторонней перевязки сонной артерии у монгольских песчанок (Meriones unguiculatus) массой 65–70 г. Были выделены аналогичные первой модели пять серий животных, общее число которых составляло 50 особей.
После проведения этого эксперимента были получены следующие данные: плотность нейронов в гиппокампе на 1 мм2 и их транскрипционная активность были значительно выше у песчанок, которым применяли комбинированную нейропротекторную терапию. Также на 21–е сутки лечения церебропротекторами процессы некроза нейронов трансформировались в процессы апоптоза, что, безусловно, более благоприятно для репарации нервной ткани, так как некроз протекает с воспалением близлежащей ткани.
Третий этап нашего исследования касался анализа таких параметров количественной электроэнцефалографии (ЭЭГ), как амплитудные спектры, функция когерентности, вызванные потенциалы и другие количественные показатели ЭЭГ. Для классификации изменений биоэлектрической активности головного мозга человека при МИ и тяжелой ЧМТ был применен метод интегрального количественного анализа ЭЭГ–паттернов и нейросетевого кластерного анализа параметров количественной ЭЭГ.
В ходе исследования изучалась реактивность мозга — изменение спектральной мощности в процентах исследуемых диапазонов в ответ на фармакологическое воздействие (введение нейротропного препарата). Были предложены три типа реакций ЦНС в ответ на введение нейропротекторов:
— I тип — отсутствие достоверных изменений показателей абсолютной спектральной мощности;
— II тип (включает четыре подгруппы) — увеличение или уменьшение спектральной мощности (АСМ);
— III тип (включает четыре подгруппы) — перераспределение ЭЭГ–мощности.
Реакции II типа характеризуются изменением корково–подкорковых взаимодействий в ответ на фармакологическое воздействие. Реакции III типа отражают влияние на уровне коры мозга в ответ на введение препарата.
Для создания нейронной модели МИ и ЧМТ была использована нейронная сеть Кохонена с учетом параметров мощности, интегральных коэффициентов и когерентности ЭЭГ. Особенности биоэлектрической активности мозга человека по состоянию структур ЦНС позволили выделить четыре кластера в моделях МИ и ЧМТ.
Нужно отметить то, что второй кластер при инсульте и второй кластер при ЧМТ имеют минимальный уровень ЭЭГ–дезорганизации, то есть преобладают нормальные ритмы. Выделен неблагоприятный четвертый кластер при МИ и третий кластер при ЧМТ в связи с умеренным уровнем ЭЭГ–дезорганизации и выраженной ареактивностью в ответ на фотостимуляционные пробы. Реакции ЦНС на введение актовегина не выявили статистически достоверных различий между кластерами.
Таким образом, в конечном итоге удалось составить алгоритм подбора нейропротекторных препаратов, который предусматривает классификацию записей ЭЭГ больного по кластерам сразу же при поступлении в отделение и дальнейший выбор стратегии нейропротекции соответственно первой реакции ЭЭГ. В комплексах терапии пациентов с ЧМТ и МИ, чьи исходные ЭЭГ–параметры относились к четырем кластерам, рекомендуется применять Глиатилин, цитиколин для вторичной нейропротекции. Именно эти нейропротекторы продемонстрировали положительный клинический эффект во многих исследованиях, в том числе и наших.
Также следует отметить, что на сегодняшний день одним из наиболее перспективных направлений метаболической защиты мозга от ишемии считается непосредственное воздействие на системы нейротрансмиттеров и нейромодуляторов мозга, на нейрональные рецепторы, а также нормализация соотношений процессов возбуждающей и тормозной нейротрансмиссии.
Как правило, следствием церебральной недостаточности является возникновение когнитивных нарушений, в основе которых лежит холинергическая недостаточность, обусловленная снижением выработки ацетилхолина и потерей холинергических нейронов. Холинергическая система, тесно взаимодействуя с дофаминергической и ГАМКергической (как по синергическим, так и по антагонистическим принципам), обеспечивает уровень сознания, спонтанную двигательную активность, эмоциональное поведение, память и волевые акты.
Существует два известных класса медикаментозных препаратов, действие которых направлено на преодоление холинергической недостаточности:
1. Ингибиторы ацетилхолинэстеразы: прозерин, галантамин, нейромидин.
2. Препараты — предшественники холина: центральный холинергический препарат холина альфосцерат (L–альфа глицерилфосфорилхолин, альфа–GPC, Глиатилин), являющийся прекурсором ацетилхолина, проникающим через гематоэнцефалический барьер; цитидин–5–дифосфохолин натрия (СДР, цитиколин).
В Донецком областном клиническом территориальном медицинском объединении было проведено исследование по изучению эффективности воздействия препарата Глиатилин на холинергическую систему у пациентов с острой и хронической церебральной недостаточностью. В нем приняли участие 19 клинически здоровых добровольцев, 7 пациентов с болезнью Паркинсона (БП) и 5 больных, перенесших острую церебральную недостаточность с исходом в апаллический синдром (АС).
В ходе исследования было зафиксировано, что значения абсолютной спектральной мощности в диапазоне 6–8 Гц, характеризующие активность холинергической системы в ЦНС, у пациентов с болезнью Паркинсона были достоверно ниже (р ≤ 0,05), чем у здоровых добровольцев, максимально в левом лобном и билатерально в окципитальном отделе коры больших полушарий. У больных с апаллическим синдромом эти показатели были достоверно ниже по сравнению со здоровыми добровольцами (р ≤ 0,05), максимально билатерально в окципитальных отделах коры больших полушарий, и ниже (р ≤ 0,05), чем у пациентов с болезнью Паркинсона, максимально в лобных и височных отделах коры больших полушарий.
Уровни абсолютной спектральной мощности ЭЭГ в диапазоне 11–12 Гц, которые характеризуют состояние дофаминергической системы, во всех исследуемых отведениях у пациентов с болезнью Паркинсона были снижены (р ≤ 0,05) относительно показателей в группе здоровых добровольцев. Такая же тенденция сохранялась и у больных с апаллическим синдромом.
Пациентам 2–й (болезнь Паркинсона) и 3–й группы (апаллический синдром) был назначен Глиатилин соответственно по 1000 и 2000 мг/сутки на 200 мл физиологического раствора, внутривенно капельно. Было отмечено, что применение Глиатилина повышало уровень абсолютной спектральной мощности в диапазоне 6–8 Гц у пациентов с болезнью Паркинсона преимущественно в окципитальных отделах и у больных с апаллическим синдромом максимально в проекции левых отведений (рис. 1).
/101/101.jpg)
Также в обеих исследуемых группах выявлены высокие прямые корреляционные связи (коэффициент корреляции более 0,7) между изменениями абсолютной спектральной мощности в диапазонах 6–8 Гц (холинергическая активность) и 11–12 Гц (дофаминергическая активность) в ответ на введение Глиатилина (рис. 2).
Таким образом, применение Глиатилина повышает уровень абсолютной спектральной мощности в диапазоне 6–8 Гц у больных с болезнью Паркинсона (преимущественно в окципитальных отделах) и у пациентов с апаллическим синдромом (максимально в проекции левых отведений). У Глиатилина отмечен дозозависимый эффект активации холинергической системы ЦНС при апаллическом синдроме. Установлена активация холинергической и дофаминергической систем в ответ на введение Глиатилина, что является необходимым для коррекции нейромедиаторной недостаточности.
В 2014 году получены промежуточные результаты двойного слепого многоцентрового клинического исследования ASCOMALVA, проведенного в Италии, в котором оценивалась эффективность комбинированного применения ингибитора холинэстеразы донепезила и холинергического предшественника холина альфосцерата в сравнении с монотерапией донепезилом у пациентов с ишемическим инсультом и болезнью Альцгеймера.
В исследовании приняли участие 210 пациентов в возрасте 56–91 года (в среднем 75 ± 10 лет). На этапе включения пациенты имели от 15 до 24 баллов по крат–кой шкале оценки психического статуса (MMSE). Все пациенты случайным образом были рандомизированы в группу активного лечения (донепезил + холина альфосцерат, n = 44) либо в группу сравнительного лечения (донепезил + плацебо, n = 47).
Показатели оценки когнитивных функций по шкалам MMSE и ADAS–cog, определяемые у пациентов, продемонстрировали следующие результаты: в группе сравнения (донепезил + плацебо) было выявлено их умеренное динамическое ухудшение; в группе активного лечения (донепезил + холина альфосцерат) отмечалась стабилизация состояния, что свидетельствовало об эффективности терапии (рис. 3).
/103/103.jpg)
Показатели оценки по шкале BADL как в группе сравнения, так и в группе активного лечения остались без изменения. Однако по шкале IADL на 24–м месяце лечения было отмечено улучшение в группе пациентов, принимавших активную терапию (снижение показателя с 3,5 до 2 баллов), по сравнению с пациентами контрольной группы.
Данные, полученные посредством использования нейропсихиатрического опросника (NPI), включая анализ данных о степени тяжести состояния пациентов (NPI–F) и степени дистресса ухаживающих лиц (NPI–D), выявили значительное снижение показателей степени тяжести состояния пациентов согласно NPI–F (c 25 до 20 баллов), а также степени дистресса ухаживающих лиц (с 14 до 10 баллов) в группе пациентов, которые принимали терапию на основе Глиатилина, в сравнении с группой пациентов, принимающих донепезил + плацебо.
Выводы исследования ASCOMALVA:
1. Восстановление холинергических связей играет важную роль в реабилитации пациентов с когнитивными нарушениями.
2. Доказано положительное влияние Глиатилина на неврологический дефицит после перенесенного инсульта, даже у пациентов с исходным когнитивным дефицитом.
3. Установлено положительное воздействие Глиатилина на двигательную функцию и способность к самообслуживанию после инсульта.
4. Отмечена отличная переносимость длительной (24 месяца) и комбинированной терапии Глиатилином.
Высокая эффективность Глиатилина объясняется следующим механизмом нейропротективного действия: из активного вещества в головном мозге происходит высвобождение холина, который участвует в биосинтезе ацетилхолина — одного из основных медиаторов нервного возбуждения. Ацетилхолин улучшает обмен информацией между нейронами, а также положительно воздействует на мембранную пластичность, что, в свою очередь, позитивно влияет на синаптическую трансмиссию. Альфосцерат биотрансформируется в глицерофосфат, который является предшественником фосфолипидов, участвует в синтезе фосфатидилхолина, в результате чего улучшается эластичность мембран и функция рецепторов.
Поэтому основными показаниями к назначению Глиатилина являются: острый период черепно–мозговой травмы, хроническая цереброваскулярная недостаточность, нарушение мозгового кровообращения по ишемическому типу (острый и восстановительный период) и геморрагическому типу (восстановительный период), деменции различного генеза.
Также хотелось бы отметить, что за последние 9 лет успешного внедрения стратегии нейропротекции было выявлено снижение летальности при тяжелой черепно–мозговой травме на 14,3 %, у пациентов с геморрагическим инсультом — на 18,6 % и с ишемическим инфарктом мозга — на 21,9 %.
В заключение следует напомнить, что лечение острого ишемического инсульта состоит из проведения специфических и неспецифических мероприятий. К специфическим мероприятиям относится внутривенное введение rtPA в пределах 4,5 часа; при отсутствии тромболизиса — назначение аспирина (160–300 мг); при повышении внутричерепного давления либо при риске развития злокачественного инфаркта мозга — применение декомпрессионной краниотомии. Неспецифические мероприятия — поддержание жизненных функций и биологических параметров в пределах нормы, профилактика осложнений.
Кандидат медицинских наук Ирина Анатольевна Андронова (Донецкий национальный медуниверситет им. М. Горького) рассказала о принципах коррекции холинергической недостаточности ишемии мозга.
В настоящее время известно, что основным медиатором холинергической системы является ацетилхолин, широко представленный в различных отделах центральной нервной системы — базальных ганглиях, таламусе, сером веществе полушарий, хвостатом ядре, ядрах моста, передних рогах боковых желудочков и вегетативных образованиях ЦНС.
При снижении выработки ацетилхолина и блокаде синтеза фосфатидилхолина возможна гибель клетки, а потеря 10 % клеточной мембраны влечет за собой нарушение ее жизнеобеспечения (Klein J., 2000). Снижение концентрации ацетилхолина сопровождается ремоделированием синапсов, уменьшением плотности рецепторов, дегенерацией структур головного мозга, прогрессированием когнитивной дисфункции (Larry B., 2004).
В норме полноценное функционирование сознания предполагает состояние бодрствования, обу–словленное реализацией когнитивных функций полушарий головного мозга и их взаимоотношениями с пробуждающими механизмами ретикулярной активирующей системы. Ретикулярная активирующая система получает афферентные импульсы из многих соматических, висцеральных, слуховых и зрительных сенсорных проводящих путей, направляет их в ретикулярное ядро зрительного бугра (thalamic reticular nucleus), из которого, в свою очередь, активация распространяется по всем отделам коры головного мозга. Лишенная связей с ретикулярной формацией, кора головного мозга приходит в недеятельное состояние (Хорас, 1907).
К субсистемам головного мозга относятся:
1. Стволово–таламо–кортикальная система.
2. Каудо–таламо–кортикальная (стриопаллидарная) система.
3. Базальная холинергическая система переднего мозга.
В базальном переднем мозге (Basal Forebrain) были найдены магноцеллюлярные нейроны, содержащие ацетилхолин и моносинаптически проецирующиеся на кору. Главной холинергической структурой является ядро Мейнерта.
Кора получает проекции от четырех основных медиаторных систем — дофаминергической, нор–адренергической, серотонинергической и холинергической. Однако только холинергическая система причастна к активации коры. Это объясняется тем, что кортикальная активация, вызванная электрической стимуляцией ретикулярной формации ствола, сопровождается высвобождением ацетилхолина в коре, то есть ретикулярная активирующая система действует на кору через холинергические афференты.
Согласно данным Н.Н. Даниловой (2001), возбуждения со специфической проекционной системы по коллатералям поступают в ретикулярную формацию ствола, где происходит их интеграция с различными центрифугальными влияниями. По–этому при фотостимуляции световой раздражитель, с одной стороны, вызывает проведение возбуждения по специфическим проекционным путям, а с другой — активацию коры, да и всего организма, осуществляемую через ретикулярную формацию ствола головного мозга.
В работе Ю.Д. Кротова (2010) были установлены предикторы недостаточности модулирующей системы мозга. Таламический ЭЭГ–ритм дельта–диапазона генерируется отдельно клетками таламуса на самом глубоком уровне их гиперполяризации. А для генерации таламусом альфа–ритмов адекватного функционирования отдельных клеток недостаточно, необходимы свойства нейронных сетей, такие как синхронизированное торможение ретикулярными нейронами (вентральное таламус–ретикулярное ядро) таламо–кортикальных нейронов при их относительной деполяризации. Усвоение навязываемого ритма световых мельканий при фотостимуляции свидетельствует о функциональной деятельности активирующей системы ретикулярной формации ствола, базальной холинергической системы переднего мозга и активирующей–инактивирующей системы неспецифического таламуса (таламо–кортикальной системы). Отсутствие усвоения навязываемого ритма является одним из предикторов функциональной недостаточности активирующих модулирующих субсистем головного мозга.
Множество публикаций свидетельствует об активности определенных диапазонов электроэнцефалографии с функционированием различных медиаторных систем центральной нервной системы. Медленные биоэлектрические процессы мозга частотой ниже 1 Гц рассматриваются как результат деятельности нейроглиальной популяции, коррелят процессов метаболизма с церебральным энергетическим обменом (Фокин, 2003), в диапазоне 6,0–7,5 Гц — с холинергической активацией, 5–6 Гц — с серотонинергической и 4–5 Гц — с адренергической (Багирова, 2006). Отмечена связь динамики альфа–ритма ЭЭГ частотой 11–12 Гц с изменением уровня активации в дофаминергической системе, а b2–ритма частотой 24–25 Гц — в серотонинергической (Панюшкина, 2000).
На базе нейрореанимационного отделения –ДОКТМО было проведено исследование с целью оценки качества коррекции холинергической недостаточности при острой церебральной недостаточности различного генеза препаратом Глиатилин. В нем приняли участие 60 пациентов: 36 — с тяжелой черепно–мозговой травмой, 24 — с мозговым инсультом.
Степень тяжести инсульта определяли по Скандинавской шкале инсультов и шкале Hant — Hess, клинические формы расстройства сознания и глубины коматозного состояния — с помощью шкалы комы Глазго. Также назначалась компьютерная томография, магнитно–резонансная томография головного мозга и ультразвуковая транскраниальная допплерография аппаратом DWLEZ–Dop V.2.1. (Germany). Кроме того, проводился стандартный комплекс обследования, позволяющий определить уровень неврологического дефицита и сохранность функций центральной нервной системы, а также регистрация биопотенциалов мозга с помощью нейрофизиологического комплекса, состоящего из 8–канального электроэнцефалографа фирмы Medicor со специальным программным обеспечением Brain mapping с применением метода интегрального количественного анализа ЭЭГ–паттерна.
Протокол записи включал: спокойное бодрствование (FON) и ахроматическую ритмическую фотостимуляцию (FTS) на частотах 2, 5 и 10 Гц.
Источником света служила импульсная электрическая лампа с энергией вспышек 0,3 Дж, установленная на расстоянии 10–12 см от глаз испытуемого строго по средней линии. Подавались короткие (не превышающие 20 мкс) ритмические сигналы–вспышки. Продолжительность, интенсивность и интервалы между вспышками были неизменны. Вспышки подавались сериями продолжительностью до 10 с. Интервал времени между сериями вспышек заданной частоты составлял не менее 2 минут.
Исследование проводили ежедневно дважды в день — до введения препарата Глиатилин и на фоне максимальной его концентрации в плазме (через 30 минут после введения препарата). Глиатилин вводился по 1000 мг/сут на 200 мл физиологического раствора, внутривенно капельно.
Определяли показатели количественной электроэнцефалографии, такие как абсолютный спектр мощности для данных частотных диапазонов ЭЭГ и суммарной ЭЭГ–мощности для диапазона 1–30 Гц. Также вычисляли интегральные коэффициенты, отражающие соотношение абсолютных спектр–мощностей различных частотных ЭЭГ–диапазонов.
Кроме того, исследовали показатели межполушарной когерентности в лобной (Fp1–Fp2), центральной (С3–С4), височной (Т3–Т4) и затылочной (О1–О2) областях головного мозга, а также показатели внутриполушарной когерентности в так называемых коротких лобно–центральной, лобно–височной, височно–центральной и центрально–затылочных парах слева и справа.
Для оценки уровня активности холинергической системы головного мозга определяли показатели абсолютной спектральной мощности ЭЭГ в диапазоне 6,0–7,5 Гц.
В зависимости от реакции на монохромную фотостимуляцию ЭЭГ пациенты с тяжелой черепно–мозговой травмой и мозговым инсультом были рандомизированы на 4 группы (рис. 4).
1–я группа: при низкочастотной FTS 2 Гц –усваивается навязываемый дельта–ритм, при высокочастотной FTS 10 Гц усвоения навязываемого ритма не выявлено. Отмечаются признаки функциональной недостаточности таламо–кортикальных нейронов и связей таламуса.
2–я группа: при низкочастотной FTS 2 Гц и при высокочастотной FTS 10 Гц усвоения навязываемого ритма не выявлено. Определена недостаточность модулирующих систем мозга на нескольких уровнях.
3–я группа: при высокочастотной FTS 10 Гц отмечалось усвоение навязываемого альфа–ритма. В данном случае имелась функциональная состоятельность всех структур модулирующих систем мозга.
4–я группа: при высокочастотной FTS 10 Гц усвоения навязываемого альфа–ритма не регистрируется, усваиваются ритмы других диапазонов. Выявлена функциональная недостаточность на уровне холинергической системы переднего мозга.
В ходе исследования было установлено, что у 14 пациентов усвоение навязываемого ритма определено лишь при стимуляции в 2 Гц, у 18 — не выявлено усвоения ни в одном из диапазонов при любой частоте стимула, у 15 — усвоение навязываемого ритма было зафиксировано при стимуляции в 2 Гц и в 10 Гц и у 13 — вне зависимости от частоты стимула были выявлены усвоения в диапазонах, отличных от частоты навязываемого ритма.
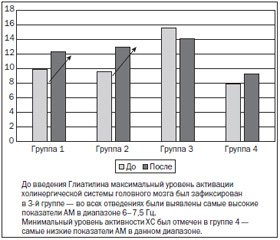
До введения Глиатилина максимальный уровень активации холинергической системы головного мозга был зафиксирован в 3–й группе: во всех отведениях были определены самые высокие показатели абсолютной мощности в диапазоне 6,0–7,5 Гц. Минимальный уровень активности холинергической системы был отмечен в группе 4 — самые низкие показатели абсолютной мощности в данном диапазоне (рис. 5).
/106/106_2.jpg)
Максимальный рост значений абсолютной мощности в диапазоне 6,0–7,5 Гц в ответ на введение 1 г Глиатилина был зафиксирован во всех ЭЭГ–отведениях у пациентов 2–й группы. У исследуемых 1–й группы значимый рост данных показателей был выявлен симметрично в лобных и окципитальных отведениях. Однако введение Глиатилина не вызывало значимых изменений уровня активации холинергической системы головного мозга у пациентов, чьи ЭЭГ относились к 3–й и 4–й группам.
На основании этого были сделаны следующие выводы:
1. При монохроматической фотостимуляции –усвоение ритма в диапазонах, отличных от частоты стимуляции, характерно для выраженной недостаточности на уровне базальной холинергической системы переднего мозга, о чем свидетельствует самый низкий уровень абсолютной спектральной ЭЭГ–мощности в диапазоне 6,0–7,5 Гц у пациентов 4–й группы исследования.
2. При выраженных нарушениях модулирующих систем мозга на нескольких уровнях (1–я и 2–я группа) даже минимальная доза Глиатилина (1000 мг/сут) вызывает значимую активацию холинергической системы, особенно на подкорковых уровнях: гиппокампа, хвостатого тела и базального ядра Мейнерта.
3. Введение Глиатилина в дозе 1000 мг/сут при исходной гиперактивации холинергической системы (3–я группа) безопасно, так как не приводит к повышению уровня абсолютной спектральной ЭЭГ–мощности в диапазоне 6,0–7,5 Гц.
4. Эффективность коррекции холинергической недостаточности при ишемии головного мозга определяется адекватной дозой Глиатилина на основании степени нарушений модулирующих систем мозга.

/102/102.jpg)
/106/106.jpg)