Международный неврологический журнал 7 (69) 2014
Вернуться к номеру
Порушення імунного гомеостазу як одна з патогенетичних ланок полінейропатії при цукровому діабеті 2-го типу
Авторы: Скрипко Л.А. — ДВНЗ «Івано-Франківський національний медичний університет»
Рубрики: Неврология
Разделы: Справочник специалиста
Версия для печати
Метою дослідження було встановити роль імунного фактора в патогенезі полінейропатії у хворих на цукровий діабет (ЦД) 2-го типу шляхом визначення рівня ФНП-α, ІЛ-1β, показників системи комплементу С3 та С4, а також оцінити ступінь зв’язку даних характеристик імунозапального процесу з показниками функціонального стану нервів.
У процесі дослідження обстежено 76 хворих на ЦД 2-го типу: у 32 (42,1 %) діагностовано діабетичну полінейропатію (ДПН) ІІА стадії, у 26 (34,2 %) — ДПН ІІІ стадії; у 18 (23,7 %) проявів полінейропатії виявлено не було. Проведено електронейроміографічне дослідження малогомілкових та великогомілкових нервів з визначенням стану функції мієліну, досліджували вміст ІЛ-1β, ФНП-α та рівень компонентів комплементу С3, С4.
У досліджуваних хворих з прогресуванням ДПН відбувається активація системи комплементу та прозапальних цитокінів, зокрема ФНП-α та ІЛ-1β, а також системи компонентів комплементу С3 і С4. Встановлено кореляційний зв’язок між зазначеними показниками та ступенем ураження мієлінових оболонок рухових нервів нижніх кінцівок: між резидуальною латенцією (РЛ) при стимуляції малогомілкових і великогомілкових нервів та С3 (r = 0,47; p = 0,031 та r = 0,58; p = 0,027 відповідно), між показниками швидкості проведення збудження (ШПЗ) малогомілковими і великогомілковими нервами та С3 (r = –0,38; p = 0,039 та r = –0,48; p = 0,032 відповідно); між РЛ при стимуляції великогомілкових нервів та ІЛ-1β (r = 0,53; p = 0,019), між показниками ШПЗ великогомілковими нервами та ІЛ-1β (r = –0,44; p = 0,036). Це свідчить про те, що хронічне низькоінтенсивне запалення, характерне для ЦД 2-го типу, є несприятливим фоном, на якому в подальшому розвиваються автоімунні реакції на структури мієлінової оболонки.
При ІІІ стадії ДПН спостерігається зменшення показника С4 на тлі високого рівня С3, що може характеризувати зниження опірності інфекціям і зростання ризику розвитку виразкового процесу стопи у хворих на ЦД 2-го типу.
Целью исследования было установить роль иммунного звена в патогенезе полинейропатии у больных сахарным диабетом (СД) 2-го типа путем определения уровня ФНО-α,
ИЛ-1β, показателей системы комплемента С3 и С4, а также оценить степень связи указанных характеристик иммуновоспалительного процесса с показателями функционального состояния нервов.
В процессе исследования обследовали 76 больных СД 2-го типа: у 32 (42,1 %) диагностировали диабетическую полинейропатию (ДПН) ІІА стадии, у 26 (34,2 %) — ДПН ІІІ стадии; у 18 (23,7 %) признаков полинейропатии не было выявлено. Проведено электронейромиографическое исследование малоберцовых и большеберцовых нервов с определением состояния функции миелина, также исследовали содержание ИЛ-1β, ФНО-α и уровень компонентов комплемента С3, С4.
У исследуемых больных наряду с прогрессированием ДПН происходит активация системы комплемента и провоспалительных цитокинов, в частности ФНО-α и ИЛ-1β, а также компонентов комплемента С3 и С4. Установлена корреляционная связь между указанными показателями и степенью поражения миелиновых оболочек двигательных нервов нижних конечностей: между резидуальной латенцией (РЛ) при стимуляции малоберцовых и большеберцовых нервов и С3 (r = 0,47; p = 0,031 и r = 0,58; p = 0,027 соответственно), между показателями скорости проведения возбуждения (СРВ) по малоберцовым и большеберцовым нервам и С3 (r = –0,38; p = 0,039 и r = –0,48; p = 0,032 соответственно); между РЛ при стимуляции большеберцовых нервов и ИЛ-1β (r = 0,53; p = 0,019), между показателями СРВ по большеберцовым нервам и ИЛ-1β (r = –0,44; p = 0,036). Это свидетельствует о том, что хроническое низкоинтенсивное воспаление, которое характерно для СД 2-го типа, является неблагоприятным фоном, на котором в дальнейшем развиваются аутоиммунные реакции к структурам миелиновой оболочки.
При ІІІ стадии ДПН наблюдается снижение показателя С4 на фоне высокого уровня С3, что может провоцировать ухудшение сопротивляемости инфекциям и повышение риска развития язвенного процесса стопы у больных СД 2 типа.
The investigation aimed to ascertain the immune factor role in polyneuropathy pathogenesis in patients with type 2 diabetes mellitus (DM) by determining TNF-α, IL-1β, indices of С3 and С4 of complement system, as well as to estimate the degree of correlation of the immuno-inflammatory process parameters with indices of the nerves functional state.
This study involved 76 patients with type 2 DM: 32 (42.1 %) patients were diagnosed with stage IIA diabetic polyneuropathy (DPN), 26 (34.2 %) patients had stage III of diabetic polyneuropathy, and polyneuropathy wasn’t detected in 18 (23.7 %) persons. Electroneuromyographic study of the fibular and tibial nerves with the myelin function state evaluation was performed, the concentration of IL-1β, TNF-α and С3 and С4 level in complement system were investigated.
Activation of complement system and pro-inflammatory cytokines, specifically TNF-α and IL-1β, as well as С3 and С4 was determined in patients with progressive DPN. We ascertained correlation between the above mentioned indices and the degree of motor nerve myelin sheaths damage in the lower extremities: between resistant latency (RL) in the stimulation of fibular and tibial nerves and С3 (r = 0.47; p = 0.031 and r = 0.58; p = 0.027, respectively), between indices of fibular and tibial nerve conduction velocity (NCV) and С3 (r = –0.38; p = 0.039 and r = –0.48; p = 0.032, respectively); between RL in tibial nerves stimulation and IL (r = 0.53; p = 0.019), between indices of tibial NCV and IL-1β (r = –0.44; p = 0.036). It shows that low-intensity inflammation common in type 2 DM, is an unfavorable background for the development of autoimmune responses to various components of myelin sheath.
In stage III of DPN the reduction of C4 index following C3 high level is observed, that can provoke the decrease in infections resistance and the increase of the risk of foot ulcer development in patients with type 2 DM.
цукровий діабет 2-го типу, діабетична полінейропатія, система комплементу, цитокіни.
сахарный диабет 2-го типа, диабетическая полинейропатия, система комплемента, цитокины.
type 2 diabetes, diabetic polyneuropathy, complement system, cytokines.
Статья опубликована на с. 101-106
Вступ
Цукровий діабет (ЦД) є основою розвитку складних супутніх захворювань та ускладнень, ранньої інвалідизації й смертності. Єдиним дебютним проявом ЦД 2-го типу може бути діабетична полінейропатія (ДПН), і у 10–15 % випадків діагноз діабету верифікується тільки після встановлення факту ураження периферичних нервів [10]. Відомо, що при початкових проявах ДПН типовим є аксональний тип ураження нервових стовбурів; з прогресуванням захворювання до патологічного процесу залучається й мієлін [17]. Демієлінізація може бути вторинним процесом, що не є специфічним і спостерігається при прогресуванні аксонального ураження нервів будь-якого генезу, але, як відомо, демієлінізації периферичних нервових волокон можуть сприяти й автоімунні процеси.
Хоча зміни в нервових волокнах є результатом гіперглікемії, що сприяє виникненню метаболічних та судинних розладів на тлі генетичної детермінованості [18], останнім часом стало відомо, що хронічна гіперглікемія й гіперінсулінемія стимулюють прозапальну активність клітинних і гуморальних ефекторів імунної системи [9]. Хронічне запалення, асоційоване з ожирінням, збільшення числа Т-клітинних популяцій, що відображає автоімунний процес, ураження панкреатичних острівців, підвищення концентрації розчинних медіаторів апоптозу бета-клітин відображають наявність клітинно-опосредкованого автоімунного процесу при ЦД 2-го типу [3]. Отже, хронічне низькоінтенсивне запалення, що виникло на тлі ЦД 2-го типу, є несприятливим фоном, на якому в подальшому розвиваються автоімунні реакції на антигени органів-мішеней [7], у тому числі й нервових волокон.
До останнього часу розвиток автозапальних і автоімунних захворювань пояснювали саме стимуляцією субпопуляції CD4+ — прозапальних клітин. Після відкриття інтерлейкінів (ІЛ), зокрема ІЛ-23, стало зрозуміло, що й інші компоненти імунної системи можуть відігравати провідну роль у розвитку автоімунних захворювань. Подібним ефектором може бути цитокін ІЛ-17, який продукується окремою субпопуляцією Т-клітин — Тh17 [16]. Хронічне запалення, що виникло на фоні тканинного дисметаболізму, збільшує експансію Тh17-субпопуляції Т-клітин [11], яка має синергічний ефект з фактором некрозу пухлини aльфа (ФНП-α) та прозапальним цитокіном ІЛ-1β [13]. Ініціаторами синтезу цитокінів є вільні радикали, продукти оксидативного стресу, а їх основними ефектами — пригнічення процесів біосинтезу білків і стимуляція апоптозу [2].
Крім того, найважливішим медіатором імунної відповіді є система комплементу, що здатна підтримувати різні запальні реакції [4, 14]. Система комплементу — це комплекс термолабільних сироваткових білків (компоненти С1-С9), каскадну активацію якого запускають імунні комплекси (класичний шлях активації) або пряме розщеплювання компонента комплементу C3 (альтернативний шлях); крім того, відомий також лектиновий шлях активації [15]. При активації комплементу утворюються: 1) медіатори запалення; 2) опсоніни, що зв’язуються з клітинами-мішенями і полегшують їх фагоцитоз; 3) мембраноатакуючий комплекс, що руйнує клітини-мішені. Визначення рівня C3 і C4 дозволяє встановити переважаючий шлях активації комплементу. C4 має важливе значення в розвитку автоімунних захворювань і використовується тільки при активації системи комплементу за класичним шляхом. C3 бере участь як у класичному, так і в альтернативному шляхах активації [2]. Незалежно від вихідного стимулюючого фактора кінцевим продуктом активації системи комплементу є складний білок, здатний руйнувати мембрани клітин, що містять чужорідні антигени, а при надмірній актівації — й автоантигени [4], джерелом яких можуть бути продукти окисної модифікації білків, перекисного окиснення ліпідів структур нервових стовбурів. Загалом неконтрольована активація комплементу, яка веде до гіперпродукції опсонінів, медіаторів запальних процесів і цитолітичних комплексів у патологічних умовах, може призводити до пошкодження здорових тканин організму [1].
Мета: встановити роль імунного фактора в патогенезі полінейропатії у хворих на ЦД 2-го типу шляхом визначення рівня ФНП-α, ІЛ-1β, показників системи комплементу С3 та С4, а також оцінити ступінь зв’язку даних характеристик імунозапального процесу з показниками функціонального стану нервових стовбурів.
Матеріал і методи дослідження
Обстежено 76 хворих на ЦД 2-го типу, які перебували на стаціонарному лікуванні в ендокринологічному відділенні Івано-Франківської обласної клінічної лікарні. Хворими була підписана інформована згода на участь у дослідженні. Середній вік становив 51,23 ± 1,79 року. Серед обстежених були 42 (55,3 %) чоловіки та 34 (44,7 %) жінки. Усі пацієнти мали середньотяжку форму діабету, що визначалось його компенсацією за рівнем глікозильованого гемоглобіну, який становив 9,18 ± 0,61 %. У 58 (76,3 %) обстежуваних хворих було діагностовано ДПН, у 18 (23,7 %) пацієнтів проявів полінейропатії виявлено не було. У дослідження включали хворих із симптомною стадією ДПН: з ІІ та ІІІ стадією за класифікацією P.J. Dyck та P.K. Tomas (1999). ІІА стадія виявлена у 32 (42,1 %) пацієнтів, ІІІ стадія ДПН — у 26 (34,2 %) хворих. Для порівняння отриманих результатів було набрано 20 практично здорових осіб (ПЗО) відповідного віку, що становили контрольну групу.
Пацієнтам було проведено загальноклінічне обстеження для виключення інших причин ураження периферичних нервів та клінічне неврологічне обстеження.
Електронейроміографічне (ЕНМГ) дослідження малогомілкових та великогомілкових нервів здійснювали на комп’ютерному двоканальному електронейроміографі «Нейро-ЭМГ-Микро» («Нейрософт», РФ) тричі на обох кінцівках з усередненням показників. Для оцінки функціонального стану аксона вивчали амплітуду потенціалу максимальної рухової відповіді — М-відповіді (мВ) на стимуляцію нерва в дистальній точці, для виявлення функціонального стану мієліну — резидуальну латенцію (РЛ) (мс) та швидкість проведення збудження (ШПЗ) (м/с) нервами.
Для оцінки цитокінового статусу в обстежених хворих визначали вміст ІЛ-1β, ФНП-α у сироватці крові методом твердофазного імуноферментного аналізу з використанням моноклональних антитіл (набір реактивів Diaclone, Франція).
Рівень компонентів комплементу С3, С4 у сироватці крові визначали методом імунотурбідиметрії з використанням тест-системи Roche Diagnostics (Швейцарія) за допомогою аналізатора Cobas 6000.
Статистична обробка отриманих результатів проведена за допомогою статистичних методів аналізу із використанням Statistica (StatSoft, Inc.) та MS Excel. Обчислювали середню арифметичну величину (М), стандартну похибку середнього (m), рівень значущості (р) перевірки статистичних гіпотез. Для оцінки вірогідності розбіжностей кількісних ознак використовували непараметричний метод статистичного аналізу — U-критерій Манна — Уїтні. Кореляційний аналіз проводили шляхом використання коефіцієнта кореляції Спірмена.
Результати дослідження та їх обговорення
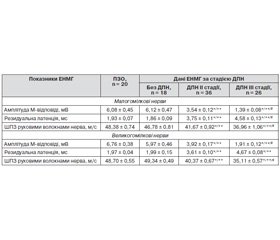
У хворих із симптомною ІІ та ІІІ стадією ДПН відзначалось вірогідне зниження амплітуди М-відповіді при дослідженні малогомілкових нервів порівняно з даними ПЗО на 41,8 % (р < 0,05) та 77,1 % (р < 0,05) відповідно (табл. 1). Водночас спостерігали вірогідно змінені показники маркерів функціонального стану мієліну. Так, показник РЛ подовжувався щодо нормативних даних при ІІ стадії ДПН у 2 рази (р < 0,05), при ІІІ стадії — у 2,5 раза (р < 0,05), а ШПЗ руховими нервами зменшувалась на 13,9 % (р < 0,05) та 23,6 % (р < 0,05) відповідно. Така ж тенденція щодо зміни характеристик нервових структур відмічалась і при аналізі даних дослідження великогомілкових нервів. У хворих на ЦД 2-го типу, ускладнений ДПН ІІІ стадії, помітне прогресування ураження периферичних нервів: усі показники ЕНМГ-дослідження вірогідно погіршувались порівняно з даними хворих із ДПН ІІ стадії (р < 0,05).
Отримані дані свідчать, що ураження моторних волокон нервів у хворих на ЦД 2-го типу, ускладнений симптомною стадією ДПН, характеризувалось змішаним характером і поглиблювалось із прогресуванням полінейропатії, що підтверджує дані літератури [18]. Поряд із ураженням аксона виявлялись ознаки демієлінізації не тільки у найбільш дистальних відділах нервових волокон, про що свідчило подовження РЛ, але й у більш проксимальних ділянках, на що вказувало сповільнення ШПЗ.
Згідно з отриманими даними у хворих без ДПН рівень С4 у сироватці крові в 1,8 раза вищий за такий у ПЗО (р < 0,05) на тлі несуттєво підвищеної концентрації С3 (p > 0,05), що свідчить про залучення системи комплементу у процес імунозапальної активації при ЦД 2-го типу, на що вказують і інші науковці [6] (табл. 2). При ДПН ІІ стадії цей процес інтенсифікується: спостерігається підвищення С3 і С4 у 2 і 1,5 раза відповідно навіть порівняно з даними пацієнтів без ДПН (р < 0,05). У хворих з ІІІ стадією ДПН рівень С3 залишається вірогідно високим, але без суттєвої різниці з показником пацієнтів із ІІ стадією (р > 0,05); стає помітним зниження рівня С4 до значень ПЗО (р > 0,05). При ІІІ стадії ДПН у 14 (53,8 %) хворих концентрація С4 була вищою за 0,45 г/л, у 6 (23 %) — нижчою за 0,25 г/л. Такі результати можуть бути зумовлені тим, що вміст С4 зменшується при його активному споживанні внаслідок активації системи комплементу за класичним шляхом, і, як зазначають [4, 8], при цьому може знижуватися опірність інфекціям, що сприяє формуванню виразок на стопах. Таким чином, як не парадоксально, але нормальний рівень С4 у хворих із ІІІ стадією ДПН, можливо, є чинником ризику розвитку виразкового процесу стопи, хоча це є попереднім висновком, що потребує подальших досліджень. Отже, дисфункція системи комплементу при ЦД 2-го типу характеризується гіперактивацією його класичного шляху, а з прогресуванням ураження периферичних нервів — і альтернативного й термінального шляхів. Для ЦД 2-го типу характерна інтенсифікація апоптозу в нейрональній та судинній тканинах. У зв’язку з цим, враховуючи отримані нами дані, не виключено, що певний внесок в цей процес роблять продукти протеолітичної активації С3 і С4 компонентів комплементу, які є відомими тригерами апоптозу [14].
У процесі дослідження виявлено варіаційну розбіжність між концентрацією ФНП-α у хворих на ЦД 2-го типу без ДПН та із симптомними стадіями полінейропатії. Навіть у пацієнтів без ДПН рівень ФНП-α був підвищеним на 26,9 % порівняно з даними ПЗО (р < 0,05) при нормальному рівні ІЛ-1β (р > 0,05). Вірогідно підвищені показники ФНП-α та ІЛ-1β при ІІ стадії ДПН щодо даних як ПЗО, так і пацієнтів без ДПН (р < 0,05) свідчать про виражену активацію імунокомпетентних клітин з прогресуванням ускладнень ЦД 2-го типу. У хворих з ІІІ стадією полінейропатії спостерігалось подальше наростання рівня зазначених інтерлейкінів (р < 0,05), що є свідченням поглиблення імунної дисфункції на тлі запального процесу при ЦД 2-го типу. Власне активація системи комплементу, зокрема ІЛ-1β, зумовлює широкий спектр патофізіологічних ефектів: індукцію синтезу гострофазових білків у печінці, посилення експресії адгезивних молекул, стимуляцію вивільнення вазодепресорних простагландинів та індуцибельної синтетази оксиду нітрогену з ендотелію [12], що підтверджує судинну теорію розвитку та прогресування ДПН. І, як зазначено в наших попередніх публікаціях [5], при цьому може посилюватися клітинна відповідь, тобто активізуються резервні ланки імунітету як адекватна відповідь організму на запальні процеси.
Встановлений кореляційний зв’язок між показниками системи комплементу та маркерами функціонального стану мієліну: між РЛ при стимуляції малогомілкових і великогомілкових нервів та С3 (r = 0,47; p = 0,031 та r = 0,58; p = 0,027 відповідно), між показниками ШПЗ малогомілковими і великогомілковими нервами та С3 (r = –0,38; p = 0,039 та r = –0,48; p = 0,032 відповідно); між показниками автозапальних і автоімунних процесів та маркерами функціонального стану мієліну: між РЛ при стимуляції великогомілкових нервів та ІЛ-1β (r = 0,53; p = 0,019), між показниками ШПЗ великогомілковими нервами та ІЛ-1β (r = –0,44; p = 0,036). Крім того, слід зауважити, що виявлена роль імунозапальних змін у розвитку аксонопатії: показник кореляції між амплітудою М-відповіді при стимуляції малогомілкових і великогомілкових нервів та С3 становив r = –0,59; p = 0,016 та r = –0,64; p = 0,009 відповідно; між амплітудою М-відповіді при стимуляції малогомілкових і великогомілкових нервів та ФНП-α — r = –0,49; p = 0,022 та r = –0,57; p = 0,017 відповідно. Це свідчить про те, що у хворих на ЦД 2-го типу, ускладнений ДПН, мієлінопатія, що супроводжує аксональне ураження периферичних нервів, є також і наслідком автоімуноагресії.
Таким чином, при ЦД 2-го типу на етапі формування такого ускладнення, як ДПН, відбувається гіперактивація системи комплементу, починаючи з класичного каскаду, а при розвитку вже симптомної стадії — й альтернативного та термінального каскаду. Це може бути зумовлено комплексом гормонально-метаболічних порушень, що спостерігаються при ЦД 2-го типу. З іншого боку, накопичення продуктів активації системи комплементу може значною мірою сприяти подальшому прогресуванню ускладнень ЦД, зокрема ДПН.
На тлі гіперглікемії відбувається неферментативне глікозилювання білкових і ліпідних структур периферичного мієліну, тобто гліколіпідів і глікопротеїдів, які набувають антигенних властивостей. Це, у свою чергу, призводить до вироблення автоантитіл, які, проникаючи через гематоневральний бар’єр, пошкоджують мієлінову оболонку, призводячи до демієлінізації.
Висновки
1. Імунозапальні зміни, що виникають у хворих на ЦД 2-го типу, сприяють розвитку та прогресуванню ДПН, що відображається активацією системи комплементу та прозапальних цитокінів, зокрема ФНП-α та ІЛ-1β, рівень яких корелює зі ступенем пошкодження мієлінових оболонок моторних волокон периферичних нервів нижніх кінцівок.
2. Підвищені показники ФНП-α та ІЛ-1β при симптомних стадіях ДПН порівняно із ПЗО та пацієнтами із ЦД 2-го типу без ДПН свідчать про виражену активацію імунокомпетентних клітин при прогресуванні ускладнень ЦД 2-го типу.
3. Рівень компонентів комплементу, а саме С3 і С4, вірогідно зростає із прогресуванням ДПН, але при ІІІ стадії спостерігається унормування показника С4 на тлі високого рівня С3. За таких обставин, згідно з літературними даними, уміст С4 зменшується внаслідок його активного споживання при активації системи комплементу за класичнім шляхом. При цьому характерне зниження опірності інфекціям і зростає ризик розвитку виразкового процесу стопи у хворих на ЦД 2-го типу.
4. Встановлений кореляційний зв’язок між показниками системи комплементу, показниками автозапальних і автоімунних процесів та маркерами функціонального стану мієліну свідчить про те, що хронічне низькоінтенсивне запалення, характерне для ЦД 2-го типу, є несприятливим фоном, на якому в подальшому розвиваються автоімунні реакції на структури мієлінової оболонки, що визначає майбутні стратегії лікування ДПН.
1. Аракелова Э.A. Мембраноатакующий комплекс как показатель гиперактивации комплемента при сахарном диабете 2 типа / Э.A. Аракелова, М.Р. Овсепян, А.С. Бояджян // Сахарный диабет. — 2011. — № 3. — С. 17–20.
2. Иммунология / Д. Мейл, Дж. Бростофф, Д.Б. Рот, А. Ройт. — М.: Логосфера, 2007. — 568 с.
3. Кайдашев И.П. Аутоиммунные повреждения панкреатических островков при сахарном диабете / И.П. Кайдашев // Клінічна імунологія. Алергологія. Інфектологія. — 2013. — № 1. — С. 12–15.
4. Назаренко Г.И. Клиническая оценка результатов лабораторных исследований / Г.И. Назаренко, А.А. Кишкун — М.: Медицина, 2006. — 543 с.
5. Скрипко Л.А. Особливості порушень імунного гомеостазу у хворих на цукровий діабет 2-го типу, ускладнений полінейропатією / Л.А. Скрипко, В.А. Гриб, В.І. Боцюрко // Галицький лікарський вісник. — 2013. — № 3. — С. 112–115.
6. Сравнительное определение уровней терминального комплекса комплемента при ишемическом инсульте, отягощенном и не отягощенном сахарным диабетом / Э.А. Аракелова, А.А. Аракелян, А.С. Бояджян [и др.] // Иммунология. — 2010. — № 6.
7. Brooks-Worrell B. Immunology in the Clinic Review Series; focus on metabolic diseases: development of islet autoimmune disease in type 2 diabetes patients: potential sequelae of chronic inflammation / B. Brooks-Worrell, J.P. Palmer // Clin. Exp. Immunol. — 2012. — Vol. 167. — P. 40–46.
8. Chernecky C.C. Laboratory tests and diagnostic procedures / C.C. Chernecky, B.J. Berger; 5th ed. — Saunder Elsevier, 2008. — 1232 p.
9. Donath M.Y. Type 2 diabetes as an inflammatory disease / M.Y. Donath, S.E. Shoelson // Nat. Rev. Immunol. — 2011. — V. 11(2). — P. 98–107.
10. Eddy J.J. Topical honey for diabetic foot ulcers / J.J. Eddy, M.D. Gideonsen // J. Fam. Pract. — 2005. — Vol. 54, № 6. — P. 533–535.
11. Furuzawa-Carballeda J. Autoimmune inflammation from the Th17 perspective / J. Furuzawa-Carballeda, M.I. Vargas-Rojas, A.R. Cabral // Autoimmun. Rev. — 2007. — 6(3). — P. 169–175.
12. Genetics of inflammation and risk of coronary artery disease: the central role of interleukin-6 / A. Woods, D.J. Brull, S.E. Humphries, H.E. Montgomery // Eur. Heart J. — 2000. — Vol. 21. — P. 1574–1583.
13. Miossec P. Interleukin-17 and type 17 helper T cells / P. Miossec, Т. Korn, V.K. Kuchroo // N. Engl. J. Med. — 2009. — Vol. 361(9). — Р. 888–898.
14. Mollnes T.E. Complement in inflammatory tissue damage and disease / T.E. Mollnes, W.C. Song, J.D. Lambris // Trends Immunol. Today. — 2002. — V. 23(2). — P. 61–66.
15. Nauta A.J., Roos A., Daha M.R. A regulatory role for complement in innate immunity and autoimmunity / A.J. Nauta, A. Roos, M.R. Daha // Int. Arch. Allergy Immunol. — 2004. — Vol. 134, № 4. — P. 310–323.
16. Obesity predisposes to Th17 bias / S. Winer, G. Paltser, Y. Chan [et al.] // Eur. J. Immunol. — 2009. — 39(9). — P. 2629–2635.
17. Rickey E. Modeling nerve conduction criteria for diagnosis of diabetic polyneuropathy / E.С. Rickey, J. William // Muscle and Nerve. — 2011. — Vol. 44. — P. 340–345.
18. Ziegler D. Treatment of diabetic neuropathy and neuropathic pain / D. Ziegler // Diabetic Care. — 2008. — Vol. 33. — P. 255–261.

/103/103.jpg)
/104/104.jpg)