Журнал «» 1 (39) 2015
Вернуться к номеру
Cовременные аспекты контроля артериального давления: достаточно ли рутинного измерения? (Часть I)
Авторы: Радченко А.Д. – ГУ «ННЦ «Институт кардиологии имени академика Н.Д. Стражеско» НАМН Украины, г. Киев
Рубрики: Кардиология
Разделы: Справочник специалиста
Версия для печати
Данная статья является обзором данных литературы, разъясняющим врачу, какие существуют дополнительные показатели контроля АД и почему необходимо их учитывать в лечении АГ.
Дана стаття є оглядом даних літератури, що роз’яснює лікарям, які існують додаткові показники конт-ролю АТ і чому необхідно їх враховувати в лікуванні АГ.
This article is a review of the literature data, explaining to a doctor, what the additional indicators of BP control are, and why they need to be considered in the treatment of AH.
артериальное давление, рутинное измерение, вариабельность, суточное мониторирование, аортальное давление.
артеріальний тиск, рутинне вимірювання, варіабельність, добове моніторування, аортальний тиск.
blood pressure, routine measurement, variability, daily monitoring, aortic pressure.
Статья опубликована на с. 7-18
Артериальная гипертензия (АГ) является самым распространенным заболеванием на нашей планете, которое, с одной стороны, приводит к осложнениям (инсульт, инфаркт миокарда, почечная недостаточность, смерть), с другой стороны, достаточно легко лечится назначением современных антигипертензивных препаратов (АГП). При этом самым важным свойством АГП должно быть эффективное снижение артериального давления (АД). Как правило, под эффективным контролем АД понимают достижение его целевого уровня, которое оценивается при рутинном (или офисном) измерении врачом. В некоторых исследованиях было продемонстрировано, что при одинаковом контроле офисного АД отдельные препараты или комбинации лучше предупреждали сердечно-сосудистые события, чем другие. Это стало поводом для возникновения дискуссий о значимости так называемых плейотропных эффектов. Плейотропные эффекты — это не связанные со снижением АД положительные влияния на метаболизм, структурные изменения сердечно-сосудистой системы, реологические свойства крови, противо- и провоспалительные агенты и т.д. Эти эффекты могут представлять научный интерес, однако рассматривать их пользу для каждого конкретного препарата необходимо только в сочетании с влиянием на АД, которое может оцениваться не только по данным офисного измерения, но и по данным других дополнительных обследований. До настоящего времени не проводилось рандомизированных клинических исследований, в которых бы получили одинаковый контроль всех параметров, характеризующих давление. Поэтому до сих пор остается неоспоримым факт, что самым важным в предупреждении кардиоваскулярных осложнений остается контроль АД и его оценка должна не ограничиваться только измерением офисного АД, а опираться на данные суточного мониторирования, домашнего самомониторирования и оценки центрального АД [52, 53, 58, 77, 92]. Кроме того, необходимо учитывать колебания офисного АД на протяжении определенного промежутка времени (в течение одного визита, или нескольких визитов, или суток). Эффективной будет та терапия, которая обеспечивает нормализацию показателей всех этих измерений (рис. 1).
/7/7.jpg)
Эта статья является обзором данных литературы, разъясняющим врачу, какие существуют дополнительные показатели контроля АД и почему необходимо их учитывать в лечении АГ.
Данные суточного мониторирования артериального давления
Однократно или даже несколько раз измеренное АД, по словам известного специалиста в области АГ профессора G. Mancia, отражает только «меньше чем микроскопическую часть от тысяч значений этого показателя» в течение суток. Появление суточного мониторирования АД (СМАД) позволило ближе подойти к оптимальной оценке его уровня. В исследовании Ohashama было показано, что смертность от сердечно-сосудистых заболеваний в популяции возрастает при увеличении среднесуточного систолического (САД) и диастолического (ДАД) АД, независимо от уровня офисного АД [52].
В другом наблюдении — PIUMA (Progetto Ipertensione Umbria Monitoriaggio Ambulatoriale) показано, что частота возникновения сердечно-сосудистых осложнений достоверно увеличивалась при неадекватном контроле среднесуточного АД. В то же время такой зависимости относительно офисного АД не наблюдалось [83, 88]. В исследовании OvA (offіce vs ambulatory), в которое было включено 1963 пациента с АГ на фоне антигипертензивной терапии (АГТ), оказалось, что среди пациентов с офисным САД < 140 мм рт.ст. были лица (15 %) с повышенным среднесуточным САД (> 135 мм рт.ст.) и именно у них достоверно чаще возникали осложнения на протяжении 5 лет (фактически так же часто, как и при офисном САД > 160 мм рт.ст.) [10]. С другой стороны, среди пациентов с офисным САД > 160 мм рт.ст. были 37,3 % с нормальным уровнем среднесуточного САД (< 135 мм рт.ст.), что возможно при АГ «белого халата», и у них значительно реже возникали осложнения, чем у пациентов с повышенным и офисным, и среднесуточным АД. Таким образом, не всегда достижение целевого офисного АД означает хороший прогноз. И наоборот, не всегда повышенное офисное АД сопряжено с плохим прогнозом. В исследовании J. Staessen с соавторами (рис. 2) использование СМАД позволило достоверно уменьшить назначение антигипертензивных препаратов пожилым пациентам за счет своевременного выявления случаев АГ «белого халата» и избежать чрезмерного использования АГП у пациентов, у которых отмечался эффект «белого халата» [75, 76]. Это значительно сократило расходы на лечение таких больных.
Поэтому в настоящее время британские рекомендации по лечению АГ (NICE, 2011) указывают, что для диагностики и контроля эффективности антигипертензивной терапии необходимо всем пациентам проводить СМАД и только в случае непереносимости этой процедуры может быть рекомендовано домашнее самомониторирование [32]. В европейских же рекомендациях указано, что всем не обязательно проводить СМАД, а только определенным категориям пациентов, потому что неоправданным является рекомендовать этот относительно дорогостоящий метод обследования в странах с плохой экономической ситуацией.
Но как бы там ни было, все признают, что метод СМАД дает гораздо больше для диагностики и определения прогноза у пациентов как с АГ (в том числе и резистентной), так и с сопутствующими состояниями (сахарный диабет, хроническое поражение почек, беременность), чем просто офисное измерение АД.
Показания к проведению суточного мониторирования артериального давления (рекомендации ESC/ESH, 2013) [5]:
• подозрение на наличие АГ «белого халата»:
– 1-я степень АГ в офисе врача;
– высокое офисное АД у лиц с отсутствием бессимптомного поражения органов и с низким общим риском кардиоваскулярных осложнений;
• подозрение на наличие «маскированной» АГ:
– высокое нормальное АД в офисе врача;
– нормальное офисное АД у лиц с поражением органов-мишеней или с высоким общим риском сердечно-сосудистых осложнений;
• выявление эффекта «белого халата» у пациентов с АГ;
• значительные колебания АД во время одного и того же или разных визитов;
• автономная, постуральная, постпрандиальная гипотензия, гипотензия, вызванная послеобеденным отдыхом или лекарственными препаратами;
• повышенное офисное АД или подозрение на преэклампсию у беременных;
• определение истинной или ложной резистентной АГ;
• значительные различия между уровнем офисного АД и данными домашнего самомониторирования;
• оценка статуса снижения АД во время сна;
• подозрение на ночную АГ или отсутствие снижения АД во время сна у пациентов с синдромом ночного апноэ, хроническим поражением почек или сахарным диабетом;
• оценка вариабельности АД.
Различают среднесуточное АД — среднее за сутки, среднее дневное АД — среднее в активный (бодрствования) период (как правило, с 6:00 до 22:00) и среднее ночное АД — среднее в период сна. Нормальные пороговые значения для этих показателей представлены в табл. 1.
/9/9.jpg)
Как правило, снижение офисного АД влечет за собой снижение и среднесуточного, и дневного, и ночного АД. Однако степень снижения и частота достижения целевого АД по данным этих методов измерения АД может значительно отличаться. Так, считается, что пациент хорошо ответил на АГТ (т.е. является «ответчиком»), если офисное САД/ДАД снизилось на 20/10 мм рт.ст., а среднесуточное — всего на 10/5 мм рт.ст. [59, 87]. По данным проведенного в Украине исследования, которое включало данные офисного измерения и суточного мониторирования 210 пациентов с мягкой и умеренной АГ, частота достижения целевого офисного АД (< 140/90 мм рт.ст.) составила 52,2 % на фоне монотерапии и 62 % на фоне комбинированной терапии. В то же время частота достижения целевого среднесуточного АД (< 125/80 мм рт.ст.) была намного меньше — всего 30,8 и 34,6 % [3]. А это означает, что у части пациентов с нормализовавшимся офисным АД среднесуточное остается повышенным и, соответственно, риск возникновения кардиоваскулярных осложнений также остается повышенным.
В исследовании ASCOT сравнивали две схемы терапии — на основе амлодипина (± периндоприл) и на основе атенолола (± тиазидный диуретик). Оказалось, что при одинаковом достижении целевого офисного АД в группе амлодипин/периндоприл риск возникновения инсульта и сердечно-сосудистой смерти был достоверно ниже, чем в группе атенолол/диуретик. При этом на протяжении всего периода наблюдения (рис. 3), согласно данным СМАД, пациенты в группе амлодипин/периндоприл имели достоверно лучший контроль ночного САД, чем пациенты в группе атенолол/диуретик.
/9/9_2.jpg)
Значение контроля именно АД, измеренного при СМАД, подтверждают и данные исследования E. Dolan с соавторами. Риск возникновения сердечно-сосудистой смерти на протяжении 5 лет у 5292 участников возрастал по мере увеличения и САД, и ДАД [16]. Однако если зависимость между смертностью и уровнем офисного АД (рис. 4) носила линейный характер, причем линия была достаточно пологая, с небольшим углом отклонения от горизонтальной, то зависимость между смертностью и уровнем ночного АД выглядела уже как часть параболы: при отсутствии контроля ночного САД риск возрастал в геометрической прогрессии. Поэтому очень важно не просто снизить офисное АД, но и обеспечить контроль среднесуточного, в том числе и ночного АД.
Считается, что именно ночное АД более тесно коррелирует не только с прогнозом, но и с поражением органов-мишеней, особенно у пациентов с сахарным диабетом, поражением почек и у беременных. Возможно также существование у 10–20 % пациентов так называемой «маскированной» АГ, которую можно выявить только при СМАД или самомониторировании, так как уровень офисного АД у них часто нормальный или повышенно-нормальный (рис. 5).
/11/11.jpg)
Однако не только величина показателей среднего уровня суточного АД имеет значение. Существуют еще и так называемые компоненты вариабельности АД. Под вариабельностью АД понимают колебания (изменения) величины АД на протяжении определенного промежутка времени (суток, дня, ночи, визита к врачу, года) или относительно какого-то периода времени (изменение величины АД ночью по сравнению с дневным периодом). СМАД как раз позволяет оценивать большинство из указанных компонентов. Более подробно оценка этих показателей рассматривается в соответствующем разделе ниже.
Кроме того, СМАД позволяет оценивать такой параметр, как нагрузка временем (индекс времени), который определяется как процент измерений САД или ДАД, которые превышали нормальный показатель за соответствующий период (днем ≥ 140/90 мм рт.ст., ночью ≥ 120/70 мм рт.ст.). Считается, что данный показатель не должен превышать 25–30 % для САД и 15–20 % для ДАД [87]. В исследовании Y. Mchizuki с соавторами показано, что если величина индекса времени превышала 50 %, то гипертрофия левого желудочка выявлялась у 88 % пациентов с АГ, если менее 50 % — то только у 9,9 % [47]. Согласно данным нашего собственного исследования, именно с индексом времени лучше всего коррелировали такие показатели, характеризующие поражение органов-мишеней, как индекс массы миокарда левого желудочка и клиренс креатинина [4]. А это означает, что важно оценивать не просто наличие повышенного АД, а и то, как длительно оно остается повышенным на протяжении суток. Индекс нагрузки временем также может служить дополнительным критерием эффективности АГТ: его снижение свидетельствует о правильности выбранной терапии.
/12/12.jpg)
Таким образом, СМАД является высокоинформативным методом диагностики АГ, показатели СМАД являются независимыми предикторами риска сердечно-сосудистых осложнений, СМАД лучше, чем рутинное измерение АД, может предсказать поражение органов-мишеней и обеспечивает достоверный контроль эффективности антигипертензивной терапии.
Данные домашнего самомониторирования АД
Наряду с методом СМАД полезную информацию можно получить, используя домашнее самомониторирование. Существуют многочисленные рекомендации по использованию данного метода измерения АД [55, 56], которые заостряют внимание на том, что пациент должен быть обученным правильному измерению и пользоваться стандартизированным прибором. Приборы, которые измеряют АД на кисти, допускаются к применению только у лиц с выраженным ожирением, когда невозможно измерить АД большой манжеткой на плече. Обычно рекомендуют измерять АД на протяжении 3–4 или лучше 7 дней, утром и вечером. Каждое измерение делается как минимум два раза с интервалом 1–2 минуты, в тех же условиях, что и обычное офисное измерение. Лучше, если аппарат имеет функцию сохранения информации и возможность считывания этой информации через персональный компьютер. Под АД, измеренным при домашнем самомониторировании, понимают среднее АД из всех измерений, за исключением данных первого дня. В норме уровень САД/ДАД при домашнем самомониторировании не должен превышать 135/85 мм рт.ст. При таком уровне АД и выше говорят о наличии АГ или недостаточном контроле АГ на фоне терапии.
Домашнее самомониторирование имеет некоторые преимущества перед офисным измерением АД и СМАД. Во-первых, возможно получение данных на протяжении нескольких дней, недель и месяцев, что позволяет лучше оценивать эффект АГТ. Во-вторых, данный метод, так же как и СМАД, позволяет исключить наличие у пациента АГ «белого халата» или диагностировать «маскированную» АГ (рис. 5). В-третьих, метод позволяет получать данные, которые хорошо коррелируют с поражением органов-мишеней, особенно с гипертрофией левого желудочка [8, 25], и имеют независимое прогностическое значение [78, 84], которое сопоставимо со значением данных СМАД [20, 40]. При этом метод домашнего самомониторирования относительно более дешевый, чем метод СМАД. В-четвертых, использование домашнего самомониторирования позволяет вовлекать пациента в процесс лечения, что повышает его приверженность к терапии. В-пятых, с помощью домашнего самомониторирования можно оценивать колебания (вариабельность) уровня АД на протяжении длительного периода времени (недели, месяца, года), что также может иметь независимое прогностическое значение [31].
Таким образом, использование домашнего самомониторирования позволяет получать информацию об АГ и эффективности АГТ, которая значительно дополняет данные рутинного измерения офисного АД и способствует более качественному контролю АД.
Центральное АД
Уже достаточно давно в небольших инвазивных исследованиях отмечено, что внутриаортальное давление отличается от АД, измеренного неинвазивно на плечевой артерии. Однако долгое время исследования по определению роли центрального и периферического АД в течении АГ сдерживались отсутствием валидной техники, которая бы позволяла неинвазивно оценить центральное давление у большого количества пациентов. Лишь относительно недавно появилась такая техника и стали накапливаться свидетельства о том, что центральное АД имеет большее значение, чем АД, измеренное на плечевой артерии, как в развитии поражения органов-мишеней, так и в возникновении кардиоваскулярных осложнений [33, 45, 64, 80]. Действительно, именно центральное АД оказывает непосредственное воздействие на органы-мишени. И логично предположить, что если аортальное давление приводит к поражению органов-мишеней, то это влияет и на прогноз. Перечень некоторых исследований, в которых именно центральному АД отдается ведущая роль в развитии поражения органов-мишеней, представлен в табл. 2.
В популяционном исследовании Strong Heart [64] продемонстрировано, что увеличение центрального пульсового АД (ПАД) на каждые 10 мм рт.ст. приводит к достоверному увеличению риска кардиоваскулярных осложнений на 23 %, в то время как увеличение на эти же 10 мм рт.ст. давления на плечевой артерии сопровождается недостоверным повышением риска на 12 %.
Считается, что в популяции оптимальным уровнем центрального САД является его величина < 110 мм рт.ст. (ближе к 100 мм рт.ст.), что эквивалентно давлению на плечевой артерии < 120 мм рт.ст. [45]. В то же время центральное САД < 120 мм рт.ст. эквивалентно давлению на плечевой артерии < 140 мм рт.ст.
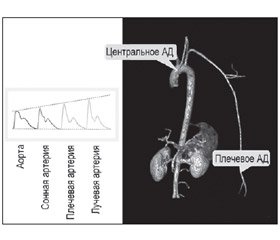
Безусловно, существует корреляция между АД, которое измерено на плечевой артерии обычным способом, и АД, которое реально есть в аорте. Однако на самом деле центральное (или аортальное) АД ниже, чем АД в плечевой артерии [57, 68]. Самые большие различия существуют для САД и ПАД. Это связано с тем, что уровень САД частично зависит от отражения пульсовой волны (места отражения, амплитуды, скорости возврата) и ее суммирования с прямой волной [51]. Поэтому он может быть разным в разных местах артериального дерева (рис. 6). Чем дальше от аорты мы измеряем АД, тем больше вероятность того, что прямая и отраженная пульсовые волны встретятся в систолу, и тогда САД повысится на величину, которую вносит отраженная пульсовая волна (эффект амплификации). Эта разница между центральным и периферическим АД может колебаться от 1 до 33 мм рт.ст. [50, 74]. Центральное ДАД, как правило, очень близко к периферическому ДАД. Среднее АД остается относительно постоянным (с тенденцией к снижению по мере движения к периферии) в крупных артериях большого круга [51]. Если бы величина амплификации давления оставалась постоянной для одного и того же пациента, то давление на плечевой артерии было бы хорошим суррогатным показателем для оценки центрального АД. Однако оказывается, что степень амплификации изменяется под воздействием различных факторов: возраста, АД, ЧСС, терапии. Поэтому периферическое АД, в отличие от центрального, не может считаться идеальным предиктором прогноза.
У молодых людей, особенно высокого роста (рис. 7), за счет амплификации может значительно увеличиваться САД и ПАД на плечевой артерии (возникает так называемая изолированная систолическая гипертензия у молодых), тогда как центральное САД и ПАД может быть нормальным [88]. Это может привести к гипердиагностике АГ и повлиять на выбор профессии или дальнейшую карьеру этих людей. Как правило, такие лица — с изолированной систолической АГ и нормальным центральным АД — не нуждаются в лечении [69]. И это единственная на настоящий момент категория пациентов с АГ, которой, согласно европейским рекомендациям 2013 г. [5], обязательно необходимо проводить неинвазивное определение центрального АД.
У пожилых людей эффект амплификации значительно меньше (рис. 8). Но может наблюдаться ситуация, когда под влиянием терапии степень снижения АД на плечевой артерии не совпадает со снижением центрального АД. При одинаковом достигнутом уровне АД на плечевой артерии центральное САД может значительно отличаться, что приводит к недооценке кардиоваскулярного риска при сохранении центрального САД высоким.
Считается, что практически все АГП снижают центральное АД. Однако степень этого снижения может отличаться и не всегда коррелировать со степенью снижения офисного АД. Так, по данным одного из первых метаанализов [48], антагонисты кальция и диуретики одинаково снижают и центральное, и периферическое АД (рис. 9). Ингибиторы ангиотензинпревращающего фермента (АПФ) снижают центральное АД в большей степени, чем периферическое. Поэтому иногда говорят о недооценке эффективности ингибиторов АПФ. Бета-блокаторы, особенно без вазодилатирующего эффекта, снижают центральное АД в меньшей степени, чем АД на плечевой артерии. Данные этого метаанализа были подтверждены и данными более нового исследования, в которое вошли результаты наблюдения с блокаторами рецепторов ангиотензина (БРА) II (так же как ингибиторы АПФ снижают центральное АД) [42].
Исходя из этого, можно сказать, что наиболее выгодными двойными комбинациями АГП могут быть «антагонист кальция + диуретик», «ингибитор АПФ (БРА II) + антагонист кальция или диуретик». При назначении таких комбинаций можно быть уверенным и без специального измерения, что если офисное АД снизилось достаточно, то и центральное АД снизится так же хорошо. Самой невыигрышной двойной комбинацией является комбинация, включающая бета-адреноблокаторы без вазодилатирующего действия. Считается, что эти препараты, замедляя ЧСС, способствуют возврату отраженной пульсовой волны в систолу и дополнительному увеличению систолического центрального АД.
В исследовании ASCOT (рис. 10) было подтверждено, что при одинаковом снижении офисного АД комбинация «антагонист кальция (амлодипин)/ингибитор АПФ (периндоприл)» обеспечивала большее снижение центрального САД, чем комбинация «бета-блокатор (атенолол)/диуретик (тиазид)». Разница составила 4,3 мм рт.ст., что в большой популяции исследования ASCOT обеспечило значительную разницу во влиянии на частоту развития кардиоваскулярных событий в пользу комбинации «амлодипин/периндоприл» [91].
/15/15.jpg)
Таким образом, определение центрального АД позволяет лучше стратифицировать риск пациента (cоответственно, выбирать, лечить (усиливать терапию) или не лечить (не изменять терапию) пациента) и обеспечивать контроль эффективности АГТ. Необходимы дальнейшие исследования, которые бы обосновывали выбор наиболее перспективных для прогноза терапевтических вмешательств. Кроме того, в настоящее время стали появляться работы по изучению изменений центрального АД на протяжении 24 часов с помощью специальных приборов [46, 90]. При этом можно получать данные не только об уровне центрального АД, но и о его изменении на протяжении дня и ночи, что открывает новые просторы для дальнейшего изучения.
Продолжение в следующем номере
1. Кобалава Ж.Д., Терещенко С.Н., Калинкин А.Л. Суточное мониторирование артериального давления: методические аспекты и клиническое значение. — М., 1997. — 32 с.
2. Настанова та клінічний протокол надання медичної допомоги «Артеріальна гіпертензія». Наказ МОЗ України № 384 від 24.05.2012. — Київ, 2012. — 107 с.
3. Радченко Г.Д. Оцінка ефективності терапії за даними добового моніторування та офісного вимірювання артеріального тиску // Укр. кардіол. журнал. — 2003. — № 1 — С. 71–74.
4. Торбас О.О., Радченко Г.Д. Порівняння значення офісного, середньодобового та центрального артеріального тиску у формуванні ураження органів-мішеней // Артериальная гипертензия. — 2014. — № 3. — С. 49–54.
5. 2013 ESH/ESC Guidelines for the management of arterial hypertension. TheTask Force for the management ofarterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC) // Journal of Hypertension. — 2013. — Vol. 31. — P. 1281–1357
6. Baguet J., Barone-Rochette S., Pepin J. Hypertension and obstructive sleep apnoe syndrome: current perspectives // J. Hum. Hypertens. — 2009. — Vol. 23. — P. 431–443.
7. Björklund K., Lind L., Zethelius B. Prognostic significance of 24-h ambulatory blood pressure characteristics for cardiovascular morbidity in a population of elderly men // J. Hypertension. — 2004. — 22. — 1691–1697.
8. Bliziotis I.A., Destounis A., Stergiou G.S. Home vs. ambulatory and office blood pressure in predicting target organ damage in hypertension: a systematic review and meta-analysis // J. Hypertens. — 2012. — Vol. 30. — P. 1289–1299.
9. Boggia J., Li Y., Thijs L. et al. International database on ambulatory blood pressure monitoring in relation to cardiovascular outcomes (IDACO) investigators. Prognostic accuracy of day versus night ambulatory blood pressure: cohort study // Lancet. — 2007. — Vol. 370. — P. 1219–1229.
10. Clement D.L., De Buyzere M. Office versus Ambulatory (OvA) recording of blood pressure, a European multicenter study: inclusion and early follow-up characteristics // Blood Press Monit. — 1998. — Vol. 3 (3). — P. 167–172.
11. Coleman C., Stowasser M., Jenkins C. et al. Central hemodynamics and cardiovascular risk in nondippers // J. Clin. Hypertens. — 2011. — Vol. 13. — P. 557–562.
12. Cuffe R.L., Rothwell P.M. Medium-term variability in systolic blood pressure is an independent predictor of stroke // Cerebrovasc. Dis. — 2005. — Vol. 19, Suppl. 2. — P. 51.
13. Cuspidi C., Meani S., Lonati L. et al. Short-term reproducibility of a non-dipping pattern in type 2 diabetic hypertensive patients // J. Hypertens. — 2006. — Vol. 24. — P. 647–653.
14. Cuspidi C., Meani S., Valerio C. et al. Noctural non-dipping patterns in untreated hypertensives at different cardiovascular risk according to the 2003 ESH/ESC guidelines // Blood Press. — 2006. — Vol. 15. — P. 37–44.
15. Dolan E., Stanton A., Atkins N., Den Hond E., Thijs L., McCormack P. et al. Determinants of white-coat hypertension // Blood Press Monit. — 2004. — Vol. 9. — P. 307–309.
16. Dolan E., Stanton A., Thijset L. et al. Superiority of Ambulatory Over Clinic Blood Pressure Measurement in Predicting Mortality The Dublin Outcome Stud // Hypertension. — 2005. — Vol. 46. — P. 156–161.
17. Dolan E., O’Brien E. on behalf of the ASCOT investigators // J. Hypertens. — 2009. — Vol. 27. — P. 876–885.
18. Fagard R.H., Cornelissen V.A. Incidence of cardiovascular events in white-coat, masked and sustained hypertension vs. true normotension: a meta-analysis // J. Hypertens. — 2007. — Vol. 25. — 2193–2198.
19. Fagard R.H., De Cort P. Orthostatic hypotension is a more robust predictor of cardiovascular events than night-time reverse dipping in elderly // Hypertension. — 2010. — Vol. 56. — P. 56–61.
20. Fagard R.H., Van Den Broeke C., De Cort P. Prognostic significance of blood pressure measured in the office, at home and during ambulatory monitoring in older patients in general practice // J. Hum. Hypertens. — 2005. — Vol. 19. — P. 801–807.
21. Farrell B., Godwin J., Richards S., Warlow C. The United Kingdom transient ischaemic attack (UK-TIA) aspirin trial: final results // J. Neurol. Neurosurg. Psychiatry. — 1991. — Vol. 54. — P. 1044–1054.
22. Fedorowski A., Stavenow L., Hedblad B., Berglund G., Nilsson P.M., Melander O. Orthostatic hypotension predicts all-cause mortality and coronary events in middle-aged individuals (The Malmo Preventive Project) // Eur. Heart J. — 2010. — Vol. 31. — P. 85–91.
23. Franklin S.S., Thijs L., Hansen T.W., Li Y., Boggia J., Kikuya M. et al. Significance of white-coat hypertension in older persons with isolated systolic hypertension: a meta-analysis using the International Data-base on Ambulatory Blood Pressure Monitoring in Relation to Cardiovascular Outcomes population // Hypertension. — 2012. — Vol. 59. — P. 564–571.
24. Freitas J., Teixeira E., Santos R. et al. Circadian heart rate and blood pressure variability in autonomic failure // Rev. Port. Cardiol. — 2005. — Vol. 24. — P. 241–249.
25. Gaborieau V., Delarche N., Gosse P. Ambulatory blood pressure monitoring vs. self-measurement of blood pressure at home: correlation with target organ damage // J. Hypertens. — 2008. — Vol. 26. — P. 1919–1927.
26. Grassi G., Bombelli M., Seravalle G. et al. Diurnal blood pressure variation and sympathetic activity // Hypertens. Res. — 2010. — Vol. 33. — P. 381–385.
27. Hayreh S. Role of nocturnal arterial hypotension in the development of ocular manifestations of systemic arterial hypertension // Cur. Opin. Phthalmol. — 1999. — Vol. 10. — Р. 474–482.
28. Hoshide Y., Kario K., Schwartz J. et al. Incomplete benefit of antihypertensive therapy on stroke reduction in older hypertensives with abnormal nocturnal blood pressure dipping (extreme-dippiers versus reverse-dippers) // Am. J. Hypertens. — 2002. — Vol. 15. — P. 844–850.
29. Kario K., Pickering T., Matsuo T. et al. Stroke prognosis and abnormal nocturnal blood pressure falls in older hypertensives // Hypertens. — 2001. — Vol. 38. — Р. 852–857.
30. Kario K., Pickering T., Umeda Y. et al. Morning surge in blood pressure as a predictor of silent and clinical cerebrovascular disease in elderly hypertensives: a prospective study // Circulation. — 2003. — Vol. 18. — P. 1401–1416.
31. Kikuya M., Ohkubo T., Metoki H., Asayama K., Hara A., Obara T. et al. Day-by-day variability of blood pressure and heart rate at home as a novel predictor of prognosis: the Ohasama study // Hypertension. — 2008. — Vol. 52. — P. 1045–1050.
32. Krause T., Lovibond K., Caulfield M. et al. Management of hypertension: summary of NICE guidance // BMJ. — 2011. — 343:d4891 doi: 10.1136/bmj.d4891
33. Laurent S., Boutouyrie P., Asmar R. et al. Aortic stiffness is an independent predictor of all-cause and cardiovascular mortality in hypertensive patients // Hypertension. — 2001. — Vol. 37. — P. 1236–1241.
34. Liu M., Takahashi H., Morita Y. et al. Non-dipping is a potent predictor of cardiovascular mortality and is associated with autonomic dysfunction in haemodialysis patients // Nephrol. Dial. Transplant. — 2003. — Vol. 18. — P. 563–569.
35. Lurbe E., Redon J. Assessing ambulatory blood pressure in renal disease: facts and concerns // Nephrol. Dial. Transplant. — 1999. — Vol. 14. — P. 2564–2568.
36. Lurbe E., Redon J., Kesani A. et al. Increase in nocturnal blood pressure and progression to microalbuminuria in type 1 diabetes // N. Engl. J. Med. — 2002. — Vol. 347. — P. 797–805.
37. Mancia G., Bombelli M., Facchetti R. et al. Long-term prognostic value of blood pressure variability in the general population: results of the Pressioni Arteriose Monitorate e Lassociazioni Study // Hypertension. — 2007. — Vol. 49. — P. 1265–1270.
38. Mancia G., Bombelli M., Facchetti R., Madotto F., Quarti-Trevano F., Grassi G., Sega R. Increased long-term risk of new-onset diabetes mellitus in white-coat and masked hypertension // J. Hypertens. — 2009. — Vol. 27. — P. 1672–1678.
39. Mancia G., Bombelli M., Facchetti R., Madotto F., Quarti-Trevano F., Polo Friz H. et al. Long-term risk of sustained hypertension in white-coat or masked hypertension // Hypertension. — 2009. — Vol. 54. — P. 226–232.
40. Mancia G., Facchetti R., Bombelli M., Grassi G., Sega R. Long-term risk of mortality associated with selective and combined elevation in office, home and ambulatory blood pressure // Hypertension. — 2006. — Vol. 47. — P. 846–853.
41. Mancia G., Zanchetti A. White-coat hypertension: misnomers, misconceptions and misunderstandings. What should we do next? // J. Hypertens. — 1996. — Vol. 14. — P. 1049–1052.
42. Manisty C.H., Hughes A.D. Meta-analysis of the comparative effects of different classes of antihypertensive agents on brachial and central systolic blood pressure, and augmentation index // Br. J. Clin. Pharmacol. — 2013. — Vol. 75 (1). — P. 79–92.
43. Mansoor G., White W., McCabe E., Giacco S. The relationship of electronically monitored physical activity of blood pressure, heart rate and the circadian blood pressure profile // Am. J. Hypertens. — 2000. — Vol. 13. — P. 262–267.
44. Masahiro Kikuya, Atsushi Hozawa, Takayoshi Ohokubo. Prognostic Significance of Blood Pressure and Heart Rate Variabilities: The Ohasama Study // Hypertension. — 2000. — Vol. 36. — P. 901–906.
45. McEniery C., McDonnell Y., Munnery M. et al. Оn Behalf of the Anglo-Cardiff Collaborative Trial Investigators Central Pressure: Variability and Impact of Cardiovascular Risk Factors The Anglo-Cardiff Collaborative Trial II // Hypertension. — 2008. — Vol. 51. — P. 1476–1482.
46. McEniery C., Smith J., Day L. et al. 24 hour ambulatory central blood pressure measurement reveals significant variation in pulse pressure amplification between day and night // J. Hypertens. — 2012. — Vol. 30, Suppl. A. — P. 2–3.
47. Mchizuki Y., Okutani M., Donfeng Y. еt al. Limited Reproducibility of Circadian Variation in Blood Pressure Dippers and Nondippers // Am. J. Hypertens. — 1998. — Vol. 11. — P. 403–409.
48. Мorgan T., Lauri J., Bertram D., Anderson A. Effect of different antihypertensive drug classes on central aortic pressure // Am. J. Hypertens. — 2004. — Vol. 17. — 118.
49. Muntner P., Shimbo D., Tonelli M., Reynolds K., Arnett D.K., Oparil S. The relationship between visit-to-visit variability in systolic blood pressure and all-cause mortality in the general population: findings from NHANES III, 1988 to 1994 // Hypertension. — 2011. — Vol. 57. — Р. 160–166.
50. Nakamura M., Sato K., Nagano M. Estimation of aortic systolic blood pressure in community-based screening: the relationship between clinical characteristics and peripheral to central blood pressure differences // J. Hum. Hypertens. — 2005. — Vol. 19. — P. 251–253.
51. Nichols W., O’Rourke M., McDonald’s. Blood Flow in Arteries: theoretical, experimental and clinical principles. — London: Hodder Arnold, 2005. — P. 166–267.
52. Ohkubo T., Hozawa A., Nagai K. et al. Prediction of stroke by ambulatory blood pressure monitoring versus screening blood pressure measurements in a general population: the Ohasama study // J. Hypertens. — 2000. — Vol. 18. — P. 847–854.
53. Ohkubo T., Hozawa A., Yamaguchi J. et al. Prognostic significance of the norturnal decline in blood pressure in individuals with and without high 24-h blood pressure: the Ohasama study // J. Hypertens. — 2002. — Vol. 20. — Р. 2183–2189.
54. Parati G., Ochoa J., Salvi P. et al. Prognostic Value of Blood Pressure Variability and Average Blood Pressure Levels in Patients With Hypertension and Diabetes // Diabetes Care. — 2013. — Vol. 36. — P. 312–324.
55. Parati G., Stergiou G.S., Asmar R., Bilo G., de Leeuw P., Imai Y. et al. European Society of Hypertension practice guidelines for home blood pressure monitoring // J. Hum. Hypertens. — 2010. — Vol. 24. — P. 779–785.
56. Parati G., Stergiou G.S., Asmar R., Bilo G., de Leeuw P., Imai Y. et al. European Society of Hypertension Working Group on Blood Pressure Monitoring. European Society of Hypertension guidelines for blood pressure monitoring at home: a summary report of the Second International Consensus Conference on Home Blood Pressure Monitoring // J. Hypertens. — 2008. — Vol. 26. — P. 1505–1526.
57. Pauca A., Wallenhaupt S., Kon N., Tucker W. Does radial artery pressure accurately reflect aortic pressure? // Chest. — 1992. — Vol. 102. — P. 1193–1198.
58. Pedersen O., Mancia G., Pickering T. et al. Ambulatory blood pressure monitoring after 1 year on valsartan or amlodipine-based treatment: a VALUE substudy // J. Hypertens. — 2007. — Vol. 25. — P. 707.
59. Pickering T.G. Self-Monitoring of Blood Pressure. — London: Science Press, 1997. — 58 p.
60. Pierdomenico S.D., Cuccurullo F. Prognostic value of white-coat and masked hypertension diagnosed by ambulatorymonitoring in initially untreated subjects: an updated meta analysis // Am. J. Hypertens. — 2011. — Vol. 24. — P. 52–58.
61. Readon J., Martinez F. Ambulatory blood pressure in clinical practice: clinical relevance of circadian rhythm and nocturnal dip // Berbari A., Mancia G. (ed.) Special Issues in Hypertension. Springer. — Milan, 2012. — P. 19–29.
62. Readon J., Vicente A., Alvarez V. et al. Circadian rhythms variability of arterial pressure: methodological aspects for the measurement // Med. Clin. — 1999. — Vol. 112. — P. 285–289.
63. Redon J., Luebe E. Ambulatory blood pressure and the kidney: implifications for renal dysfunction / Ed. by Epstain M. // Calcium antagonists in clinical medicine. — Philadelphia: Hanley &Belfus, 2002. — P. 665–679.
64. Roman M., Devereux R., Kizer J. et al. High Central Pulse Pressure Is Independently Associated With Adverse Cardiovascular Outcome The Strong Heart Study // J. Am. Coll. Cardiol. — 2009. — Vol. 54. — P. 1730–1734.
65. Rothwell P., Howard S.C., Dolan E., O’Brien E., Dobson J.E., Dahlöf B., Poulter N.R., Sever P.S. ASCOT-BPLA and MRC Trial Investigators // Lancet Neurol. — 2010. — Vol. 9. — P. 469–480.
66. Rothwell P., Sally K., Dolan E. et al. Prognostic significance of visit-to-visit variability, maximum systolic blood pressure, and episodic hypertension // Lancet. — 2010. — Vol. 375. — P. 895–905.
67. Rothwell P.M. Limitations of the usual blood-pressure hypothesis and importance of variability, instability, and episodic hypertension // Lancet. — 2010. — Vol. 375. — P. 938–48.
68. Rowell L., Brengelmann G., Blackmon J. et al. Disparities between aortic and peripheral pulse pressures induced by upright exercise and vasomotor change in man // Circulation. — 1968. — Vol. 37. — P. 954–964.
69. Saladini F.L., Santonastaso M., Mos L., Benetti E., Zanatta N., Maraglino G., Palatini P. HARVEST Study Group. Isolated systolic hypertension of young-to-middle-age individuals implies a relatively low risk of developing hypertension needing treatment when central blood pressure is low // J. Hypertens. — 2011. — Vol. 29 (7). — P. 1311–1319.
70. Sander D., Kukla C., Klingelhofer J. et al. Relationship between circadian blood pressure patterns and progression of earlycarotid atherosclerosis // Circulation. — 2000. — Vol. 102. — P. 1536–1541.
71. Sante D., Pierdomenico S. Blood Pressure Variability and Cardiovascular Outcome in Essential Hypertension // Am. J. Hypertens. — 2007. — Vol. 20. — P. 162–163.
72. Sarnak M., Levey A., Schoolwerth A. et al. AHA councils on kidney in cardiovascular disease, high blood pressure research, clinical cardiology and epidemiology and prevention // Circulation. — 2003. — Vol. 108. — P. 2154–2169.
73. Sega R., Trocino G., Lanzarotti A., Carugo S., Cesana G., Schiavina R. et al. Alterations of cardiac structure in patients with isolated office, ambulatory, or home hypertension: Data from the general population (Pressione ArterioseMonitorate E Loro Associazioni [PAMELA] Study) // Circulation. — 2001. — Vol. 104. — P. 1385–1392.
74. Sharman J.E., Stowasser M., Fassett R.G., Marwick T.H., Franklin S.S. Central blood pressure measurement may improve risk stratification // J. Hum. Hypertens.— 2008. — Vol. 22. — P. 838–844.
75. Staessen J., O’Brien E., Thijs L., Fagard R. Modern approaches to blood pressure measurement // Occup. Environ. Med. — 2000. — Vol. 57. — P. 510–520.
76. Staessen J.A., O’Brien E.T., Amery A.K., Atkins N., Baumgart P., De Cort P. et al. Ambulatory blood pressure in normotensive and hypertensive subjects: results from an international database // J. Hypertens. Suppl. — 1994. — Vol. 12. — P. S1–12.
77. Stanton A., Atkins N., O’Brien E., O’Malley K. Antihypertensive therapy and circadian blood pressure profiles: a retrospective analysis utilising cumulative sumsи // Blood Press. — 1993. — V. 2, № 4. — P. 289–295.
78. Stergiou G.S., Siontis K.C., Ioannidis J.P. Home blood pressure as a cardiovascular outcome predictor: it’s time to take this method seriously // Hypertension. — 2010. — Vol. 55. — P. 1301–1303.
79. Takakuwa H., Ise T., Kato T. еt al. Diurnal variation of hemodynamic indices in non-dipper hypertensive patients // Hypertens. Res. — 2001. — Vol. 24. — P. 195–201.
80. The CAFE Investigators, for the Anglo-Scandinavian Cardiac Outcomes Trial (ASCOT) Investigators CAFE Steering Committee and Writing Committee. Differential Impact of Blood Pressure-Lowering Drugs on Central Aortic Pressure and Clinical Outcomes Principal Results of the Conduit Artery Function Evaluation (CAFE) Study // Circulation. — 2006. — Vol. 113. — P. 1213–1225.
81. Verdecchia P., Porcellati C., Schillaci G. et al. Ambulatory blood pressure. An independent predictor of prognosis in essential hypertension // Hypertens. — 1994. — Vol. 24. — Р. 793–801.
82. Verdecchia P., Schillaci G., Reboldi G. et al. Prognostic impact of office versus ambulatory blood pressure control in treated hypertensive patients // J. Hypertens. — 2001. — Vol. 19, Suppl. 2. — P. 3.
83. Verdecchia P., Angeli F., Gattobigio R. еt al. Impact of Blood Pressure Variability on Cardiac and Cerebrovascular Complications in Hypertension // Am. J. Hypertens. — 2007. — Vol. 20. — P. 154–161.
84. Ward A.M., Takahashi O., Stevens R., Heneghan C. Home measurement of blood pressure and cardiovascular disease: systematic review and meta-analysis of prospective studies // J. Hypertens. — 2012. — Vol. 30. — P. 449–456.
85. Webb A., Fischer U., Mehta Z. et al. Effects of antihypertensive-drug class on interindividual variation in blood pressure and risk of stroke: a systematic review and meta-analysis // Lancet. — 2010. — Vol. 375. — Р. 906–915.
86. Weber Т., Wassertheurer S., Hametner B., Herbert A. et al. Reference Values for Central Blood Pressure // J. Am. Coll. Cardiol. — 2014. — Vol. 63 (21). — P. 2299–2299.
87. White W. Blood pressure monitoring in cardiovascular medicine and therapeutics. — New Jersey: Humana Press, 2001. — 308 p.
88. Wilkinson I., Franklin S., Hall I. et al. Pressure Amplification Explains Why Pulse Pressure is unrelated to risk in young subjects // Hypertens. — 2001. — Vol. 38. — P. 1461–1466.
89. Williams B., Lacy P. Central haemodynamics and clinical ouycome: going beyond brachial blood pressure // Eur. Heart J. — 2010. — Vol. 31. — P. 1819–1822.
90. Williams B., Lacy P., Baschiera F. et al. Novel description of the 24-hr circadian rhythms of brachial versus aortic BP and the impact of blood pressure treatment in a randomized controlled clinical trial // J. Hypertens. — 2012. — Vol. 30., Suppl. A. — P. 47.
91. Williams B., Lacy P., Thom S. et al. CAFÉ Investigators, Anglo-Scandinavian Cardiac Outcomes Trial Investigators, CAFÉ Steering Committee and Writing Committee. Differential impact of blood pressure lowering drugs on central aortic pressure and clinical outcomes: principal results of the conduit artery function evaluation study // Circulation. — 2006. — Vol. 113. — P. 1213–1225.
92. Yamamoto Y., Akiguchi I., Oiwa K. et al. Adverse effect of nighttime blood pressure on the outcome of lacunar infarct patients // Stroke. — 1998. — Vol. 29 (3). — 570–576.
93. Zelveian P., Oshchepkova E., Buniatian M. et al. Prognostic value of the degree of night decrease of systolic pressure in patients with mild and moderate forms of hypertension (7–9 year prospective study) // Ter. Arkh. — 2003. — Vol. 75. — P. 48–51.
94. Zhang Y., Agnoletti D., Safar M.E., Blacher J. Effect of antihypertensive agents on blood pressure variability: the Natrilix SR Versus Candesartan and Amlodipine in the Reduction of Systolic Blood Pressure in HypertensivePatients (X-CELLENT) Study // Hypertension. — 2011. — Vol. 58. — P. 155–160.

/8/8.jpg)
/13/13.jpg)
/14/14.jpg)