Газета «Новости медицины и фармации» Гастроэнтерология (553) 2015 (тематический номер)
Вернуться к номеру
Современные возможности лечения и профилактики хронического гастрита, эрозивно-язвенных заболеваний гастродуоденальной зоны, синдрома раздраженного кишечника: в фокусе Мукоген
Авторы: Татьяна Чистик
Рубрики: Гастроэнтерология
Разделы: Медицинские форумы
Версия для печати
Статья опубликована на с. 27-32
Проблема патологии гастродуоденальной зоны остается одной из наиболее актуальных в современной гастроэнтерологии. Это обусловлено высокой распространенностью заболеваний желудка и двенадцатиперстной кишки и ее тенденцией к дальнейшему росту. Безусловно, успехи мировой гастроэнтерологии последних десятилетий, особенно связанные с открытием инфекции H.pylori и разработкой способов ее успешного лечения, повысили эффективность лечения гастродуоденальных заболеваний. Однако, несмотря на эти достижения, продолжается поиск дополнительных способов усовершенствования терапии этой патологии.
23–24 апреля в Одессе состоялось заседание Украинского клуба панкреатологов и Одесского отделения Украинской гастроэнтерологической ассоциации «Новости мировой панкреатологии. Проблемы диагностики, лечения, диетического питания при заболеваниях поджелудочной железы и коморбидных заболеваниях», в рамках которого были рассмотрены важнейшие вопросы профилактического лечения хронического атрофического гастрита, эрозивно-язвенных заболеваний желудка и двенадцатиперстной кишки, синдрома раздраженного кишечника.
С докладом «Проблема атрофического гастрита и рака желудка: современные возможности канцеропревенции» выступила доктор медицинских наук, профессор кафедры общей практики и медицинской реабилитации Одесского государственного медицинского университета, руководитель отдела гастроэнтерологии Украинского НИИ гастроэнтерологии и курортологии Наталья Владимировна Драгомирецкая.
Проблема хронического атрофического гастрита и рака желудка имеет глобальный характер. Известно, что на сегодняшний день рак желудка в Украине является второй по распространенности формой злокачественных новообразований у мужчин и четвертой — у женщин. Причем ежегодная смертность среди таких пациентов составляет 61,3 %, а пятилетняя выживаемость — 12,3 %. Каждый год в нашей стране диагностируется 16 000 новых случаев рака желудка, 75 % из них — в терминальной стадии и лишь 5 % — в начальной. Такие неутешительные цифры являются следствием гиподиагностики рака желудка и его предшественника — атрофического гастрита, что, в свою очередь, связано с недостаточным назначением эзофагогастродуоденоскопии с последующим морфологическим исследованием, а также недостаточной настороженностью врачей относительно данной патологии.
Хронический атрофический гастрит занимает особое место в структуре гастроэнтерологических заболеваний, характеризуясь длительным течением и частыми рецидивами. В его основе лежит хронический воспалительный процесс в слизистой оболочке желудка, сопровождающийся нарушением физиологической регенерации, уменьшением количества железистых клеток, а в случае прогрессирования — атрофией железистого эпителия и его частичным замещением кишечным эпителием (кишечная метаплазия), расстройством всей гастродуоденальной системы: секреторной, инкреторной, моторной функций, что может способствовать возникновению рака желудка.
Главная роль в этом процессе принадлежит Helicobacter pylori. Известно, что среди H.pylori-инфицированных людей заболеваемость раком желудка в 1,6–2,4 раза выше, чем у неинфицированных. Вероятность развития карциномы у пациентов с хроническим атрофическим гастритом, ассоциированным с H.pylori, возрастает в 4–5 раз, особенно в случаях инфицирования в детском возрасте. По мнению большинства зарубежных авторов, наличие H.pylori — основная причина возникновения атрофии слизистой оболочки желудка, а H.pylori-ассоциированный хронический атрофический гастрит — причина рака желудка.
Достижения, связанные со снижением заболеваемости раком желудка в некоторых странах, являются результатом уменьшения роли данной инфекции как наиболее частого и распространенного фактора развития хронического атрофического гастрита. Доказательством может служить тот факт, что наиболее быстрое снижение заболеваемости раком желудка за последние 10 лет наблюдается в тех странах, в которых была проведена эрадикация инфекции практически у всего населения (например, Бельгия).
Таким образом, важным аспектом успешного лечения хронического атрофического гастрита и профилактики рака желудка является эрадикация возбудителя путем проведения антихеликобактерной терапии. Эта профилактика может быть первичной, при ее осуществлении на стадии хронического гастрита; вторичной — на стадии кишечной метаплазии и третичной — на фоне рака желудка.
Согласно рекомендациям Маастрихтского соглашения III–IV схема первой линии лечения преду–сматривает назначение ингибитора протонной помпы и двух антибиотиков (обычно это кларитромицин и амоксициллин). Компоненты этой схемы удачно сбалансированы по эффективности и побочным действиям, роль каждого из них хорошо продумана в отношении точек приложения и патогенетических механизмов. Эта схема получила название стандартной тройной терапии.
Адекватным аналогом этой схемы в Маастрихтских рекомендациях названа схема тройной терапии первой линии с назначением ранитидина висмута цитрата и двух антибиотиков. Ранитидин висмута цитрат представляет собой комбинированный препарат, состоящий из цитрата висмута и Н2-блокатора второго поколения. По результатам многоцентровых исследований, уровень эрадикации H.pylori в схемах тройной терапии без висмута составляет в среднем 71 %, тогда как использование схем тройной терапии с препаратами висмута обеспечивает эрадикацию у 93 % больных.
Если в результате использования стандартной тройной терапии не удалось добиться эрадикации H.pylori, согласно Маастрихтским рекомендациям назначают терапию второй линии, именуемую стандартной квадротерапией. Эта схема предполагает замену антибактериальных препаратов (обычно метронидазолом и тетрациклином) с добавлением препаратов солей висмута при сохранении ингибитора протонной помпы в качестве антисекреторного средства. Уровень эрадикации при использовании квадротерапии в качестве терапии второй линии составляет 74–98 % в зависимости от наличия у микроорганизма резистентности к тому или иному антибиотику.
По данным зарубежных ученых, эффективная антихеликобактерная терапия приводит к уменьшению воспаления слизистой оболочки желудка, однако регресса атрофических и метапластических процессов не наблюдается, а в некоторых случаях процесс продолжает прогрессировать. Таким образом, только антихеликобактерная терапия не решает проблему.
На сегодняшний день в комплексном лечении хронических атрофических гастритов в целях повышения его эффективности применяют цитопротекторную терапию, осуществляемую ребамипидом (Мукоген), оказывающим плейотропное действие, а именно:
1. Репаративное действие ребамипида (Мукоген) реализуется за счет индукции синтеза простагландинов посредством экспрессии ЦОГ-2 (Kleine A. et al., 1993; Sun W.H. et al., 2000) и блокадой соответствующих рецепторов (Suetsugu H. et al., 2000), а также благодаря активации таких факторов роста, как EGF — эпидермальный фактор роста (Tarnawski A. et al., 1998), VEGF — фактор роста эндотелия сосудов (Tarnawski A. et al., 2004), HGF — фактор роста гепатоцитов (Udogava A. et al., 2003).
2. Цитопротекторный эффект ребамипида связан с индукцией секреции слизи (Ishihara R. et al., 1992).
3. За счет утилизации свободных радикалов (Ya–shikawa T. еt al., 2003), ингибирования активации нейтрофилов и их миграции (Yashida N. еt al., 1996), а также ингибирования продукции цитокинов лейкоцитами и эпителиальными клетками желудка (Masamune A. et al., 2001) осуществляется противовоспалительное действие препарата.
4. Антихелиобактерный эффект обеспечивается снижением уровня колонизации слизистой (Suzuki H. et al., 1998) и игибированием адгезии H.pylori к эпителию желудка (Hayashi S. et al., 1998).
2. Цитопротекторный эффект ребамипида связан с индукцией секреции слизи (Ishihara R. et al., 1992).
3. За счет утилизации свободных радикалов (Ya–shikawa T. еt al., 2003), ингибирования активации нейтрофилов и их миграции (Yashida N. еt al., 1996), а также ингибирования продукции цитокинов лейкоцитами и эпителиальными клетками желудка (Masamune A. et al., 2001) осуществляется противовоспалительное действие препарата.
4. Антихелиобактерный эффект обеспечивается снижением уровня колонизации слизистой (Suzuki H. et al., 1998) и игибированием адгезии H.pylori к эпителию желудка (Hayashi S. et al., 1998).
На базе отдела гастроэнтерологии Украинского НИИ гастроэнтерологии и курортологии (г. Одесса) было проведено исследование, посвященное изучению эффективности цитопротектора Мукоген в составе комплексной терапии 130 пациентов, страдающих хроническим атрофическим гастритом в течение 5–10 лет и сопутствующими заболеваниями желудочно-кишечного тракта: хроническим панкреатитом, хроническим холециститом, заболеваниями кишечника. Всем пациентам была назначена антихеликобактерная терапия, цитопротектор Мукоген и минеральная вода «Нафтуся». Оценка эффективности терапии проводилась на основании жалоб, данных клинических и инструментальных исследований (фиброгастроскопия).
В ходе исследования было установлено, что проведение антихеликобактерной терапии обеспечивает регресс симптоматики хронического атрофического гастрита, преимущественно в виде уменьшения абдоминального болевого синдрома. Через месяц лечения Мукогеном отмечалось практически полное ее исчезновение, и полная ликвидация боли была достигнута применением еще в течение 1 месяца гидрокарбонатной воды «Нафтуся».
Проведение фиброгастроскопии после антихеликобактерной терапии выявило уменьшение признаков воспаления слизистой оболочки желудка; после приема Мукогена и минеральной воды признаки воспаления исчезли, однако гистологическая картина сохранялась неизменной. И лишь через 6–18 месяцев терапии Мукогеном было обнаружено уменьшение проявлений кишечной метаплазии и дисплазии.
Таким образом, была впервые разработана и научно обоснована схема поэтапного лечения хронического атрофического гастрита. Включение Мукогена и минеральной воды «Нафтуся» в комплексную терапию данной патологии позволило значительно повысить ее эффективность — уменьшить болевой синдром, улучшить морфологическую и гистологическую картину заболевания.
Доктор медицинских наук, профессор кафедры внутренней медицины Наталья Борисовна Губергриц представила вниманию слушателей доклад «Цитопротекторная терапия эрозивно-язвенных заболеваний желудка и двенадцатиперстной кишки».
С открытием этиологической роли Helicobacter pylori в развитии ряда заболеваний органов пищеварения гастроэнтерология шагнула далеко вперед. Теперь не вызывает сомнения, что пептическая язва желудка и/или двенадцатиперстной кишки может быть вылечена. Но есть множество этиологических вариантов пептической язвы, которые относят к симптоматическим. В этих случаях далеко не всегда удается не только устранить, но даже выявить причину заболевания. В таких случаях считается, что его возникновение связано с преобладанием факторов агрессии над факторами защиты. Впрочем, это, безусловно, относится и к хеликобактерным язвам, при которых не всегда возможно эффективно подавить агрессию. Все чаще встречаются антибиотикорезистентные штаммы H.pylori, а также пациенты, у которых после успешной эрадикации H.pylori не происходит заживления язв и эрозий.
На сегодняшний день для повышения эффективности терапии эрозивно-язвенных заболеваний гастро–дуоденальной зоны применяется Мукоген (ребамипид), являющийся гастропротекторным средством, производным 2(1Н)-хинолона. Мукоген стимулирует выработку простагландина в слизистой желудка, сокращает сроки и улучшает качество эпителизации язвы желудка, снижает вероятность рецидива язвы в будущем, а также защищает слизистую желудка от повреждений, вызываемых токсическими и ульцерогенными веществами. Кроме того, Мукоген обеспечивает увеличение количества поверхностной и растворимой слизи в желудке посредством усиления активности ферментов, ускоряющих биосинтез высокомолекулярных гликопротеинов; повышает экскрецию эпителиального фактора роста и увеличивает количество рецепторов к нему в нормальной и изъязвленной слизистой желудка и, как следствие, вызывает стимуляцию пролиферации эпителиальных клеток поврежденного участка слизистой оболочки; подавляет активность нейтрофилов и выработку цитокинов воспаления; не являясь антихеликобактерным препаратом, способствует эрадикации H.pylori при комбинации со средствами стандартной противоязвенной терапии, так как препятствует адгезии бактерий к эпителиальным клеткам желудка; улучшает кровоток и гемодинамику в слизистой желудка; обладает антиоксидантными свойствами; тормозит канцерогенез.
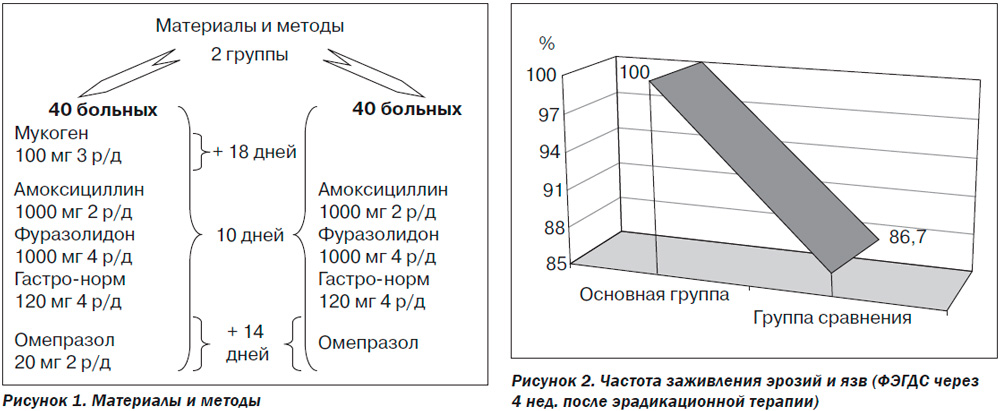
Эффективность Мукогена в терапии эрозивно-язвенных поражений желудочно-кишечного тракта была отмечена в ряде зарубежных исследований. Собственное исследование преследовало цель сравнить эффективность стандартной антихеликобактерной терапии и терапии с включением Мукогена. В нем приняли участие 80 пациентов, страдающих эрозивно-язвенными поражениями ЖКТ, вызванными Helicobacter pylori, которые случайным образом были разделены на две равные группы по 40 человек (рис. 1).
Эффективность проведенной терапии оценивалась по динамике клинической картины, данным фиброгастроскопии и гистологических исследований.
После 1 месяца лечения было выявлено, что антихеликобактерная терапия с включением Мукогена имеет выраженное преимущество в сравнении со стандарт–ной терапией. Так, в группе исследования положительная динамика в отношении клинических симптомов, в том числе диспепсии, была продемонстрирована в 83 % случаев, тогда как в группе сравнения этот показатель составил 70 %.
По данным фиброгастроскопии, воспаление слизистой оболочки желудка значительно уменьшилось в обеих группах, но в группе Мукогена это было обнаружено у 95 % пациентов, а в группе стандартной терапии — только у 85 % больных. Причем частота заживления язв и эрозий составила 100 % в группе исследования и лишь 86 % в группе сравнения (рис. 2).
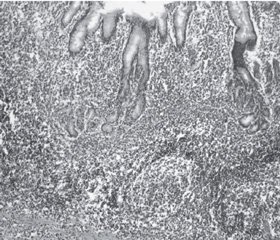
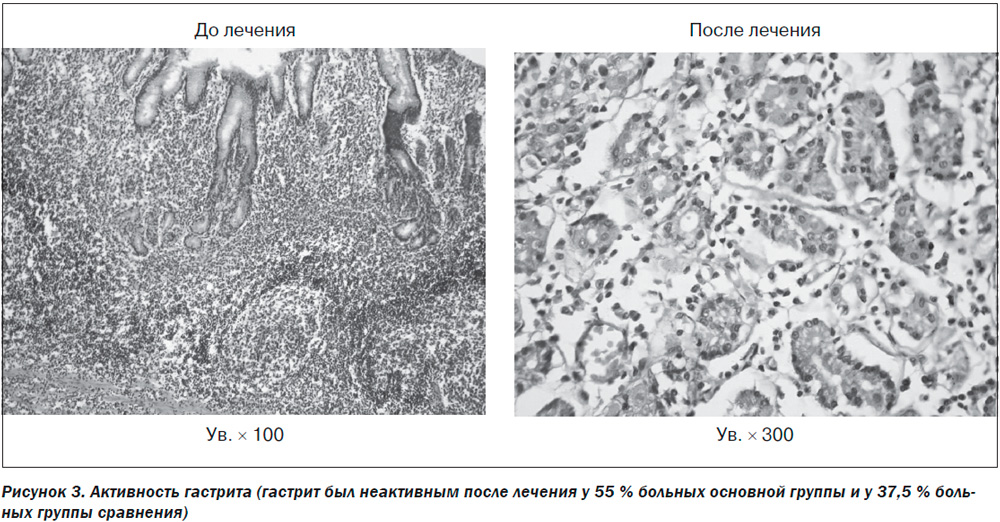
Улучшение гистологической картины и уменьшение активности гастрита также были сильнее выражены в группе пациентов, получающих Мукоген: 55 % по сравнению с 37,5 % в группе стандартной антихеликобактерной терапии (рис. 3).
Следует отметить, что после проведенной терапии на протяжении года у пациентов, получающих комплексную терапию с включением Мукогена, отмечалось значительно меньшее количество рецидивов.
Таким образом, исследование показало целесообразность назначения Мукогена пациентам с эрозивно-язвенными поражениями желудочно-кишечного тракта, поскольку препарат способствовал 100% заживлению язв и эрозий, быстрее купировал симптоматику, улучшал морфологическую и гистологическую картину гастрита, уменьшал число рецидивов.
С докладом «Кишечные боли: пути преодоления» выступил доцент кафедры внутренней медицины № 1 НМУ им. А.А. Богомольца Николай Николаевич Руденко.
Наиболее частыми жалобами в гастроэнтерологической практике являются жалобы на боль, причем более половины их приходится на боль в области кишечника. Нередко кишечная боль носит функциональный либо воспалительный характер и, как правило, связана с одной из следующих из причин: нарушение моторики кишечника (повышение или снижение тонуса), избыточный бактериальный рост, висцеральная гиперчувствительность, центральное нарушение восприятия боли, ишемия (Chang E. et al., 2011). Известно, что абдоминальная боль в 100 % случаев наблюдается при синдроме раздраженного кишечника (СРК) и абдоминальной ишемии, в 50–70 % — при воспалительных заболеваниях кишечника (ВЗК), в 40 % — при раке.
Патогенез возникновения боли в кишечнике различен. Так, при хроническом воспалении в кишечнике увеличивается выработка IL, Pg, 5-HT, CRF, тучных клеток, что приводит к изменению моторики и восприятия боли. Синдром избыточного бактериального роста (СИБР) изменяет иммунитет, вызывает воспаление, повышает кишечную проницаемость, гипералгезию и дисбаланс энтеральной нервной системы (Moraru I.G. et al., 2013). Развитие висцеральной гиперчувствительности может быть спровоцировано воспалением, стрессом, СИБР, состоянием ЦНС (Moloney R.D. et al., 2015). Интенсивность боли при СРК и ВЗК зависит от стадии менструального цикла. Центральному нарушению восприятия боли зачастую сопутствуют депрессия (20–70 %), тревога (20–50 %), различные психосоматические заболевания (15–48 %). При воспалительных заболеваниях кишечника у 16–44 % пациентов развивается депрессия, около 30 % предпринимали суицидальные попытки, и только 40 % из них получают адекватное лечение.
По определению рабочей группы Всемирной организации здравоохранения, синдром раздраженного кишечника — это функциональное расстройство, при котором абдоминальная боль сочетается с нарушениями функции кишечника и дефекации. Распространенность СРК среди населения составляет 14–48 %. У женщин эта патология отмечается в 2–4 раза чаще, чем у мужчин. Хотя заболевание нередко начинается в молодости, пик обращаемости к врачу по поводу указанной болезни относится к возрасту 35–50 лет.
До сих пор истинные причины СРК, к сожалению, не установлены. Считается, что СРК возникает вследствие двигательных и чувствительных нарушений кишечника. Важную роль при этом играют расстройства нормальной функции центральной нервной системы.
У больных отмечаются аномальная кишечная моторика, нарушения процессов секреции в кишечнике, изменения висцеральной чувствительности. При СРК как тонкая, так и толстая кишка проявляют повышенную реактивность в виде кишечного спазма, замедления или ускорения моторики при воздействии различных раздражителей, включая лекарственные препараты и даже пищу. Кроме этого, существенную роль при данном заболевании играет нарушенный микробный состав в просвете тонкой и толстой кишки. Продукты жизнедеятельности микроорганизмов поддерживают раздраженное состояние кишечника, способствуют нарушению гидролиза сахаров, жиров, белков. Может снижаться интракишечный рН, что вызывает инактивацию пищеварительных ферментов и приводит к относительной ферментативной недостаточности.
Одновременно изменения чувствительности и моторики кишечника могут произойти под влиянием ЦНС, включая высшие ее отделы. Пациенты склонны к депрессии, тревоге, канцерофобии, они нередко более активно реагируют на стресс. Пограничные нервно-психические расстройства обнаруживают у 75 % больных СРК. Можно, однако, предположить и обратную связь: подобные изменения личности являются не причиной, а следствием длительных нарушений со стороны желудочно-кишечного тракта. Эндогенные опиоиды (энкефалины, эндорфины) и катехоламины выделяются и в ЖКТ, и в головном мозге. Они могут влиять через изменение обмена медиаторов (ацетилхолина, серотонина, гастрина и др.) на моторику и секрецию кишечника. СРК нередко рассматривается как психосоматическое заболевание, при котором стрессовые ситуации выступают в качестве триггерных факторов с последующим включением нервных, нервно-мышечных и гормональных цепных реакций, определяющих индивидуальный тип моторики человека.
Таким образом, в патогенезе СРК ведущая роль отводится следующим факторам: психологическому, нарушению моторики и висцеральной чувствительности, изменению химического состава кишечного содержимого.
К основным диагностическим критериям СРК (Andresen V. et al., 2011) относят:
— наличие кишечных симптомов (боль и вздутие) в течение ≥ 6 месяцев и изменение дефекации в течение ≥ 3 месяцев;
— наличие периодов их отсутствия;
— множественные жалобы на другие органы и системы;
— выраженную эмоциональную окраску жалоб;
— отсутствие альтернативных заболеваний, позволяющих объяснить данные симптомы;
— симптомы снижают качество жизни пациентов и заставляют обратиться за медицинской помощью.
— наличие кишечных симптомов (боль и вздутие) в течение ≥ 6 месяцев и изменение дефекации в течение ≥ 3 месяцев;
— наличие периодов их отсутствия;
— множественные жалобы на другие органы и системы;
— выраженную эмоциональную окраску жалоб;
— отсутствие альтернативных заболеваний, позволяющих объяснить данные симптомы;
— симптомы снижают качество жизни пациентов и заставляют обратиться за медицинской помощью.
Согласно японским рекомендациям 2015 года (Tukudo S. et al., 2015), при синдроме раздраженного кишечника лечение должно проводиться поэтапно. I ступень включает в себя модификацию образа жизни, диету и симптоматически направленное лечение. Если через 4 недели данных мероприятий кишечные симптомы сохраняются, то переходят ко II ступени, с добавлением психотерапевтического и психофармакологического лечения. В случае отсутствия эффекта от лечения еще через 4 недели — к III, с присоединением высокоспециализированной психотерапии.
Свою эффективность в лечении синдрома раздраженного кишечника (de Greek M. et al., 2014) доказали следующие группы лекарственных препаратов: спазмолитики, пробиотики, антидепрессанты, фитотерапия, слабительные при СРК-З, антагонисты 5НТ3-рецепторов при СРК-Д, антиконвульсанты и антибиотики. Влияние на моторику кишечника может осуществляться через вегетативную нервную систему (холинолитики), ионные каналы (Ca, Na, K), серотониновые и опиоидные рецепторы, нейропептиды.
Спазмолитики, обладая высокой безопасностью, являются препаратами первого ряда в устранении боли при синдроме раздраженного кишечника. Так, в мета–анализе Сhang F.Y. et al., 2015), объединившем 27 рандомизированных клинических исследований с участием более 2,5 тысячи пациентов, было продемонстрировано, что их применение при СРК способно уменьшить боль в 32–55 % случаев.
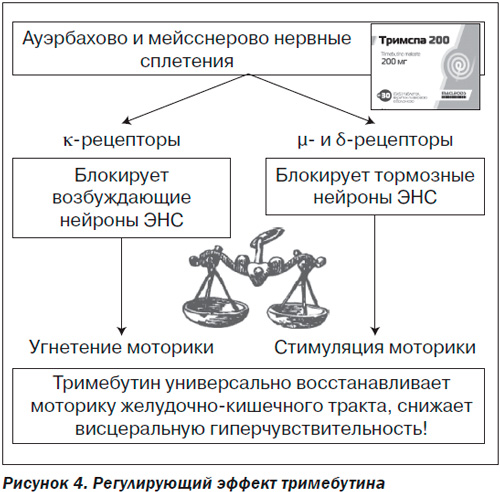
Тримебутин (Тримспа) является стимулятором µ-, δ- и κ-опиоидных рецепторов, блокатором серотониновых рецепторов, блокатором Na- и Ca-каналов, стимулятором синтеза мотилина. Воздействуя на κ-рецепторы, тримебутин блокирует возбуждающие нейроны энкефалинергической системы кишечника, за счет чего достигается спазмолитический эффект препарата при гиперкинетических состояниях ЖКТ. Влияние на µ- и δ-рецепторы, в свою очередь, приводит к блокированию тормозных нейронов, что сопровождается стимуляцией моторики. Таким образом, тримебутин (Тримспа) обладает универсальным действием на моторную функцию кишечника и снижает висцеральную чувствительность (рис. 4).
Эффективное купирование болевого синдрома тримебутином (Тримспа) доказано в ряде рандомизированных клинических исследований. Так, в работе D.L. Dumitrascu et al. (2006) было показано, что применение тримебутина при СРК в течение 2 недель обеспечивает уменьшение боли в 4 раза. В исследовании G.S. Karabulut et al. (2013) у 95 % детей, принимающих данный препарат в течение 3 недель, отмечалось достоверное снижение симптоматики. В другом рандомизированном клиническом исследовании (Kang S.H. et al., 2013) прием тримебутина (Тримспа) на протяжении 8 недель у 76 % пациентов уменьшил выраженность боли более чем на 30 %.
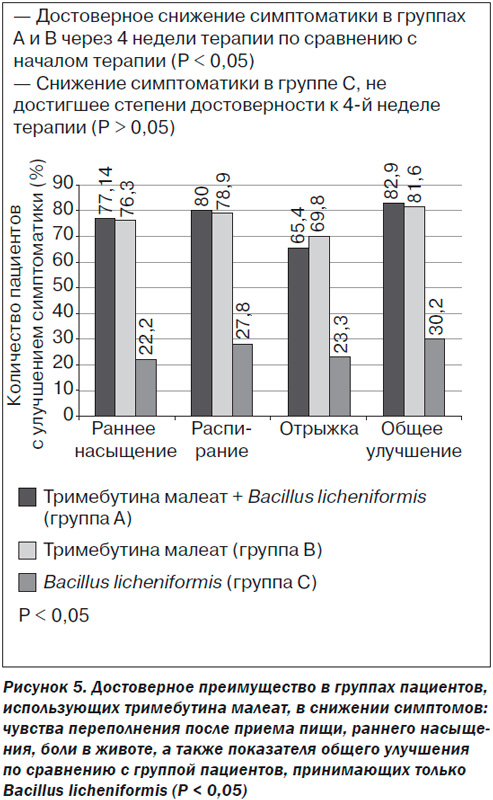
Успешное лечение тримебутином (Тримспа) синдрома раздраженного кишечника и функциональной диспепсии было доказано в исследовании Y.Q. Zhong et al. (2007): прием препарата в течение 4 недель достоверно уменьшал боль и другие кишечные симптомы (рис. 5).
При сочетании СРК и гастроэзофагеальной рефлюкс–ной болезни (Kountouras J. et al., 2002) применение тримебутина на протяжении 3 месяцев лечения значительно уменьшало симптоматику. В исследовании, проведенном V. Vitton в 2012 году, было продемонстрировано, что у пациентов, страдающих дисфункцией сфинктера Одди, использование тримебутина было эквивалентно сфинктеротомии: улучшалась клиническая симптоматика, купировался болевой синдром и значительно улучшалось качество жизни.
Также в купировании болевого синдрома при СРК-Д и СИБР, по мнению ряда авторов (Simren M. et al., 2013), могут применяться пробиотики, обладающие многофакторным действием и безопасностью. В метаанализе, включающем 15 РКИ (1793 пациента), было выявлено, что данная группа препаратов вдвое уменьшает выраженность боли. Эффективно использование антидепрессантов, нивелирующих кишечную симптоматику за счет улучшения настроения, уменьшения тревожности, нормализации моторики и уменьшения периферической и центральной болевой чувствительности. При СРК, сопровождающемся запорами, возможно использование растворимых растительных волокон — псиллиум, что, по заключению 12 РКИ, устраняет запоры и облегчает боль.
К новым перспективным направлениям в лечении СРК относятся применение агонистов 5НТ4-рецепторов (prucalopride); агонистов гуанилатциклазы (миа–клотид); антагонистов тахикининовых рецепторов (ezlopitant); фекальной трансплантации; антибиотиков (рифаксимин); антиноцицептиков (мелатонин); плацебо.
При воспалительных заболеваниях кишечника лечение боли преследует следующие цели: подавить воспаление, нормализовать моторику кишечника (спазмолитики), осуществить центральную и периферическую гипосенситизацию (габапентин, антидепрессанты) и борьбу с СИБР.
В ряде клинических исследований было показано, что при бактериальных колитах на боль в области кишечника предъявляют жалобы почти 60 % пациентов, а при неспецифическом язвенном колите — 39 %. При ВЗК даже в период ремиссии у 20–50 % больных сохраняется абдоминальная боль. Для лечения болевого синдрома в таких случаях показан тримебутин (Srinath A. et al., 2014). Не следует применять НПВП, так как они провоцируют обострение воспалительного процесса, осторожно и на краткие сроки могут использоваться опиаты, например у пациентов с ВЗК в послеоперационном периоде.
Таким образом, на основании всего вышеперечисленного можно сделать следующие выводы:
— синдром боли в кишечнике — один из самых распространенных в гастроэнтерологии;
— подавляющее число болей в кишечнике — функциональные;
— у большинства пациентов боли эффективно купируются спазмолитиками;
— тримебутин (Тримспа) — надежный и безопасный спазмолитик.
— синдром боли в кишечнике — один из самых распространенных в гастроэнтерологии;
— подавляющее число болей в кишечнике — функциональные;
— у большинства пациентов боли эффективно купируются спазмолитиками;
— тримебутин (Тримспа) — надежный и безопасный спазмолитик.