Статья опубликована на с. 15-20
Наиболее важными медико-социальными заболеваниями в современном мире стали мозговой инсульт (МИ) и деменция. Количество случаев этих заболеваний с каждым годом прогрессивно увеличивается, а финансовые затраты, связанные с лечением и реабилитацией таких больных, ложатся тяжелым бременем на общество [1–4]. Частой причиной развития МИ и деменции является патология мелких сосудов мозга [5–9]. Одно из патоморфологических проявлений болезни мелких сосудов — глубокие инфаркты головного мозга, или лакунарные инфаркты. Размер таких лакун может колебаться от 3 до 20 мм в диаметре. Они проявляются при проведении нейровизуализации (компьютерная томография, магнитно-резонансная томография (МРТ) головного мозга) или посмертно [14]. Такие лакуны могут сопровождаться развитием острой симптоматики в виде инсультов. Однако в большинстве случаев глубокие субкортикальные инфаркты мозга клинически могут и не сопровождаться симптомами острого нарушения мозгового кровообращения. Поэтому они получили название «немых», или субклинических, инфарктов мозга (НИМ). Однако, как показывают результаты проведенных исследований, «немые» инфаркты мозга повышают риск развития инсульта и деменции [15, 16]. НИМ клинически могут проявляться в виде подкоркового синдрома, нарушений походки, депрессии, когнитивного снижения [17]. Широкое внедрение в клиническую практику методов нейровизуализации позволило переосмыслить определение понятия острой церебральной ишемии и по-новому посмотреть на проблему НИМ.
Несмотря на то что НИМ очень распространены и встречаются в несколько раз чаще, чем симптомные инфаркты мозга, проведено мало исследований, посвященных проблеме лечения данной патологии. По указанному вопросу выполнено немного исследований, а имеющиеся данные не являются полными. В связи с этим изучение проблемы лечения НИМ требует более глубокого и всестороннего исследования. Поэтому представляло интерес изучение влияния такого препарата, как Церебролизин, эффективность которого доказана у пациентов с деменцией, на состояние больных с НИМ [18].
Церебролизин — это препарат биологически активных низкомолекулярных нейропептидов (215,2 мг в 1 мл раствора), аналогичных по действию естественным факторам роста нейронов. Благодаря уникальной технологии производства препарат, получаемый из биологического сырья (экстракт мозга молодых свиней), теряет свою видоспецифичность, легко проникает через гематоэнцефалический барьер, оказывая мультимодальное нейротрофическое действие на основные биохимические процессы в нервной ткани, обеспечивающие ее защиту и естественную регенерацию. На основании многочисленных нейроморфологических, нейрохимических и иммунологических исследований доказана высокая нейротрофическая, нейромодуляторная, антигипоксическая, антиоксидантная и антиапоптотическая активность препарата Церебролизин, что определяет его высокую эффективность в лечении сосудистой деменции. В качестве метаболического регулятора он повышает энергетический метаболизм мозга. Нейропротективный эффект препарата Церебролизин заключается в защите нейронов от повреждающего действия лактат-ацидоза, повышения свободнорадикального окисления, ишемии и гипоксии. Обнаружена способность препарата Церебролизин выступать в роли синаптического модулятора и показана его способность усиливать нейрогенез [18]. В клинических исследованиях, проведенных как в Украине, так и за рубежом, подтверждена высокая эффективность препарата Церебролизин в лечении сосудистой деменции. Доказано положительное влияние препарата Церебролизин на восстановление нарушенных познавательных функций и речи, улучшение памяти и внимания.
Задачи исследования:
1) изучить влияние препарата Церебролизин на двигательную активность у больных с НИМ;
2) изучить влияние препарата Церебролизин на когнитивные нарушения у больных с НИМ.
Для решения поставленных задач в работе были использованы следующие методы:
— клинико-неврологический (с использованием шкалы Тинетти);
— психодиагностический (краткая шкала оценки психического статуса (Mini-Mental State Examination, ММSЕ), тест запоминания 10 слов;
— статистический.
Результаты исследования
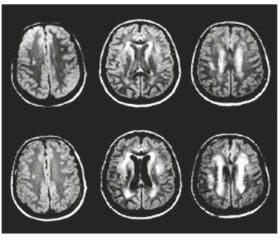
Нами было пролечено 32 пациента с «немыми» инфарктами мозга в возрасте от 62 до 76 лет (средний возраст составил 67,5 года). Среди обследованных нами больных было 19 женщин и 13 мужчин. При проведении МРТ в режиме диффузионно-взвешенной визуализации и FLAIR-режимах «немые» инфаркты выглядели гиподенсивными. Размеры таких очагов колебались от 5 до 15 мм. Наши исследования показали, что у 16 больных (50 %) такие очаги размещались в базальных ганглиях, у 14 больных (43,8 %) — субкортикально, у 8 больных (25 %) — в стволе мозга. Такие очаговые изменения вещества головного мозга у большинства больных сопровождались диффузным поражением белого вещества в перивентрикулярной зоне (лейкоареозис), расширением периваскулярных пространств, атрофией головного мозга. На рис. 1 показан пример «немых» инфарктов мозга, расположенных субкортикально.
На основании клинических и инструментальных исследований нами были выделены следующие факторы сердечно-сосудистого риска у обследованных больных (табл. 1).
С учетом данных клинико-неврологического, нейровизуализационного, инструментального исследований наши больные соответствовали диагнозу «дисциркуляторная энцефалопатия II–III cт.» (согласно классификации сосудистых заболеваний головного мозга).
Препарат Церебролизин данным пациентам назначался в дозе 10 мл путем медленных внутривенных инфузий после разведения до объема 100 мл 0,9% хлоридом натрия 1 раз в сутки на протяжении 20 дней. Лечение препаратом Церебролизин проводилось на фоне базисной терапии, которая включала прием антигипертензивных, сахароснижающих препаратов, статинов, антиаритмиков.
Эффективность лечения оценивалась до и после проведенного курса терапии.
На основании проведенных клинико-неврологических исследований нами были выявлены следующие симптомы и синдромы у обследуемых больных. Среди клинических проявлений заболевания особого внимания заслуживают экстрапирамидные расстройства, обнаруженные у 22 больных (69,6 %), особенно ригидность и брадикинезия, положительные рефлексы орального автоматизма, нарушения равновесия и ходьбы. Экстрапирамидные нарушения в основном проявлялись олигобрадикинезией, гипомимией, сложностью инициации двигательных актов, трудностью переключения с одного действия на другое. Мышечная ригидность была более выражена в нижних конечностях. У некоторых больных наблюдалась апраксия ходьбы с замедлением походки, укорочением и неравномерностью шага, неустойчивостью при поворотах, тремором конечностей. У 19 % пациентов отмечался тремор верхних конечностей в покое. Экстрапирамидные нарушения чаще всего были у пациентов, у которых при МРТ отмечались диффузные изменения белого вещества головного мозга, а также визуализировались единичные или множественные инфаркты в области базальных ганглиев. Можно предположить, что наличие этого синдрома связано не только с непосредственным поражением стриатума, но и с нарушением таламокортикальных связей вследствие множественных лакунарных НИМ. Почти у половины больных отмечались атактические расстройства, которые проявлялись нарушением стояния и ходьбы. Псевдобульбарный синдром был обнаружен у 17 (53,9 %) обследованных пациентов. Он проявлялся рефлексами орального автоматизма, в тяжелых случаях — дизартрией, эпизодами насильственного плача и смеха. Пирамидная недостаточность была выявлена у 45,5 % больных, достигала степени пареза только у 3,4 % пациентов. При обследовании отмечались изменения в рефлекторной сфере: оживление сухожильных и периостальных рефлексов (нередко — асимметричное) с расширением рефлексогенных зон, угнетение поверхностных рефлексов, кистевых и стопных патологических рефлексов. У части больных наблюдались сенсорные расстройства, проявляющиеся снижением слуха, шумом в ушах, зрительными расстройствами в виде фотопсий.
Исследование двигательных функций включало первичный осмотр пациентов с оценкой неврологической симптоматики, детальный анализ ходьбы с использованием формализованной клинической шкалы оценки двигательной активности пожилых Тинетти [19] и импрегнационной методики.
Шкала двигательной активности пожилых Тинетти [19] позволяет оценить статическое равновесие и походку у пожилых больных при выполнении ими конкретных двигательных заданий. Степень двигательных нарушений оценивают по двум субшкалам: общей устойчивости и походки. Для оценки двигательных функций пациента просят сесть и подняться со стула, пройти по прямой линии, встать на носки и поднять руки вверх (показать, как он достает предметы с высоких полок), присесть и поднять предмет с пола. Оценивают устойчивость в толчковых пробах, выполнение поворота. В итоге выставляют общий балл, в соответствии с которым можно определить отсутствие или наличие легких, средних, значительных нарушений двигательной активности.
По результатам исследования у больных с НИМ на фоне лечения препаратом Церебролизин (табл. 2) выявлено достоверное улучшение показателей устойчивости и походки по шкале Тинетти. Отмечено достоверное уменьшение базы шага, достоверное увеличение длины и частоты шага между первичным осмотром и через 20 дней после приема препарата Церебролизин.
Среди обследованных нами пациентов с НИМ когнитивные нарушения различной степени выраженности были выявлены у 29 больных (89,4 %). Характерными особенностями когнитивного дефицита у большинства этих пациентов были замедленность психической деятельности, снижение внимания, речевой активности, нарушение планирования, организации и контроля деятельности. Также характерной была флуктуация течения когнитивных расстройств (табл. 3).
Как свидетельствуют данные, представленные в табл. 3, в среднем у обследуемых нами больных до лечения препаратом Церебролизин наблюдались когнитивные нарушения, которые достигали степени клинически значимого когнитивного снижения. В структуре нарушений когнитивных функций доминировали расстройства вербальной памяти (4,8 ± 0,2 балла), ориентирования (7,8 ± 0,4 балла), счетных операций (4,1 ± 0,4 балла), гностических функций (7,9 ± 0,7 балла). Общий показатель когнитивной производительности составил 24,6 ± 1,7 балла.
Результат анализа динамики познавательных нарушений в ходе лечения свидетельствует об отчетливом и равновыраженном улучшении всех оцениваемых параметров. Так, на фоне приема препарата Церебролизин несколько возросли показатели вербальной памяти (4,8 ± 0,2 до лечения и 5,2 ± 0,4 — после лечения) и отмечены достоверные улучшения показателей счетных операций (соответственно 4,1 ± 0,4 и 4,4 ± 0,3), гностических функций (7,9 ± 0,7 и 8,4 ± 0,6), общего показателя когнитивной продуктивности (24,6 ± 1,7 и 26,1 ± 1,6).
У обследуемых нами больных были обнаружены дисмнестические расстройства по данным методики запоминания 10 слов (табл. 4).
Так, объем непосредственного воспроизведения вербального материала составил 4,4 ± 0,9 слова. Продуктивность произвольного запоминания вербального материала была снижена по сравнению с нормативными данными. Фиксировался типичный платообразный тип кривой заучивания, характерный для больных с цереброваскулярными заболеваниями. Объемы отсроченного воспроизведения были также достоверно снижены по сравнению с нормой, что указывало на наличие расстройств долговременной памяти у обследованных нами пациентов.
Результаты исследования произвольного внимания представлены в табл. 4. Как видно, в группе обследованных нами больных отмечалось отчетливое, статистически значимое по сравнению с нормой увеличение времени выполнения заданий по каждой из 5 таблиц, что свидетельствует о наличии нарушений произвольного внимания, концентрации, распределения и переключения. Показатели эффективности функций внимания и врабатываемости свидетельствовали о снижении произвольного внимания и умственной работоспособности в целом в группе обследуемых нами пациентов.
В ходе терапии препаратом Церебролизин отмечены отчетливые позитивные изменения функций вербальной памяти. Достоверно улучшались объемы непосредственного запоминания (до лечения — 4,4 ± 0,9; после лечения — 4,6 ± 1,1), объемы второго воспроизведения (до — 5,1 ± 1,3; после — 5,4 ± 1,4), объемы отсроченного воспроизведения (до — 4,9 ± 1,0; после — 5,1 ± 1,3).
Представленные данные свидетельствуют, что к окончанию лечения у обследованных пациентов значительно улучшились количественные показатели теста, характеризующие состояние памяти и внимания. Это выразилось в запоминании большинства слов уже со второго или третьего предъявления (повторений), истощаемость к концу исследования была достоверно меньше.
Выводы
Терапия препаратом Церебролизин на протяжении 20 дней способствовала регрессированию субъективных и объективных симптомов у больных с НИМ.
При лечении больных с НИМ Церебролизин приводит к достоверному улучшению двигательных и когнитивных функций. По результатам проведенного исследования выявлено улучшение внимания, кратковременной памяти, а также регуляторных функций на фоне лечения препаратом Церебролизин. Учитывая, что мнестические нарушения при НИМ носят динамический характер и связаны с недостаточностью внимания и нарушением регуляции, отмеченное улучшение памяти на фоне лечения препаратом Церебролизин связано с влиянием именно на эти патогенетические звенья.
Выявлено также достоверное улучшение устойчивости и походки, о чем свидетельствуют показатели шкалы Тинетти.
Препарат хорошо переносится пациентами и не вызывает побочных эффектов при длительном приеме.
Церебролизин может быть рекомендован в клиническую практику для лечения больных с дисциркуляторной энцефалопатией II–III ст. с «немыми» инфарктами мозга.
Список литературы
1. Lloyd-Jones D., Adams R.J., Brown Т.М. et al. Heart disease and stroke statistics — 2010 update: a report from the American Heart Association // Circulation. — 2010. — 121. — e46-215.
2. Report of the Director General. Life in the 21st Century: A vision for all. — Geneva, Switzerland: World Health Organization, 1998.
3. Feigin V.L., Lawes C.M., Bennett D.A., Anderson C.S. Stroke epidemiology: a review of population-based studies of incidence, prevalence, and case-fatality in the late 20th century // Lancet Neurol. — 2003. — 2. — 43-53.
4. Strong K., Mathers C., Bonita R. Preventing stroke: saving lives around the world // Lancet Neurol. — 2007. — 6. — 182-7.
5. Pantoni L. Cerebral small vessel disease: from pathogenesis and clinical characteristics to therapeutic challenges // Lancet Neurol. — 2010. — 9. — 689-701.
6. Vermeer S.E., Den Heijer T., Koudstaal P.J., Oudkerk M., Hofman A., Breteler M.M. Incidence and risk factors of silent brain infarcts in the population-based Rotterdam Scan Study // Stroke. — 2003. — 34. — 3926.
7. Vermeer S.E., Longstreth W.T. Jr, Koudstaal P.J. Silent brain infarcts: a systematic review// Lancet Neurol. — 2007. — 6. — 611-9.
8. Moran С., Phan T.G., Srikanth V.K. Cerebral small vessel disease: a review of clinical, radiological, and histopathological phenotypes // International Journal of Stroke. — 2012. — Vol. 7, Issue 1. — P. 36-46.
9. Norrving B. Lacunar infarcts: no black holes in the brain are benign // Pract. Neurol. — 2008. — № 8. — P. 222-28.
10. Fisher C.M. Capsular infarcts: the underlying vascular lesions // Arch. Neurol. — 1979. — 36. — 65-73.
11. Fisher C.M. The arterial lesions underlying lacunes // Acta Neuropathol. — 1968. — 12. — 1-15.
12. Fisher C.M. Lacunes: small, deep cerebral infarcts // Neuro-logy. — 1965. — 15. — 774-84.
13. Garcia-Eroles L., Targa C., Comes E., Parra O. Clinical predictors of lacunar syndrome not due to lacunar infarction // BMC Neurol. — 2010. — 10. — 31 (1–6).
14. Seifert T., Enzinger C., Storch M.K., Pichler G., Niederkorn K., Fazekas F. Acute small subcortical infarctions on diffusion weighted MRI: clinical presentation and aetiology // Neurol. Neurosurg. Psychiatry. — 2005. — 76. — 1520-4.
15. Donnan G.A., Norrving B. Lacunes and lacunar syndromes // Handb. Clin. Neurol. — 2009. — 93. — 559-75.
16. Левин O.C. Дисциркуляторная энцефалопатия: современные представления о механизмах развития и лечения // Журнал доказательной медицины для практических врачей. — 2010. — № 9. — С. 3-7.
17. Яхно Н.Н., Захаров В.В. Сосудистые когнитивные расстройства // Русский медицинский журнал. — 2005. — Т. 13, № 12. — С. 2-7.
18. Чуканова Е.И. Церебролизин в лечении пациентов с синдромом мягкого когнитивного снижения // Трудный пациент. — 2008. — № 2–3. — С. 3-6.
19. Tinetti M.E. // New Engl. J. Med. — 2003. — Vol. 348(1). — P. 42-49.
/16.jpg)

/17.jpg)
/18.jpg)