Международный неврологический журнал 3 (73) 2015
Вернуться к номеру
Проблемні питання лікування розсіяного склерозу
Рубрики: Неврология
Разделы: Медицинские форумы
Версия для печати
Статтю опубліковано на с. 99-102
4–6 квітня в м. Трускавці відбулася науково-практична конференція
«Від патофізіології до раціональної терапії в нейрогеронтології»,
на якій розглядали ключові патологічні стани в неврології.
Звичайно ж, не обійшли увагою тему діагностики та терапії
нейродегенеративних захворювань.
Перспективам лікування розсіяного склерозу (РС) була присвячена доповідь професора Т.І. Негрич (кафедра неврології Львівського національного медичного університету ім. Данила Галицького). Лікування розсіяного склерозу є не зовсім простим завданням, тому доцільно звернути увагу на декілька важливих моментів у цьому процесі.
По-перше, бажано намагатися дотримуватися чітких рекомендацій стосовно лікування кожного конкретного типу перебігу цього захворювання.
Рекомендації з лікування ремітуючо-рецидивуючого (РР) РС (рівень доказовості А) передбачають використання препаратів першої лінії — IFN-beta 1b підшкірно (Бетаферон), IFN-beta 1a підшкірно (Ребіф) та внутрішньом’язово (Авонекс), а також глатирамеру ацетату підшкірно. Причому при зафіксованих 2 або більше загостреннях протягом останніх 2 років препаратами вибору можуть бути IFN-beta 1b підшкірно, IFN-beta 1a підшкірно, глатирамеру ацетат. Тоді як при 2 або більше загостреннях протягом останніх 3 років препаратом вибору є IFN-beta 1a внутрішньом’язово.
Кожен із цих медикаментозних засобів позитивно впливає на клінічний перебіг РС. Можемо це продемонструвати на прикладі Авонексу, оскільки подібні закономірності стосуються й інших вищенаведених препаратів. Так, на 37 % знижується інвалідизація, на 32 % зменшується кількість загострень, на 47 % нормалізуються когнітивні розлади, а також на 55 % уповільнюються атрофічні процеси в мозку за даними магнітно-резонансної томографії (МРТ), на 52 % менше активних вогнищ і поява нових вогнищ.
У пацієнтів із високою активністю ремітуючо-рецидивуючого РС, які не відповідають на лікування препаратами першого ряду (≥ 1 загострення за попередній рік терапії і поява ≥ 9 T2 або ≥ 1 Gd+ вогнища при МРТ-обстеженні), або у хворих із дуже тяжкими загостреннями, що призвели до тяжкої інвалідизації та наростання кількості вогнищ при повторному МРТ-обстеженні (≥ 2 інвалідизуючих вогнища за попередній рік та ≥ 1 Gd+ вогнище або збільшення кількості T2-вогнищ) як засіб монотерапії модифікуючого спрямування для запобігання загостренням і затримки прогресування інвалідизації використовують медикаменти другого ряду, такі як наталізумаб або гіленія (рівень доказовості А).
При лікуванні вторинно-прогресуючого (ВП) РС (рівень доказовості А) використовують медикаментозні засоби першої лінії — IFN-beta-1b (Бетаферон) та IFN-beta-1а (Ребіф) підшкірно, а також препарати другої лінії — мітоксантрон, а при ВП РС із загостреннями — наталізумаб (у США).
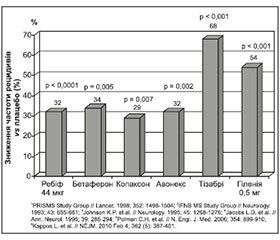
Другий важливий момент, на який необхідно звертати увагу, полягає в тому, що в окремих клінічних випадках необхідно намагатися одразу призначати ті препарати, що мають більшу ефективність, а не чекати, поки настане інвалідизація пацієнта, яка в багатьох випадках є необоротною. Повинна насторожувати висока частота рецидивів або їх тяжкість. У процесі лікування РС хворобомодифікуючими засобами першого ряду частота рецидивів цього захворювання суттєво знижується: на 34 % при лікуванні бетафероном (р = 0,005), на 32 % — ребіфом 44 мкг (р ≤ 0,0001) та Авонексом (р = 0,002), на 29 % — копаксоном (р = 0,007). Водночас більш суттєво вона знижується при призначенні гіленії 0,5 мг та тізабрі (54 та 68 % відповідно, р ≤ 0,0001), що має надзвичайно важливе клінічне значення і вказує на переваги такого лікування (рис. 1).
/100.jpg)
Саме тому у провідних клініках Європи, що займаються лікуванням РС (і ми могли це бачити, перебуваючи там на робочому місці), зокрема в Італії, Німеччині, Швейцарії, вже навіть при клінічно ізольованому синдромі, при радіологічно ізольованому синдромі, у дітей або в дебюті захворювання в певних конкретних випадках роблять вибір на користь препаратів другого ряду патогенетичної терапії.
Ще однією з причин, що примушують лікаря робити вибір на користь препаратів другого ряду, є зручність їх прийому (таблетовані форми або рідкі інфузії). Так, відомо, що 32 % пацієнтів пропускають або змінюють режим дозування через причини, пов’язані з реакцією на ін’єкцію. Для копаксону це щоденні підшкірні ін’єкції, для бетаферону — через день, для ребіфу — тричі на тиждень, для Авонексу — один раз на тиждень внутрішньом’язово. Є пацієнти з певними особливостями шкіри, у яких у місцях ін’єкцій утворюються синці, почервоніння, набряки аж до грубого косметичного дефекту. Саме зі збільшенням частоти ін’єкцій обернено пропорційно корелює частка пацієнтів із прихильністю до терапії. Водночас можуть бути розбіжності в поглядах на лікування у хворого на РС та його лікаря. Так, дані клініки й МРТ-обстежень можуть бути позитивними і дуже обнадійливими, а пацієнт вирішує переривати терапію. Тому рішення повинні приймати обидві сторони — пацієнт і його лікуючий лікар, знаходячи розумні, обґрунтовані компроміси.
Третє болюче питанням, що виникає в процесі курації хворих на РС: чи можна переходити з одного препарату на інший? А якщо так — на який і коли?
Стосовно цього останніми роками теж з’явилися певні рекомендації, що базуються на даних доказової медицини. Спробуємо навести деякі з них.
Ідентифікація факторів, що можуть впливати на ефективність імуномодулюючих ліків при РР РС, є дуже важливою. Як виявилося, нейтралізуючі антитіла (НА) впливають на ефективність інтерферонів бета. Група експертів підтвердила інформацію про те, що НА та інші біомаркери інтерферонів (наприклад, резистентний до міксовірусу протеїн А (MxA)) можуть використовуватися разом із клінічними та нейровізуалізаційними показниками для прийняття рішення про продовження лікування в кожному конкретному випадку. У разі тривалого підвищення титрів НА і/або відсутності МхА-біоактивності приймається рішення про перехід на інший препарат — не інтерферон бета. Це саме стосується і пацієнтів із наростанням негативної клінічної динаміки в неврологічному статусі незалежно від показників біомаркерів. Так, наприклад, у 60 % пацієнтів, у яких не було виявлено НА у плазмі крові, не було загострень, водночас серед осіб із наявними НА — лише у 20 %. Ще однією з переваг використання біомаркерів для оцінки ефективності призначеного лікування є те, що за допомогою біомаркерів ефективність оцінюється індивідуально у кожного пацієнта і вся процедура займає години, тоді як класичні МРТ-методики повинні залучати десятки або сотні пацієнтів і потребують місяців, а оцінювання за підрахунком загострень чи наростання інвалідизації взагалі триває роками і охоплює сотні чи навіть тисячі осіб. Доведено, що переведення з одного інтерферону на інший клінічно недоцільно (Limmroth et al. // WCN, 2005).
Коли постає питання про заміну препаратів у ме–жах одного ряду, наприклад про перехід із копаксону на бетаферон або ребіф чи Авонекс і навпаки або ж перехід на лікування медикаментозними засобами другого/третього ряду, то дані доказової медицини тут дуже чіткі. Краще переходити на терапію другої-третьої лінії, оскільки статистично вірогідно вже через 24 міс. такого «переключення» зменшуються кількість загострень, показники шкали інвалідизації EDSS та МРТ-активність (табл. 1) (Prosperini et al.).
Також рекомендуються певні таблиці, якими можна користуватися, визначаючи рівні «занепокоєння», що базуються на врахуванні кількості й тяжкості загострень, наростанні інвалідизації та даних МРТ-обстежень. Використовуючи чіткі алгоритми, можна визначити той момент, коли варто змінити терапію (табл. 2–4).
Заміну терапії необхідно здійснювати при високому рівні занепокоєння в одній зі сфер (загострення, прогресування інвалідизації чи МРТ) або при середньому рівні занепокоєння у будь-яких двох сферах або при низькому рівні занепокоєння у трьох сферах.
Ключовими принципами і пропозиціями щодо заміни терапії є:
— мінімізація проблем із комплайєнтністю за допомогою адекватного спілкування, підтримки пацієнта з урахуванням його освіти; оцінка комплайєнтності за допомогою будь-якої швидкісної активності;
— скринінг активності захворювання, особливо протягом перших 2 років лікування (розгляньте моніторинг/спостереження за допомогою МРТ);
— беріть до уваги прогностичні фактори при прийнятті рішення щодо «переключення» лікування;
— при несприятливому прогнозі швидко здійснюйте «переключення»;
— розгляньте можливість терапії «переключення» при несприятливому прогнозі на фоні лікування агентом другого ряду;
— документально фіксуйте і проводьте оцінку всіх загострень на фоні лікування (безпосереднє обстеження, МРТ);
— «переключення», що ґрунтується на наявності когнітивного дефіциту, має верифікуватися за допомогою тестування і нейровізуалізації;
— ізольоване погіршення, виявлене при неврологічному обстеженні або на МРТ головного мозку, має бути підставою для ретельного моніторингу, а не негайного «переключення» лікування;
— за відсутності змін на МРТ повторіть обстеження через кілька місяців;
— не чекайте занадто довго до терапевтичного «переключення»;
— наростання когнітивного дефіциту потребує заміни терапії.
Основною метою нашого виступу є заклик до лікарів-неврологів більш швидко реагувати на зміни стану пацієнта, вчасно і правильно призначати їм лікування, а також не боятися переходити на більш сильні препарати. На це нам дає право досвід, у тому числі здобутий під час участі в міжнародному багатоцентровому відкритому непорівняльному проспективному клінічному дослідженні 4-ї фази TIMER. У це дослідження були включені 224 пацієнти, із них 90 — з України, серед них 19 — зі Львівського центру розсіяного склерозу. Понад половина пацієнтів (124 з 215; 57,7 %) мали більше ніж одне загострення на рік.
Вивчали вплив наталізумабу на здатність до пересування у пацієнтів із РР РС. Використовували тести для оцінки ходи:
— Timed 25-Foot Walk (T25FW);
— Timed 100-Meter Walk (T100MW);
— Maximum Walking Distance (MWD).
Також визначали кореляції між цими тестами та шкалою інвалідизації (Expanded Disability Status Scale, EDSS).
Наталізумаб у дозі 300 мг вводився внутрішньовенно 1 раз на 4 тижні протягом 48 тижнів. До дослідження залучили дорослих пацієнтів (18–60 років) із підтвердженим РР РС, які раніше не отримували наталізумаб та мали щонайменше 1 загострення за попередній рік, із застосуванням препарату відповідно до затверджених терапевтичних показань інструкції для медичного застосування. До аналізу ефективності залучили пацієнтів, які отримали щонайменше одну інфузію наталізумабу та пройшли хоча б одне обстеження під час лікування.
Виявили, що наталізумаб підвищує швидкість пересування у пацієнтів із рецидивуючо-ремітуючим розсіяним склерозом.
Тест T100MW може більш точно визначити зміни у здатності до пересування, ніж тест T25FW, оскільки більшість пацієнтів показали клінічно значуще підвищення (≥ 20 %) швидкості пересування в тесті T100MW (25 %) порівняно з тестом T25FW (13 %) на 48-му тижні (P = 0,032).
Разом із тим обидва тести здатні визначити клінічно значимі покращення функції ходи. Так, під час дослідження при застосуванні наталізумабу збільшилась кількість пацієнтів із понад 20% підтвердженим покращенням швидкості пересування згідно з тестом T25FW до 78 % на другому році лікування порівняно з плацебо (P = 0,0133).
Отже, дослідження TIMER зробило вагомий внесок у практичну неврологію України, оскільки:
— пацієнти мали змогу протягом двох років отримувати безкоштовне лікування;
— тести для оцінки ходи доповнюють та вдосконалюють неврологічний огляд, дозволяючи більш точно оцінити клінічний стан хворого, є простими у виконанні та доступними для рутинного огляду, оскільки приблизно 75 % пацієнтів із розсіяним склерозом зазнають клінічно значимих порушень здатності до пересування.
Завдяки TIMER було зроблено і серйозні наукові висновки. Підтвердилося, що наталізумаб підвищує швидкість пересування у пацієнтів із рецидивуючо-ремітуючим розсіяним склерозом, а в 84,2 % пацієнтів не зафіксовано клінічної активності захворювання після лікування.
Третя сторона, а саме дослідники, вдячні за змогу брати участь у такому серйозному дослідженні, що дало неоціненний науковий і практичний досвід, а також за допомогу в публікації матеріалів дослідження у European Journal of Neurology.
AVON-PUB-052015-6

/101.jpg)