Статтю опубліковано на с. 145-150
Ураження головного мозку судинної етіології — одна з головних проблем сучасної неврології. Це пов’язано не лише із кількісним збільшенням інсультів та постарінням населення планети, коли причини виникнення та прогресування захворювань мозку з’ясовані, але і зі збільшенням у популяції факторів ризику [2].
Попередні численні дослідження показали, що в переважній більшості випадків гострі порушення мозкового кровообігу (ГПМК) розвиваються в мозку, структурні зміни якого вже відбулися. Сучасні методи нейровізуалізації дозволили визначати зміни речовини головного мозку, що передують ГПМК [1]. Дифузні зміни білої речовини мозку, збільшення розмірів шлуночків та субарахноїдального простору, дрібновогнищеві інфаркти мозку сьогодні розглядаються як ознаки хронічної ішемії мозку. У вітчизняній неврології у хронічній ішемії мозку виділяють початкові прояви недостатності кровопостачання мозку та дисциркуляторну енцефалопатію (ДЕ). У МКХ-10 терміну «дисциркуляторна енцефалопатія» немає. Використовуються I67.3 — прогресуюча судинна лейкоенцефалопатія (хвороба Бінсвангера), I67.4 — гіпертензивна енцефалопатія та ін. На практиці у вітчизняній літературі широко застосовується термін «дисциркуляторна енцефалопатія», вираженість якої позначають як стадії І, ІІ, ІІІ. Вважається, що цей синдром об’єднує майже всі форми хронічної патології мозку при артеріальній гіпертензії та атеросклерозі — від легких клінічних проявів до більш тяжких форм. Клінічно хронічна ішемія мозку залежно від стадії проявляється неврологічними розладами та когнітивними порушеннями.
До факторів ризику гострих та хронічних порушень мозкового кровообігу насамперед належить артеріальна гіпертензія, атеросклероз, дисліпідемія, паління, цукровий діабет тощо. Останні два десятиріччя невпинно вивчається поєднання факторів ризику, що отримало назву «метаболічний синдром» (МС). Багатьма дослідженнями показано, що ризик виникнення ГПМК залежить від тривалості та ступеня підвищення артеріального тиску, тривалості та компенсації цукрового діабету, прогресування дисліпідемії тощо. В останні роки в літературі з’явились публікації про вплив компонентів метаболічного синдрому без цукрового діабету на розвиток ГПМК. Проблема хронічної ішемії мозку, її прогресування залежно від поодиноких складових МС та їх поєднання вивчена недостатньо.
В останні роки МС називають епідемією розвинутих країн. У світі серед населення віком понад 30 років частота МС досягає 15–25 % [3]. У класичному розумінні, згідно з визначенням Міжнародної федерації діабету, МС — це поєднання абдомінального ожиріння, інсулінорезистентності (ІР), гіперглікемії, дисліпідемії, артеріальної гіпертензії (АГ), порушення системи гемостазу та хронічного субклінічного запалення, в основі яких лежать складні нейрогуморальні та гормональні порушення. Пусковим механізмом МС більшість авторів вважають інсулінорезистентність, що індукує розвиток цих станів [3, 4]. Відомо, що поєднання артеріальної гіпертензії з МС зумовлює більш виражені зміни в органах-мішенях і призводить до прогресування атеросклерозу та збільшення загального сумарного ризику розвитку серцево-судинних захворювань у 3–4 рази, а смертності від них — у 2–3 рази порівняно з АГ без МС [3, 4]. Міжнародна федерація діабету (IDF) у 2005 р. надала оновлені критерії МС, розглядаючи як головний компонент центральне ожиріння (для європейців окружність талії > 94 см у чоловіків, > 80 см у жінок, додатково виділені етнічні специфічні критерії для інших груп) в поєднанні з будь-якими двома з чотирьох критеріїв: гіпертригліцеридемія > 1,7 ммоль/л або специфічне лікування цього виду дисліпідемії; низький рівень холестерину ліпопротеїнів високої щільності (ЛПВЩ) < 1,03 ммоль/л у чоловіків та < 1,29 у жінок або специфічне лікування цього виду дислипідемії; АГ > 130/85 мм рт.ст. або лікування діагностованої АГ; гіперглікемія > 5,6 ммоль/л або раніше діагностований цукровий діабет [1, 4].
Цікавість вчених щодо розвитку та прогресування атеросклерозу у хворих із МС викликана насамперед змінами когнітивних функцій на початкових стадіях захворювання. До сімейних лікарів та неврологів часто звертаються пацієнти, які, на перший погляд, мають скарги (головний біль, головокружіння, зниження пам’яті та працездатності), що можна віднести до ознак дисциркуляторної енцефалопатії. Огляд хворого, проведення нейропсихологічних тестів, неврологічний статус не дають підстав називати даний стан ДЕ І ст. через відсутність будь-яких змін. Рекомендації щодо покращення життєвих умов, відпочинку сприяють зникненню скарг. Таких пацієнтів виділяють в окрему групу — із початковими порушеннями недостатності кровопостачання мозку (ППНКМ). І якщо на початку захворювання відпочинок та зміни способу життя дають ефект, то поступово відбувається накопичення у цих пацієнтів факторів ризику розвитку хвороб системі кровообігу [1, 2]. А коли пацієнт має додаткові фактори ризику розвитку судинних захворювань, наприклад деякі складові МС, імовірно, цей процес відбувається швидше та перехід від ППНКМ до ДЕ стирається в часі.
Диференціальна діагностика між ППНКМ і ДЕ І ст. досить складна. Вона базується на виявленні в неврологічному статусі окремих мінімальних ознак ураження, а також скарг, що можуть бути скореговані за певних умов (повноцінний відпочинок, зменшення навантаження на роботі тощо). Крім того, слід пам’ятати, що скарги можуть бути неспецифічними, виникати й при інших захворюваннях. Тому слід ретельно виключати інші психогенні та соматичні стани, що можуть призвести до виникнення скарг, подібних до тих, які виникають при початкових стадіях хронічної ішемії. Сьогодні вважають, що ППНКМ не можна розглядати як початкову стадію розвитку цереброваскулярної патології, лише як клінічний синдром початкових її проявів [ 2].
Згідно з прийнятими рекомендаціями, диференціально-діагностичні критерії ППНКМ і ДЕ І ст. досить суб’єктивні та складно уніфікуються. Вважається, що при ППНКМ скарги нестабільні й можуть зникати за певних умов (відпочинок, зміна характеру роботи, покращення умов життя тощо). У неврологічному статусі відсутня мікросимптоматика на відміну від ДЕ І ст. або можуть бути лише окремі нестабільні мікросимптоми.
Діагностика ДЕ І ст. така ж складна, як і ППНКМ. Крім того, ДЕ може бути викликана черепно-мозковою травмою, інтоксикацією, соматичною патологією тощо, а причиною головного критерію — порушень когнітивних функцій — може бути нейродегенеративне захворювання (наприклад, хвороба Альцгеймера).
При визначенні І ст. ДЕ враховуються такі критерії: скарги на головний біль, головокружіння, зниження пам’яті та працездатності відрізняються стабільністю, тривалістю та частотою. Відпочинок не приводить до зникнення цих скарг, але якщо постійно лікуватись, вони можуть зменшитись. Виявляється неврологічна мікросимптоматика в неврологічному статусі. При проведенні нейропсихологічного тестування визначаються легкі когнітивні порушення [ 2].
ППНКМ і ДЕ І ст. об’єднує наявність судинного захворювання (атеросклероз, артеріальна гіпертензія тощо).
При визначенні стадії ДЕ або ППНКМ необхідно враховувати й когнітивний резерв, що пацієнт набув за своє життя, тобто необхідно визначати рівень освіти та інтелектуальні здібності (кількість років освіти, спеціальність, мотивація до навчання й праці тощо). Зрозуміло, що людина, яка за своє життя накопичила більше знань, навиків, буде довше залишатися когнітивно компенсованою, ніж та, що в житті не напружувала свої когнітивні можливості та не отримала суттєвого багажу знань.
Мета дослідження: визначити особливості перебігу ППНКМ і ДЕ І ст. у пацієнтів з МС порівняно з пацієнтами контрольної групи, які не мають ознак МС
Матеріали та методи
Було обстежено 70 пацієнтів із ППНКМ і ДЕ І ст. Пацієнти розподілені на основну та контрольну групи, які, у свою чергу, були поділені так: основна — на 1-шу й 2-гу групи, а контрольна — на 3-тю та 4-ту групи. До основної групи входили пацієнти з МС. Першу групу становили 14 пацієнтів із ППНКМ; другу групу — 26 хворих з ДЕ І ст. віком від 37 до 58 років (середній вік 44,3 ± 5,8 року). До контрольної групи увійшли пацієнти без ознак МС. Третю групу становили 12 пацієнтів з ознаками ППНКМ, четверту групу — 18 пацієнтів з ДЕ І ст. (середній вік 43,4 ± 5,2 року). Усі групи були порівнянні за віком, статтю, вираженістю складових МС та рівнем освіти.
Пацієнтам проводились клініко-неврологічне обстеження (скарги, анамнез, неврологічний статус), обстеження серцево-судинної системи, вимірювання артеріального тиску, електрогардіографія, дуплексне сканування брахіоцефальних судин з кольоровим картуванням потоку. Визначали показники загального аналізу крові, сечі, глюкози крові, гемокоагуляційні властивості, коефіцієнт атерогенності, С-реактивний білок, білірубін, АЛТ, АСТ, загальний холестерин, тригліцериди, ліпопротеїни низької та високої щільності, глікозильований гемоглобін (HbA1с).
Пацієнти, у яких був діагностований цукровий діабет, у дослідження не включались.
Нейропсихологічне тестування включало оцінку психічного стану за Монреальською шкалою оцінки когнітивних функцій (МоСА), шкалою тривоги та депресії Гамільтона; дослідження уваги: пошук чисел по таблицях Шульте з оцінкою часу виконання завдання.
Усім хворим проводилась магнітно-резонансна томографія (МРТ) головного мозку. На МРТ визначали розміри вогнищ, кількість кіст, розміри бокових шлуночків, конвекситальних борозн, гіпокампа. При оцінці розмірів вогнищ ураження використовували класифікацію НДІ неврології РАМН 2003 р. [2, 4]: лакунарні (до 10 мм), дрібні (10–15 мм), середні (10–50 мм), великі (понад 50 мм).
Пацієнтам також визначали антропометричні показники: вагу в кілограмах, зріст, окружність талії та стегон, вираховували індекс маси тіла.
Cтатистична обробка результатів дослідження проводилась за допомогою сучасних методів математичного аналізу з використовуванням пакетів статистичних програм Statistica 6.0 і Excel 2003. Як критерії вірогідності показників використовували параметричний критерій Стьюдента та непараметричний критерій U (Вілкоксона — Манна — Уїтні).
Результати дослідження та їх обговорення
У пацієнтів 1-ї та 2-ї груп було визначено ознаки МС згідно з критеріями IDF.
Ретельний аналіз неврологічного статусу, соматичного стану пацієнтів, лабораторних показників не виявив у пацієнтів всіх груп захворювань, які б могли впливати на результати дослідження (черепно-мозкові травми, дисфункція щитоподібної залози, системні захворювання, анемію, дефіцит В12 тощо), крім тих, що передбачають участь у ньому.
Як видно з табл. 1, відсоткове співвідношення в підгрупах було рівне.
У пацієнтів основної групи виявлено порушення ліпідного спектра, підвищення рівня загального холестерину, ЛПНЩ та тригліцеридів: основна група — 5,77 ± 1,00 ммоль/л, 3,92 ± 0,94 ммоль/л, 1,75 ± 0,57 ммоль/л відповідно; контрольна група — 4,14 ± 0,98 ммоль/л, 2,95 ± 0,94 ммоль/л и 1,35 ± 0,70 ммоль/л відповідно. Окружність талії в пацієнтів основної групи — 92,4 ± 6,8 см — значно перевищувала відповідний показник у пацієнтів контрольної групи — 78,02 ± 0,4 см.
Зважаючи на те, що найбільш чутливою до легких когнітивних порушень є Монреальська шкала когнітивної оцінки, було застосовано нейропсихологічне дослідження саме за розділами цієї шкали. Показники шкали МоСА змінювалась від 21 до 29 балів. В основній групі результат за МоСА становив: Me = 26,20 ± 0,44 бала, Q1 = 25,2, Q2 = 27,2, а в групі контролю Me = 25,80 ± 0,39 бала, Q1 = 26,0, Q2 = 28,4.
Були виявлені зміни в таких когнітивних сферах: увага та концентрація, пам’ять, оптико-просторові навички, абстрактне мислення та рахунок. Найчастіше зустрічались порушення уваги й концентрації та зниження пам’яті.
Завдання на увагу та концентрацію включало повторення цифр, повторення цифр у зворотному порядку, серійний рахунок. Максимальна оцінка по цьому завданню становила 6 балів. Середня відповідь у пацієнтів основної групи становила 4,5 ± 0,5 та в контрольній групі — 5,0 ± 0,5.
Завдання на пам’ять передбачало читання 5 слів, потім повторення їх за дві спроби. Пацієнтів попереджали про необхідність повторення слів після виконання тесту. При повторенні на початку тесту бали не присуджували. При відстроченому відтворенні надавали по 1 балу за кожне слово. Середній бал за цим завданням становив: у 1 групі — 4,2 ± 0,5 бала, у 2-й групі — 3,8 ± 0,5 бала, у 3-й групі — 4,3 ± 0,4 бала та в 4-й групі — 4,2 ± 0,5 бала. Максимальна кількість відтворених слів становила 5, тобто могли надаватися 5 балів.
Для визначення оптико-просторових порушень пацієнтам пропонувалось намалювати годинник та за допомогою маленької та великої стрілок вказати час десять хвилин на дванадцяту. Бали присуджувались за 3 пунктами: контур годинника, цифри на годиннику, правильність розташування годинникових стрілок (по 1 балу за кожний пункт, максимум 3). При виконанні цього завдання визначались порушення просторово-гностичних характеристик (правильність зображення цифр, точність позначення часу, співвідношення розміру стрілок). Також виявлялись ознаки графічного органічного симптомокомплексу — якість зображення годинника в цілому й порушення швидкісних характеристик виконання завдання.
Варто відзначити, що когнітивні порушення проявлялись в легкому та помірному зниженні пам’яті, у тому числі професійної, порушенні уваги, уповільненні психічних процесів, а також в обмеженні здатностей до планування й контролю.
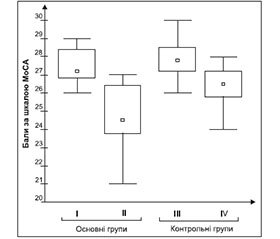
Як видно з поданих на рис. 1 даних, при ППНКМ не визначалось різниці між пацієнтами з МС та без МС.
Показники когнітивних функцій за жодним пунктом суттєво не відрізнялись, незважаючи на наявність у пацієнтів з МС підвищеного рівня глікозильованого гемоглобіну, ознак ІР, дисліпідемії тощо. І лише при ДЕ І ст. починається розбіжність між показниками когнітивних функцій у пацієнтів основної та контрольної груп, а саме між 2-ю та 4-ю групами. Ймовірно, це свідчить, що до певного часу складові МС не впливають на ті частини мозку, що визначають когнітивні функції. Поступово, з прогресуванням та накопиченням нових ознак МС, відбуваються зміни в структурно-функціональних показниках головного мозку та проявляються клінічно у вигляді порушення когнітивних функцій.
Пацієнтам обох груп визначався рівень глікозильованого гемоглобіну, що свідчить про стан вуглеводного обміну впродовж останніх трьох місяців. Результати десятирічного дослідження DCCT підтвердили ефективність контролю глікемії, що визначається за рівнем HbA1с, у розвитку мікро- та макросудинних ускладнень [6, 7]. У пацієнтів контрольної групи цей показник був у нормі, не перевищував 6,0 %. Пацієнти основної групи мали підвищений рівень глікозильованого гемоглобіну. Медіана в 1-й групі становила 7,4 % (6,8–8,7); медіана у 2-й групі — 7,1 % ( 6,2–7,6). Виявлено обернений кореляційний зв’язок між показниками глікозильованого гемоглобіну та когнітивних функцій у балах за шкалою МоСА (рис. 2).
/149.jpg)
У літературі останніх років наявні суперечливі дані щодо впливу ІР на когнітивні функції [6,7]. З одного боку, інсулін має здатність проникати через гематоенцефалічний бар’єр та чинити різнонаправлений вплив на когнітивні функції. Гостре введення інсуліну здатне покращити когнітивні функції, можливо, за рахунок прямої дії на неспецифічні інсулінові рецептори, що містяться на нейронах і астроцитах у корі та лімбічних структурах (у нормі мозок продукує деяку кількість інсуліну, що виконує функцію пептидного нейромодулятора) [4]. З іншого боку, хронічна гіперінсулінемія може мати принципово інший ефект — викликає когнітивне зниження й підвищення ризику мікроваскулярних ускладнень та хвороби Альцгеймера [7]. Постійний надлишок інсуліну здатний негативно впливати на енергетичний метаболізм клітин та стійко пригнічувати продукцію ендогенного інсуліну в мозку [7]. До сьогодні не існує вірогідних даних щодо впливу МС на когнітивні функції.
На рис. 2 зображена обернена кореляційна залежність рівня глікозильованого гемоглобіну та когнітивних функцій за шкалою МоСа. У результаті аналізу показників нами було отримано кореляційний зв’язок між підвищенням рівня глікозильованого гемоглобіну та зниженням показників когнітивних функцій (r = –0,44; p < 0,05).
Висновки
1. У результаті проведеного дослідження виявлено порушення когнітивних функцій у хворих з МС за шкалою МоСА, що є найбільш чутливою при легких та помірних порушеннях когнітивних функцій.
2. Показано, що при початкових порушеннях кровопостачання мозку немає суттєвої різниці в когнітивних функціях між пацієнтами з ознаками МС та без них.
3. У групі пацієнтів з ДЕ І ст. між тими, хто мав ознаки МС, та тими, в кого їх не було, визначаються відмінності в когнітивних функціях. Це свідчить про вірогідний вплив компонентів МС на прогресування ДЕ з погіршенням когнітивних функцій.
4. Знайдено обернений кореляційний зв’язок між показниками глікозильованого гемоглобіну та когнітивними функціями за шкалою МоСА.
Отже, можна припустити, що на початку прогресування хронічної ішемії мозку більший вплив має інсулінорезистентність, а в подальшому прогресуванню сприяють артеріальна гіпертензія та дисліпідемія.
/148_2.jpg)
/149.jpg)

/147.jpg)
/148.jpg)