Статтю опубліковано на с. 170-172
Вступ
Проблема судинних захворювань головного мозку посідає центральне місце серед найбільш актуальних питань охорони здоров’я. Лакунарний інсульт (ЛІ) — поширена форма цереброваскулярної патології. Дуже часто його недооцінюють через незначну неврологічну симптоматику, низький рівень ранньої смертності та невеликий відсоток інвалідизації. Частота ЛІ становить 15–25 % від загальної кількості ішемічних інсультів [7, 13], проте дані клінік США та Європи різняться, що може бути спричинено різними рамками, визначеними у дослідженнях. Цілий ряд публікацій присвячений темі прогресуючого ЛІ. Було встановлено, що у 20–30 % пацієнтів з ЛІ неврологічний дефіцит поглиблюється протягом декількох годин і навіть діб після початку інсульту [5, 8, 9, 12, 15]. Погіршення стану часто супроводжується ураженням рухових функцій, що може призвести до втрати функціональної здатності [11, 12, 16]. У той же час безсимптомне прогресування патології дрібних судин є типовою особливістю лакунарних інфарктів. Саме тому ЛІ повинен вважатися потенційно тяжким станом. За даними деяких авторів, у більш віддалені терміни різко зростають рівень смертності, небезпека виникнення повторного інсульту та деменції [6, 14].
Дослідження останніх років демонструють, що активація ендотелію мікроциркуляторного русла головного мозку може бути основним механізмом в патогенезі ЛІ, що в подальшому приводить до підвищення проникності гематоенцефалічного бар’єра. Підвищена проникність призводить до просочування продуктів крові у периваскулярні простори, що, у свою чергу, призводить до гліальних і нейрональних пошкоджень [10, 17, 18]. Баланс у системі вазорегуляції забезпечується активним функціонуванням вазодилататорів і констрикторних агентів. Ендотелін-1 (ЕТ-1) — найпотужніший із факторів вазоконстрикції [2]. У низьких концентраціях ЕТ-1 забезпечує вазодилатуючий ефект, а у високих — спричиняє вазоконстрикцію артерій і вен шляхом активації Са2+-каналів, проліферацію гладком’язових клітин і фібробластів судинної стінки, бере участь в апоптозі, викликає експресію адгезивних молекул. Підвищення плазмової концентрації ЕТ-1 є маркером гострого церебрального інсульту. На даний час ЕТ-1 розглядають як один із факторів, що спричинює церебральний вазоспазм аж до розвитку ішемії головного мозку [1, 3, 4].
Матеріали і методи
Під нашим спостереженням перебували 40 пацієнтів із гострим ЛІ. Середній вік — 63,15 ± 1,38 року, жінок було 12 (30 %), чоловіків — 28 (40 %). За віком хворі були розділені на 3 групи: І група — до 60 років (18 хворих), ІІ група — 61–70 років (13 хворих) та ІІІ група — 71 рік і більше (9 пацієнтів). Вираженість неврологічного дефіциту оцінювали за шкалою інсульту Національного інституту здоров’я (США) (National Institute of Health Stroke Scale — NIHSS). Серед обстежуваних було 27 хворих із легким інсультом (67,5 %) та 13 хворих (32,5 %) з інсультом середнього ступеня тяжкості. Серед усіх обстежуваних у 38 була гіпертонічна хвороба (ГХ). Підвищення артеріального тиску хворі відзначали у себе в середньому впродовж 10,0 ± 1,22 року: 13 пацієнтів (38,24 %) страждали від ГХ менше 5 років, 12 (35,29 %) — від 6 до 10 років, і 9 пацієнтів (26,47 %) хворіли більше ніж 10 років. У 6 пацієнтів (15,79 %) встановлено 1-й ступінь артеріальної гіпертензії, у 23 пацієнтів (60,53 %) — 2-й та у 9 хворих (23,68 %) — 3-й ступінь. Відповідно до проведеного опитування 9 пацієнтів (23,68 %) постійно приймали гіпотензивні препарати, 17 пацієнтів (44,74 %) приймали нерегулярно, і 12 пацієнтів (31,58 %) взагалі не отримували лікування. Усім хворим при госпіталізації проведено комп’ютерну томографію (КТ) головного мозку, що дало змогу верифікувати діагноз ЛІ. Відповідно до отриманих даних КТ головного мозку у 23 пацієнтів (57,5 %) виявлено одиничне вогнище ішемії, а у 17 (42,5 %) — множинні вогнища ішемії, що вказує на наявність «німих» інсультів у даної групи хворих.
Хворим на першу добу після госпіталізації проводили забір цільної крові з вени у пробірки з EDTA, центрифугування зразків із наступним виділенням плазми. Визначення вмісту ЕТ-1 проводилося за допомогою набору ІФА для визначення ендотеліну-1 ЕІА-3420 виробництва DRG (США).За норму було взято середнє значення ЕТ-1 у сироватці крові практично здорових людей, репрезентативних за віком та статтю з досліджуваною групою (середній вік — 62,50 ± 1,75 року), — 0,47 ± 0,01 пмоль/л.
Результати та їх обговорення
Рівень ЕТ-1 у гострому періоді ЛІ був вірогідно (р < 0,01) вищим за контрольні значення — 1,72 ± 0,09 пмоль/л проти 0,47 ± 0,01 пмоль/л.
Встановлена тенденція до зниження рівня ЕТ-1 з віком (р < 0,05). Так, показники І та ІІ груп були практично ідентичними (1,78 ± 0,11 пмоль/л та 1,77 ± 0,14 пмоль/л відповідно), а ІІІ групи — дещо нижчими (1,51 ± 0,23 пмоль/л).
Рівень ЕТ-1 у групі чоловіків становив 1,66 ± 0,11 пмоль/л, а у групі жінок — 1,84 ± 0,14 пмоль/л (р > 0,05).
Таким чином, у гострому періоді ЛІ не виявлено суттєвої залежності між рівнем ЕТ-1 та статтю й віком пацієнтів (r = –0,16).
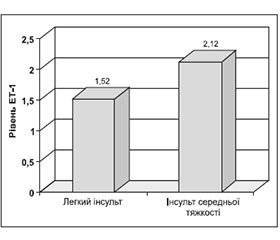
Встановлено, що у хворих на ЛІ середньої тяжкості значення ЕТ-1 вірогідно (р < 0,01) вище, ніж у хворих на легкий інсульт, — 2,12 ± 0,11 пмоль/л проти 1,52 ± 0,09 пмоль/л (рис. 1). Виявлено прямий зв’язок між рівнем ЕТ-1 та тяжкістю інсульту за шкалою NIHSS (r = 0,66).
У хворих зі стажем ГХ до 5 років рівень ЕТ-1 у крові становив 1,81 ± 0,16 пмоль/л, від 6 до 10 років — 1,60 ± 0,14 пмоль/л, а у хворих, які страждають на ГХ більше 10 років, — 1,58 ± 0,19 пмоль/л (рис. 2).
Чіткої кореляції між тривалістю ГХ у загальній сукупності та показником ЕТ-1 виявлено не було (r = –0,09), проте у групі хворих зі стажем ГХ до 5 років встановлено слабкий зворотний зв’язок між тривалістю хвороби та рівнем ЕТ-1 (r = –0,036). Рівень ЕТ-1 у хворих, які не приймали гіпотензивні препарати, становив 1,93 ± 0,17 пмоль/л, у хворих, які вживали препарати нерегулярно, — 1,80 ± 0,15 пмоль/л, та у пацієнтів, які регулярно отримували гіпотензивні препарати, — 1,72 ± 0,12 пмоль/л. Отже, рівень ЕТ-1 був вірогідно (р ≤ 0,05) нижчим у тих пацієнтів, які регулярно отримували антигіпертензивні препарати.
У хворих з ознаками «німих» лакунарних вогнищ рівень ЕТ-1 становив 1,51 ± 0,09 пмоль/л, що вірогідно (р ≤ 0,05) нижче за значення даного показника у хворих з одиничним вогнищем ішемії на КТ (1,87 ± 0,13 пмоль/л).
Висновки
1. У гострому періоді ЛІ зафіксовано вірогідне підвищення рівня ЕТ-1 у плазмі крові, що підтверджує наявність ендотеліального дисбалансу при даній патології. Встановлена залежність між тяжкістю інсульту та рівнем ЕТ-1.
2. У хворих з одиничним первинним вогнищем ішемії на КТ рівень ЕТ-1 у плазмі вірогідно вищий, ніж у пацієнтів з «німими» вогнищами.
3. У хворих, які регулярно приймали гіпотензивні препарати, зафіксовано нижчий рівень ЕТ-1 у гострому періоді ЛІ.
Список литературы
1. Волошин П.В., Малахов В.А., Завгородняя А.Н. Эндотелиальная дисфункция у больных с церебральным ишемическим инсультом: пол, возраст, тяжесть заболевания, новые возможности медикаментозной коррекции // Международный неврологический журнал. — 2007. — Т. 12, № 2. — С. 15-20.
2. Ружецова У.Ю. Взаимосвязь между симпатической нервной системой и эндотелином-1 в капиллярном кровотоке у больных ишемической болезнью сердца — значение GNB3 С825Т полиморфизма // Лечащий врач. — 2008. — № 1. — С. 87-92.
3. Рябченко А.Ю., Долгов А.М., Денисов Е.Н., Гуманова Н.Г. Роль оксида азота и эндотелина-1 в развитии ишемических нарушений мозгового кровообращения // Неврологический вестник. — 2014. — № 1. — С. 34-37.
4. Шамалов Н.А., Кочетов А.Г., Шетова И.М. и др. Связь факторов регуляции сосудистого тонуса с развитием геморрагической трансформации у больных ишемическим инсультом // Журнал неврологии и психиатрии. Приложение «Инсульт». — 2011. — С. 12-17.
5. Audebert H.J., Pellkofer T.S., Wimmer M.L., Haberl R.L. Progression in lacunar stroke is related to elevated acute phase parameters // Eur. Neurol. — 2004. — № 51. — Р. 125-131. Doi: 10.1159/000077012.
6. Bamford J., Sandercock P., Dennis M. еt al. Classification and natural history of clinically identifiable subtypes of cerebral infarction // Lancet. — 1991. — № 337. — Р. 1521-6.
7. Bejot Y., Catteau A., Caillier M., Rouaud O., Durier J., Marie C. et al. Trends in incidence, risk factors, and survival in symptomatic lacunar stroke in Dijon, France, from 1989 to 2006: a population-based study // Stroke. — Jul 2008. — № 39(7). — Р. 1945-1951. Doi:10.1161/STROKEAHA.107.510933.
8. Castellanos M., Castillo J., Garcia M.M. et al. Inflammation-mediated damage in progressing lacunar infarctions. A potential therapeutic target // Stroke. — 2002. — № 33. — Р. 982-987. Doi: 10.1161/hs0402.105339.
9. Kim Y.S., Lee K.Y., Koh S.H. et al. The role of matrix metalloproteinase 9 in early neurological worsening of acute lacunar infarction // Eur. Neurol. — 2006. — № 55. — Р. 11-15. Doi: 10.1159/000091137.
10. Lammie A. The role of oedema in lacune formation / A. Lammie // Cerebrovasc. Dis. — 1998. — Vol. 8. — P. 246. Doi: 10.1159/000015860.
11. Nagakane Y., Naritomi H., Oe H., Nagatsuka K., Yamawaki T. Neurological and MRI findings as predictors of progressive-type lacunar infarction // Eur. Neurol. — 2008. — № 60. — Р. 132-141. Doi: 10.1159/000144084.
12. Nakamura K., Saku Y., Ibayashi S., Fujishima M. Progressive motor deficits in lacunar infarction // Neurology. — 1999. — № 52. — Р. 29-33. Doi: 10.1212/WNL.52.1.29 1526-632X.
13. Sacco S., Marini C., Totaro R., Russo T., Cerone D., Carolei A. A population-based study of the incidence and prognosis of lacunar stroke // Neurology. — May 9 2006. — № 66(9). — Р. 1335-1338. Doi: 10.1212/01.wnl.0000210457.89798.0e.
14. Samuelsson M., Soderfeldt B., Olsson G.B. Functional outcome in patients with lacunar infarction // Stroke. — 1996. — № 27. — Р. 842-846. Doi: 10.1161/01.STR.27.5.842.
15. Serena J., Leira R., Castillo J., Pumar J.M., Castellanos M., Davalos A. Neurological deterioration in acute lacunar infarctions. The role of excitatory and inhibitory neurotransmitters // Stroke. — 2001. — № 32. — Р. 1154-61. Doi: 10.1161/01.STR.32.5.1154.
16. Steinke W., Ley S.C. Lacunar stroke is the major cause of progressive motor deficits // Stroke. — 2002. — № 33. — Р. 1510-1516. Doi: 10.1161/01.STR.0000016326.78014.FE.
17. Wardlaw J.M. Is breakdown of the bloodbrain barrier responsible for lacunar stroke, leukoaraiosis and dementia? / J.M. Wardlaw [et al.] // Stroke. — 2003. — Vol. 34. — P. 806-812. doi: 10.1161/01.STR.0000058480.77236.B3.
18. Wardlaw J.M. What causes lacunar stroke? / J.M. Wardlaw // J. Neurol. Neurosurg. Psychiatry. — 2005. — Vol. 76. — P. 617-619. Doi: 10.1136/jnnp.2004.039982.
1. Voloshyn P.V., Malakhov V.A., Zavhorodnyaya A.N. Эndotelyal'nayadysfunktsyya u bol'nykh s tserebral'nymyshemycheskymynsul'tom: pol, vozrast, tyazhest' zabolevanyya, novыevozmozhnostymedykamentoznoykorrektsyy // Mezhdunarodnыynevrolohycheskyyzhurnal. 2007. T. 12, #. 2. S. 15‒20.
2. RuzhetsovaU.Yu. Vzaymosvyaz' mezhdusympatycheskoynervnoysystemoy y endotelynom-1 vkapyllyarnomkrovotoke u bol'nykhyshemycheskoybolezn'yuserdtsa - znachenye GNB3 S825T polymorfyzma. // Lechashchyyvrach. 2008. N 1. S.87-92.
3. RyabchenkoA.Yu., Dolhov A.M., Denysov E.N., Humanova N.H. Rol' oksydaazota y endotelyna-1 v razvytyyyshemycheskykhnarushenyymozhovohokrovoobrashchenyya // Nevrolohycheskyyvestnyk. 2014. N 1. S.34-37.
4. Shamalov N.A., Kochetov A.H., Shetova Y.M. y dr. Svyaz' faktorovrehulyatsyysosudystohotonusa s razvytyemhemorrahycheskoytransformatsyy u bol'nykhyshemycheskymynsul'tom // Zhurnalnevrolohyy y psykhyatryy (prylozhenyeYnsul't). 2011. S. 12‒17.

/171.jpg)