Статтю опубліковано на с. 173-177
Вступ
Діабетична полінейропатія (ДПН) — це найбільш поширене пізнє ускладнення цукрового діабету (ЦД), що знижує якість життя хворого [2]. Це важливий фактор ризику розвитку синдрому діабетичної стопи та подальшої інвалідизації хворих. У світі 40–70 % усіх нетравматичних ампутацій нижніх кінцівок проводиться в пацієнтів із ЦД [6]. Тому раннє виявлення та запобігання розвитку ДПН вкрай важливе для зниження ризику виразкоутворення й можливої подальшої ампутації кінцівки [13]. Згідно із загальноприйнятою класифікацією, за патофізіологічними ознаками полінейропатії поділяють на аксональні та демієлінізуючі [2, 8]. Відомо, що при початкових проявах полінейропатії у хворих на ЦД 2-го типу характерний аксональний тип ураження нервових стовбурів, із прогресуванням захворювання в патологічний процес залучається й мієлін. Тобто в пацієнтів виявляють явища не тільки аксонопатії, але й демієлінізації периферичних нервових волокон [15]. Зміни в нервах є результатом гіперглікемії, що сприяє виникненню метаболічних та судинних розладів на тлі генетичної детермінованості [17]. Останнім часом стало відомо, що хронічна гіперглікемія й гіперінсулінемія стимулюють прозапальну активність клітинних і гуморальних ефекторів імунної системи [12]. За даними ряду досліджень, у хворих на ЦД 2-го типу спостерігаються стійкі зміни в різних ланках імунної системи: клітинному, гуморальному імунітеті, фагоцитарній активності [16]. Встановлено, що сироватка хворих на ЦД 2-го типу з нейропатією містить автоімунні імуноглобуліни, що є свідченням комплементнезалежного кальційзалежного апоптозу нейронів. Рівень експресії цих імуноглобулінів асоціюється з тяжкістю нейропатії і з типом нейронального ураження, тому припускають, що зазначені цитотоксичні фактори поряд із гіперглікемією можуть впливати на розвиток ДПН [16]. Одним із ключових компонентів мієлінової оболонки є периферичний мієліновий білок 22 (peripheral myelin protein 22, PMP22), синтезований шваннівськими клітинами, показник сироваткового рівня якого може слугувати маркером ступеня ураження мієліну [10]. Функція PMP22 — забезпечення міжклітинних контактів; він слугує фактором росту нервів і їх мієлінізації [11]. Підвищення рівня PMP22 виявлене не тільки при спадкових, але і при набутих полінейропатіях, зокрема й при ЦД; окремі автори вважають це критерієм демієлінізуючого процесу периферичних нервів [14].
Таким чином, імунокорекція могла би бути однією зі складових комплексного лікування ДПН, спрямованого на блокування патоімунних процесів, пригнічення запалення, запобігання ураженню мієліну та аксональній дегенерації. Для корекції імунної дисфункції у хворих на ЦД 2-го типу авторами було запропоновано застосування імунокоригуючого засобу, тимоміметика, що містить аргініл-альфа-аспартил-лізил-валіл-тирозил-аргінін-гексапептид, імунофану, при вживанні якого у 26 % випадків вдалося повністю нормалізувати імунологічні показники [7]. У комплексному лікуванні імунної дисфункції при ЦД 2-го типу призначення поліоксидонію дозволяє знизити ініціально підвищені титри автоантитіл, швидше нормалізувати показники вуглеводного обміну, маркери декомпенсації цукрового діабету [9]. Імунокорекція препаратом суперлімф при синдромі діабетичної стопи призводить до нормалізації фагоцитарної ланки імунітету, сприяє зменшенню ендогенної інтоксикації [5]. Заслуговує на увагу досвід застосування розчину імуноглобуліну людського простого (ІГЛП). У рандомізованих клінічних дослідженнях доведений терапевтичний ефект застосування ІГЛП при широкому спектрі автоімунних і системних запальних захворювань, що перебігають із вираженими порушеннями в імунній системі. Препарат також застосовують для лікування первинних та набутих імунодефіцитних станів [1]. У неврологічній практиці ІГЛП добре зарекомендував себе для лікування міастенії, міастенічного синдрому Ламберта — Ітона, демієлінізуючих захворювань і деяких видів нейропатій. Проте немає достатньо даних про те, які схеми та дозування є оптимальними [4].
Незважаючи на підтвердження ролі імунної дисфункції в прогресуванні ЦД та його ускладнень, у сучасній науковій літературі є недостатньо даних щодо вибору ефективної терапії ДПН, вони є суперечливими, а питання патогенетичної терапії й надалі залишається складною проблемою, що стало передумовою для нашого дослідження.
Метою роботи було визначення ефективності застосування імуномодулюючої терапії, зокрема імуноглобуліну людського простого, з метою корекції імунної дисфункції у хворих на ЦД 2-го типу, ускладнений полінейропатією, за рівнем антитіл до периферичного мієлінового білка 22.
Матеріали та методи
Під спостереженням знаходилось 78 хворих на ЦД 2-го типу, ускладнений ДПН, які перебували на стаціонарному лікуванні в ендокринологічному відділенні Івано-Франківської обласної клінічної лікарні. З них було 32 (41,03 %) чоловіки та 46 (58,97 %) жінок, середній вік становив 48,51 ± 1,68 року. Хворими була підписана поінформована згода на участь у дослідженні. Всі пацієнти мали середньотяжку форму діабету, що визначалось його компенсацією за рівнем глікозильованого гемоглобіну, який становив 9,26 ± 1,64 %. У дослідження включали хворих із симптомними стадіями ДПН за класифікацією P.J. Dyck та P.K. Tomas (1999): з ІІ стадією ДПН — 42 та з ІІІ стадією — 36 пацієнтів. Для порівняння отриманих результатів було набрано 20 практично здорових осіб (ПЗО) відповідного віку.
Усім досліджуваним хворим було проведено загальноклінічне обстеження, у тому числі визначали маркери компенсації ЦД (рівень базальної глікемії та НbА1c) та проводили клінічне неврологічне обстеження. Електронейроміографічне (ЕНМГ) дослідження моторних волокон малогомілкових та великогомілкових нервів здійснювали тричі на обох кінцівках з усередненням показників на комп’ютерному двоканальному електронейроміографі «Нейро-ЭМГ-Микро» («Нейрософт», РФ). Для визначення функціонального стану аксонів оцінювали амплітуду потенціалу максимальної рухової відповіді, М-відповіді (мВ), на стимуляцію нерва в дистальній точці, для визначення функціонального стану мієліну — резидуальну латенцію (РЛ) (мс) та швидкість проведення збудження (ШПЗ) (м/с) нервами.
Імунний статус вивчали за такими характеристиками: імунокомпетентні клітини: СD8+ — Т-супресори, СD3+ — Т-зрілі лімфоцити, СD4+ — Т-хелпери, СD16+ — NK, натуральні кілери, СD19+ — В-лімфоцити — визначали методом імунофлуоресценції набором моноклональних і поліклональних антитіл ООО «Сорбент» (м. Подільськ); рівень імуноглобулінів IgM, IgG — методом радіальної імунодифузії в гелі за Манчіні (ФГУП «НПО «Микроген», РФ). Розраховували імунорегуляторний індекс (ІРІ): СD4+/СD8+. Визначення рівня антитіл до периферичного мієлінового білка 22 у сироватці крові проводили серологічним методом імуноферментного аналізу (ELISA, США).
За схемою лікування всіх хворих було рандомізовано на 2 групи методом випадкових чисел. До І групи (контрольна група) увійшло 38 пацієнтів, які отримували базисне лікування, що включало відповідну дієту, цукрознижувальні середники, статини, гіпотензивні препарати, антиагреганти, препарати α-ліпоєвої кислоти, бенфотіамін, актовегін, при больовому синдромі — габапентин [3]. ІІ група (основна група) включала 40 хворих, яким, окрім базисного лікування, призначали ІГЛП («Біовен», Україна) 5% у дозі 150 мл (0,2 мг/кг) впродовж 5 днів, що вводився один раз на добу внутрішньовенно краплинно. Хворі обстежувались при надходженні, при виписці і через три місяці після завершення лікування.
Для об’єктивного судження про ступінь вірогідності результатів дослідження нами застосовано статистичні методи аналізу отриманих результатів із використанням пакету статистичного аналізу даних Statistica (StatSoft, Inc.) та MS Excel. При проведенні статистичної обробки використовували в основному непараметричні методи аналізу.
Результати дослідження та їх обговорення
Аналізуючи показники імуногомеостазу в динаміці лікування (табл. 1), слід констатувати відсутність суттєвого впливу як базового, так і комплексного лікування на рівень загального вмісту Т-лімфоцитів (CD3+), Т-супресорів (CD8+) та вірогідну нормалізацію популяції Т-хелперів (CD4+), причому незалежно від обраної тактики лікування (р < 0,05). В основній групі в динаміці лікування спостерігалась тенденція до стабілізації показника натуральних кілерів (CD16+), хоча вірогідних змін не відмічено (р > 0,05). Найбільш відчутні зміни в процесі лікування стосувались показників вмісту В-лімфоцитів (CD19+), продукції IgG та IРI. Так, рівень CD19+ знизився через 10 днів базової терапії до 18,06 ± 0,75 % (р < 0,05). В основній групі на 10-й день лікування відмічаємо значне зниження вмісту В-лімфоцитів, до 15,02 ± 0,47 %, вірогідне щодо даних як до лікування (р < 0,05), так і контрольної групи (р < 0,05), що утримується і через 3 місяці після завершення терапії ІГЛП (р < 0,05).
/175.jpg)
Продукція IgG вірогідно знижувалась лише в основній групі як порівняно з показниками до лікування (р < 0,05), так і з показниками контрольної групи (р < 0,05), та залишається на тому ж рівні через 3 місяці після лікування (р < 0,05), хоча й не досягала показників ПЗО. Звертає на себе увагу вірогідне зниження ІРІ в усіх групах хворих після проведеного лікування (р < 0,05), але в основній групі на тлі комплексного лікування із застосуванням ІГЛП він практично досягає значень ПЗО: 1,47 ± 0,11 г/л — через 10 днів лікування та 1,41 ± 0,08 г/л — через 3 місяці.
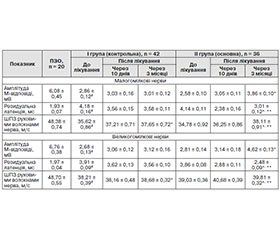
Цікавим фактом виявилася й динаміка показників ЕНМГ-тестування (табл. 2).
Так, при дослідженні малогомілкових нервів в основній групі на фоні лікування ІГЛП досягнуто вірогідне підвищення показника М-відповіді через 3 місяці порівняно з даними до лікування (р < 0,05) і в контрольній групі (р < 0,05), хоча в пацієнтів на фоні базового лікування спостерігалась також тенденція до покращення (р > 0,05). Аналогічну динаміку характеристики функціонального стану аксона спостерігали і при дослідженні великогомілкових нервів.
Виявлене вкорочення РЛ при дослідженні малогомілкових та великогомілкових нервів у пацієнтів обох досліджуваних груп у процесі проведеної терапії. Хоча в групі контролю спостерігалась лише тенденція до покращення, що утримувалась і у віддаленому періоді, тобто через 3 місяці (р > 0,05). Тоді як в основній групі відмічене вірогідне покращення через 3 місяці після терапії ІГЛП для обох нервів ніг (р < 0,05), причому помітна і міжгрупова різниця після лікування (р < 0,05). Така ж динаміка спостерігається й при аналізі даних ШПЗ руховими волокнами нерва. Це свідчить про значимий вплив проведеної імунокорекції в пацієнтів, що опосередковано має здатність відновлювати функціональний стан мієліну.
Виявлене суттєве підвищення рівня антитіл до PMP22 порівняно з ПЗО: 7,82 ± 1,04 нг/мл проти 0,05 ± 0,27 нг/мл (р < 0,05), що підтверджує зростання ступеня демієлінізації периферичних нервів при ЦД 2-го типу з прогресуванням полінейропатії у хворих на ЦД 2-го типу (рис. 1).
При дослідженні рівня антитіл до РМР22 в сироватці крові пацієнтів через 3 місяці після лікування за загальноприйнятою схемою спостерігалось вірогідне зниження показника порівняно з даними хворих до лікування (р < 0,05). Але більшого ефекту досягнуто при застосуванні комплексного лікування з включенням ІГЛП порівняно з показником хворих до лікування (р < 0,05) та пацієнтів контрольної групи (р < 0,05).
Ряд авторів вважають, що у хворих на ЦД 2-го типу імунні порушення виникають у відповідь на наявні метаболічні зрушення, що викликають появу автоантигенів, і саме дизімунні розлади можуть визначати розвиток і перебіг ДПН [15, 17]. Крім цього, про значний вплив на розвиток даного ускладнення імунних процесів свідчить високий рівень антитіл до РМР22, показник якого зростає з прогресуванням полінейропатії та є маркером ураження мієліну [16]. Враховуючи виявлений позитивний вплив імуномодулюючої терапії, зокрема ІГЛП, на функціональний стан периферичних нервів за даними ЕНМГ, показники імунного гомеостазу та на зниження рівня антитіл до РМР22, її можна розглядати як додаткову перспективу в лікуванні діабетичної полінейропатії.
Висновки
1. Застосування в комплексному лікуванні імуномодулюючої терапії ІГЛП дозволяє поряд із корекцією імунологічних порушень нормалізувати показники електронейроміографічного дослідження, особливо що стосується функціонального стану мієліну. Клініко-імунологічні ефекти зберігаються щонайменше до 3 місяців.
2. Стабілізація імунологічних показників, що досягається за допомогою ІГЛП, створює сприятливий фон для поліпшення ефективності базового лікування, а також дозволяє досягти вповільнення процесів ураження мієліну нервових волокон, що проявляється у зниженні сироваткового рівня РМР22.
Список литературы
1. Аверченков В.М. Внутривенные иммуноглобулины: механизмы действия и возможности клинического применения / В.М. Аверченков, И.С. Палагин // Клиническая иммунология и противомикробная химиотерапия. — 2004. — Т. 6, № 3. — С. 273-279.
2. Гурьева И.В. Диабетическая полинейропатия / И.В. Гурьева, О.С. Левин // Consilium Medicum. — 2014. — № 4. — С. 12-19.
3. Наказ МОЗ № 1118 від 21.12.2012 р. Уніфіковані клінічні протоколи первинної та вторинної (спеціалізованої) медичної допомоги. Цукровий діабет 2 типу — С. 55-60 (джерело: http://www.moz.gov.ua).
4. Негреба Т.В. Клиническая эффективность иммуноглобулина при разных типах течения рассеянного склероза / Т.В. Негреба // Український вісник психоневрології. — 2005. — Том 13, вип. 4, № 45. — С. 33-34
5. Потемкин В.В. Комплексное лечение больных с синдромом диабетической стопы с использованием иммунопрепарата «Суперлимф» / В.В. Потемкин, Л.В. Ковальчук, Е.Н. Томилова [и др.] // Современные аспекты хирургической эндокринологии. — 2010. — С. 281.
6. Прудиус П.Г. Проблема обліку хронічних ускладнень у хворих на цукровий діабет / П.Г. Прудиус, М.В. Власенко, Н.І. Гуріна // Международный эндокринологический журнал. — 2010. — № 8. — С. 32.
7. Скрипник Н.В. Ефективність імунотропної терапії у хворих на цукровий діабет 2-го типу з метаболічним синдромом в умовах йодного дефіциту / Н.В. Скрипник // Ліки України. — 2012. — № 1–2. — С. 9-10
8. Ткаченко О.В. Поліневропатії / О.В. Ткаченко, В.В. Оржешковський // Мистецтво лікування. — 2010. — № 1. — С. 38-41.
9. Филатова Г.А. Влияние Полиоксидония на показатели иммунного статуса пациентов с хроническим обструктивным бронхитом на фоне сахарного диабета I и II типов / Г.А. Филатова, А.М. Попкова, Т.И. Гришина // Клиническая иммунология. — 2004. — № 7. — С. 16-21.
10. Brooks-Worrell B. Immunology in the Clinic Review Series; focus on metabolic diseases: development of islet autoimmune disease in type 2 diabetes patients: potential sequelae of chronic inflammation / B. Brooks-Worrell, J.P. Palmer // Clin. Exp. Immunol. — 2012. — Vol. 167. — P. 40-46.
11. Catharina G.F. Entrapment in antimyelin-associated glycoprotein neuropathy / G.F. Catharina, C.N. Nicolette, H.J.W. John, F. Hessel // Journal of Neurology. — 2009. — Vol. 256, № 4. — Р. 620-624.
12. Donath M.Y. Type 2 diabetes as an inflammatory disease / M.Y. Donath, S.E. Shoelson // Nat. Rev. Immunol. — 2011. — Vol. 11, № 2. — P. 98-107.
13. Dyck P.J. Severity staging of diabetic polyneuropathy / F.A. Gries, N.E. Cameron, P.A. Low, D. Ziegler eds. // Textbook of Diabetic Neuropathy. — Stuttgart, Thieme, 2003. — Р. 170-175.
14. Granberg V. Autoantibodies to autonomic nerves associated with cardiac and peripheral autonomic neuropathy / V. Granberg, N. Ejskjaer, M. Peakman, G. Sundkvist // Diabetes Care. — 2005. — Vol. 28. — P. 1959-1964.
15. Rickey E. Modeling nerve conduction criteria for diagnosis of diabetic polyneuropathy / E.С. Rickey, J. William // Muscle and Nerve. — 2011. — Vol. 44. — P. 340-345.
16. Seissler J. Autoimmune diagnostics in diabetes mellitus / J. Seissler, W.A. Scherbaum // Clin. Chem. Lab. Med. — 2006. — Vol. 44, № 2. — P. 133-137 (джерело: http://www.ncbi.nlm.nьитиih.gov/pubmed/20795891)
17. Ziegler D. Treatment of diabetic neuropathy and neuropathic pain / D. Ziegler // Diabetic Care. — 2008. — Vol. 33. — P. 255-261.
/176_2.jpg)

/175.jpg)
/176.jpg)