Статья опубликована на с. 97-104
Введение
Инсульт — это состояние, характеризующееся быстрым появлением признаков фокального или общего нарушения мозговых функций, которые сохраняются 24 часа или дольше и могут привести к смерти больного (Всемирная организация здравоохранения, 1995).
В последнее время все больше обследований и публикаций обращено к вопросам инсультов, которые возникают в детском возрасте [1]. До недавнего времени считалось, что возникновение инсульта у ребенка практически невозможно. Ученые и врачи во всем мире участвуют в проведении масштабных исследований, которые могли бы помочь в понимании причин, приводящих к возникновению инсульта у детей, для возможного их предотвращения и развития повторных случаев у конкретного ребенка. Данные подобных исследований уже были опубликованы [2, 3]. Также необходимо отметить, что появляется все больше работ, в которых уделяется большое внимание генетическому компоненту в развитии инсультов в детском возрасте. Более ранние работы были посвящены исследованию полиморфизма генов MTHFR (C677T), FII (G20210A), FV (G1691A) [4–9]. Однако появляются работы, указывающие на дополнительное влияние полиморфизма генов MTHFR (A1298C), MTRR (A66G), в связи с участием данных генов в фолатном цикле, а также гена ACE (I/D), наличие полиморфизма которого увеличивает склонность к инсультам за счет сосудистого компонента [10, 11]. Продолжаются генетические исследования, которые затрагивают и отдельные популяции [12, 13]. Вопрос изучения перинатальных и анамнестических факторов, которые могут приводить к развитию инсультов, по литературным данным, больше освещен в отношении инсультов перинатального периода [14–16], и практически не встречается анализ влияния данных факторов на развитие инсультов в постнатальном периоде.
Ранее в Украине не проводился комплексный анализ клинических и анамнестических факторов в комбинации с наличием у конкретного ребенка полиморфизма генов, которые могли бы влиять на развитие острого инсульта в детском возрасте.
Цель: провести комплексный клинико-анамнестический и генетический анализ (наличие полиморфизма генов MTHFR (C677T), MTHFR (A1298C), MTRR (A66G), ACE (I/D), FII (G20210A), FV (G1691A)) для оценки их влияния на развитие инсультов в детском возрасте.
Материалы и методы
Принимая во внимание тот факт, что инсульт в детском возрасте — это мультифакторное заболевание, нами был проведен анализ комбинаций клинико-анамнестических и генетических факторов, которые могут быть причиной развития инсультов у детей.
В исследование вошли 122 ребенка в возрасте от 0 до 14 лет. Все дети были разделены на основную и контрольную группы. Дети основной и контрольной групп находились на обследовании и лечении в ГДКБ № 1 г. Киева в период с 01.01.2009 по 01.12.2013 г.
Основная группа включала в себя 78 детей с острым нарушением мозгового кровообращения, из них 47 детей — с ишемическим инсультом (ИИ) и 31 ребенок — с геморрагическим инсультом (ГИ). В контрольную группу были включены 44 ребенка, которые на момент обследования не имели каких-либо изменений в неврологическом статусе.
Исследование было разделено на несколько этапов.
На первом этапе был проведен анализ клинико-анамнестической и статистической модели, которая включала в себя изучение следующих показателей:
— акушерский анамнез у матери (наличие абортов, выкидышей, мертворожденных);
— протекание беременности (угроза прерывания, норма, болезни матери; артериальное давление, наличие анемии; гестоз 1-й и 2-й половины беременности, прием фолиевой кислоты и/или витаминов для беременных);
— роды (самостоятельные, кесарево сечение, вакуум-экстракция);
— неделя гестации при рождении (38–42 нед., 36–37 нед., 35 нед. и меньше);
— вес при рождении (больше 3000 г, 2500–2990 г, меньше 2500 г);
— рост при рождении (больше 50 см, 45–49 см, меньше 45 см);
— оценка по шкале Апгар при рождении (больше 8 баллов, 7–8 баллов, 6 баллов и ниже);
— наличие реанимации в раннем неонатальном периоде;
— наличие в семье случаев инсультов различного генеза.
При проведении анализа полученных данных было выявлено, что наличие в анамнезе осложненных родов, в том числе реанимационных мероприятий в раннем неонатальном периоде, рождение детей с низкой оценкой по шкале Апгар (6 баллов и ниже), весом при рождении ребенка меньше 2500 г и ростом меньше 49 см, чаще наблюдалось в основной группе по сравнению с группой контроля.
Следующий этап исследования включал проведение молекулярно-генетического обследования с изучением полиморфизма генов MTHFR (C677T), MTHFR (A1298C), MTRR (A66G), ACE (I/D), FII (G20210A), FV (G1691A). Частота распространенности полиморфных вариантов генов в основной группе и группе контроля представлена на рис. 1.
/99.jpg)
В результате проведенных нами обследований и подсчета возможного влияния полиморфизма указанных генов (рис. 1) было выявлено, что мутация в генах FII (G20210A) и FV (G1691A) не оказывает достоверного влияния на развитие инсультов у детей украинской популяции. В своих дальнейших исследованиях мы рассматривали только полиморфизм генов MTHFR (C677T), MTHFR (A1298C), MTRR (A66G), ACE (I/D). Отмечается выраженное повышение частоты генотипа СТ гена MTHFR_С677Т (χ2 = 9,10; р < 0,003; OR = 3,77; 95% CI 1,64–8,67), генотипа АС гена MTHFR_A1298C (χ2 = 5,61; р < 0,018; OR = 2,91; 95% CI 1,27–6,71), генотипа AG гена MTRR_A66G (χ2 = 4,01; р < 0,045; OR = 2,80; 95% CI 1,10–7,11), генотипов ID (χ2 = 6,92; р < 0,009; OR = 3,33; 95% CI 1,41–7,86) и DD гена АСЕ (χ2 = 9,26; р < 0,002; OR = 8,78; 95% CI 1,96–39,35) в сравнении с группой контроля. Таким образом, наличие указанных генотипов практически в 3 раза увеличивает риск развития инсульта у детей, а при наличии DD генотипа гена АСЕ риск развития инсульта увеличивался практически в 9 раз.
Далее нами проводился комплексный анализ полученных данных с помощью метода MDR и метода линейной регрессии.
Результаты и их обсуждение
На основании проведенных ранее исследований в группе детей с различными инсультами были выявлены наиболее весомые факторы риска в отношении развития заболевания у детей. Этими факторами были: полиморфизм генов MTHFR и АСЕ, наличие реанимационной помощи в неонатальном периоде, гестационный возраст ребенка при рождении. На рис. 2 представлено графическое изображение результатов анализа межгенного и межфакторного взаимодействия в развитии инсультов различного генеза у детей.
Как видно на рис. 2, большая часть показателей энтропии была высокой, наибольшим был показатель энтропии гена АСЕ, который составил 41,35 %, и показатель наличия реанимационной помощи в неонатальном периоде у ребенка, который составляет 38,56 %.
Для выявления прогностической характеристики было проведено исследование влияния независимого эффекта на развитие заболевания. Исходя из данной задачи, на следующем этапе с использованием метода МDR нами были выявлены две статистически значимые прогностические модели: трех- и четырехкомпонентные. Эти данные представлены в табл. 1.
Анализируя данные табл. 1, выявлено, что четырехкомпонентная модель имела меньшую точность и значение в сравнении с трехкомпонентной. Анализ совокупного взаимодействия показал, что наибольшее значение и точность имела модель, которая включала в себя комбинацию гестационный возраст/неонатальний период/ACE_I/D. Таким образом, общий риск развития инсультов у детей определялся гестационным возрастом при рождении, заболеваемостью в неонатальном периоде и полиморфизмом гена ACE.
Далее мы проводили обследование ассоциации перечисленных полиморфных вариантов генов с имеющимися клинико-анамнестическими параметрами у детей с различными типами инсультов.
Данные, полученные при обследовании детей с ИИ, представлены на рис. 3.
Как видно на рис. 3, наиболее значимые показатели энтропии установлены для двух достоверных прогностических факторов — реанимационной помощи в неонатальном периоде (28,29 %) и гестационного возраста при рождении (22,16 %). Выявлено, что клинико-анамнестические данные могут иметь более значимое влияние на риск развития инсульта у детей по сравнению с генетическими факторами.
Для построения прогностической модели нами использованы признанные прогностически значимые показатели, которые представлены в табл. 2.
Как видно из табл. 2, лучшей прогностической моделью была трехкомпонентная: гестационный возраст/реанимация/MTHFR_С677Т. Эта модель показала 100% отображение и 82,78% достоверность.
Прогностические показатели, полученные нами для определения риска развития ГИ, отличались от таковых при ИИ. На рис. 4 подано графическое изображение результатов анализа межгенного и межфакторного взаимодействия у детей с ГИ.
Анализируя рис. 4, видно, что ведущими факторами риска развития ГИ у детей были: гестационный возраст ребенка при рождении (38,25 %), полиморфизм генов ACE_I/D (8,73 %), MTHFR_A1298C (6,04 %), MTHFR_C677T (1,86 %), MTRR _A66G (1,40 %). Для всех обследуемых генов, кроме MTRR, был установлен синергический эффект на риск развития заболевания. Гестационный возраст имел независимый эффект на развитие заболевания в данной группе пациентов — показатель энтропии наивысший. Другие проанализированные анамнестические факторы не имели влияния на развитие ГИ у детей.
Детям с ГИ также было проведено построение прогностической модели с использованием значимых показателей (табл. 3).
Анализ табл. 3 указывает на то, что полученные модели, которые включали в себя несколько показателей, отличались меньшим отображением в сравнении с моделью, которая предусматривала анализ одного показателя, а именно — гестационного возраста. После проведения пермутационного теста было выявлено, что статистически значимыми были трех- и четырехкомпонентные модели, которые включали, кроме анализа гестационного возраста, также полиморфизм генов MTHFR, MTRR, ACЕ. Как видно из табл. 3, наиболее четкое отображение и достоверность была у трехкомпонентной модели, которая включала комбинацию следующих показателей: гестационный возраст/MTRR_A66G/ACE_I/D — 74,23 %.
На следующем этапе исследования мы провели изучение ассоциации между наличием генетического полиморфизма обследуемых генов у детей с инсультами и их возрастом. Средний возраст детей с инсультами в нашем обследовании составил 44,01 ± 7,01 месяца. В табл. 4 представлены данные о результатах изучения ассоциации полиморфных вариантов генов с дебютом инсульта.
Как видно из табл. 4, для всех носителей неблагополучных полиморфных вариантов генов, выявленных нами, был характерен ранний дебют заболевания. Достоверные отличия были выявлены для полиморфизма генов MTRR и ACE.
При наличии 66АА генотипа гена MTRR дебют заболевания был достоверно более поздним, чем при наличии 66AG и 66GG генотипов. Наиболее ранний дебют заболевания (18,36 ± 6,13 месяца) в общей группе был обусловлен DD генотипом гена АСЕ. Дебют заболевания у детей с 677ТТ и 1298СС генотипами гена MTHFR происходил в более поздний срок по сравнению с неблагополучными вариантами генов MTRR и ACE.
На рис. 5 схематично изображен дебют (по вертикали в месяцах) отдельно для ИИ и ГИ в завимости от полиморфных вариантов обследуемых генов.
Анализируя данные рис. 5, выявлено, что при ИИ ранний дебют достоверно зависел от DD генотипа гена АСЕ (15,33 ± 4,51 месяца) и генотипа GG по гену MTRR (28,50 ± 4,82 месяца). Более поздний дебют был при наличии полиморфных вариантов гена MTHFR — 1298CC (49,25 ± 13,11 месяца) и 677TT (55,26 ± 25,50). При ГИ достоверное влияние на возраст ребенка имели полиморфные варианты генов MTRR и ACE. При генотипе DD гена АСЕ дебют заболевания был в 21,05 ± 10,12 месяца, также рано дебютировали ГИ при наличии генотипа GG гена MTRR — 21,89 ± 9,97 месяца. Не зарегистрировано достоверных различий между дебютом ГИ и полиморфизмом гена MTHFR.
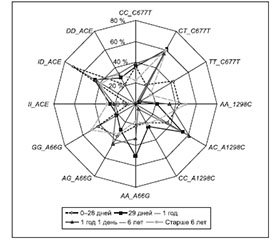
Далее нами было проанализировано наличие полиморфных вариантов генов у 78 пациентов с инсультами и распространение выявленных прогностических факторов в различных возрастных группах. Дети в группах были распределены следующим образом: 14 (17,95 %) из 78 детей имели дебют заболевания в возрасте от 0 до 28 дней, 28 детей (35,89 %) находились в возрастной группе 29 дней — 1 год, группы от 1 года и 1 день до 6 лет и от 6 до 14 лет были равные — по 18 детей (23,08 %) в каждой. На рис. 6 представлено распределение генотипов по генам MTHFR, MTRR и ACE в различных возрастных группах.
Как видно на рис. 6, в возрастной группе 0–28 дней отмечалось повышение частоты генотипа ID до 71,43 %, что имело достоверное отличие от группы 1 год 1 день до 6 лет — 33,33 % (χ2 = 4,05; p = 0,048; OR = 5,00; 95% CI 1,10–22,82). Полученные данные указывали на то, что полимофизм гена АСЕ влияет на развитие инсульта в нео-
натальном периоде. В группе 0–28 дней также была повышена частота генотипа GG гена MTRR — до 42,86 %. Наиболее распространенная частота данного генотипа была в возрастной группе старше 6 лет — до 50,0 %. Данная распространенность была достоверно выше в сравнении с группой детей 29 дней — 1 год — 21,43 % (χ2 = 4,07; p = 0,04; OR = 3,67; 95% CI 1,01–13,34) и более высокой в сравнении с детьми возрастной группы 1 год 1 день — 6 лет — 22,22 %. У детей возрастной группы 0–28 дней была достоверно повышена частота генотипа ТТ гена MTHFR — 42,86 % в сравнении с детьми возрастной группы 29 дней — 1 год — 3,57 % (χ2 = 8,56; p = 0,03; OR = 23,14; 95% CI 2,38–24,99) и детьми группы 1 год 1 день — 6 лет — 5,56 % (χ2 = 4,41; p = 0,036; OR = 12,75; 95% CI 1,31–84,36). Дети возрастных групп 29 дней — 1 год и старше 6 лет имели достоверно повышенную частоту генотипа СТ по гену MTHFR в сравнении с возрастной подгруппой 0–28 дней — соответственно 60,71 % (χ2 = 4,31; p = 0,028; OR = 5,67; 95% CI 1,28–25,02), 61,11 % (χ2 = 3,97; p = 0,04; OR = 5,76; 95% CI 1,18–28,25) в сравнении с 21,43 %. Достоверных отличий в распространении генотипов полиморфных вариантов А1298С гена MTHFR в различных возрастных группах выявлено не было. Таким образом, на риск развития инсультов в возрастной группе 0–28 дней влияет полиморфизм генов ACE, MTHFR (С677Т), MTRR, в подгруппе 29 дней — 1 год — полиморфизм MTHFR (С677Т), в возрастной группе старше 6 лет — достоверное влияние генотипа GG гена MTRR.
Изучение анамнестических данных также включает в себя проведение анализа распространенности заболеваний в семьях. Для изучения наследственной склонности к возникновению инсультов проводилось изучение и анализ семейных случаев отдельно в группах детей с ишемическими и геморрагическими инсультами и с группой контроля.
Отягощенный семейный анамнез имели 28 детей (59,57 ± 7,15 %) из 47 детей с ИИ, а у 19 (40,43 ± 7,15 %) детей не отмечались случаи инсультов в семьях. В группе контроля семейный анамнез был отягощен у 5 (11,36 ± ± 4,78 %) детей. При таких данных значение семейной агрегации составило: 59,57/11,36 = 5,24. Подсчет коэффициентов семейной агрегации выявил, что вероятность развития инсульта у детей из группы с ИИ в 5,24 раза выше, чем в группе контроля.
Только у 5 (16,13 ± 6,60 %) из 31 ребенка с ГИ были семейные случаи заболевания инсультами. В контрольной группе в 4 семьях встречались случаи инсультов (9,09 %). Значение семейной агрегации составило: 16,13/9,09 = 1,8. При подсчете коэффициента семейной агрегации было выявлено, что вероятность развития инсульта в группе детей с ГИ практически в 2 раза выше, чем в группе контроля.
Официальных данных относительно распространенности инсультов среди детской популяции в Украине ранее не было опубликовано. Для подсчета значения семейной агрегации с целью определения вероятности распространения инсультов в популяции существует необходимость в создании единого по всей территории Украины реестра детей, перенесших инсульт.
Выводы
1. Доказано, что лучшей прогностической моделью риска развития ИИ у детей была трехкомпонентная модель, которая включала гестационный возраст, пребывание в реанимации в неонатальном периоде и полиморфизм С677Т гена MTHFR, прогностическая ценность представленной модели составляла 82,78 %.
2. Показано, что лучшей достоверной прогностической моделью риска развития ГИ у детей была также трехкомпонентная с прогностической ценностью 74,23 %, которая, помимо гестационного возраста, включала A66G полиморфизм гена MTRR и I/D полиморфизм гена ACE.
3. На риск развития инсультов в возрастной группе 0–28 дней влияет полиморфизм генов ACE, MTHFR (С677Т), MTRR, в подгруппе 29 дней — 1 год — полиморфизм MTHFR (С677Т), в возрастной группе старше 6 лет — достоверное влияние генотипа GG гена MTRR (р < 0,05). Наиболее ранний дебют ИИ и ГИ отмечался у детей с DD генотипом гена АСЕ (р < 0,001) и GG гена MTRR (р < 0,05).
4. Вероятность развития ИИ и ГИ достоверно повышается при наличии семейных случаев заболевания, что указывает на необходимость создания в Украине реестра детей, перенесших инсульт, и проведения дальнейших исследований с целью разработки индивидуальных профилактических мероприятий
Список литературы
1. Евтушенко С.К., Перепечаенко Ю.М. Этиологические факторы и их взаимосвязь с видами ишемического инсульта у детей // Журнал неврологии и психиатрии им. С.С. Корсакова. — 2003. — № 8. — С. 30-36.
2. Евтушенко С.К. Инсульты у детей // Современная педиатрия. — 2010. — № 3. — С. 175-182.
3. Львова О.А. Наследственные нарушения как ведущий этиологический фактор нарушения мозгового кровообращения у детей // Журнал неврологии и психиатрии им.С.С.Корсакова. — 2013. — № 9. — С. 13-18.
4. Смульська Н.О., Горовенко Н.Г., Кир’яченко С.П. Асоціація поліморфних варіантів генів MTHFR (C677T), MTHFR (A1298C), MTRR (A66G), FV (G1691A), FII (G20210A), ACE (I/D) та їх комбінацій з риском розвитку ішемічного інсульту в дитячому віці // Український медичний часопис. — 2014. — № 3(101). — С. 131-134.
5. Шнайдер Н.А. Детский инсульт // Практическая ангиология. — 2007. — № 3. — С. 46-54.
6. Zadro R. Inherited prothrombotic risk factors in children with first ischemic stroke / R. Zadro, D. Herak // Biochemia Medica. — 2012. — Vol. 22, № 3. — P. 298-310.
7. Duran R. Factor V Leiden mutation and other thrombophilia markers in childhood ischemic stroke / R. Duran, B. Biner, M. Demir // Clin. Appl. Thromb. Haemost. — 2005. — Vol. 11. — P. 83-88.
8. Panigrahi L. Role of MTHFR C677T polymorphism in ische-mic stroke / L. Panigrahi, T. Chatterjee, A. Biswas // Neurology India. — 2006. — Vol. 54, Issue 1. — P. 48-52.
9. Djordjevic V. Genetic risk factors for arterial ischemic stroke in children: a possible MTHFR and eNOS gene–gene interplay? / Djordjevic V., Stankovic M., Brankovic-Sreckovic V., Rakicevic L. [et al.] // J. Child Neurol. — 2009. — Vol. 24. — P. 823-827.
10. Yamada Y. Genetic Risk for Ischemic and Hemorrhagic Stroke // Y. Yamada, N. Metoki, H. Yoshida [et al.] // Arterioscler. Thromb. Vasc. Biol. — 2006. — Vol. 26. — P. 1920-1925.
11. Smulska N. Genetic predispose in the development of ischemic stroke in childhood // Journal of pediatric neurology. — 2014. — Vol. 18. — Р. 820.
12. Sarecka-Hujar B. The TT genotype of methylenetetrahydrofolate reductase 677C > T polymorphism increases the susceptibility to pediatric ischemic stroke: meta-analysis of the 822 cases and 1,552 controls / B. Sarecka-Hujar, I. Kopyta, K. Pienczk-Reclawawicz // Mol. Biol. Rep. — 2012. — Vol. 39, № 8. — P. 7957-7963.
13. Kopyta I.A. Polymorphisms of genes encoding coagulation factors II, V, VII, and XIII in relation to pediatric ischemic stroke: family-based and case-control study / I.A. Kopyta, E. Emich-Widera, A. Balcerzyk, P. Niemiec / Neurologist. — 2012. — Vol. 18(5). — P. 282-286.
14. Маllic A. The epidemiology of childhood stroke / A. Маllic, F. O’Callaghan // Eur. J. Pediatr. Neurol. — 2010. — Vol. 14, № 3. — P. 197-205.
15. Kenet G. Impact of thrombophilia on arterial ischemic stroke or cerebral sinovenous thrombosis in children: a systematic review & meta-analysis of observational studies / Kenet G., Herak D.C., Lutkhoff L.K., Albisetti M. [et al.] // Circulation. — 2010. — Vol. 121. — P. 1838-1847.
16. Harbert M.J. Perinatal Risk Factors and Later Social, Thought and Attention Problems after Perinatal Stroke / Har- bert M.J., Jett M., Appelbaum M. // Stroke Research and Treatment. — 2012. — Doi: 10.1155/2012/914546.
/102_2.jpg)

/99.jpg)
/100.jpg)
/100_2.jpg)
/101.jpg)
/102.jpg)