Журнал «» 6 (44) 2015
Вернуться к номеру
Сравнение интенсивного и стандартного контроля артериального давления: данные исследования SPRINT
Авторы: Подготовили А.Д. Радченко, Е. Кущ - по материалам статьи «A Randomized Trial of Intensive versus Standard Blood-Pressure Control», опубликованной в «The New England Journal of Medicine» в ноябре 2015 г.
Рубрики: Кардиология
Разделы: Клинические исследования
Версия для печати
Статья опубликована на с. 13-23
Исследовательская группа SPRINT (the SPRINT Research Group)
Артериальная гипертензия является одним из самых распространенных заболеваний среди взрослого населения, особенно среди лиц старше 60 лет, от которого страдает около 1 миллиарда взрослых людей во всем мире [1, 2]. Изолированная систолическая артериальная гипертензия является наиболее распространенной формой артериальной гипертензии у людей 50 лет и старше [3, 4], в связи с чем систолическое артериальное давление (САД) становится более важным показателем, нежели диастолическое артериальное давление, в качестве независимого прогностического фактора риска развития коронарных событий, инсульта, сердечной недостаточности и терминальной стадии почечной недостаточности [5–13]. В исследовании The Global Burden of Disease Study было показано, что повышенное артериальное давление являлось ведущим среди 67 изученных факторов риска развития смерти и увеличения количества утраченных лет жизни с поправкой на инвалидность в 2010 году [14].
Клинические исследования продемонстрировали, что лечение артериальной гипертензии снижает риск сердечно-сосудистых событий, в том числе частоту развития инсульта (на 35–40 %), инфаркта миокарда (на 15–25 %) и сердечной недостаточности (на 64 %) [5, 15, 16]. Однако целевой уровень артериального давления остается неопределенным. Обсервационные исследования показали прогрессивное увеличение кардиоваскулярного риска при повышении уровня САД выше 115 мм рт.ст. [10], однако доступные данные рандомизированных контролируемых исследований в общей популяции пациентов с артериальной гипертензией указывают на эффективность лечения лишь при достижении уровня САД менее 150 мм рт.ст., при этом данные, касающиеся более низких целевых уровней артериального давления, ограниченны [11, 17–21]. В исследовании с участием больных сахарным диабетом 2-го типа частота основных сердечно-сосудистых событий при целевых уровнях САД менее 120 мм рт.ст. не отличалась от таковой при достижении рекомендованного целевого уровня САД менее 140 мм рт.ст., однако частота развития инсульта была ниже при целевых уровнях САД менее 120 мм рт.ст. [22]. Недавнее исследование с участием пациентов с перенесенным инсультом, заключавшееся в сравнении двух стратегий лечения со снижением САД менее 130 мм рт.ст. и менее 150 мм рт.ст., не показало значительного преимущества более низких целевых уровней в снижении риска развития любого повторного инсульта, однако продемонстрировало значительное преимущество в снижении риска развития геморрагического инсульта [23].
Гипотеза относительно того, что достижение более низкого целевого уровня САД (например, менее 120 мм рт.ст.) способствует снижению частоты клинических событий в большей мере, нежели достижение стандартных целевых уровней, была разработана в 2007 году группой экспертов Национального института болезней сердца, легких и крови (National Heart, Lung, and Blood Institute, NHLBI) в качестве основной тестируемой гипотезы в отношении предупреждения осложнений, связанных с артериальной гипертензией у пациентов без диабета [24].
В данной статье приводятся первичные результаты исследования Systolic Blood Pressure Intervention Trial (SPRINT), в котором проводилось сравнение пользы от лечения при достижении целевого уровня САД менее 120 мм рт.ст. и достижении целевого уровня САД менее 140 мм рт.ст.
Методы
Дизайн исследования и контроль
Исследование SPRINT проводилось в 102 клинических центрах США и Пуэрто-Рико и включало 9361 пациента (представлено в дополнительном приложении, которое доступно в полном тексте статьи на страницах NEJM.org). Координационный центр исследования служил для сбора данных, биостатистической обработки и включал центральную лабораторию, центр для расшифровки данных электрокардиографии, центр оценки магнитно-резонансных изображений и центр распределения препаратов. Протокол исследования был опубликован ранее [25, 26] и доступен на страницах NEJM.org.
Исследование SPRINT спонсировалось Национальным институтом болезней сердца, легких и крови США в сотрудничестве с Национальным институтом диабета, заболеваний кишечника и почек, Национальным институтом неврологических нарушений и инсульта, Национальным институтом старения. Независимый мониторинговый комитет проводил наблюдение за «расслеплением» результатов и безопасностью. Исследование было одобрено соответствующими комитетами в каждом центре исследования. Был также комитет по дизайну исследования, сбору данных, написанию публикаций и проверке соответствия протоколу. Координационный центр был ответственен за анализ полученных данных. Сотрудники Национального института болезней сердца, легких и крови принимали участие в разработке дизайна исследования и входили в состав управляющего комитета исследования.
Популяция исследования
В исследование включались лица в возрасте не менее 50 лет, с уровнем САД от 130 до 180 мм рт.ст. и с повышенным кардиоваскулярным риском. Повышенный кардиоваскулярный риск определялся по наличию одного фактора или более: манифестная или субклиническая стадия сердечно-сосудистого заболевания, кроме инсульта; хроническая болезнь почек, за исключением поликистоза почек, с показателем расчетной скорости клубочковой фильтрации (СКФ) от 20 до 60 мл/мин на 1,73 м2 площади поверхности тела, которая определялась по формуле MDRD; десятилетний кардиоваскулярный риск по Фрамингемской шкале 15 % и более; возраст 75 лет и старше. Пациенты с сахарным диабетом и перенесенным инсультом были исключены. Детально критерии включения и исключения представлены в дополнении к полной статье. Все участники предоставили письменное информированное согласие.
Рандомизация и тактика
Пациенты, соответствующие критериям включения и не имеющие критериев исключения, были рандомизированы в группу целевого уровня САД менее 140 мм рт.ст. (группа стандартного лечения) и менее 120 мм рт.ст. (группа интенсивного лечения). Рандомизация происходила непосредственно в центре включения. Участники и персонал исследования знали группу лечения, но сторонние наблюдатели (эксперты) — нет.
Все участники, подвергнутые рандомизации, были сопоставимы по своим основным характеристикам. Алгоритм лечения был не тот, который использовался в исследовании Action to Control Cardiovascular Risk in Diabetes (ACCORD) [22]. Этот алгоритм представлен на рис. S1 и S2 и в табл. S1 приложения. Все антигипертензивные препараты были включены в специальные формуляры и были бесплатными для пациентов. Исследователи могли выписать и другие антигипертензивные препараты, но они не обеспечивались исследованием. Протокол рекомендовал, но не обязывал использовать препараты, которые имели достоверные доказательства их эффективности в предупреждении кардиоваскулярных осложнений: тиазидные диуретики (рекомендованы как препараты первой линии), петлевые диуретики (при наличии значительного нарушения функции почек), бета-адреноблокаторы (при наличии ишемической болезни сердца) [5, 27]. Хлорталидон был рекомендован как основной диуретик, амлодипин — как предпочтительный антагонист кальция [28, 29]. Азилсартан и азилсартан в комбинации с хлорталидоном предоставлялись компанией Takeda Pharmaceuticals International и Arbor Pharmaceuticals. Ни одна компания не играла какой-либо роли в этом исследовании. Участники делали визиты каждый месяц в течение первых 3 месяцев и затем каждые 3 месяца. Терапия в группе интенсивного лечения корригировалась каждый месяц до достижения целевого уровня менее 120 мм рт.ст. Для участников группы стандартного лечения терапия корригировалась до достижения уровня САД 135–139 мм рт.ст. Доза препаратов уменьшалась, если САД снижалось менее 130 мм рт.ст. на одном визите и менее 135 мм рт.ст. на двух последующих визитах. Коррекция терапии проводилась на основе данных трех измерений в офисе врача после 5 минут отдыха пациента в положении сидя. Измерения проводились с использованием системы Model 907, Omron Healthcare. Модификация образа жизни была рекомендована как часть лечебной стратегии. Удержание пациента в исследовании и оценка приверженности к лечению регулярно осуществлялись в исследовании [26].
Методы исследования
Демографические данные собирались исходно. Клинические и лабораторные данные оценивали в начале исследования и через каждые 3 месяца. В обеих группах каждые 3 месяца проводился систематизированный опрос на предмет оценки сердечно-сосудистых исходов самими пациентами. Опросники были одинакового формата для обеих групп рандомизации. Медицинские записи и ЭКГ должны были подтверждать возникшие события. В случаях, когда устанавливался факт смерти, использовался стандартный протокол для получения информации о возникшем событии.
Под серьезными побочными явлениями понимали фатальные или угрожающие жизни события, приводящие к значимой и длительной инвалидизации, требующие или удлиняющие госпитализацию, или те события, которые, по мнению исследователей, были клинически значимыми, могли навредить пациенту или привести к возникновению других, описанных выше событий, требующих интенсивного вмешательства [30, 31]. Короткий список мониторируемых событий включал события, требующие лечения в отделении интенсивной терапии: гипотензию, синкопе, травмы после падения, электролитные нарушения, брадикардию. Также мониторировали случаи острого повреждения почки или острой почечной недостаточности, если они встречались при поступлении или в процессе госпитализации и о них сообщалось в выписном эпикризе в виде первичного или вторичного диагнозов. Оценка связи серьезных нежелательных явлений с интенсивностью лечения проводилась специалистом по контролю безопасности исследования и ежемесячно рассматривалась комитетом по безопасности.
Клинические исходы исследования
Определение конечных точек исследования представлено в приложении (на страницах NEJM.org). Комитет, чьи члены не знали, в какую группу входил пациент, оценивал клинические исходы по специальному протоколу. Первичной гипотезой исследования было то, что лечение с целью достижения целевого уровня САД менее 120 мм рт.ст. в сравнении с целевым уровнем менее 140 мм рт.ст. приведет к снижению частоты развития комбинированной конечной точки (инфаркт миокарда, острый коронарный синдром без инфаркта миокарда, инсульт, острая декомпенсированная сердечная недостаточность, смерть от кардиоваскулярных причин). Вторичными точками исследования были отдельные составляющие первичной комбинированной точки, смерть от любых причин. Также определяли частоту почечных событий, используя разные определения для пациентов с исходной хронической болезнью почек (СКФ < 60 мл/мин на 1,73 м2) и пациентов исходно без данного заболевания. Под почечными исходами у пациентов, которые исходно имели хроническое заболевание почек, понимали снижение СКФ на 50 % и более (подтвержденные последующими лабораторными анализами) или развитие терминальной стадии хронического поражения почек, т.е. состояние, которое требовало длительного диализа или трансплантации почки. Для участников, не имеющих хронической болезни почек перед включением в исследование, почечные исходы определялись как снижение СКФ на 30 % и более или до значения менее 60 мл/мин на 1,73 м2. Возникшая альбуминурия, которая определялась на всем протяжении исследования как удвоение отношения альбумина (в миллиграммах) к креатинину (в граммах) в разовой порции мочи, считалась событием, если показатель был < 10 исходно и становился более чем 10 в ходе исследования.
Исходы также оценивались в предварительно установленных подгруппах, которые распределялись в зависимости от наличия сердечно-сосудистого заболевания исходно (есть или нет), наличия хронической болезни почек исходно (есть или нет), пола, расовой принадлежности (афроамериканцы или неафроамериканцы), возраста (< 75 лет или ≥ 75 лет), а также от уровня исходного САД (≤ 132 мм рт.ст., от > 132 до < 145 мм рт.ст. и ≥ 145 мм рт.ст.). Также было запланировано сравнение влияния достижения целевых уровней САД на частоту развития деменции, изменений когнитивных функций и ишемического поражения мелких сосудов головного мозга; данные результаты в этой статье не представлены.
Статистический анализ
Был запланирован 2-летний период включения пациентов в исследование с максимальным сроком наблюдения 6 лет, ожидаемый процент выпадения из наблюдения — 2 % в год. Было рассчитано, что при необходимом количестве пациентов 9250 исследование будет иметь 88,7% силу и при ожидаемой 20% частоте первичной конечной точки в группе стандартного лечения события будут возникать с частотой 2,2 % в год. Первичный анализ проводился, исходя из принципа intention-to-treat (предположение, что пациенты принимают терапию). Частота событий рассчитывалась с помощью Сох регрессионного анализа. Период наблюдения ограничивался датой последнего события. Взаимоотношения между эффектами лечения в подгруппах определяли с помощью вероятностного теста и определения достоверности по Hommel [32]. Модель Fine-Gray использовалась для сравнения риска смерти.
Результаты
Популяция исследования
Общее количество участников исследования составило 9361 человек, которые были включены в промежутке между ноябрем 2010 года и ноябрем 2013 года (рис. 1).
/15.jpg)
Основные исходные характеристики участников представлены в табл. 1. 20 августа 2015 г. директор Национального института сердца, легких и крови принял рекомендации комитета по мониторингу данных и безопасности об информировании участников исследования о результатах первичного анализа данных за два соответствующих временных отрезка (рис. S3 в приложении к полной статье), и был инициирован процесс преждевременной остановки исследования. Средний срок наблюдения по состоянию на 20 августа 2015 года составил 3,26 года из запланированных в среднем 5 лет.
Артериальное давление
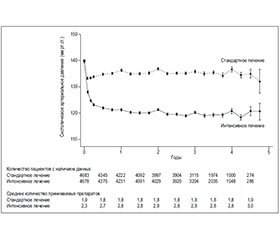
Обе стратегии лечения привели к быстрому появлению устойчивой разницы в САД между группами (рис. 2). Спустя год исследования средний уровень САД составлял 121,4 мм рт.ст. в группе интенсивного лечения и 136,2 мм рт.ст. в группе стандартного лечения со средней разницей в показателях в 14,8 мм рт.ст.
Средний уровень диастолического артериального давления спустя год от начала лечения составлял 68,7 мм рт.ст. в группе интенсивного лечения и 76,3 мм рт.ст. в группе стандартного лечения (рис. S4 в приложении). На этапе 3,26 года наблюдения средний уровень САД составлял 121,5 мм рт.ст. в группе интенсивного лечения и 134,6 мм рт.ст. в группе стандартного лечения, а среднее количество назначенных препаратов составляло 2,8 и 1,8 соответственно. Относительное распределение принимаемых классов антигипертензивных препаратов было аналогичным в двух группах, однако использование каждого класса было более интенсивным в группе более низкого целевого САД (табл. S2 в приложении).
Клинические исходы
Первичная конечная точка была подтверждена у 562 участников — 243 (1,65 % в год) в группе интенсивного лечения и 319 (2,19 % в год) в группе стандартного лечения (отношение рисков (hazard ratio — HR) при интенсивном лечении 0,75; 95% доверительный интервал (ДИ) от 0,64 до 0,89; Р < 0,001) (табл. 2). Разница во влиянии на развитие конечной точки между группами стала очевидной после первого года наблюдения (рис. 3А).
Достоверная разница наблюдалась как по первичной конечной точке, так и по определенным вторичным (табл. 2).
Общее количество смертей составило 365: 155 в группе интенсивного лечения и 210 в группе стандартного лечения (HR 0,73; 95% ДИ от 0,60 до 0,90; Р = 0,003). Разница в смертности между группами стала очевидной спустя приблизительно 2 года (рис. 3В). Причины смерти представлены в табл. S3 в приложении. Отношение рисков сердечно-сосудистой смерти было на 43 % ниже при интенсивном лечении, нежели при стандартном лечении (Р = 0,005) (табл. 2).
Количество пациентов, которых нужно было бы пролечить для предотвращения общей конечной точки, смерти от любых причин, а также сердечно-сосудистой смерти на протяжении 3,26 года, составило 61, 90 и 172 соответственно. Влияние интенсивного лечения на частоту общей конечной точки и частоту смерти по любой причине достоверно не отличалось в подгруппах (рис. 4 и S5 в приложении). Не отмечалось достоверной связи между определенными подгруппами и эффективностью интенсивного лечения. Когда в модели Файн-Грэй смертельный исход рассматривался как конкурирующий риск, результаты в отношении основных исходов являлись фактически неизменными (HR 0,76; 95% ДИ от 0,64 до 0,89).
Среди участников с исходной хронической болезнью почек значительной разницы между группами в комбинированных исходах — снижение СКФ на 50 % и более или развитие терминальной стадии — отмечено не было, однако отмечается, что общее количество таких случаев было малым (табл. 2). Среди участников без исходной хронической болезни почек частота исхода, которая определялась снижением СКФ более чем на 30 % или до значения менее 60 мл/мин на 1,73 м2, была выше в группе интенсивного лечения, нежели в группе стандартного лечения (1,21 % в год в сравнении с 0,35 % в год; HR 3,49; 95% ДИ от 2,44 до 5,10; Р < 0,001).
Серьезные нежелательные явления
Серьезные нежелательные явления возникли у 1793 участников в группе интенсивного лечения (38,3 %) и у 1736 участников в группе стандартного лечения (37,1 %) (HR при интенсивном лечении 1,04; Р = 0,25) (табл. 3 и 4S в приложении). В группе интенсивного лечения чаще возникали такие серьезные нежелательные явления, как артериальная гипотензия, синкопе, нарушение баланса электролитов, острое повреждение почек или острая почечная недостаточность, но не травмы в результате падения или брадикардия, в сравнении с группой стандартного лечения. Ортостатическая гипотензия, выявленная во время визита в лечебное учреждение, наблюдалась значительно реже в группе интенсивного лечения. У 220 участников группы интенсивного лечения (4,7 %) и у 118 участников группы стандартного лечения (2,5 %) были отмечены серьезные нежелательные явления, классифицированные как возможно или определенно связанные с лечением (HR 1,88; Р < 0,001). Величина и характер различий по нежелательным явлениям между группами лечения среди пациентов в возрасте 75 лет и старше были аналогичны таковым во всей когорте (табл. S6 в приложении).
Обсуждение
Исследование SPRINT продемонстрировало, что среди взрослых пациентов, страдающих артериальной гипертензией без сахарного диабета, снижение САД до целевого уровня менее 120 мм рт.ст. в сравнении со стандартными целевыми уровнем САД менее 140 мм рт.ст. приводило к значительному снижению частоты развития фатальных и нефатальных сердечно-сосудистых событий, а также к смерти от любых причин. У участников исследования в группе интенсивного лечения, в сравнении с участниками в группе стандартного лечения, показатель относительного риска возникновения первичной конечной точки был ниже на 25 %; в дополнение к этому, в группе интенсивного лечения была ниже и частота некоторых других важных исходов, в том числе сердечной недостаточности (относительный риск меньше на 38 %), смерти по сердечно-сосудистым причинам (относительный риск меньше на 43 %), а также смерти по любой причине (относительный риск меньше на 27 %). В течение периода последующего наблюдения в исследовании (в среднем 3,26 года) количество пациентов, которых нужно было пролечить по стратегии интенсивного контроля для предупреждения одного основного события, составило 61, а количество пациентов, которых нужно было бы пролечить для предупреждения одной смерти по любой причине, составляло 90. Данные преимущества как в случае с первичной конечной точкой, так и в случае смерти являлись достоверными во всех предварительно установленных подгруппах, включая участников в возрасте 75 лет и старше.
В связи с меньшим, чем ожидалось, снижением СКФ, а также из-за более раннего прекращения исследования количество почечных событий было незначительным. Среди участников, исходно страдающих хронической болезнью почек, количество участников со снижением СКФ на 50 % и более или развитием терминальной стадии заболевания почек за время проведения исследования существенно не отличалось между двумя группами лечения. Среди участников, которые не имели хронической болезни почек на исходном этапе, снижение СКФ на 30 % и более (до уровня менее 60 мл/мин на 1,73 м2) отмечалось чаще в группе интенсивного лечения, нежели в группе стандартного лечения (1,21 % в год в сравнении с 0,35 % в год). Острое повреждение почек или острая почечная недостаточность встречались чаще в группе интенсивного лечения, нежели в группе стандартного лечения (табл. 3 и 5S).
Отличия в нежелательных почечных исходах могут быть связаны с обратимым интраренальным гемодинамическим эффектом более значительного снижения артериального давления, а также с более интенсивным приемом диуретиков, ингибиторов ангиотензинпревращающего фермента и блокаторов ангиотензиновых рецепторов в группе интенсивного лечения [35, 36]. С учетом доступных на данный момент данных доказательства значимого постоянного повреждения почек, связанного со стремлением к достижению более низких показателей артериального давления, отсутствуют, однако при этом нельзя исключить возможность долгосрочных нежелательных почечных исходов. Данные наблюдения и гипотезы нуждаются в дальнейшем исследовании и анализе, который включал бы в себя больше клинических исходов и более длительное последующее наблюдение.
Результаты исследования SPRINT значительно дополнили доказательные данные о пользе снижения САД, особенно у пациентов старшего и пожилого возраста с артериальной гипертензией. Такие исследования, как исследование систолической артериальной гипертензии среди людей пожилого возраста (Systolic Hypertension in the Elderly Program trial — SHEP) [17], исследование систолической артериальной гипертензии в Европе (Systolic Hypertension in Europe trial — Syst Euro) [11], а также исследование артериальной гипертензии среди людей преклонного возраста (Hypertension in the Very Elderly Trial — HYVET) [18], продемонстрировали пользу от снижения САД менее 150 мм рт.ст. Несмотря на это, исследования, в которых оценивалось влияние более низких уровней САД, чем изучаемые в данных исследованиях, являлись либо недостаточно масштабными [19–21], либо они проводились без рандомизации по целевому уровню САД [37]. Основной спорный момент относительно выбора целевых уровней САД в данной популяции был обусловлен недостаточными данными о рисках и пользе целевых уровней САД ниже 150 мм рт.ст. [11, 17–21, 37]. SPRINT предоставляет доказательные данные в пользу еще более низких целевых уровней САД, нежели ныне рекомендованные для большинства пациентов с артериальной гипертензией.
Сравнение исследований SPRINT и ACCORD неминуемо, поскольку в данных исследованиях изучались идентичные целевые уровни САД (< 120 мм рт.ст. в сравнении с < 140 мм рт.ст.). В отличие от результатов, полученных в SPRINT, польза в отношении сердечно-сосудистых событий и смертности, отмеченная в исследовании ACCORD, не являлась статистически значимой и имела меньшую величину. Следует обратить внимание на некоторые важные отличия между данными исследованиями. Исследование ACCORD включало только участников с диабетом, в то время как в SPRINT участники с сахарным диабетом исключались; в дополнение к этому, объем выборки исследования ACCORD составлял лишь половину выборки SPRINT (4733 в сравнении с 9361). Исследование SPRINT включало когорту более старших пациентов (средний возраст 68 лет в сравнении с 62 годами в исследовании ACCORD), в том числе 28 % участников в возрасте 75 лет и старше, а также включало участников с хронической болезнью почек. Исследование ACCORD продемонстрировало (незначительное) снижение риска первичных комбинированных событий на 12 % с 95% доверительным интервалом, включавшим возможность снижения риска на 27 %, что сопоставимо с показателями пользы в отношении сердечно-сосудистых исходов, отмеченными в исследовании SPRINT. В исследовании ACCORD также использовался факториальный дизайн, включавший сравнение стандартного и интенсивного сахароснижающего и липидоснижающего лечения в одном исследовании. Дополнительный анализ результатов ACCORD показал, что при сравнении стандартного комбинированного сахароснижающего и антигипертензивного лечения с одним лишь интенсивным антигипертензивным лечением частота основных сердечно-сосудистых исходов снижалась на 26 %, при этом дополнительная польза комбинирования двух интенсивных стратегий лечения отсутствовала [38]. Таким образом, расхождение результатов между исследованиями может быть связано с отличиями дизайна исследований, взаимодействием между видами лечения либо быть просто случайностью. Наличие разницы в получаемой пользе по отношению к сердечно-сосудистым исходам при снижении САД между популяциями пациентов с диабетом и без него кажется маловероятным, но его нельзя исключить.
В исследовании по вторичной профилактике ограниченных субкортикальных инсультов (Secondary Prevention of Small Subcortical Strokes trial) (целевой уровень САД при интенсивном лечении < 130 мм рт.ст.) [23] и в исследовании ACCORD (целевой уровень САД при интенсивном лечении < 120 мм рт.ст.) более низкие целевые показатели артериального давления были связаны со снижением частоты развития инсультов на 19 % (Р = 0,08) и 41 % соответственно, нежели при более высоких целевых показателях. В группе интенсивного лечения в исследовании SPRINT снижение частоты развития инсультов было недостоверным и составляло 11 %. При этом в исследовании SPRINT люди с ранее перенесенными инсультами или транзиторной ишемической атакой на исходном этапе также исключались.
В исследовании SPRINT были отмечены значительные межгрупповые отличия в развитии некоторых нежелательных явлений, связанных с лечением. Ортостатическая гипотензия, диагностированная при визите в лечебное учреждение (табл. 3), наблюдалась реже в группе интенсивного лечения в сравнении с группой стандартного лечения (Р = 0,01), однако в то же время синкопе, наоборот, чаще наблюдалось в группе интенсивного лечения, нежели в группе стандартного лечения (3,5 % в сравнении с 2,4 %, Р = 0,003), как и артериальная гипотензия (3,4 % в сравнении с 2,0 %, Р < 0,001). В случае травм при падении разница между группами лечения отсутствовала (HR 1,00; Р = 0,97). Как уже было упомянуто выше, более высокий показатель острого повреждения почек или острой почечной недостаточности наблюдался в группе интенсивного лечения. Данные нежелательные явления необходимо оценивать с учетом пользы в отношении сердечно-сосудистых событий и смертности, связанных с интенсивным контролем САД.
Степень убедительности данных SPRINT подкрепляется большим объемом выборки, разнообразием популяции (в том числе значительной долей пациентов в возрасте 75 лет и старше), а также успехом в достижении запланированной разницы в уровнях САД в двух группах лечения во время проведения исследования. Ограничение исследования обусловлено отсутствием возможности экстраполировать результаты на популяцию таких не включавшихся в исследование пациентов, как пациенты с диабетом, инсультом в анамнезе, а также на пациентов младше 50 лет. Также стоит заметить, что мы не включали в исследование более пожилых пациентов, пребывающих в центрах сестринского ухода или в пансионатах для проживания людей с особыми потребностями. В дополнение к вышесказанному необходимо отметить, что до тех пор, пока не будет проведен анализ соответствующих конечных точек, невозможно обоснованно интерпретировать влияние более низких показателей артериального давления на центральную нервную систему и почки.
Результаты SPRINT поднимают важные практические проблемы. Контроль показателей артериальной гипертензии на уровне менее 140/90 мм рт.ст. достигается только примерно у 50 % общей популяции в США, что говорит о том, что контроль даже на данном уровне является затруднительным [39]. Мы исключали пациентов с более тяжелой степенью артериальной гипертензии, а контроль показателей систолического артериального давления на уровне менее 120 мм рт.ст. требовал приема в среднем одного дополнительного антигипертензивного препарата. Помимо этого, стоит добавить, что средний уровень САД в группе интенсивного лечения является несколько выше 120 мм рт.ст., что указывает на то, что больше половины участников имели уровень САД выше целевого (< 120 мм рт.ст.). Данные наблюдения предполагают, что достижение целевого уровня САД менее 120 мм рт.ст. в общей популяции пациентов с артериальной гипертензией является более трудоемким и затратным по времени как для врачей, так и для пациентов, нежели достижение целевых показателей систолического артериального давления в 140 мм рт.ст., и будет требовать дополнительных затрат на препараты и большего количества визитов в лечебное учреждение.
Таким образом, следует отметить, что достижение целевого уровня САД менее 120 мм рт.ст. в сравнении с уровнем менее 140 мм рт.ст. у пациентов с высоким кардиоваскулярным риском, но без диабета проявлялось снижением частоты развития фатальных и нефатальных сердечно-сосудистых событий, а также смерти по любой причине. Несмотря на это, некоторые нежелательные явления значительно чаще развивались при более низких целевых показателях.

/16.jpg)
/17.jpg)
/18.jpg)
/20.jpg)
/19.jpg)
/21.jpg)
/22.jpg)