Статья опубликована на с. 17-27
Введение
Современный алгоритм иммунотерапии при рассеянном склерозе (РС) включает 4 группы препаратов. К препаратам I ряда относятся бета-интерфероны и копаксон; II ряда — моноклональные антитела (натализумаб и др.), цитостатик митоксантрон, иммуномодулятор финголимод (гиления) и лаквинимод; III ряда — иммуноглобулины для внутривенного введения, циклофосфамид; IV ряда — препараты, находящиеся на стадии клинического исследования.
Хорошо известно, что применение цитостатиков ограничено их высокой токсичностью, в связи с чем они уходят на второй план при относительно благоприятном рецидивирующем течении (РТ) РС, поддающемся, как правило, методам пульс-терапии глюкокортикоидами, плазмафереза и в ряде случаев — внутривенному введению иммуноглобулина.
Однако при РТ также следует выделять многообразные варианты как по клиническому течению, так и по прогностической значимости, включая трансформацию во вторично-прогредиентное течение (ВПТ) у части больных. Поэтому цитостатики остаются ведущими из препаратов выбора при частых и тяжелых рецидивах в рамках РТ и при быстро прогрессирующих вариантах прогредиентного типа течения (ПТТ) РС, которые, как правило, малокурабельны, и для них отсутствуют показания к превентивной терапии бета-интерферонами и копаксоном. Прогноз при ПТТ, как правило, носит неблагоприятный характер за счет неуклонного накопления неврологического дефицита, ведущего к стойкой инвалидизации. Однако у части пациентов с ПТТ, имеющих определенные закономерности течения на предыдущих этапах, заболевание может протекать более благоприятно и рассматриваться в рамках неопределенного характера прогноза.
Клинический анализ этапов прогрессирования при ПТТ показал, что характер прогноза при этих формах РС формируется в процессе течения предыдущих этапов заболевания и определяется такими интегративными показателями, как пути формирования, варианты и темпы прогрессирования [1–4].
Процесс формирования прогрессирования при ПТТ происходит двумя путями. При ВПТ 1-й путь начинается после рецидивирующего этапа разной продолжительности с последующей трансформацией в этап вторичного прогрессирования и, как правило, свидетельствует о более мягком течении заболевания. 2-й путь встречается реже, протекает менее благоприятно и характеризуется развитием вторичного прогрессирования непосредственно вслед за ремиссией после дебюта, минуя рецидивирующий этап. При первично-прогредиентном течении (ППТ) 1-й путь формируется через этап стабилизации, наступившей после дебюта; 2-й путь — непосредственно вслед за дебютом, минуя этап стабилизации [1–3].
Системный анализ этапов прогрессирования при ПТТ РС выявил их структурную неоднородность, которая представлена тремя основными вариантами:
— неуклонный вариант, протекающий без клинически очерченных периодов стабилизации;
— рецидивирующий вариант, протекающий со скачкообразными ухудшениями, напоминающими рецидивы;
— поступательный вариант, представляющий собой чередование периодов медленного прогрессирования неврологической симптоматики, имеющей, как правило, локальный акцент, и стабилизации разной продолжительности.
Для первых двух вариантов (неуклонного и рецидивирующего), протекающих, как правило, неблагоприятно, характерно преобладание грубой и стойкой неврологической симптоматики, приводившей к глубокой инвалидизации. Поступательный вариант, как правило, характеризуется отсутствием грубого неврологического дефицита, более продолжительным периодом остаточной трудоспособности, лучшей социально-психологической адаптацией, большей эффективностью иммунокорригирующей патогенетической терапии.
Характер дальнейшего прогрессирования определялся не только вариантами, но и темпами нарастания неврологической симптоматики — быстрыми, умеренными и замедленными. Для быстрых темпов характерны неуклонный, рецидивирующий варианты и их чередование; для умеренных и особенно замедленных темпов — поступательный вариант. Таким образом, этапы прогрессирования при ППТ и ВПТ способны претерпевать структурную реорганизацию, особенности которой, включая варианты и темпы прогрессирования, определяют характер, длительность и прогноз при ВПТ и ППТ.
Сказанное выше свидетельствует о том, что применение цитостатиков, несмотря на значительное количество побочных эффектов, хотя и является своеобразной «терапией отчаяния», но в ряде случаев существенно отдаляет сроки тяжелой инвалидизации, особенно при быстрых темпах неуклонного прогрессирования [5].
Цитостатик митоксантрон (новантрон, неоталем), дериват антраценедиона, разработан в 1970-х годах для лечения новообразований. По химической структуре (наличие антрахинонового ядра) имеет элементы сходства с противоопухолевыми антрациклиновыми антибиотиками (доксорубицин, рубомицин). В качестве иммунодепрессанта 2-го поколения, обладающего узконаправленным действием на иммунокомпетентные клетки, применяется при агрессивном течении РС с целью быстрого подавления активности воспалительного процесса и предотвращения необратимых структурных повреждений. Митоксантрон является наиболее безопасным препаратом, которому отдается предпочтение среди всех цитостатиков для активной иммуносупрессии (АИС) и стабилизации состояния у пациентов с РС, у которых наблюдается недостаточный эффект стандартной иммуномодулирующей терапии (ИМТ). Митоксантрон включен в европейский протокол как доказанное средство для терапии прогредиентных форм РС [6].
Неэффективность применения иммуномодулирующих препаратов может объясняться различными типами процессов, приводящих к демиелинизации у разных пациентов. При первом и втором типах ее вызывают аутоагрессивные Т- и В-лимфоциты, а при третьем и четвертом типах демиелинизация является ответом на апоптоз и дегенерацию миелинобразующих клеток — олигодендроцитов [7]. Современные иммуномодуляторы воздействуют в основном на демиелинизацию первого и второго типа.
По сравнению с другими цитостатиками, которые используются для лечения РС (азатиоприн, циклофосфан, метотрексат, имуран), митоксантрон обладает более мощным иммуносупрессивным действием, клиническая эффективность сохраняется в течение 12 месяцев после прекращения его применения, а при достижении адекватного терапевтического эффекта этот препарат обладает меньшей выраженностью побочных эффектов, которые у большинства больных носят транзиторный характер.
Положительный эффект митоксантрона обу–словлен иммуносупрессивными свойствами, основанными на неспецифическом цитотоксическом влиянии на В- и Т-лимфоциты и макрофаги. In vitro показано, что препарат замедляет пролиферацию активированных лимфоцитов периферической крови, в том числе В-лимфоцитов; изменяет антигенпрезентирующие свойства моноцитов и дендритных клеток; уменьшает секрецию провоспалительных цитокинов (γ-интерфероны, ФНО-α и интерлейкин-2); индуцирует апоптоз В-лимфоцитов, моноцитов и дендритных клеток, выступающих в качестве главного источника антигенпредставления; тормозит синтез РНК и ДНК за счет высокоаффинного встраивания в их структуру с последующей блокировкой синтеза, вызывая аберрацию хромосом и образующихся связей между цепями ДНК за счет действия на топоизомеразу II [8–11]. Недостаточная эффективность митоксантрона может быть обусловлена подавлением им нейропротективного действия воспаления, так как соотношение повреждающих и защитных компонентов воспалительного процесса может значительно различаться в разных фазах РС за счет гетерогенности процесса демиелинизации, и в случае третьего и четвертого ее типа митоксантрон, действующий преимущественно на Т-лимфоциты, не дает ожидаемого эффекта [12, 13].
К частым побочным эффектам митоксантрона следует отнести тошноту, рвоту, умеренно выраженную алопецию, головную боль, диарею. В связи с угнетением функций костного мозга повышается риск развития инфекционных заболеваний, в частности инфекций верхних дыхательных путей и мочевого тракта, а также тромбоцитопении. Нередкое осложнение при применении митоксантрона — лейкопения, которая обычно развивается на 10–14-й день после введения препарата и сохраняется в течение 4–7 дней. Как правило, лейкопения носит доброкачественный преходящий характер и сопровождается полным восстановлением на 18–21-й день. Грозным осложнением применения митоксантрона является острый миелолейкоз (до 1 % пациентов), который чаще возникает через 2–4 года после лечения. Другим жизнеугрожающим осложнением является кардиотоксичность, которая проявляется изменениями на ЭКГ, бессимптомным снижением фракции выброса левого желудочка или прогрессирующей сердечной недостаточностью [14–16]. Нарушение репродуктивной функции также относится к одному из отсроченных побочных эффектов митоксантрона. Транзиторная и перманентная аменорея отмечается у 11,8 % пациенток с РС. Нарушение репродуктивной функции у мужчин в основном ограничивается уменьшением количества сперматозоидов, которое восстанавливается через 3–4 месяца после окончания лечения [17].
С учетом вышеперечисленных осложнений на сегодняшний день принята новая схема лечения РС (не более 100–120 мг/м2), которая ограничивает серьезные побочные эффекты митоксантрона.
Цель — определить эффективность и безопасность использования митоксантрона при активных, быстропрогрессирующих прогредиентных типах течения РС.
Задачи исследования:
— оценить клиническую эффективность митоксантрона при прогредиентных типах течения РС;
— провести сравнительный анализ клинической эффективности митоксантрона при первично- и вторично-прогредиентных типах течения РС;
— оценить динамику томографических показателей после лечения митоксантроном и в процессе двухлетнего катамнестического наблюдения у пациентов с прогредиентными типами течения РС;
— оценить степень безопасности и переносимости митоксантрона у пациентов с РС;
— уточнить показания к назначению митоксантрона с учетом особенностей течения и характера прогноза при прогредиентных типах течения РС.
Материал и методы
Для курсового лечения митоксантроном было отобрано 70 пациентов (23 мужчины и 47 женщин) с прогредиентными типами течения, у 20 из которых наблюдался ППТ и у 50 — ВПТ.
Митоксантрон вводился внутривенно капельно каждые 2–3 месяца по 12–20 мг/м2 в комбинации с однократным введением глюкокортикоидов (метипред, солу-медрол по 500–1000 мг). Суммарная курсовая доза составляла от 100 до 120 мг/м2.
Перед каждым введением препарата проводился кардиологический (ЭКГ) и гематологический мониторинг (клинический анализ крови с подсчетом лейкоцитарной формулы, биохимические показатели функции печени и почек), оценка жизненно важных показателей — АД, ЧСС, соматического статуса.
В соответствии с дизайном исследования всем пациентам перед началом лечения митоксантроном была произведена МР-томография головного и спинного мозга. Оценка эффективности лечения ограничивалась анализом изменений в головном мозге с обязательным контрастированием гадолинием (с пересчетом на 1 кг веса). Напряженность магнитного поля составляла не менее 1,5 Т. Проводился учет общего числа очагов и гадолиний-контрастированных повреждений вещества головного мозга. Обязательный протокол МРТ-исследования включал оценку количества, локализации и активности очагов в Т1 и Т2 в аксиальной, сагиттальной и коронарной плоскостях до и после введения гадолиния. Последующие МРТ в таком же режиме проводились с интервалом в 1 год — непосредственно после окончания курса лечения и ежегодно в течение 2 лет катамнестического наблюдения, в общей сложности 4 раза. При наличии клинических обострений дополнительно проводились внеплановые МРТ по общепринятому протоколу, позволяющие при окончательном анализе учитывать количество новых активных очагов, обнаруженных при дополнительных исследованиях МРТ.
Назначение митоксантрона проводилось с учетом следующих критериев:
— диагноз РС у всех пациентов соответствовал обновленным критериям Мак-Дональда [18];
— возраст от 18 до 55 лет;
— прогредиентные типы течения РС (ВПТ и ППТ) с быстрыми темпами прогрессирования в течение предшествующих 12 месяцев с увеличением суммарного неврологического дефицита не менее чем на 1,5–2,0 балла по шкале EDSS;
— радиологическая активность — более двух очагов в Т1-режиме, накапливающих контраст, и не менее 9 гиперинтенсивных очагов в Т2-режиме, по результатам МРТ до начала лечения;
— продолжительность заболевания более 5 лет;
— исходный уровень лейкоцитов не ниже 3,0 • 109/л (по данным клинического анализа крови);
— информированное согласие пациента.
Противопоказаниями к лечению служили: системные болезни; тяжелые инфекции; хроническая соматическая патология (заболевания сердца, почечная и печеночная недостаточность); психические нарушения; беременность и лактация; индивидуальная непереносимость препарата.
На рецидивирующем этапе 36 (72,0 %) пациентов с ВПТ получали иммуномодуляторы 1-го ряда (интерфероны, копаксон) и 8 (16,0 %) пациентов — натализумаб (тизабри), эффективность которых была недостаточна или отсутствовала.
Эффективность действия митоксантрона оценивалась непосредственно после окончания курса лечения. В дальнейшем ежегодно в течение 2 лет осуществлялось катамнестическое наблюдение с анализом клинического состояния пациентов и радиологической картины по данным МРТ.
Учитывались динамика выраженности неврологического дефицита, наличие и длительность этапа стабилизации, темпы и варианты дальнейшего прогрессирования. С учетом этих показателей были предложены следующие критерии эффективности лечения митоксантроном:
— высокая эффективность — частичный регресс неврологической симптоматики (от 0,5 до 1,0 и более балла по шкале EDSS) на фоне стабилизации состояния;
— умеренная эффективность — формирование этапа стабилизации и прекращение дальнейшего прогрессирования (отсутствие отрицательной динамики по шкале EDSS);
— низкая эффективность — замедление темпов прогрессирования за счет трансформации неуклонного и/или рецидивирующего варианта прогрессирования в более благоприятный — поступательный вариант;
— отсутствие эффективности — дальнейшее неуклонное прогрессирование прежними темпами.
Результаты исследования и их обсуждение
Лечение митоксантроном было начато у 70 пациентов, в том числе у 20 — с ППТ и у 50 — с ВПТ.
Возраст пациентов колебался от 24 до 55 лет (средний возраст 43,70 ± 2,17 года), в том числе для ППТ — 44,60 ± 3,58 года, для ВПТ — 43,40 ± 2,66 года, и не зависел от характера прогноза при двух типах течения. Средняя длительность заболевания у всех пациентов составила 11,20 ± 0,91 года, причем средний показатель длительности болезни при ВПТ (12,10 ± 1,13 года) был достоверно выше, чем при ППТ (9,10 ± 0,94 года) (уровень значимости интервала p < 0,05), у большинства пациентов за счет продолжительной ремиссии после дебюта (3 года и более) и длительного рецидивирующего этапа (8 и более лет). При ППТ у трети пациентов (35,0 %) начальные проявления заболевания наблюдались после 30 лет (диапазон возрастных колебаний составил 19–51 год). При ВПТ у большинства пациентов (82,0 %) заболевание начиналось между 20 и 30 годами (при диапазоне возрастных колебаний 15–42 года). Средний возраст дебюта составил 26,10 ± 2,09 года и при оценке с помощью доверительного интервала был недостоверен при обоих типах течения (29,70 ± 3,74 года при ППТ и 24,80 ± 2,42 года при ВПТ). Двухколоночный тест Стьюдента показал, что при ВПT преобладание среднего возраста дебюта для неблагоприятного прогноза статистически достоверно (p < 0,1) по отношению к неопределенному прогнозу (табл. 1).
Досрочно прекратили лечение и в дальнейшем были исключены из анализа 3 пациента в связи со следующими причинами:
— у 2 (ППТ — 1 и ВПТ — 1) отсутствие эффективности привело к дальнейшему неуклонному прогрессированию и отказу от лечения;
— у 1 (ВПТ) процесс лечения сопровождался стойким снижением лейкоцитов (ниже 3,0 • 109/л).
Результаты лечения проанализированы у 67 пациентов (19 — с ППТ и 48 — с ВПТ) с учетом приведенных выше критериев эффективности.
В клинической картине при ППТ РС до лечения преобладали такие клинические показатели, как продолжительные дебюты (80 %) с замедленным (90 %) формированием олиго- и полисиндромной симптоматики (70 %); дебюты средней степени тяжести (65 %), в структуре которых преобладала пирамидная (70 %), мозжечковая (60 %) симптоматика, когнитивные (55 %) и сфинктерные (50 %) нарушения при сравнительно редком развитии чувствительных (25 %) и стволовых (20 %) расстройств. В дальнейшем у большинства больных заболевание протекало в виде неуклонного варианта быстрого прогрессирования (70 %), развившегося непосредственно после дебюта (75 %), с формированием неблагоприятного характера прогноза у 85 % пациентов. У 25 % пациентов продолжительный дебют сменялся стабилизацией, после окончания которой формировался этап первичного прогрессирования [1, 2]. Наличие стабилизации после дебюта (1-й путь формирования этапа прогрессирования при ППТ) характеризовалось более доброкачественным течением и неопределенным характером прогноза у 15 % пациентов в этой подгруппе больных. Выраженность неврологического дефицита при ППТ до начала курса митоксантрона представлена в табл. 2.
/21.jpg)
По данным шкалы EDSS (средний балл 6,45 ± 3,57), у 70 % пациентов с ППТ отмечены высокие баллы (6,5–8,0), свидетельствующие о глубокой инвалидизации и неблагоприятном характере прогноза. При неопределенном прогнозе у 3 пациентов (15 %) неврологический дефицит соответствовал 4,0 и 4,5 балла.
В клинической картине ВПТ перед началом лечения, в отличие от ППТ, преобладали моносиндромные (52 %) и олигосиндромные (34 %) дебюты легкой и средней степени тяжести (54 и 40 % соответственно) различной продолжительности (44 % — короткая, по 28 % — средняя и длительная) с преимущественно постепенными (50 %) и замедленными (28 %) темпами формирования. В клинической структуре дебютов отсутствовали признаки начальной атрофии зрительных нервов, реже встречались пирамидные (38 %), мозжечковые (36 %), когнитивные (38 %) и особенно сфинктерные нарушения (6 %) с одновременным возрастанием частоты стволовых (40 %) и чувствительных (54 %) расстройств, а также развитием у трети пациентов острого ретробульбарного неврита. У подавляющего большинства больных (72 %) вслед за ремиссией после дебюта разной продолжительности начинался рецидивирующий этап, протекавший с чередованием рецидивов разной степени тяжести.
Неблагоприятный прогноз преобладал у лиц с тяжелыми рецидивами (44 %). Длительность рецидивирующего этапа варьировала от 3 (22,3 %) до 8 и более лет (50 %). У 28 % пациентов этап вторичного прогрессирования начинался непосредственно вслед за ремиссией после дебюта и характеризовался чередованием различных вариантов прогрессирования, которые встречались с разной частотой (поступательный — 58 %, рецидивирующий — 62 % и неуклонный — 80 %) и зависели от характера прогноза: при неблагоприятном прогнозе преобладал неуклонный, при неопределенном прогнозе — поступательный и/или рецидивирующий вариант.
У всех пациентов с ВПТ исходный средний балл по шкале EDSS составил 6,11 ± 1,40, в том числе у 28 (56 %) пациентов с неблагоприятным прогнозом определялись высокие баллы (6,5 и более); при неопределенном прогнозе у 22 (44 %) диапазон баллов варьировал от 3,5 до 6,0 и свидетельствовал об умеренной степени инвалидизации (табл. 2).
Характер прогноза формировался с учетом текущей клинической ситуации и ретроспективного анализа течения всех этапов заболевания в целом. На этой основе для каждого варианта прогноза при ПТТ РС были использованы статистически достоверные клинические диагностические критерии, разработанные в наших предыдущих исследованиях [3, 4].
У пациентов с ППТ перед курсом митоксантрона прогноз оценивался как неблагоприятный (85 % пациентов) на основании следующих достоверных клинических показателей: возраст дебюта — старше 30 лет; замедленные темпы формирования олиго- или полисиндромной клинической симптоматики в дебютах; тяжелые или средней тяжести продолжительные дебюты, непосредственно переходящие в этап первичного прогрессирования, минуя стабилизацию после дебюта; наличие ведущей мозжечковой симптоматики и нарушение функции тазовых органов в дебютах; быстрые темпы неуклонного варианта прогрессирования; формирование выраженного и стойкого неврологического дефицита (выше 6 баллов по шкале EDSS).
Клинические показатели при неблагоприятном прогнозе при ВПТ (56 % пациентов) характеризовались постепенными и замедленными темпами формирования неврологической симптоматики в дебютах средней степени тяжести; наличием в клинической структуре дебютов мозжечковой симптоматики и нарушений функции тазовых органов; короткой ремиссией после дебюта; отсутствием рецидивирующего этапа и формированием вторичного прогрессирования вслед за клинической ремиссией после дебюта; преобладанием тяжелых и длительных рецидивов с короткими ремиссиями между ними на рецидивирующем этапе; неуклонным и рецидивирующим вариантами прогрессирования; формированием выраженного и стойкого неврологического дефицита (более 6 баллов по шкале EDSS).
Оценка неопределенного прогноза (15 % пациентов) при ППТ была основана на следующих клинических показателях: начало заболевания после 30 лет; длительные дебюты легкой или средней степени тяжести, формирующиеся постепенными темпами; наличие в клинической структуре дебютов пирамидной, стволовой симптоматики, нарушений функции тазовых органов; формирование этапа первичного прогрессирования после стабилизации, наступившей вслед за дебютом; поступательный и/или рецидивирующий вариант прогрессирования; умеренный неврологический дефицит (до 6 баллов по шкале EDSS), формирующийся медленными и умеренными темпами.
Неопределенный прогноз при ВПТ (44 % пациентов) характеризовался быстрыми темпами развития клинической симптоматики в дебюте; средней продолжительностью легких и коротких дебютов; клинической ремиссией после дебюта средней продолжительности; легкими и/или средней тяжести рецидивами на рецидивирующем этапе; формированием вторичного прогрессирования после рецидивирующего этапа; поступательным и/или рецидивирующим вариантом прогрессирования; умеренным неврологическим дефицитом (до 6 баллов по шкале EDSS), формирующимся медленными и/или умеренными темпами.
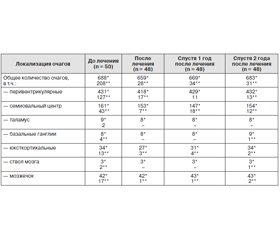
По данным МРТ головного мозга до начала лечения диффузный атрофический нейродегенеративный процесс в виде внутренне-наружной гидроцефалии разной степени выраженности преобладал при ППТ. Общее количество очагов, локализованных преимущественно в перивентрикулярных областях, у 20 пациентов при ППТ составило 198; у 50 пациентов при ВПТ — 688. Таким образом, среднее число обнаруженных очагов для каждого пациента при ВПТ (13,7) было выше, чем при ППТ (9,9). Аналогичная тенденция распространялась на число активных гадолиний-контрастируемых очагов (44 при ППТ и 208 при ВПТ), средние значения которых для каждого пациента составили 2,2 и 4,2 соответственно (табл. 3, 4).
/23.jpg)
После окончания курса митоксантрона высокая эффективность с частичным и избирательным регрессом неврологической симптоматики отмечена у 4 (21,1 %) пациентов с ППТ и у 12 (25 %) с ВПТ; умеренная эффективность в виде стабилизации процесса — у 7 (36,8 %) пациентов с ППТ и у 24 (50 %) с ВПТ; низкая эффективность получена в результате замедления темпов дальнейшего прогрессирования с трансформацией неуклонного в более благоприятный поступательный вариант у 5 (26,3 %) пациентов с ППТ и у 11 (22,9 %) с ВПТ; у 3 (15,8 %) пациентов с ППТ и у 1 (2,1 %) с ВПТ, имеющих высокий балл (7,5) по шкале EDSS, эффективность отсутствовала; 1 (5,3 %) пациент с 8 баллами по шкале EDSS при ППТ отказался от продолжения лечения в связи с неуклонным быстрым прогрессированием заболевания.
Таким образом, при тяжелых ПТТ РС положительные результаты лечения митоксантроном в виде высокой и умеренной эффективности были получены у 57,9 % пациентов с ППТ и у 75 % с ВПТ. У всех пациентов с высокой эффективностью, независимо от типа течения, исходные баллы до лечения колебались в диапазоне от 3,5 до 5,5 (табл. 5).
Непосредственно после окончания курса митоксантрона общее количество выявленных очагов в головном мозге, по данным МРТ, не претерпело существенной динамики. У пациентов с ППТ их число увеличилось на 2,5 % (со 198 до 203), а при ВПТ уменьшилось на 4,2 % (с 688 до 659), что в среднем на одного больного составило 10,6 очага при ППТ и 13,7 очага при ВПТ (табл. 3).
Процесс снижения радиологической активности в виде достоверного уменьшения числа гадолиний-контрастируемых очагов протекал более интенсивно. При ППТ у 19 больных число активных очагов уменьшилось на 84,1 % (с 44 до 7), а при ВПТ у 48 больных — на 86,6 % (со 208 до 28). Средний показатель числа очагов, приходящихся на одного больного, составил 0,3 при ППТ и 0,6 при ВПТ. Отношение активных очагов к общему числу очагов до и после лечения при ППТ снизилось с 22,2 до 3,4 %, а при ВПТ — с 30,2 до 4,2 % (табл. 4).
Через 1 год после окончания лечения высокая эффективность в виде регресса неврологической симптоматики сохранялась у 3 из 4 (15,9 %) пациентов с ППТ и у 6 (12,5 %) с ВПТ. Устойчивая стабилизация в виде умеренной эффективности продолжалась у 5 (26,3 %) пациентов с ППТ и у 22 (45,9 %) с ВПТ. Низкая эффективность выявлена у 6 (31,5 %) пациентов с ППТ и у 16 (33,3 %) с ВПТ в связи с сохранением поступательного варианта прогрессирования, сформировавшегося в процессе лечения. Отсутствие эффективности в связи с дальнейшим быстрым неуклонным прогрессированием получено у 5 (26,3 %) пациентов с ППТ и у 4 (8,3 %) с ВПТ (табл. 5).
Полученные данные свидетельствуют о том, что после курса митоксантрона в течение года у пациентов с разными типами прогредиентного течения происходила частичная реорганизация показателей эффективности: при ППТ — у 6 (31,6 %) и при ВПТ — у 12 (25,0 %) пациентов (табл. 5).
Реорганизация показателей эффективности при ППТ:
— 1 пациент из группы с высокой эффективностью переместился в группу с умеренной эффективностью в связи с прекращением дальнейшего регресса неврологической симптоматики;
— 3 пациента из группы с умеренной эффективностью переместились в группу с низкой эффективностью в связи с возобновлением этапа медленного прогрессирования после стабилизации;
— 2 пациента из группы с низкой эффективностью переместились в группу с отсутствием эффективности в результате возобновления высоких темпов неуклонного прогрессирования.
Реорганизация показателей эффективности при ВПТ:
— 6 пациентов из группы с высокой эффективностью после прекращения регресса неврологической симптоматики переместились в группы с умеренной (4 человека) и низкой (2 человека) эффективностью;
— 6 пациентов из группы с умеренной эффективностью перешли в группу с низкой эффективностью в связи с наступлением очередного этапа вторичного прогрессирования (после окончания стабилизации), который, в отличие от исходного состояния, протекал в виде более доброкачественного поступательного варианта (3 человека); у 3 человек возобновление быстрых темпов неуклонного прогрессирования оценивалось как отсутствие эффективности.
Данные МРТ за рассматриваемый годовой период свидетельствуют об отсутствии отрицательной динамики как общего числа очагов, так и гадолиний-контрастируемых очагов в рассматриваемых структурах мозга. Отмечен минимальный рост общего числа очагов при ППТ на 2,6 % (с 203 до 208) и при ВПТ на 1,5 % (с 659 до 669); количество активных очагов уменьшилось при ППТ в рамках статистической погрешности (с 7 до 3) и увеличилось при ВПТ с 28 до 34. Среднее количество очагов, приходящихся на одного больного (10,9 при ППТ и 13,9 при ВПТ), в том числе активных (0,1 при ППТ и 0,7 при ВПТ), по сравнению с данными, полученными непосредственно после лечения, также колебалось в рамках статистической погрешности. Различия в соотношениях между активными очагами и общим числом очагов (с 3,4 до 1,4 % при ППТ и с 4,2 до 5,1 % при ВПТ) в период между окончанием курса митоксантрона и катамнестическим наблюдением в течение 1 года были также статистически недостоверны (табл. 3, 4).
Через 2 года после лечения митоксантроном высокая эффективность была отмечена только у 1 (2,1 %) пациента с ВПТ и отсутствовала при ППТ; умеренная эффективность в виде стабилизации сохранялась у 8 (42,1 %) пациентов с ППТ и у 23 (47,9 %) с ВПТ; низкая эффективность в виде замедленных темпов поступательного варианта прогрессирования, которые сформировались в процессе лечения, определялась у 4 (21,1 %) пациентов с ППТ и у 19 (39,6 %) с ВПТ; отсутствие эффективности в связи с возобновлением быстрых темпов неуклонного прогрессирования выявлено у 7 (36,8 %) пациентов с ППТ и у 5 (10,4 %) с ВПТ (табл. 5).
В процессе двухлетнего катамнестического наблюдения продолжалась реорганизация показателей эффективности, которая носила избирательный характер и свидетельствовала о преобладании позитивного воздействия курса митоксантрона у подавляющего большинства пациентов при двух типах прогредиентного течения РС. За этот период дальнейшая отрицательная динамика показателей эффективности была выявлена у 5 (26,3 %) пациентов с ППТ и у 8 (16,6 %) с ВПТ РС.
Реорганизация показателей эффективности при ППТ:
— 3 пациента из группы с высокой эффективностью переместились в группу с умеренной эффективностью в результате прекращения дальнейшего регресса неврологической симптоматики и формирования этапа стабилизации;
— у 2 пациентов переход из группы с низкой эффективностью в группу с отсутствием эффективности произошел за счет восстановления неуклонного варианта быстрого прогрессирования.
Реорганизация показателей эффективности при ВПТ:
— 3 пациента в связи с прекращением дальнейшего регресса неврологической симптоматики и наступления этапа стабилизации из группы с высокой эффективностью перешли в группу с умеренной эффективностью;
— 2 человека после значительного улучшения в виде регресса неврологической симптоматики из группы с высокой эффективностью переместились в группу с низкой эффективностью за счет возобновления этапа вторичного прогрессирования, протекавшего замедленными темпами в виде поступательного варианта;
— 2 пациента в связи с прекращением этапа стабилизации и возобновлением медленных темпов прогрессирования из группы с умеренной эффективностью перешли в группу с низкой эффективностью;
— 1 пациент с медленными темпами прогрессирования из группы с низкой эффективностью переместился в группу с отсутствием эффективности в связи с возобновлением быстрых темпов неуклонного прогрессирования.
Сравнительный анализ эффективности митоксантрона у пациентов с ППТ и ВПТ выявил преобладание лиц с отсутствием эффективности при ППТ на всех временных этапах наблюдения, тогда как пациенты с умеренной и низкой эффективностью достоверно чаще встречались при ВПТ после 1 и 2 лет наблюдения соответственно (табл. 5).
Спустя 2 года катамнестического наблюдения, по данным МРТ, общее число очагов (рост на 2,4 % — с 208 до 213 при ППТ и на 2,1 % — с 669 до 683 при ВПТ) и гадолиний-контрастируемых очагов (с 3 до 4 при ППТ и с 34 до 31 при ВПТ) не претерпевает значимых изменений. Среднее число очагов, приходящихся на одного больного (11,2 при ППТ и 14,2 при ВПТ), в том числе активных (0,2 при ППТ и 0,6 при ВПТ), остается статистически недостоверным по отношению к предыдущим показателям и сохраняет тенденцию к преобладанию при ВПТ. Различия в соотношениях между активными очагами и общим числом очагов (с 1,4 до 1,8 % при ППТ и с 5,1 до 4,5 % при ВПТ) за период между 1-м и 2-м годами катамнестического наблюдения по-прежнему сохранялись в рамках статистической погрешности (табл. 3, 4).
Побочные реакции наблюдались у 32 (47,7 %) из 67 пациентов, носили транзиторный характер и не привели к отмене препарата. Как правило, они проявлялись в виде интоксикации разной степени тяжести (тошнота, рвота, общая слабость, головная боль, миалгии, бессонница, диарея), частых и затяжных ОРВИ и у большинства пациентов купировались приемом церукала, мотилиума, парацетамола.
Заключение
Таким образом, проведенное исследование показало целесообразность применения митоксантрона при прогредиентных типах течения РС с учетом характера прогноза. При неопределенном прогнозе с преобладанием умеренного неврологического дефицита по шкале EDSS (от 4 до 6 баллов) доказана высокая эффективность препарата за счет формирования продолжительного этапа стабилизации, который у ряда пациентов, особенно с мозжечковыми нарушениями, сопровождался частичным регрессом неврологической симптоматики. При неблагоприятном прогнозе, который, как правило, характеризовался быстрыми темпами неуклонного прогрессирования и выраженным неврологическим дефицитом (6 и более баллов по шкале EDSS), митоксантрон замедлял темпы прогрессирования и способствовал трансформации неуклонного варианта в более благоприятный поступательный вариант прогрессирования.
Митоксантрон, по данным мониторинга МРТ, проведенного в рамках протокольного наблюдения во время и после курса лечения, замедляет радиологическую активность воспалительного процесса, уменьшает число новых подтвержденных гадолиний-контрастируемых очагов поражения, но не оказывает влияния на общий нейродегенеративный процесс, который зависит от длительности, тяжести и типа течения РС с преобладанием при ППТ.
Вышесказанное позволяет рекомендовать митоксантрон в качестве метода деэскалационной иммуносупрессивной терапии при тяжелых малокурабельных прогредиентных формах РС с учетом типа течения, характера прогноза, степени выраженности неврологического дефицита, темпов и вариантов прогрессирования.

/21.jpg)
/23.jpg)
/24.jpg)