Статтю опубліковано на с. 52-56
Вступ
Когнітивний та неврологічний дефіцит у поєднанні з поведінковими розладами формують клініку наслідків черепно-мозкової травми (ЧМТ). Загибель нейронів та втрата асоціативних зв’язків у гострому періоді ЧМТ обумовлені складними механізмами, серед яких окислювальний стрес, ексайтотоксічность, перифокальна деполяризація нейронів, автоімунне запалення та апоптоз. Дослідження в галузі патофізіології апоптозу відкривають широкі можливості для запобігання багатьом до цього часу важко керованим патологічним станам, для їх прогнозування й лікування.
Висловлюється думка, що зростання рівня проапоптичних білків у сироватці крові в гострому періоді ЧМТ не лише є результатом цитолізу, але й може мати регуляторний характер. Встановлено взаємозв’язок між надлишковою активацією екстрацелюлярної сигнал-активуючої кінази та вторинними механізмами клітинної загибелі при ЧМТ [1]. Високі темпи апоптозу були незалежним фактором, пов’язаним зі смертністю протягом 6 місяців, тому запропоновані як критерій несприятливого перебігу ЧМТ [2].
Активація апоптозу у віддаленому періоді ЧМТ, на думку автора [3], обумовлена порушенням гематоенцефалічного бар’єра та затяжним характером запалення. Результатом зниження трансмембранного потенціалу й утворення пор є вихід проапоптогенних факторів (цитокінів) у цитоплазму та активування каскаду каспаз. Це, у свою чергу, сприяє посиленню астенічної, депресивної, тривожної симптоматики і навіть появі псевдопсихопатичних, галюцинаторно-параноїдних і когнітивних порушень.
В експерименті було продемонстровано диференційні вік-асоційовані зміни в рівнях експресії трьох апоптогенних білків, зроблено висновок про їх вплив на вікові відмінності у відновленні пізнавальної функції після ЧМТ [4]
Зроблено припущення, що кількісна візуалізація апоптозу дозволить значно поліпшити прийняття клінічних рішень при захворюваннях, пов’язаних із цим процесом [5].
Однак існує ймовірність наявності ще не ідентифікованих факторів, що ведуть до прогресуючого когнітивного зниження після ЧМТ. Зважаючи на той факт, що, згідно зі статистикою, ЧМТ вражає переважно осіб молодого та середнього віку, актуальним є відкриття можливих патогенетичних ланок. Важливим є встановлення предикторів цього прогресування з метою розробки методів профілактики [6].
Мета роботи: встановити фактори, що впливають на формування когнітивного та неврологічного дефіциту у хворих із наслідками ЧМТ.
Матеріал та методи
Проведено обстеження 280 хворих із наслідками ЧМТ. Середній вік основної групи — 42,54 ± 0,59 року, середній катамнез травми — 8,02 ± 0,49 року. Чоловіків було 233 (83,21 %). Дизайн дослідження передбачав: вік пацієнтів від 18 до 60 років, формування груп з різною тяжкістю ЧМТ (легка (ЛЧМТ), середньої тяжкості (СТЧМТ) та тяжка (ТЧМТ)) та катамнезом травми, відсутність в анамнезі даних за онкопатологію та соматичної патології в стадії декомпенсації. До контрольної групи увійшли 30 осіб, репрезентативних за віком та статтю.
Неврологічний статус оцінювали за Neurological Outcome Scale for Traumatic Brain Injury (NOS-TBI) [7], стан когнітивної сфери — за Монреальською шкалою когнітивного дефіциту (МоСА). З метою скринінгу рівня тривоги та депресії усі пацієнти заповнювали опитувальник HADS.
Для оцінки апоптозу лейкоцитів крові використовували FITC (флюоресцеїн ізотіоціанат) — мічений анексин V із набору реагентів ANNEXIN V FITC (Beckman Coulter, США). Аналіз проб проводили на проточному цитометрі Epics XL (Beckman Coulter, США) з аргоновим лазером. Досліджувану популяцію клітин гейтували в координатах FSC (вісь абсцис) і SSC (вісь ординат), потім аналізували на наявність флюоресценції в координатах на основі Dot Plot. Використовували автоматичне програмне забезпечення й методи збору та аналізу даних із високою роздільною здатністю (1024 канали). Отримані результати подавали у відсотках (співвідношення числа анексинпозитивних клітин до загальної кількості фракції лейкоцитів).
Дискримінаційний аналіз типу клітинної смерті включав: 2-й квадрант — клітини, позитивні за прорідію йодидом (PI+) і анексином V (AnV+) FITC — пізня стадія апоптозу або некроз; 3-й квадрант — клітини, негативні за PI і анексином V FITC — життєздатні клітини; 4-й квадрант — клітини, позитивні за анексином V FITC і негативні за PI — рання стадія апоптозу. Рівень продукції активних форм кисню (АФК) аналізували за інтенсивністю світіння барвника дихлорфлюоресцеїну діацетату (Sigma Aldrich, США) на проточному цитофлюориметрі Epics XL (Beckman Coulter, США). Значення дослідженого параметра виражали у відсотках [8]
Статистична обробка результатів виконана у відділі системних статистичних досліджень ДВНЗ «Тернопільський державний медичний університет імені І.Я. Горбачевського МОЗ України» за допомогою програмного пакета Statsoft Statistica.
Результати дослідження та їх обговорення
За результатами МоСА-тесту пацієнтів із наслідками ЧМТ розподілили на три групи: І (n = 45) — з вираженими когнітивними розладами (МоСА-тест 16,04 ± 0,31 бала), ІІ (n = 184) — з помірними когнітивними розладами (МоСА-тест 21,75 ± 0,12 бала) та ІІІ (n = 51), у якій когнітивного дефіциту зафіксовано не було (МоСА-тест 26,20 ± 0,14 бала). У кожній із цих груп обчислили значення АФК+, РІ+, AnV+ (табл. 1).
У хворих із вираженими та помірно вираженими когнітивними розладами відсоток клітин у фазі апоптозу був більшим, ніж у групі без когнітивного зниження (р < 0,000). У пацієнтів з помірними когнітивними розладами вірогідно вищою була й концентрація АФК+. За рівнем РІ+ групи не відрізнялися.
За шкалою NOS-TBI неврологічний дефіцит у загальній групі оцінено в 3,25 ± 0,14 бала. У 23 (8,2 %) хворих не зафіксовано відхилень неврологічного статусу, у решти неврологічний дефіцит коливався від 1 до 11 балів.
З метою встановлення впливу окремих факторів (вік пацієнтів, термін травми, концентрація АФК+, РІ+, AnV+) на рівень когнітивного (МоСА-тест) та неврологічного (NOS-TBI) дефіциту проведено дослідження кореляційних зв’язків між даними показниками (рис. 1).
Порівняння сили та характеру впливу таких факторів, як вік, термін травми, відсоток лейкоцитів периферичної крові в стадії некрозу та апоптозу, а також АФК+ на неврологічний та когнітивний дефіцит демонструє певні тенденції. Якщо вік та термін травми негативно впливали (хоч і на слабкому рівні) на обидві функції, то залежність між концентрацією АФК+, РІ+, AnV+, з одного боку, та МоСА-тестом і NOS-TBI, з іншого боку була різною: негативною стосовно когнітивного та позитивною стосовно неврологічного дефіциту.
Отже, у пацієнтів із наслідками ЧМТ встановлено середньої сили різнонаправлений кореляційний зв’язок між відсотком лейкоцитів периферичної крові в стадії апоптозу та тяжкістю неврологічного й когнітивного дефіциту.
Для більш детального дослідження ми проаналізували дані залежності в групах, виділених за тяжкістю та катамнезом травми.
Співвідношення між МоСА-тестом та факторами, що розглядалися вище, демонструють синергізм за більшістю критеріїв у групах із ЛЧМТ та ТЧМТ (рис. 2).
Однак негативний вплив був більш вираженим за умови ЛЧМТ в анамнезі: АФК+ (r = –0,36 при ЛЧМТ проти r = –0,13 при ТЧМТ), РІ+ (r = –0,17 проти r = +0,13 відповідно) та AnV+ (r = –0,55 проти r = –0,23 відповідно).
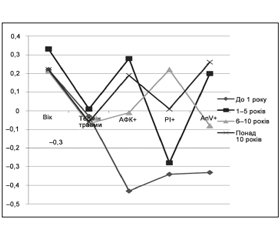
Кореляційні зв’язки між критеріями, що досліджувалися, та МоСА-тестом у пацієнтів із різним катамнезом ТЧМТ подані на рис. 3.
У всіх групах спостерігали слабкий негативний вплив віку пацієнтів на стан когнітивних функцій, максимально вираженим (r = –0,3) він був при катамнезі травми понад 10 років. На рівні слабкого зв’язку з МоСА-тестом перебував також і термін травми. Концентрація лейкоцитів із підвищеним вмістом АФК+ (%) негативно впливала на стан когнітивного функціонування лише при катамнезі травми до 1 року та 1–5 років, в інших групах ця залежність нівелювалася. Обернений кореляційний зв’язок між відсотком клітин у стадії некрозу та апоптозу та значенням МоСА-тесту проявився лише при катамнезі до 1 року, в стадії апоптозу — у хворих із катамнезом травми понад 10 років.
Отже, до факторів, що негативно впливають на когнітивне функціонування у хворих із наслідками ТЧМТ, слід віднести: при катамнезі до 1 року — рівень АФК+ і AnV+, а також вік пацієнта, при катамнезі 1–5 років — вміст АФК+, понад 10 років — рівень AnV+ і вік пацієнта.
Аналізуючи діаграму з кореляційними залежностями МоСА-тесту у хворих з наслідками СТЧМТ, встановили негативний вплив AnV+ на рівні помірного в групах з катамнезом до 1 року та понад 10 років, на рівні слабкого — у групі з катамнезом у 6–10 років. Уміст РІ+ лейкоцитів периферичної крові знаходився в оберненій кореляційній залежності з МоСа-тестом у групах з катамнезом 1–5 років та понад 10 років. Подовження терміну травми позитивно впливало на результат МоСА-тесту лише в групі з анамнезом до 1 року.
Як і в попередніх групах, у хворих з наслідками ЛЧМТ (рис. 5) негативний вплив на формування когнітивного дефіциту мали: рівень клітин у стадії апоптозу (на рівні помірного), концентрація АФК+ (на рівні помірного в пацієнтів з терміном травми до 1 року та понад 10 років) та слабкого (при катамнезі травми 1–5 років). Помірний статистично позначений вплив рівня РІ+ був у групі з терміном ЛЧМТ 6–10 років.
Отже, залежно від катамнезу захворювання встановлено певні закономірності негативного впливу окремих факторів на формування когнітивного дефіциту в пацієнтів із наслідками ЧМТ:
— при катамнезі до 1 року та понад 10 років максимально позначеним був вплив АФК (%), AnV+ (%) та віку пацієнта:
— при катамнезі ТЧМТ 1–5 років — лише АФК+.
Кореляційні зв’язки між значеннями NOS-TBI у хворих з наслідками ТЧМТ та віком пацієнтів, катамнезом травми, концентрацією АФК+ (%), РІ+ (%), AnV+ (%) подані на рис. 6.
У всіх групах вплив вікового фактора на вираженість неврологічного дефіциту (за шкалою NOS-TBI) був на рівні слабкого. У пацієнтів з катамнезом травми до 1 року обернена кореляційна залежність між NOS-TBI та концентрацією лейкоцитів периферичної крові в стадії некрозу й апоптозу та збагачених АФК+ вказує на саногенний характер активації даних процесів. У хворих із більш тривалим катамнезом зв’язок між даними показниками був прямо пропорційним, досягаючи максимальних значень для АФК+ при катамнезі травми 1–5 років, для AnV+ — понад 10 років.
У хворих з наслідками СТЧМТ також не встановлено переконливої залежності між ступенем тяжкості неврологічного дефіциту та віком пацієнтів, катамнезом травми, а також лабораторним показниками (АФК+, АnV+, РІ+). У групі з катамнезом до 1 року середньої сили обернений кореляційний зв’язок між показниками раннього й пізнього апоптозу та значеннями шкали можна трактувати як позитивне явище, направлене на відновлення функції, що підтверджується й даними літератури. Однак у наступних групах характер впливу змінювався: встановлено слабку пряму кореляційну залежність між значеннями PI+ та NOS-TBI у групі з катамнезом травми в 6–10 років та AnV+ і NOS-TBI у групі з катамнезом понад 10 років.
Висновки
1. Незалежно від тяжкості ЧМТ встановлено слабкий негативний кореляційний зв’язок між віком пацієнтів, терміном травми та вираженістю неврологічного (NOS-TBI) й когнітивного (МоСА-тест) дефіциту.
2. У пацієнтів з наслідками ЧМТ встановлено середньої сили різнонаправлений кореляційний зв’язок між тяжкістю неврологічного й когнітивного дефіциту та відсотком лейкоцитів периферичної крові в стадії апоптозу.
3. Найбільш позначений негативний кореляційний зв’язок між МоСа-тестом та АФК+, АnV+, РІ+ був у пацієнтів з наслідками ЛЧМТ та при катамнезі травми до 1 року й понад 10 років.
4. Вплив віку пацієнтів, терміну травми та АФК+, АnV+, РІ+ на тяжкість неврологічного дефіциту при ТЧМТ й СТЧМТ був на рівні слабкого.
Список литературы
1. Clausen F., Lundqvist H., Ekmark S., Lewén A., Ebendal T., Hillered L. Oxygen free radical-dependent activation of extracellular signal-regulated kinase mediates apoptosis-like cell death after traumatic brain injury // J. Neurotrauma. — 2004 Sep. — 21(9). — Р. 1168-82.
2. Miñambres E., Ballesteros M.A., Mayorga M., Marin M.J., Muñoz P., Figols J., López-Hoyos M. Cerebral apoptosis in severe traumatic brain injury patients: an in vitro, in vivo, and postmortem study // J. Neurotrauma. — 2008. — 25(6). — 581-91.
3. Казаков В.Е. Факторы риска возникновения психических нарушений в отдаленном периоде черепно-мозговой травмы // Міжнародний неврологічний журнал. — 2013. — № 7(63). — С. 169-172.
4. Gang Niu, Xiaoyuan Chen Apoptosis Imaging: Beyond Annexin V // J. Nucl. Med. — 2010. — Vol. 51, № 11. — Р. 1659-1662.
5. Plassman B.L., Grafman J. Traumatic brain injury and late-life dementia // Handb. Clin. Neurol. — 2015. — № 128. — Р. 711-22.
6. Dong Sun, McGinn M., Hankins J.E., Mays K.M., Rolfe A., Colello R.J. Aging- and injury-related differential apoptotic response in the dentate gyrus of the hippocampus in rats following brain trauma // Front. Aging Neurosci. — 2013, 18 December.
7. Wilde E.A., Mc Cauley S.R., Kelly T.M. et al. Feasibility of the Neurological Outcome Scale for Traumatic Brain Injury (NOS-TBI) in Adults // Journal of Neurotrauma. — 2010. — № 27(6). — Р. 975-981.
8. Li W., Liu H., Zhou J.-S. et al. Caveolin-1 Inhibits Expression of Antioxidant Enzymes through Direct Interaction with Nuclear Erythroid 2 p45-related Factor-2 (Nrf2) // The Journal of Biological Chemistry. — 2012. — Vol. 287, Issue 25. — P. 20922-20930.
/55.jpg)

/53.jpg)
/54.jpg)