Статья опубликована на с. 59-68
В современной неврологии чрезвычайно актуальной и социально значимой проблемой являются сосудистые заболевания головного мозга, которые занимают одно из первых мест среди неврологической патологии [3, 7, 10, 11, 16, 18]. В постсоветских странах, в том числе в Украине, традиционно особое внимание уделяется дисциркуляторной энцефалопатии (ДЭ). По материалам статистически-аналитической службы Министерства здравоохранения Украины за 2010 год, диагноз ДЭ был установлен у 6,1 % населения [23].
Дисциркуляторная энцефалопатия — синдром многоочагового или диффузного поражения головного мозга, обусловленный хронической сосудистой мозговой недостаточностью, связанной с атеросклерозом, артериальной гипертензией и другими заболеваниями, в результате которых страдает сосудистая система [9, 21, 43]. В патогенезе диффузного поражения мозга при ДЭ лежат процессы, обусловленные ухудшением церебральной гемодинамики, с последующим развитием ишемии, гипоксии, энергетического дефицита, повышения перекисного окисления липидов, нарушения функции нейрональных мембран и возникновением нейромедиаторного дисбаланса. Кроме того, при этом также может происходить запуск каскада нейродегенеративных процессов, что особенно характерно для лиц старшего возраста [8, 16, 19, 22, 42].
Клиническая картина ДЭ состоит из когнитивных (КН), эмоциональных, двигательных и других неврологических нарушений. Данное заболевание имеет прогрессирующее стадийное течение. Расстройство когнитивных функций в значительной степени определяет клиническую картину ДЭ [9, 12]. Нерезко выраженные когнитивные нарушения встречаются уже у 90 % пациентов с начальной ДЭ и возможным последующим постепенным или ступенеобразным прогрессированием, вплоть до степени деменции [17]. В связи с этим большой интерес исследователей привлекает проблема ранней диагностики когнитивных расстройств, формирующихся у лиц с хроническими нарушениями мозгового кровообращения [1, 2, 10, 25, 28, 33]. В основе когнитивной дисфункции при цереброваскулярной патологии лежит не первичное поражение тех или иных корковых зон или систем, а нарушение связей между различными корковыми отделами и субкортикальными структурами с последующим возникновением симптомов вторичной лобной дисфункции, которая и обусловливает нарушения в когнитивной и эмоциональной сфере при ДЭ. Патоморфологической основой этих изменений является поражение глубинных отделов белого вещества головного мозга, что сопровождается феноменом лейкоареоза, а также возможным развитием атрофии коры и расширением желудочков мозга [12, 16, 41].
Наиболее характерными признаками когнитивной дисфункции при цереброваскулярной патологии являются снижение темпа мыслительных процессов, нарушение планирования и организации деятельности, способности к концентрации внимания, памяти, повышенная утомляемость при умственных нагрузках [8, 25, 29, 37]. КН при сосудистой патологии головного мозга сочетаются, как правило, с эмоционально-личностными нарушениями: раздражительностью, тревожностью, депрессией и эмоциональной лабильностью, так как в основе последних лежит вторичная дисфункция лобных долей головного мозга [10, 11, 27].
У больных с хронической церебральной ишемией на начальных стадиях формируется синдром легких когнитивных нарушений (ЛКН), который по мере прогрессирования основного заболевания может трансформироваться в более выраженные когнитивные расстройства вплоть до развития деменции [17].
В последнее время нейрогеронтологи уделяют большое внимание проблеме синдрома умеренных когнитивных нарушений (УКН) (англ. mild cognitive impаirment (MCI)). Синдром УКН представляет собой достаточно гетерогенное состояние, характеризующееся признаками ухудшения памяти и/или общим когнитивным снижением при отсутствии синдрома деменции. Для синдрома УКН характерно ухудшение познавательной деятельности, которое обусловливает некоторые трудности при выполнении сложных видов профессиональной и социальной активности [4, 12, 40]. Также внимание исследователей привлекают более ранние когнитивные нарушения, предшествующие синдрому УКН и получившие название синдрома легких когнитивных нарушений. Название и критерии диагностики данного синдрома были предложены коллективом авторов под руководством Н.Н. Яхно в 2005 году [25]. В англоязычной литературе для обозначения подобного синдрома используют термин Pre-Mild Cognitive Impairment (pre-MCI) [34, 36, 37]. При легких когнитивных нарушениях показатели психометрических шкал могут оставаться в пределах среднестатистической возрастной нормы или незначительно отклоняться от нее. Тем не менее больные осознают снижение своих когнитивных способностей в сравнении с исходным уровнем, и это является для них поводом для беспокойства. Риск прогрессирования легких когнитивных расстройств и их трансформации в умеренные и тяжелые у таких пациентов, как правило, выше среднестатистического [25, 36, 41].
Очевидно, что более раннее выявление когнитивных расстройств, на стадии додементных (легких или умеренных) когнитивных нарушений, весьма актуально в плане проведения эффективной терапии [1, 12, 18, 33]. В настоящее время у больных пожилого возраста в качестве терапии КН, развивающихся на фоне цереброваскулярной патологии, целесообразным является использование препаратов, воздействующих на метаболические процессы в центральной нервной системе [14, 15, 18, 19].
Установлено, что с возрастом в сосудистой стенке снижается активность многих обменных процессов: уменьшается потребление кислорода и образование аденозинтрифосфата (АТФ), падает синтез белков и мукополисахаридов. Нарушение кровоснабжения мозга еще более усиливает метаболические сдвиги — происходит нарушение энергетического потенциала нейронов, снижается биосинтез макроэргических соединений (АТФ, аденозиндифосфат), происходят изменения в структурно-функциональном состоянии нейрональных мембран, развивается оксидативный стресс и в результате — дистрофия и дегенерация нейронов, нейромедиаторные нарушения [5, 22, 31]. Поэтому при лечении хронической цереброваскулярной патологии важно оптимизировать микроциркуляцию и улучшить метаболизм в мозговой ткани [3, 18, 20, 26].
Одним из современных препаратов, обладающих комплексным антиишемическим, антигипоксическим, антиоксидантным, вазотропным и цитопротекторным действием, является Вазонат. Действующим веществом препарата является мельдония дигидрат, структурный аналог гамма-бутиробетаина (предшественник карнитина). Мельдоний снижает уровень активированных форм ацилкарнитина и ацилкоэнзима А в клетках, предупреждая таким образом их токсическое действие. Препарат ингибирует процесс образования карнитина из гамма-бутиробетаина, уменьшает уровень карнитина в плазме. Кроме того, воздействие гамма-бутиробетаина вызывает индукцию оксида азота — эндотелиального фактора вазодилатации, обладающего множеством физиологических эффектов, которые проявляются в нормализации тонуса кровеносных сосудов, уменьшении агрегации тромбоцитов, увеличении эластичности эритроцитов. В результате нормализируется микроциркуляция крови и ее перераспределение к ишемизированным участкам нервной ткани, улучшаются обменные процессы в клетках, регулируется гликолиз и транспорт кислорода [14, 19, 39].
Целью данного исследования являлось изучение влияния препарата Вазонат на клинико-нейропсихологические и нейрофизиологические показатели при синдроме легких и умеренных когнитивных нарушений у пациентов пожилого возраста с ДЭ.
Материалы и методы исследования
Было обследовано 40 пациентов в возрасте от 60 до 75 лет, из них 18 женщин и 22 мужчины, с ДЭ и когнитивными нарушениями различной степени выраженности. Всем больным проведено клиническое (липидограмма, проба на активность ревматизма, протеинограмма, коагулограмма, уровень сахара в крови), параклиническое (дуплексное сканирование прецеребральных сосудов — исключался критический стеноз сонных артерий), тщательное соматическое обследование. Диагноз ДЭ устанавливался согласно общепринятым диагностическим критериям [10, 24]. Синдром ЛКН был установлен соответственно критериям Н.Н. Яхно и соавт. (2005) [25]; синдром УКН — модифицированным критериям R. Petersen (2004) [40]. В соответствии с вышеуказанными критериями, обследованные больные были разделены на 2 группы в зависимости от выраженности когнитивного дефицита: первая — 20 человек с синдромом УКН на фоне ДЭ II ст., и вторая — 20 пациентов с синдромом ЛКН на фоне ДЭ I ст. Больные в обеих группах были сопоставимы по возрасту, полу и уровню образования. Средний возраст пациентов в первой группе составил 70,8 ± 0,9 года, во второй — 69,3 ± 1,1 года, длительность образования — соответственно 14,10 ± 0,32 и 14,80 ± 0,19 года.
Пациенты, принимавшие участие в исследовании, не получали седативные препараты, транквилизаторы, стимуляторы центральной нервной системы, ингибиторы ацетилхолинэстеразы, модуляторы NMDA-рецепторов, антидепрессанты.
Для исключения сопутствующей патологии, которая могла бы стать причиной когнитивного дефицита, всем больным было проведено общеклиническое обследование, включавшее консультацию терапевта, эндокринолога, офтальмолога, выполнение электрокардиографии и лабораторных тестов, магнитно-резонансной/компьютерной томографии (МРТ/КТ) головного мозга. Терапия препаратом Вазонат назначалась больным в дозе 5 мл внутривенно струйно ежедневно в течение 10 дней.
Эффективность терапии оценивали на основании общеклинического, неврологического обследования, электроэнцефалографии (ЭЭГ), рейтинговой шкалы субъективных неврологических симптомов, ряда экспериментально-психологических тестов. MMSE (Mini-mental state examination), шкала оценки психического статуса, состоит из ряда субтестов, позволяющих быстро и эффективно оценить ориентировку во времени, месте, состояние кратковременной и долговременной памяти, функцию речи, гнозиса, праксиса [32]. Сумма баллов по субтестам составляет общую оценку по MMSE. Использовались также субтест кодирования, специальное экспериментально-психологическое исследование с применением таблиц Шульте, тесты на запоминание 10 слов и 8 цифр [6], тест семантически и фонетически опосредованных ассоциаций — «вербальных ассоциаций», батарея тестов на лобную дисфункцию — БТЛД (Frontal Assessment Battery) [30, 35]. БТЛД включает в себя субтесты, оценивающие способности к концептуализации, беглости речи, динамическому праксису, простой и усложненной реакции выбора, исследование хватательного рефлекса. Для выявления нарушений зрительно-моторной координации и конструктивного праксиса использовался тест рисования часов [38]. С целью более углубленного изучения мнестической деятельности применялась шкала памяти Векслера пересмотренная (Wechsler Memory Scale-Revised, WMS-R). Шкала содержит серию субтестов, которые дают возможность оценить внимание, долговременную и кратковременную память. Уровень внимания изучался на основании параметров субтестов: «Психологический контроль», «Цифровой ряд», «Визуальный мнестический ряд». Вербальная память (смысловая, простая и сложная ассоциативная) исследовалась с помощью субтестов «Логическая память», «Вербальные парные ассоциации (простые и сложные ассоциативные пары)», визуальная память (образная, ассоциативная, зрительно-пространственная) — с помощью субтестов «Образная память», «Визуальные парные ассоциации», «Визуальная репродукция» [45]. Всем пациентам проводилось исследование эмоционально-личностного состояния с помощью гериатрической шкалы депрессии — GDS (Geriatric Depression Scale) и шкалы тревожности Спилбергера — Ханина [6, 44].
Для изучения биоэлектрической активности головного мозга применяли систему компьютерной электроэнцефалографии (КЭЭГ) NeuroCom («XAИ-Медика»). Использовались 19 хлорсеребряных электродов, которые располагались соответственно международной системе «10–20» с референтными электродами на мочках ушей. Спектральный анализ ЭЭГ был проведен по алгоритму быстрого преобразования Фурье. Параметры волн были рассчитаны в диапазоне частот (Гц): дельта (1,5–3,9), тета (4,0–7,9), альфа (8–13), бета (14–35), гамма (35–45). Мощность спектра в середине полосы рассчитывалась интегрированием плотности мощности спектра. Относительная мощность основных составляющих спектра ЭЭГ представлена в процентах от общей мощности спектра для каждого отведения соответствующего диапазона частот. Проведена оценка спектральных коэффициентов — отношение абсолютных значений мощностей альфа- и тета-ритма, альфа- и дельта-ритма, альфа-ритма и суммы мощностей дельта- и тета-ритмов и отношение сумм абсолютных значений мощностей быстрых к медленным ритмам. Указанные параметры были рассчитаны для всей записи с усреднением по 9–10 эпохам. Размер эпохи составил 4 секунды [3, 13].
Статистическая обработка полученных результатов выполнена с помощью стандартного статистического пакета Statistica for Windows 6.0.
Результаты и их обсуждение
Объективная клиническая картина больных первой группы с синдромом УКН соответствовала ІІ стадии ДЭ. Пациенты в основном жаловались на головную боль, головокружение, повышенную утомляемость, общую слабость, раздражительность, тревожность, бессонницу, наибольшую тревогу вызывало у них ухудшение памяти. В неврологическом статусе наблюдалось: асимметрия носогубных складок (74,5 %), субкортикальные рефлексы (Маринеско — Радовича, Вюрпе, Карчикяна) (обнаружены у 68,1 %), рефлекторная пирамидная недостаточность (89,2 %) и статокоординаторные расстройства — проба Ромберга, проба Тома-Жумантье (92,9 %). При объективном исследовании эмоционально-личностных характеристик у больных с синдромом УКН выявлены умеренные явления депрессии (11,90 ± ± 1,97 балла), повышенный уровень личностной (42,20 ± ± 2,62 балла) и ситуативной (38,00 ± 2,73 балла) тревожности. Общий балл шкалы MMSE в данной группе составлял 26,40 ± 0,19. Соответственно результатам КТ/МРТ исследований головного мозга у большинства обследованных выявлены перивентрикулярные и субкортикальные очаги лейкоареоза, в отдельных случаях встречались лакунарные очаги и нерезко выраженные атрофические изменения.
Клиническая картина больных с синдромом ЛКН соответствовала І стадии ДЭ. Пациенты преимущественно жаловались на снижение памяти, головную боль, повышенную утомляемость. Эти нарушения сопровождались объективными расстройствами в виде легкой анизорефлексии (35 %), статокоординаторных расстройств (35,5 %), рефлексов орального автоматизма (40,1 %). При объективном исследовании эмоционально-личностных характеристик с помощью шкал GDS и Спилбергера — Ханина у больных с синдромом ЛКН выявлены легкие явления депрессии (10,80 ± 1,47 балла), несколько повышенный уровень личностной (46,00 ± 2,55 балла) и ситуативной (43,70 ± 1,55 балла) тревожности. Общий балл шкалы MMSE составлял 28,30 ± 0,16. По данным КТ/МРТ исследований в этой группе больных были обнаружены единичные мелкоочаговые изменения паренхимы мозга, а в отдельных случаях — нерезко выраженные явления корковой атрофии.
Проведена сравнительная оценка показателей экспериментально-психологического тестирования у пациентов с синдромом УКН и ЛКН. Так, по данным шкалы MMSE установлено, что в группе УКН по сравнению с группой ЛКН выявлено некоторое ухудшение ориентирования во времени, снижение показателей внимания, воспроизведения трех слов после отвлечения внимания (p < 0,05).
Кроме того, у больных с синдромом УКН отмечено достоверное снижение показателей субтеста кодирования, максимальной репродукции 10 слов и увеличение количества предъявлений ряда из восьми цифр. Также этим пациентам требовалось больше времени для выполнения специального экспериментально-психологического задания по таблицам Шульте (p < 0,05).
Изучение параметров шкалы WMS-R показало, что группа больных с синдромом УКН имела более низкие показатели ментального, слухового и зрительного контроля уровня внимания (p < 0,05). Параметры всех субтестов шкалы на кратковременную (образную, вербальную смысловую, ассоциативную простую и сложную, визуальную ассоциативную, зрительно-пространственную) память были достоверно ниже у пациентов с синдромом УКН, чем у больных с ЛКН (p < 0,05). Установлено также достоверное снижение долговременной составляющей функции памяти в группе УКН по сравнению с группой ЛКН за счет вербального смыслового, ассоциативного простого и сложного, визуального ассоциативного и зрительно-пространственного компонентов (p < 0,05).
На основании исследования показателей эмоционально-волевой сферы обращает на себя внимание некоторое увеличение ситуативной тревожности в группе пациентов с синдромом ЛКН (p < 0,05).
Были детально изучены показатели выраженности субъективных симптомов и нейропсихологических тестов до и после лечения препаратом Вазонат.
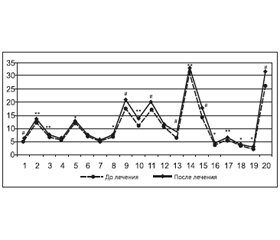
В результате терапии препаратом Вазонат в первой группе отмечалось улучшение общего состояния пациентов, что проявлялось уменьшением общего балла рейтинговой шкалы субъективных неврологических симптомов (до лечения — 10,62 ± 0,37, после лечения — 8,85 ± 0,29; p < 0,05), за счет улучшения оценки памяти (p < 0,05), уменьшения головной боли (p < 0,05), головокружения (p < 0,05), увеличения умственной работоспособности на фоне снижения повышенной утомляемости (p < 0,05) (рис. 1).
В ходе нейропсихологического исследования установлено, что у больных с синдромом УКН общий балл по шкале MMSE достоверно увеличился с 26,40 ± 0,19 до 28,47 ± 0,25 (p < 0,001) за счет улучшения выполнения субтестов «внимание и счет» (p < 0,01) и «отсроченное вспоминание» (p < 0,05) (рис. 2).
/63.jpg)
Также выявлено, что под влиянием лечения препаратом Вазонат достоверно увеличился общий балл теста на лобную дисфункцию (p < 0,01). По его результатам установлено улучшение параметров, характеризующих беглость речи и сложную реакцию выбора (p < 0,05). Кроме того, вырос показатель беглости речи теста «вербальные ассоциации» в семантической категории (до лечения — 11,58 ± 1,00, после лечения — 13,10 ± 0,92; p < 0,05). Установлено достоверное улучшение показателя теста рисования часов (p < 0,05) и символ-цифрового субтеста (до лечения — 28,87 ± 2,30, после лечения — 32,47 ± 2,56; p < 0,01). При исследовании параметров когнитивных функций по шкале памяти Векслера под влиянием терапии установлена положительная динамика выполнения большинства субтестов (рис. 3). У больных усилился контроль уровня внимания: ментальный («Психологический контроль», p < 0,001), слуховой («Цифровой ряд» прямой, p < 0,01) и зрительный («Мнестический ряд», p < 0,05). Также отмечалось улучшение показателей субтестов, характеризующих кратковременную память: визуальную образную («Образная память», p < 0,05), ассоциативную («Визуальные парные ассоциации», p < 0,01) и зрительно-пространственную («Визуальная репродукция», p < 0,01); вербальную смысловую («Логическая память», p < 0,001) и ассоциативную («Вербальные парные ассоциации» — сложные ассоциативные пары, p < 0,001). Кроме того, у этих пациентов увеличились показатели субтестов, оценивающих долговременную память: визуальную ассоциативную («Визуальные парные ассоциации», p < 0,05), зрительно-пространственную («Визуальная репродукция», p < 0,01), вербальную ассоциативную («Вербальные парные ассоциации» — простые и сложные ассоциативные пары, p < 0,05) и вербальную смысловую («Логическая память», p < 0,001) (рис. 3).
/63_2.jpg)
Таким образом, по данным WMS-R, у пациентов, страдающих ДЭ ІІ ст. с синдромом УКН в результате проведенного лечения препаратом Вазонат установлено улучшение показателей внимания (ментального, слухового и зрительного), зрительно-моторной координации, беглости речи, конструктивного и динамического праксиса. Также достоверно улучшились показатели памяти: кратковременной визуальной (образной, ассоциативной и зрительно-пространственной), вербальной (смысловой и ассоциативной), долговременной визуальной (ассоциативной и зрительно-пространственной), а также вербальной (ассоциативной и смысловой).
После окончания курса лечения препаратом Вазонат в группе больных с синдромом ЛКН также отмечалось улучшение общего состояния, уменьшение головной боли и головокружения. Общий балл по рейтинговой шкале субъективных неврологических симптомов до лечения составлял 9,31 ± 0,56, после лечения — 7,46 ± 0,25 (p < 0,001). По данной шкале установлено достоверное улучшение памяти (p < 0,05), уменьшение головной боли (p < 0,05) и головокружения (p < 0,01) (рис. 4).
На фоне проведенного лечения во второй группе больных было выявлено улучшение когнитивного состояния. Так, под влиянием терапии препаратом Вазонат общий балл по шкале MMSE увеличился с 28,30 ± 0,16 до 29,00 ± 0,19 (p < 0,001), главным образом за счет улучшения выполнения субтеста «повторение сложного предложения» из блока «речь и праксис» (рис. 5).
/64.jpg)
Данные изменения свидетельствуют об улучшении способности к восприятию и воспроизведению вербальной информации. Было выявлено достоверное увеличение суммарного балла теста на лобную дисфункцию (p < 0,01), преимущественно за счет выполнения субтеста, характеризующего динамический праксис. Достоверно увеличился показатель теста рисования часов (p < 0,01), что свидетельствует о некотором улучшении зрительно-моторной координации и конструктивного праксиса. Положительная динамика отмечалась также при выполнении символ-цифрового субтеста — количество правильно отображенных символов до лечения составляло 38,00 ± 2,86, после лечения — 41,10 ± 2,92 (p < 0,01), что указывает на улучшение внимания, зрительной памяти, способности к обучению и повышение активности больных.
Изучение параметров шкалы WMS-R показало, что в группе пациентов с синдромом ЛКН улучшился слуховой контроль уровня внимания («Цифровой ряд» — счет в обратной последовательности, p < 0,05). Кроме того, увеличились показатели, характеризующие память. В частности, после окончания курса терапии препаратом Вазонат установлены достоверные изменения в параметрах субтестов на кратковременную память: визуальную («Образная память», p < 0,01), вербальную смысловую («Логическая память», p < 0,05) и ассоциативную («Вербальные парные ассоциации» — сложные ассоциативные пары, p < 0,05). Также у этих пациентов улучшились показатели, характеризующие и долговременную вербальную смысловую память («Логическая память», p < 0,01) (рис. 6).
/65.jpg)
Таким образом, под влиянием лечения препаратом Вазонат в группе ЛКН на фоне ДЭ І cт. отмечалось улучшение общего состояния пациентов, уменьшение выраженности жалоб, что сопровождалось достоверным увеличением параметров, характеризующих кратковременную вербальную (смысловую, ассоциативную) и визуальную образную память. Также в этой группе больных достоверно увеличились параметры тестов, свидетельствующих об улучшении уровня внимания, зрительно-моторной координации, динамического и конструктивного праксиса, способности к обучению и восприятию новой информации и повышении активности больных.
Следует также отметить, что под влиянием проведенного курса терапии препаратом Вазонат в обследуемых группах больных достоверных изменений в эмоционально-волевой сфере выявлено не было.
По результатам нейрофизиологического исследования (КЭЭГ), при лечении препаратом Вазонат отмечались позитивные сдвиги биоэлектрической активности головного мозга в группе больных с синдромом УКН. Установлено достоверное увеличение относительной мощности альфа- и бета-ритмов в ряде отведений (p < 0,05) и уменьшение относительной мощности дельта-ритма в лобных отведениях (p < 0,01). При анализе значений спектральных коэффициентов наблюдалось достоверное повышение коэффициента альфа/тета — в центральных (С3, С4) отведениях, коэффициента альфа/дельта в центральных (С3, С4), височных (T4, Т5, T6), затылочных (О1, O2) отведениях, коэффициента альфа/(дельта + тета) — в правом височном (Т6) отведении. Также отмечено увеличение значения коэффициента альфа + бета/дельта + тета в лобных отведениях (Fp2, F3) (рис. 7).
Полученные данные указывают на положительные изменения биоэлектрической активности головного мозга, по-видимому, за счет улучшения церебральной гемодинамики и нейрометаболизма.
Следовательно, результаты проведенных нами исследований свидетельствуют о положительном влиянии препарата Вазонат на клинические симптомы, нейропсихологические и нейрофизиологические показатели у пациентов с дисциркуляторной энцефалопатией. После окончания курса лечения препаратом Вазонат значительно улучшилось общее состояние в обеих группах больных — с синдромом легких и умеренных когнитивных нарушений, а также установлена положительная динамика когнитивного статуса. Полученные данные свидетельствуют о позитивном влиянии препарата Вазонат на кратковременную (визуальную образную, вербальную смысловую и ассоциативную) и долговременную (вербальную смысловую) память, а также зрительно-моторную координацию, концентрацию уровня внимания, счет, беглость речи, оптико-пространственный и конструктивный праксис, способность к обучению. У пациентов с синдромом УКН также значимо улучшилась визуальная долговременная (ассоциативная и зрительно-пространственная) память. Улучшение состояния когнитивных функций в группе больных с синдромом УКН сопровождалось положительными изменениями биоэлектрической активности головного мозга, что свидетельствует об улучшении функционального состояния головного мозга. Побочных реакций у больных, принимавших препарат, не отмечалось.
Полученные результаты свидетельствовали о положительном влиянии препарата Вазонат на церебральную гемодинамику и явились основой для проведения повторных курсов терапии.
Таким образом, позитивная динамика функционального состояния головного мозга у больных пожилого возраста с ДЭ и когнитивными нарушениями под влиянием лечения препаратом Вазонат, по-видимому, связана с улучшением церебральной гемодинамики и нейрометаболизма на фоне применения препарата. Вазонат целесообразно использовать в лечении ДЭ и коррекции когнитивного дефицита у пациентов пожилого возраста с легкими и умеренными сосудистыми когнитивными расстройствами.
Список литературы
1. Бачинская Н.Ю. Синдром умеренных когнитивных нарушений // Здоров’я України. — 2011. — № 2. — С. 3-4.
2. Бачинська Н.Ю., Копчак О.О. Особливості помірних когнітивних порушень у хворих з метаболічним синдромом // Лікарська справа. — 2014. — № 3–4. — С. 37-44.
3. Бачинська Н.Ю., Демченко О.В., Полєтаєва К.М., Холін В.О. Особливості синдрому помірних когнітивних порушень у хворих на гіпертонічну дисциркуляторну енцефалопатію та можливості корекції когнітивних змін препаратом Прамістар // Международный неврологический журнал. — 2012. — № 2(48). — С. 99-106.
4. Бачинська Н.Ю., Полєтаєва К.М., Демченко О.В. та ін. Діагностика легких та помірних когнітивних порушень при старінні: Метод. рекомендації. — К., 2012. — 48 с.
5. Белоусов Ю.Б. Клиническая фармакология и фармакотерапия / Ю.Б. Белоусов, В.С. Моисеев, В.К. Лепахин. — М., 2001. — 768 с.
6. Блейхер В.М. Патопсихологическая диагностика / В.М. Блейхер, И.В. Крук. — К.: Здоров’я, 1986. — 280 с.
7. Волошин П.В., Міщенко Т.С., Лекомцева Є.В. Аналіз поширеності та захворюваності на нервові хвороби в Україні // Международный неврологический журнал. — 2006. — № 3(7). — С. 9-13.
8. Горева А.В., Слободин Т.Н., Головченко Ю.И. Особенности состояния гемодинамики у больных с прогрессирующими когнитивными нарушениями // Український медичний часопис. — 2012. — № 2(88), ІІІ–ІV. — С. 46-50.
9. Дамулин И.В., Захаров В.В. Дисциркуляторная энцефалопатия: Метод. рекомендации / Под ред. Н.Н. Яхно. — М.: РКИ «Северо пресс», 2003. — 32 с.
10. Дамулин И.В. Когнитивные расстройства при цереброваскулярной патологии // Журнал неврологии и психиатрии. — 2009. — Т. 109, № 1. — С. 70-75.
11. Дзяк Л.А., Мизякина Е.В., Цуркаленко Е.С. Когнитивные нарушения у больных с дисциркуляторной энцефалопатией // Практична ангіологія. — 2007. — № 1(6). — С. 63-68.
12. Захаров В.В., Яхно Н.Н. Когнитивные расстройства в пожилом и старческом возрасте: Метод. пособие для врачей. — М., 2005. — 71 с.
13. Зенков Л.Р. Клиническая электроэнцефалография (с элементами эпилептологии): Руководство для врачей / Л.Р. Зенков. — 3-е изд. — М.: МЕДпресс-информ, 2004. — 368 с.
14. Калвиньш И.Я. Милдронат и триметазидин: сходство и различие в их действии / И.Я. Калвиньш. — Рига: ПАО «Grindex», 2001. — С. 5.
15. Кузнецова С.М. Место метаболической терапии в лечении кардионеврологических больных // НейроNews. — 2011. — № 6(33). — С. 63-67.
16. Левин О.С. Патология белого вещества при дисциркуляторной энцефалопатии: диагностические и терапевтические аспекты // Трудный пациент. — 2011. — № 12(9). — С. 16-23.
17. Локшина А.Б., Захаров В.В. Легкие и умеренные когнитивные нарушения при дисциркуляторной энцефалопатии // Неврол. журн. — 2006. — Т. 11, прил. 1. — С. 57-63.
18. Мищенко Т.С., Мищенко В.Н., Лапшина И.А. Оптимизация терапии больных дисциркуляторной энцефалопатией // Український вісник психоневрології. — 2015. — Т. 23, вип. 1. — С. 37-41.
19. Морозова О.Г., Яршевский А.А. Влияние препарата Вазонат на синдром вегетативной дисфункции у пациентов с хроническими церебральными ишемиями / Мат. XV Международной конференции «Основные направления фармакотерапии в неврологии» (г. Судак, 24–26 апреля 2013 г.). — К., 2013. — С. 140-144.
20. Приходько В.Ю., Микропуло И.Р., Масленникова Н.А. Метаболическая терапия в клинической практике: Выбор оптимального препарата // Сучасні препарати та технології. — 2012. — № 1(77). — С. 80-85.
21. Cучасна діагностика і лікування у неврології та психіатрії / За ред. Т.С. Міщенко, В.С. Підкоритова. — К.: ТОВ «Доктор-Медіа», 2008. — 624 с.
22. Фролькис В.В. Старение и нейрогуморальные механизмы — К.: Наукова думка, 1981. — С. 45-56.
23. Хобзей М.К., Зінченко О.М., Міщенко Т.С. Проблема патології нервової системи в Україні та стан вітчизняної неврологічної служби на межі десятиріччя // Здоров’я України. — 2010. — Тематичний номер. — С. 3-4.
24. Шмидт Е.В. Классификация сосудистых поражений головного и спинного мозга // Журн. невропат. психиатр. — 1985. — Т. 85, № 9. — С. 1281-1288.
25. Яхно Н.Н., Локшина А.Б., Захаров В.В. Легкие и умеренные когнитивные расстройства при дисциркуляторной энцефалопатии. // Клин. геронтол. — 2005. — № 11. — С. 38-39.
26. Яхно Н.Н., Захаров В.В., Страчунская Е.Я. Лечение недементных когнитивных нарушений у пациентов с артериальной гипертензией и церебральным атеросклерозом // Неврологический журнал. — 2012. — № 4. — С. 49-55.
27. Barnes D.E., Alexopoulos G.S., Lopez O.L. et al. Depressive symptoms, vascular disease, and mild cognitive impairment: findings from the Cardiovascular Health Study // Arch. Gen. Psychiatry. — 2006. — Vol. 63(3). — Р. 273-279.
28. Bowler J.V. Modern concept of vascular cognitive impairment // Br. Med. Bull. — 2007. — Vol. 83. — P. 291-305.
29. Duara R., Loewenstein D.A., Greig M.T. et al. Pre-MCI and MCI: Neuropsychological, Clinical, and Imaging Features and Progression Rates // Am. J. Geriatr. Psychiatry. — 2011. — Vol. 19(11). — P. 951-960.
30. Dubois В., Slachevsky A. et al. The FAB. A frontal assessment battery at bedside // Neurology. — 2000. — Vol. 55. — P. 1621-1626.
31. Fisher J.P., Hartwich D., Seifert T. еt al. Cerebral perfusion, oxygenation and metabolism during exercise in young and elderly individual // J. Physiol. — 2013. — Vol. 591. — P. 1859-70.
32. Folstein M., Folstein S., McHugh P.R. Mini-mental state: a practical method for grading the cognitive state of patients for the clinician // J. Psychiatr. Res. — 1975. — Vol. 12. — P. 189-198.
33. Gauthier S., Leuzy A., Racine E. et al. Diagnosis and management of Alzheimer’s disease: past, present and future ethical issues // Prog. Neurobiol. — 2013. — Vol. 110. — P. 102-112.
34. Mayeux R., Reitz C., Brickman A.M. et al. Operationalizing diagnostic criteria for Alzheimer’s disease and other age-related cognitive impairment // Alzheimer’s & Dementia: The Journal of the Alzheimer’s Association. — 2011. — Vol. 7. — P. 15-34.
35. Lezak M.D. Neuropsychological assessment. — 4th еd. — Oxford. Oxfordshire: Oxford University Press, 2004. — 1016 p.
36. Reisberg B., Gauthier S. Current evidence for subjective cognitive impairment (SCI) as the pre-mild cognitive impairment (MCI) stage of subsequently manifest Alzheimer’s disease // Int. Psychogeriatr. — 2008. — Vol. 20(1). — P. 1-16.
37. Storand M., Grant E.A., Miller J.P., Morris J.C. Longitudinal course and neuropathologic outcomes in original vs revised MCI and in pre-MCI // Neurology. — 2006. — Vol. 67(3). — P. 467-73.
38. Sunderland T., Hill J.L., Mellow A.M., Lawlor B.A., Gundersheimer J., Newhouse P.A. et al. Clock drawing in Alzheimer’s disease: a novel measure of dementia severity // J. Am. Geriatr. Soc. — 1989. — Vol. 37. — P. 725-9.
39. Sjakste N., Kleschyov A.L., Boucher J.L. et al. Endothelium- and nitric oxide-dependent vasorelaxing activities of gamma-butyrobetaine esters: possible link to the antiischemic activities of mildronate // Eur. J. Pharmacol. — 2004. — Vol. 495. — Р. 67-73.
40. Petersen R.C., Morris J.C. Mild cognitive impairment as a clinical entity and treatment target // Arch. Neurol. — 2005. — Vol. 62. — P. 1160-1163.
41. Petersen R.C., Caracciolo B., Brayne C. et al. Mild cognitive impairment: a concept in evolution // J. Intern. Med. — 2014. — Vol. 275(3). — P. 214-218.
42. Rincon F., Wright C.B. Vascular cognitive impairment // Curr. Opin. Neurol. — 2013. — Vol. 26(1). — P. 29-36.
43. Verdelho A., Madureira S., Moleiro C. et al. White matter changes and diabetes predict cognitive decline in the elderly // Neurology. — 2010. — Vol. 75. — P. 160-167.
44. Yesavage J.A., Brink T.L., Rose T.L. et al. Development and validation of a geriatric depression screening scale: a preliminary report // J. Psychiatr. Res. — 1982. — Vol. 17(1). — P. 37-49.
45. Wechsler D. Wechsler memory scale revised: manual / D. Wechsler. — New York: The psychological corporation Harcourt Brace Jovanovich, Inc., 1987. — 150 p.
/62.jpg)
/63_2.jpg)
/65.jpg)

/63.jpg)
/64.jpg)
/66.jpg)