Статтю опубліковано на с. 26-32
Проблема розсіяного склерозу (РС) є однією із пріоритетних серед захворювань нервової системи. Це зумовлено насамперед зростанням захворюваності на розсіяний склероз у багатьох країнах світу. За даними проведених міжнародних досліджень, нараховується близько 3 мільйонів хворих [1–3]. В Україні зареєстровано понад 20 тис. хворих [2]. Поширеність цього тяжкого захворювання, ураження осіб молодого віку, прогресуючий тип перебігу, що призводить до втрати працездатності й інвалідизації хворих, зумовлюють необхідність удосконалення методів діагностики, патогенетичного та симптоматичного лікування [3].
Розсіяний склероз частіше виявляється серед молодих активних людей і супроводжується різноманітними неврологічними симптомами (розладами зору, руховими, координаторними розладами, парестезіями, втомою, порушенням функції тазових органів), що при несприятливому перебігу призводить до інвалідизації.
Надання допомоги хворим на РС є одним із важливих медико-соціальних завдань. Вона надається як неврологами, так і сімейними лікарями.
Курація хворого на РС ґрунтується насамперед на принципі індивідуалізованого підходу. Лікар повинен бути обізнаним у питаннях сучасної класифікації РС, його клінічних проявах, методах діагностики, а також максимально уявляти, в якому стані знаходиться хворий — у стадії загострення або ремісії, стабілізації, вторинного прогресування, водночас правильно оцінювати результати магнітно-резонансного обстеження головного та спинного мозку пацієнта.
Діагноз РС можна поставити на основі анамнезу, неврологічного обстеження, показників ліквору та магнітно-резонансної томографії (МРТ) головного та спинного мозку. На етапі ранньої діагностики розсіяного склерозу хворі повинні спостерігатись неврологом, який має спеціальну підготовку з ведення хворих із демієлінізуючими захворюваннями нервової системи. Це особливо важливо, тому що є біля 50 захворювань, що мають подібні клінічні ознаки.
На сьогодні застосовується наступна діагностична схема для лікаря-невролога, який стикається із хворим із підозрою на РС:
1) точний і ретельний збір анамнезу;
2) здійснення кваліфікованої МРТ із не менш кваліфікованою нейрорадіологічною інтерпретацією;
3) аналіз ліквору на самому початку діагностичного пошуку — це інколи допомагає встановити справжню причину хвороби або засумніватися в основному діагнозі;
4) проведення серії лабораторних тестів для виключення альтернативних діагнозів;
5) у деяких випадках при серйозному погіршенні клінічної картини рекомендується біопсія мозку.
З часу винайдення МРТ у 1980 р. важко недооцінювати роль цього методу в діагностиці та оцінці лікування РС. У комбінації з характерними симптомами МРТ сприяє ранній і чутливій діагностиці. МРТ відіграє значну роль щодо оцінки ефективності лікування у клінічних дослідженнях, а також дозволяє оцінити ефективність лікування в кожному індивідуальному випадку [4–6].
Вогнища демієлінізації визначаються в Т2-режимі як гіперінтенсивні, виявляються у 95 % випадків вірогідного розсіяного склерозу. Якщо ж MPT виявляє наявність вогнищ у хворих з імовірним розсіяним склерозом (у разі клінічно ізольованого синдрому), у 65 % випадків вони є предикторами розвитку вірогідного розсіяного склерозу протягом найближчих 5 років [4].
Розмір типових для розсіяного склерозу вогнищ зазвичай становить 3 мм і більше. Ці вогнища можна виявити перивентрикулярно, у мозолястому тілі (з характерним за формою поширенням вогнищ з нього в білу речовину — «пальці Доусона»), у стовбурі мозку, мозочку, спинному мозку і в зорових нервах [4].
Виявлення гіперінтенсивних вогнищ у декількох зонах центральної нервової системи (ЦНС) в Т2-режимі відображає багатовогнищевість неврологічного ураження при розсіяному склерозі. Найбільш характерний розподіл вогнищ розсіяного склерозу в головному мозку при вірогідному розсіяному склерозі (за даними MPT) такий: у перивентрикулярному просторі — 98 %, у мозолястому тілі — 97 %, ізольовані вогнища в білій речовині часток мозку — 93 %, у мозочку — 57 %, у варолієвому мості — 52 %, у довгастому мозку — 36 %, у базальних гангліях — 8 % [6].
При MPT із контрастуванням гадолінієм у білій речовині можуть виявлятися ділянки підвищеної інтенсивності в результаті проходження контрастної речовини через порушений гематоенцефалічний бар’єр. Тимчасове підвищення інтенсивності на Т1-зважених зображеннях із гадолінієм зазвичай супроводжує або передує появі нових вогнищ на Т2-зважених зображеннях [4].
Згідно з сучасним уявленням, при ремітуючому та вторинно-прогресуючому розсіяному склерозі активність хвороби, що визначається за даними МРТ, приблизно в 10 разів перевищує активність процесу за клінічними ознаками, тобто тільки 1 з 10 вогнищ, що виявляються при МРТ, проявляється клінічно. Імовірно, це пояснюється тим, що не всі вогнища розташовуються та клінічно виявляються в зонах ураження мозку [7].
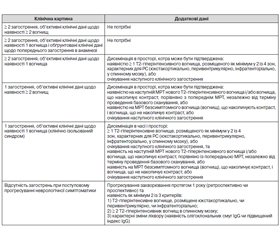
Діагностику РС проводять відповідно до діагностичних критеріїв McDonalds (2010) [8], що включають в себе дані параклінічних методів обстеження, зокрема МРТ (табл. 1).
На додаток до вищесказаного, сучасні методи виявлення імунологічних розладів при дослідженні ліквору (олігоклональні смуги, що відображають посилений інтратекальний синтез IgG) виділені в окрему схему лабораторної діагностики РС (табл. 1).
Проводячи аналіз Т2-вогнищ за даними МРТ, необхідно звертати увагу на їх локалізацію. Для розсіяного склерозу характерне перивентрикулярне, юкстакортикальне, інфратенторіальне розташування, а також у мозолястому тілі. Кількість вогнищ і зон локалізації для підтвердження «розсіювання в просторі» в оновлених критеріях Мак-Дональда (2010) зменшилась: при наявності ≥ 1 T2-вогнища у ≥ 2 топографічних зонах (перивентрикулярно, інфра-, юкстакортикально і в спинному мозку, який вперше включений до таких зон) критерій «розсіювання у просторі» підтверджується [8]. Але існує дисоціація клінічних і МРТ-проявів активності захворювання. Так, вогнища, діагностовані на МРТ, часто не супроводжуються клінічними симптомами. Також клінічно безсимптомні гострі ураження є частим явищем, що спостерігається у 2–15 разів частіше, ніж рецидиви. З іншого боку, клінічні симптоми загострення можуть спостерігатися без змін на МРТ [6].
Однією з основних ознак активності захворювання є реєстрація на Т1-зважених зображеннях після конт–растування ознак накопичення контрастної речовини. Такі вогнища можна назвати активними. Активні бляшки накопичують контрастну речовину, відображаючи проникність гематоенцефалічного бар’єру, що гістологічно корелюють з міграцією Т-клітин. Наявність Gd-накопичуючого вогнища у будь-який час достатня для підтвердження критерію «розсіювання в часі» згідно з критеріями Мак-Дональда (2010) [8].
Важливим у веденні хворих на РС є моніторинг клініко-візуалізаційної картини, нові томограми порівнюють з попередніми. Необхідно аналізувати локалізацію та кількість вогнищ, які визначались до дослідження в даний час, тому що деякі «старі» вогнища можуть зменшуватися в розмірах і зникати. Потім оцінюють стан нових бляшок, чи накопичують вони контраст, яка форма розподілу контрасту в самій бляшці. Із отриманих даних роблять висновок про ступінь активності процесу у хворого під час обстеження. Активність демієлінізуючого процесу за даними МРТ в 2–15 разів перевищує клінічну [5, 6, 9].
Тривалість накопичення гадолінію показує час, протягом якого вогнища мають високий рівень запальної активності з проникненням імунних клітин до ЦНС. Середня тривалість Gd-накопичення становить 3,1 тижня [9]. Після закінчення автоімунного запалення 40 % нових Т2-вогнищ залишаються постійно гіпоінтенсивними на Т1-зображеннях. Їх називають «чорні дірки». Також «чорні дірки» можна назвати індикаторами більш тривалого і глибокого руйнування нервової тканини, маркерами аксонального дефіциту. Кількість і розміри Т1-зважених вогнищ («чорних дірок») за період спостереження більш специфічні для деструкції нервового волокна, аксонального дефіциту і характеристики активності демієлінізуючого процесу [6, 9].
Додатковими методами є електрофізіологічні: електроміографія, реєстрація викликаних потенціалів. Ці методи дають інформацію в динаміці, згідно з їх показниками є можливість визначати рівень і ступінь ураження провідних шляхів нервової системи. У процесі лікування хворих на РС з симптомами ураження зорового аналізатора доцільне постійне (2–4 рази на рік) спостереження у офтальмолога.
Після своєчасної постановки діагнозу розсіяного склерозу лікар-невролог розробляє індивідуальне ведення хворого на РС, ґрунтуючись на наступних принципах надання спеціалізованої медичної допомоги. Крім лікаря-невролога, в лікуванні хворих на РС беруть участь офтальмолог, сімейний лікар, уролог, психіатр, фізіотерапевт, а також методисти лікувальної фізкультури, масажисти, медичні сестри, які мають спеціальну підготовку.
Хворі на РС можуть спостерігатись в умовах амбулаторно-поліклінічного рівня, на цьому етапі проводяться:
— діагностика РС при первинному зверненні у хворих із легким ступенем неврологічних розладів;
— тривале лікування хворих інтерферонами-бета, глатирамеру ацетатом і моніторинг лабораторних показників на фоні терапії;
— курси симптоматичної терапії та реабілітації хворих на РС;
— спостереження за пацієнтом протягом усього періоду захворювання.
Стаціонарне лікування хворих із РС здійснюється у спеціалізованих неврологічних відділеннях.
У стаціонарі діагностика РС при первинному зверненні проводиться:
— хворим із помірно вираженими неврологічними порушеннями, що ускладнюють їх функціональну активність та можливість ходьби;
— усім хворим із тяжкими неврологічними порушеннями у зв’язку з ризиком розвитку порушень життєво важливих функцій, що призводять до летального кінця.
Обов’язковій госпіталізації підлягають усі хворі на РС із загостренням при будь-якій формі захворювання (ремітуючій, первинно- або вторинно-прогресуючій).
Лікування глюкокортикостероїдами, цитостатиками, імуноглобуліном G здійснюється тільки в стаціонарних умовах. Госпіталізація показана також у випадках початку терапії інтерферонами-бета, глатирамеру ацетатом для оцінки переносимості засобів і побічних реакцій, а також у випадках непереносимості або неефективності імуномодулюючих препаратів (інтерферонів-бета, глатирамеру ацетату) і необхідності зміни терапії. Клінічний досвід доводить, що госпіталізація показана при лікуванні ботуліновим токсином.
Основні завдання лікувальної тактики хворих на РС:
1) зняти прояви загострення захворювання;
2) впливати на осередки автоімунного запалення, стимулювати розвиток або посилення компенсаторно-пристосувальних механізмів;
3) запобігти розвитку нових загострень, або віддалити їх у часі, або зменшити їх вираженість;
4) намагатися впливати на симптоми, що утруднюють можливість виконувати роботу, вести звичний спосіб життя, — так зване симптоматичне лікування;
5) вибрати заходи, що дозволяють хворому пристосуватися до наявних наслідків хвороби, щоб максимально полегшити його життя. І хоча ця сфера більшою мірою соціальна, ніж медична, найчастіше хворий за порадою з цього приводу звертається до лікаря, і саме лікар визначає час для виконання тих чи інших рекомендацій, виходячи з можливостей хворого і прогнозу захворювання.
Одним із важливих принципів курації хворих на розсіяний склероз є вміння лікаря-невролога віддиференціювати загострення РС від псевдозагострення. Згідно з критеріями McDonalds (2010), загостренням (або екзацербацією) вважають появу нового чи погіршення раніше стабільного неврологічного порушення, що гостро розвинулося, та на підставі клініко-лабораторних досліджень встановлено причину ураження, що має запальний і демієлінізуючий характер [8, 10].
Нові неврологічні симптоми або старі, що посилилися, повинні супроводжуватися об’єктивним неврологічним погіршенням, для оцінки якого найчастіше використовують шкалу функціональних систем (ФС) (Functional System Score — FSS) та розширену шкалу оцінки інвалідизації (Expanded Disability Status Scale — EDSS), а саме — збільшення за шкалою EDSS на 0,5–2 бали по одній або на 1 бал по ≥ 2 ФС [11].
Зміна за ФС має відповідати симптомам, що з’явились у пацієнта, зберігаються ≥ 24 год та не пов’язані з такими клінічними факторами, як лихоманка, інфекції, травми, реакції на лікарські препарати; їм має передувати не менше ніж 30-денний період стабільного перебігу захворювання [12].
Типові загострення РС включають: одно- чи двобічне (рідше) порушення зору, спричинене невритом зорового нерва; сенсорні чи моторні порушення, часто внаслідок ураження спинного мозку; стовбурові симптоми, що проявляються нестійкою диплопією, онімінням обличчя, атаксією. Загострення можуть бути монофокальними або мультифокальними і зазвичай супроводжуються змінами неврологічного статусу за шкалою EDSS на ≥ 0,5 бала [3].
Рецидив РС вважають наявним, якщо у пацієнта при клінічному обстеженні виявляють зміни неврологічного статусу за EDSS (моторні, сенсорні, когнітивні), виключені супутні захворювання і на МРТ видно активні вогнища. Екзацербація зазвичай з’являється та розвивається протягом декількох днів, при цьому середня тривалість рецидиву становить 1–4 тиж. Рецидив у більшості випадків не потребує невідкладної медичної допомоги. При клінічному аналізі ми маємо переконливі докази щодо підвищення ризику загострення РС протягом декількох тижнів після інфекційного епізоду; вважають, що інфекція може провокувати загострення РС.
Водночас важливо відрізняти справжню необоротність неврологічних порушень при загостренні РС від псевдорецидиву (ПР) [13]. ПР — тимчасове погіршення неврологічного дефіциту внаслідок метаболічного чи фізіологічного фактора, наприклад впливу тепла (також відомий як uhthoff’s phenomenon), лихоманки чи запальних змін, пов’язаних з інфекцією. ПР зазвичай є реактивацією попереднього чи вже існуючого симптому, а не новою неврологічною подією. За даними систематичного огляду встановлено, що у 40 % пацієнтів, госпіталізованих із загостренням РС, у подальшому гострий рецидив (ГР) виключався. Цікаво, що у більшості з цих пацієнтів ідентифіковано інфекцію сечових шляхів [14, 15]. Клінічний досвід дає нам змогу вміти аналізувати та виключати вплив хронічних симптомів РС, таких як депресія, втома, хронічний біль та розлади сну, на тимчасове погіршення самопочуття хворого [16].
Однією з проблем у диференційній діагностиці справжнього загострення з ПР є те, що інфекції також можуть викликати справжні рецидиви, у таких випадках симптоми не покращуються з контролем температури тіла або інфекції. Неправильно діагностований рецидив може мати глибокі негативні наслідки для результатів лікування. Наприклад, застосування кортикостероїдів, стандартної терапії для лікування ГР може призводити до розвитку або погіршення існуючих у хворого інфекцій, у тому числі й фатальних. Для запобігання таким ускладненням необхідно якомога точніше діагностувати ГР та зберігати пильність щодо скринінгу інфекції [17, 18].
Дія сучасних засобів медикаментозної терапії РС спрямована на попередження активації патологічного процесу в майбутньому (превентивне лікування), уповільнення прогресування нейродегенерації та зменшення вираженості симптомів захворювання.
Основні принципи медикаментозної терапії:
— ранній початок терапії — при підтвердженому діагнозі слід призначати лікування, не чекаючи наступного загострення;
— тривала і безперервна терапія — приймати препарати слід так довго, як пацієнт може собі це дозволити;
— індивідуальний підбір препаратів і їх раціональне комбінування;
— перевагу слід надавати препаратам із селективним впливом на механізми розвитку патологічного процесу при РС.
Останніми роками значно розширився спектр терапії РС. На сьогодні загальноприйнятими схемами лікування загострень є пульс-терапія метилпреднізолоном — 500–1000 мг на фізіологічному розчині 400,0 внутрішньовенно (в/в) краплинно впродовж 3–5 днів, або пульс-дози дексаметазону — 16 мг на фізіологічному розчині 100,0 протягом 1–3 днів, 12 мг на фізіологічному розчині 4–6 днів в/в краплинно, 8 мг на фізіологічному розчині 7–9 днів в/в краплинно, потім 4 мг внутрішньом’язово 10–11 днів.
У даний час на передній план у профілактиці загострень виходить застосування імуномодуляторів. До них належать бета-інтерферон, глатирамеру ацетат і внутрішньовенні імуноглобуліни [19].
З появою інтерферону-бета почалася нова ера в лікуванні пацієнтів із РС, а саме — хворобомодифікуюча терапія (ХМТ), яка дозволяє знизити частоту виникнення рецидивів і нових вогнищ на МРТ [19, 20]. Крім того, результати численних клінічних випробувань свідчать, що ранній початок ХМТ затримує розвиток інвалідності [20]. Однак навіть із застосуванням ХМТ у хворих можуть виникати гострі рецидиви РС.
Водночас необхідно зазначити, що при лікуванні загострень із незначними проявами РС призначення антиоксидантів, антиагрегантів, ангіопротекторів обумовлено очевидною біологічною доцільністю. Такі засоби (трентал, курантил, вітамін С, вітамін Е, ноотропи, препарати альфа-ліпоєвої кислоти, цитофлавін та ін.) застосовуються за загальноприйнятими терапевтичними схемами [21, 22].
Результатом багаторічних досліджень стала поява низки імуномодулюючих препаратів (бета-інтерферонів, глатирамеру ацетату), що реально знижують частоту загострень при ремітуючому перебігу РС. Результатом всесвітніх клінічних випробувань, проведених подвійним сліпим методом, стало зниження частоти загострень РС у середньому на 30 % при регулярному використанні цих препаратів. Крім того, вони різною мірою сповільнюють швидкість наростання необоротних порушень, що призводять до інвалідності.
Позитивні клінічні дані щодо лікування РС копаксоном, препаратами бета-інтерферону (бетаферон, ребіф, авонекс), як правило, збігаються з даними МРТ, що показують вірогідне зниження кількості активних вогнищ і зменшення загального об’єму вогнищевого ураження головного мозку. Подібний ефект був відзначений також у препаратів, що містять великі дози імуноглобулінів для внутрішньовенного введення.
На сьогодні в Україні крім препаратів, що змінюють перебіг розсіяного склерозу, І лінії (бета-інтерферони, глатирамеру ацетат) є засоби ІІ лінії (мітоксантрон, наталізумаб, фінголімод). Серед них наталізумаб і фінголімод отримали дозвіл на застосування в клінічній практиці у 2009 та 2011 роках відповідно. Успішно завершені клінічні випробування 5 нових препаратів, що будуть дозволені у комплексному лікуванні РС в Україні найближчим часом (терифлуномід, лаквінімод, диметил фурамат, алемтузумаб, даклізумаб) [19, 23].
Для профілактики загострень хворим на РС рекомендується уникати інфекційних захворювань (при їх розвитку пройти повний курс лікування бажано на постільному режимі), фізичних перевантажень, інсоляції. Хворим не показані теплові процедури, бальнеотерапія.
Отже, терапія РС полягає у своєчасному лікуванні загострень, призначенні препаратів, що уповільнюють прогресування хвороби шляхом попередження загострень, поетапному проведенні всебічної симптоматичної терапії та нейрореабілітації. Але важливим етапом ведення хворих на РС є застосування симптоматичної терапії.
Симптоматичне лікування розсіяного склерозу умовно можна поділити на 2 групи: 1) медикаментозна терапія; 2) методи фiзiотерапiї, фiзична та психологiчна реабiлiтацiя, транскортикальна стимуляція мозку.
У рамках медикаментозного симптоматичного лiкування корекцiя спастичностi, симптому втоми, координаторних порушень, корекцiя нейропсихологiчних розладiв, розладiв функцiї тазових органів, лікування чутливих пароксизмальних синдромів [24]. У табл. 2 наведені лікарські засоби, що застосовуються при симптоматичному лікуванні розсіяного склерозу.
Правильно підібрана симптоматична терапія не лише покращує клінічний стан, якість життя хворих, але і попереджає розвиток ускладнень РС, особливо при вторинно-прогресуючому перебігу хвороби, таких як інфекційні захворювання, порушення вегетативних функцій і периферичного кровообігу, утворення контрактур і пролежнів.
Для збереження залишених функцiй застосовують методи вiдновлювальної нейрореабiлiтацiйної терапiї. Реабiлiтацiя пацiєнтiв з РС повинна бути направлена на зниження iнвалiдизацiї, запобігання ускладненням (контрактури, пролежні), поліпшення самообслуговування, зниження рiвня соцiaльної дезадаптацiї та поліпшення якостi життя [25].
Фізична реабілітація хворих включає лікувальну фізкультуру, масаж, фізіотерапію; психічна реабілітація — психотерапію, психоаналіз, психологічну адаптацію, працетерапію; когнітивна реабілітація — комплекс вправ, що допомагають пацієнтам краще справлятися з наявними когнітивними порушеннями чи поліпшувати специфічні когнітивні вміння. Існуючі програми когнітивної реабілітації спрямовані на поліпшення уваги, здатності до навчання, комунікативних навичок і корекцію порушень пам’яті. Нейропсихологічна реабілітація позитивно впливає на настрій і соціальну поведінку, а відповідно, і на соціальні зв’язки та якість життя.
Нові досягнення симптоматичного лікування РС, антибактеріальної терапії інфекційних ускладнень, патогенетичного лікування (меншою мірою) призвели до збільшення середньої тривалості життя в середньому більше 40 років з моменту встановлення діагнозу «розсіяний склероз» до смерті внаслідок цього захворювання. У всьому світі популяція хворих із РС стала значно старшою.
Таким чином, успішна курація пацієнтів із РС полягає у сучасному комплексному підході до лікування, що включає своєчасне адекватне лікування загострень, призначення імуномодулюючих препаратів, поступове проведення симптоматичної терапії, заснованої на мультидисциплінарному підході, і психофізичної реабілітації.
Проблема розсіяного склерозу далека від вирішення, але досягнення останніх років у патогенетичній, симптоматичній і реабілітаційній терапії дозволити виключити розсіяний склероз із списка некурабельних неврологічних захворювань.
Список литературы
1. Гусев Е.И., Бойко А.Н. Рассеянный склероз: от изучения иммунопатогенеза к новым методам лечения. — М.: ООО «Губернская медицина», 2001. — 128 с.
2. Міщенко Т.С., Шульга О.Д., Бобрик Н.В., Шульга Л.А. Розсіяний склероз: глобальні перспективи // Укр. мед. часопис. — 2014. — № 3(101), V/VI. — С. 84-87.
3. Рассеянный склероз. Клиническое руководство / Под ред. Гусева Е.И., Завалишина И.А., Бойко А.Н. — М.: Реал Тайм, 2011. — 528 с.
4. Дзяк Л.А. Рассеянный склероз: современные возможности диагностики // Neuronews. — 2013. — № 7(52). — С. 35-40.
5. Волошина Н.П., Гапонов И.К. Возможности магнитно-резонансной томографии в диагностике и прогнозе течения рассеянного склероза в зависимости от пола и возраста больных // Український вісник психоневрології. — 2010. — Т. 2, № 3(64). — С. 19-23.
6. Фломин Ю.В., Костюковская А.Е., Куцын В.Н. Использование МРТ при рассеянном склерозе // Нейрон-ревю. — 2008. — № 6. — С. 1-12.
7. Inglese M., Grossman R.I., Filippi M. Magnetic Resonance Imaging Monitoring of Multiple Sclerosis Lesion Evolution // J. of Neuroimaging. — 2006. — Vol. 15(4 Suppl.). — 22S-29S.
8. Polman C.H., Reingold S.C., Banwell B. et al. Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria // Ann. Neurol. — 2011. — № 69(2). — P. 292-302.
9. Fillipi M., Rocca M.A., Comi J. The use of quantative magnetic-resonance-based techniques to monitor the evolution of multiple sclerosis // Lancet Neurology. — 2003. — № 2. — Р. 731-733.
10. Cоколова Л.И., Кобысь Т.А., Домрес Н.В. Современные критерии Мак-Дональда в диагностике рассеянного склероза // Международный неврологический журнал. — 2012. — № 7(53). — С. 9-12.
11. Kurtzke J.F. Rating neurological impairment in multiple sclerosis: an expanded disability status scale (EDSS) // Neuro-logy. — 1983. — № 3. — P. 1444-1452.
12. Thrower B.W. Relapse management in multiple sclerosis // Neurologist. — 2009. — Vol. 15. — P. 1-5.
13. Vollmer T. The natural history of relapses in multiple sclerosis // J. Neurol. Sci. — 2007. — Vol. 256. — P. 5-13.
14. Repovic P., Lublin F.D. Treatment of multiple sclerosis exacerbations // Neurol. Clin. — 2011. — Vol. 29. — P. 389-400.
15. Alcauskas M., Krieger S., Oynhausen S. et al. Diagnostic accuracy of the emergency department in the multiple sclerosis population (data from the Mount Sinai Resource Utilization in MSProject [RESUMS]). — 62nd American Academy of Neurology Annual Meeting. — 2010 April 10–17. — Toronto,Canada.
16. Freedman M.S., Patry D.G., Grand’Maison F. et al. Treatment optimization in multiple sclerosis // Can. J. Neurol. Sci. — 2004. — Vol. 31. — P. 157-168.
17. Rakusa M., Murphy O., McIntyre L. et al. Testing for urinary tract colonisation beforehigh-dose corticosteroid treatment in acute multiple sclerosis relapses: prospective algorithm validation // Eur. J. Neurol. — 2013. — Vol. 20(3). — P. 448-452.
18. Школьник В.М., Бараненко О.М., Погорелов О.В. Кальбус О.І. Сучасні підходи до лікування при загостренні розсіяного склерозу з позицій доказової медицини // Укр. мед. часопис. — 2014. — № 4. — С. 108-111.
19. Новая эра в изучении рассеянного склероза: взгляды на терапевтические подходы: Пер. с англ. / Ed. by T. Ziemsen, M. Tintore. — СвитГрупп-пресс, 2012. — 94 с.
20. Karusis D., Biermann L.D., Bohlega S., Boiko A., Chofflon M., Fazekas F., Freedman M., Gebeily S., Gouider R., Havrdova E., Jakab G., Karabudak R., Miller A. A recommended treatment algorithm in relapsing multiple sclerosis: report of an international consensus meeting // Eur. J. Neurol. — 2006. — № 13. — P. 61-71.
21. Mark S., Selchen D., Arnold D., Prat A., Banwell B., Yeung M., Morgenthau D., Lapierre Y. Treatment Optimization in MS: Canadian MS Working Group Updated Recommendations // The Canadian Journal of Neurological scienice. — 2013. — Vol. 40, № 3. — P. 307-323.
22. Одинак М.М., Бисага Г.Н., Зарубина И.В. Новые подходы к антиоксидантной терапии при рассеянном склерозе // Журнал неврологии и психиатрии им. С.С. Корсакова. — 2002. — № 1. — С. 72-75.
23. Соколова Л.І., Гудзенко Г.В., Лобанова І.С., Кобись Т.О., Горбенко В.Ю. Застосування препаратів альфа-ліпоєвої кислоти та вітамінів групи В у лікування хворих на розсіяний склероз // Український неврологічний журнал. — 2012. — № 2. — С. 72-78.
24. Евтушенко С.К., Деревянко И.Н. Современные подходы к лечению рассеянного склероза: достижения, разочарования, надежды (ІІ сообщение) // Международный неврологический журнал. — 2012. — № 2(6). — С. 23-35.
25. Brown T.R., Kraft G.H. Exersice and rehabilitation for individuals with multiple sclerosis // Phys. Med. Rehabil. Clin. N. — 2005. — № 16. — P. 455-513.

/28.jpg)
/32.jpg)