Статья опубликована на с. 10-15
Актуальность проблемы
В последние десятилетия во всем мире отмечается неуклонный рост количества больных с абсцессами печени (АП), в 20–30 % случаев развиваются угрожающие жизни осложнения, которые могут привести к летальному исходу [1]. По данным разных авторов, несмотря на прогресс в диагностике и лечении, летальность при АП может достигать 40 % [2, 3].
На сегодняшний день применяются пункционные, дренажные и резекционные методы хирургического лечения. Многие вопросы, касающиеся показаний к каждому из перечисленных методов, все еще остаются дискутабельными [4–6].
Материал и методы
В работе обобщен опыт хирургического лечения 194 больных с одиночными бактериальными абсцессами печени за период 1998–2015 гг. Анализируя случаи, в которых имелась возможность проследить эволюцию гнойника от стадии инфильтрации до абсцедирования, мы констатировали, что сначала в каком-то участке печени образуется зона инфильтрации, подвергающаяся размягчению, затем формируется несколько небольших жидкостных образований, которые потом сливаются в один гнойник. В этом аспекте патогенеза логичнее говорить о едином гнойно-воспалительном процессе в определенном участке печени, который при отсутствии адекватного лечения в дальнейшем может превратиться в гигантский гнойник. Поэтому одиночными мы считали абсцессы, расположенные в одной доле или в смежных сегментах в пределах одного воспалительного фокуса. Более правильно в таких случаях говорить о многокамерном абсцессе, а не о нескольких самостоятельных гнойниках. При этом зачастую во время лапаротомной ревизии или при выполнении фистулографии через дренаж два расположенных рядом гнойника оказывались соединенными каналом по типу «запонки». Такая классификация абсцессов печени объединяет пациентов в группу для единого хирургического подхода — ликвидации гнойной полости, что является основной целью оперативного вмешательства. Совершенно другой подход к пациентам с множественными и милиарными (равномерно разбросанными в разных сегментах и долях печени) гнойниками, как правило, холангиогенного генеза. Здесь первостепенно корригируется проходимость желчевыводящих протоков и через протоковую систему осуществляется дренаж. Такие пациенты в настоящее исследование не включались.
Одиночными абсцессами печени заболевали чаще женщины, их было 108 (55,7 %), мужчин — 86 (44,3 %). Возраст пациентов колебался в пределах от 17 до 84 лет и в среднем составил 56 лет.
Патогенетически абсцессы разделились на посттравматические — 22 (11,3 %), холангиогенные — 25 (12,9 %), метастатические (гематогенные) — 17 (8,8 %), контактные — 16 (8,2 %), нагноение опухолей — 5 (2,6 %), инфицированные паразитарные кисты — 23 (11,9 %), инфицированные непаразитарные кисты — 17 (8,8 %), криптогенные — 69 (35,5 %).
Значительно чаще поражалась правая доля — у 137 (70,7 %), а в ней чаще других страдал седьмой сегмент: I — у 3 (1,5 %), II — у 13 (6,7 %), III — у 22 (11,3 %), IV — у 19 (9,8 %), V — у 35 (18,1 %), VI — у 40 (20,6 %), VII — у 47 (24,3 %) и VIII — у 15 (7,7 %). Слабость VII сегмента печени при инфицировании мы объясняем особенностями его кровоснабжения по системе воротной вены. Правая ветвь воротной вены большего диаметра, чем левая, и по направлению является продолжением основного ствола.
Объемы абсцессов колебались в широких пределах: менее 60 мл — у 51 (26,4 %) больного, 60–200 мл — у 91 (46,9 %), 201–500 мл — у 22 (11,4 %) и более 500 мл — у 28 (14,4 %).
Длительность заболевания до поступления в клинику также варьировала: до 1 недели — у 29 (14,9 %), до 1 месяца — у 90 (46,5 %), до 3 месяцев — у 35 (18,0 %) и более 3 месяцев (хронические абсцессы) — у 40 (20,6 %) больных.
Основными жалобами при поступлении были общая слабость (у всех больных), в разной степени повышение температуры до 37,5–39 °C — у 124 (72,9 %), нередко с ознобами, и ноющие боли в правом подреберье или эпигастрии — у 160 (94,1 %) пациентов.
Почти половина пациентов страдали сопутствующими заболеваниями, которые либо стали причиной абсцесса, либо оказывали отягощающее влияние на его течение: желчнокаменной болезнью — 23 (11,9 %) пациента, сахарным диабетом — 30 (15,5 %), циррозом печени — 5 (2,6 %), поликистозом печени — 7 (3,6 %), гнойным пиелонефритом — 7 (3,6 %). Желтуха встретилась у 39 (20,1 %) больных, преимущественно при холангиогенных абсцессах, общий билирубин при этом колебался от 25 до 280 мкмоль/л.
При бактериологическом исследовании содержимого абсцессов печени преобладающими возбудителями были граммотрицательные микроорганизмы — кишечная палочка, клебсиелла, реже встречались стафилококк, стрептококк и протей.
Во всех случаях мы придерживались активной хирургической тактики — все больные оперированы, антибиотикотерапия была фоном для выполнения хирургических процедур. До получения идентифицированных культур из гноя назначалась эмпирическая антибиотикотерапия препаратами широкого спектра действия (для покрытия грамотрицательных и грамположительных аэробов и анаэробов). Кроме этого, всем больным проводилось медикаментозное лечение, включающее инфузионную (коррекция водно-электролитных нарушений) и гепатотропную терапию.
Исследуемым 194 больным выполнена 221 операция (табл. 1), то есть 26 (13,4 %) пациентов оперированы более одного раза: 20 (10,3 %) оперированы дважды, 5 (2,3 %) трижды и одна больная — 4 (0,5 %) раза. Каждая отдельная манипуляция, включая пункционно-аспирационную санацию, считалась отдельной операцией.
Время пребывания в стационаре у выписанных больных колебалось от 8 до 64 суток и в среднем составило 22 дня. Умерло 10 (5,2 %) пациентов. Причинами смерти стали гнойный холангит, интоксикация, печеночная, а затем и полиорганная недостаточность, тромбоэмболия легочной артерии (ТЭЛА).
В процессе лечения возникали осложнения со стороны как грудной клетки — 102 (52,5 %), так и брюшной полости — 48 (24,7 %) (табл. 2).
У 7 умерших был холангиогенный абсцесс с желтухой, холангитом и прогрессирующей печеночной недостаточностью (у двух возникла ТЭЛА), в трех случаях причина смерти связана с декомпенсацией состояния организма по соматическим органам. Развитие перитонита в двух случаях произошло вследствие самопроизвольного вскрытия абсцесса в брюшную полость до поступления в клинику, пациенты выздоровели; еще в двух случаях перитонит был следствием перфорации острой язвы и хрониосепсиса — случаи закончились смертью.
В остальных случаях осложнения не потребовали каких-либо дополнительных оперативных пособий и были ликвидированы медикаментозным лечением.
Довольно частым осложнением лечения абсцессов печени были неполные наружные желчные свищи — 8 (4,7 %) случаев. У 5 пациентов они закрылись самостоятельно, у одного потребовали дополнительного дренирования биломы, еще у одного — выполнения эндоскопической папиллосфинктеротомии.
Результаты и обсуждение
Проведен анализ преимуществ и недостатков аспирационных, дренирующих и резекционных методов лечения одиночных абсцессов печени по следующим параметрам: травматичность, персистенция остаточной гнойной полости, подтекание содержимого гнойника в брюшную полость, повторные операции, длительность пребывания в стационаре.
Пункционно-аспирационная санация выполнялась 44 раза (19,9 % всех операций) под контролем ультразвукового исследования (УЗИ) под местной анестезией. После максимальной аспирации содержимого и бакпосева полость санировалась раствором антисептика (чаще декасаном). Изначально пункция с аспирацией применена у 39 (20,1 %) больных с размерами гнойника не более 7–8 см в диаметре при их локализации в вентральных сегментах печени. Но желаемый лечебный эффект после первой пункционной санации наступил только у половины — 19 (48,7 %) больных, после двух санаций — еще у 5 (12,8 %). У 6 (15,4 %) пациентов после двух санаций и в связи с отсутствием какого-либо положительного эффекта выполнено дренирование гнойника, которое в дальнейшем привело к выздоровлению. Умер 1 больной вследствие прогрессирующего холангита после двух аспирационных санаций холангиогенного абсцесса V сегмента печени. Лапаротомную коррекцию выполнять было нельзя в связи с тяжестью состояния больного.
Случаи неэффективности пункционно-аспирационной санации при ее вынужденном применении встретились у пациентов с многокамерными холангиогенными абсцессами дорсальной локализации и выраженной капсулой, а также при длительности заболевания более месяца.
Высокая эффективность метода пункционно-аспирационной санации даже при его однократном применении отмечена у больных с продолжительностью заболевания до месяца, с гнойником до 5 см, без выраженной капсулы и криптогенным по патогенезу.
Дренирование абсцесса выполнялось 124 раза 115 больным четырьмя способами: под контролем УЗИ — 56 (48,7 %) пациентам, лапароскопически — 38 (33,0 %), под контролем ангиографа — 2 (1,7 %) и транслапаротомным доступом — 28 (24,3 %).
Положительный эффект наступил только у 105 (91,3 %) больных, остальным потребовалась переустановка дренажа под УЗИ-контролем, лапароскопическим или лапаротомным доступом. Неэффективным дренирование было при многокамерности или наличии в полости гнойника секвестров. Этим больным далее были выполнены резекции печени.
Показанием для лапаротомной санации и дренирования стали: уже развившийся перитонит вследствие самопроизвольного вскрытия абсцесса в брюшную полость (2 пациента), сложная для мини-инвазивных методов дорсальная локализация гнойников, неэффективность мини-инвазивных методов и непереносимость при наличии показаний к резекционным операциям. Преимущество лапаротомного доступа в том, что через него может быть выполнена любая операция. В то же время операция по поводу любого гнойника печени может закончиться лапаротомной санацией и дренированием.
Длительность функционирования дренажа находилась в пределах 5–28 суток и в среднем составила 12,0 ± 5,2 суток. За это время остаточная полость уменьшалась примерно вдвое. После дренирования в 3 случаях наблюдалось формирование наружных желчных свищей.
Резекция печени выполнена 53 (27,3 %) больным, в 9 (17,0 %) случаях — лапароскопически. Все операции были эффективными и привели к выздоровлению. Доступом при резекционных методах была верхнесрединная лапаротомия, иногда J-образный разрез. У 15 пациентов резекция была экономной, типа фенестрации, у 13 выполнялась перицистэктомия в связи с нагноившимися паразитарными кистами, у 25 пациентов произведены сегмент- или гемигепатэктомии. Осложнениями стали: нагноение резекционной раны печени (7) и наружный желчный свищ (4).
Пункционно-аспирационный метод показал свою эффективность у больных с размерами гнойника до 8 см, без секвестров, однокамерных и расположенных в вентральных сегментах печени. Эффективность метода повышается при применении повторных пункций. Основной причиной неудач при вынужденном использовании пункционно-аспирационного метода лечения стало неспадение остаточной полости. Метод оказался неэффективным в случаях сформированной ригидной пиогенной капсулы и при гнойниках больших размеров.
Пункционно-дренажный способ лечения показал себя более эффективным, однако и ему были свойственны неудачи, и они также были связаны с длительным существованием остаточной гнойной полости. Кроме этого, добавились подтекания содержимого абсцесса в брюшную полость, хотя ни одно из них не потребовало дополнительных хирургических манипуляций. Выигрышным в этих ситуациях показал себя лапароскопический доступ, при котором, помимо дренажа абсцесса, устанавливался страховочный улавливающий дренаж в брюшную полость.
Исходя из анализа неудач, можно сформулировать положение о том, что пункционно-аспирационно-дренажные методики могут быть методом выбора при лечении большинства абсцессов печени и их следует применять в таких случаях:
1. Гнойник любых размеров, но не превышающий размеров одной доли.
2. Наличие технических условий для выполнения дренирования под контролем УЗИ или лапароскопически.
3. Тяжелое общее состояние пациента, не позволяющее выполнить более радикальную операцию.
Последний пункт характеризует вынужденное применение мини-инвазивных пункционно-дренажных методик и может быть первым этапом лечения. Его основная задача в случае невозможности полного излечения — подготовить пациента к более травматичной, но эффективной операции.
Резекционные методы являются радикальными операциями в тех случаях, когда гнойный очаг в печени удается удалить в пределах здоровых тканей без вскрытия его полости (классическая резекция или перицистэктомия). В случаях пристеночного расположения абсцесса с паренхиматозной манжетой толщиной 5–7 мм (рис. 1) хорошо себя зарекомендовала экономная резекция типа фенестрации. При этом, хотя одна стенка гнойника и остается неудаленной, исключается дальнейшее существование инфицированной остаточной полости.
Недостатком резекционного метода является большая травматичность, поэтому следует считать его операцией резерва и показания ограничить следующими пунктами:
1. Гнойник больших размеров, занимающий целую долю или больше.
2. Многокамерные абсцессы с множеством перемычек и секвестров (рис. 2).
3. Нагноившиеся паразитарные кисты и хронические абсцессы.
4. Несколько единичных, не сообщающихся между собой и локально расположенных гнойников задних сегментов печени.
/13_2.jpg)
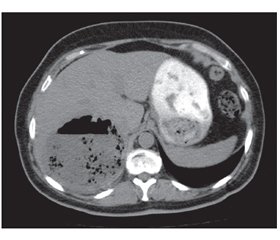
Клинический пример. Больная В., 55 лет, поступила в клинику института через месяц после начала заболевания с жалобами на ноющие боли в правом подреберье, гектическую температуру 39–40 °С, слабость. В крови анемия (Hb 115 г/л), лейкоцитоз 30 • 109 со сдвигом до 30 % палочкоядерных форм. По данным компьютерной томографии, в 6–7-м сегментах печени локализуется многокамерный абсцесс (рис. 3) общим объемом 200–250 мл с множественными внутренними тяжами, перемычками и секвестрами. Под контролем УЗИ гнойник дренирован, однако опорожнить и промыть полость не удалось, а общее количество полученного гноя не превысило 20 мл. В связи с отсутствием положительной динамики больная оперирована лапаротомным доступом, произведена резекция 6–7-го сегментов печени с гнойником без вскрытия его просвета. По данным гистологического исследования, гнойник имел характерное строение для туберкулезного абсцесса. Бакпосев роста микрофлоры не дал. Послеоперационный период осложнился пневмонией с правосторонним экссудативным плевритом. В процессе лечения инфекционные процессы в брюшной полости и грудной клетке полностью ликвидированы.
/14.jpg)
Выводы
Мини-инвазивные методы лечения одиночных абсцессов печени являются малотравматичными и высокоэффективными и поэтому могут быть первой линией хирургической помощи. В то же время хирургическая доктрина лечения гнойников печени должна носить эскалационный характер и при необходимости обязывать хирурга к своевременному переходу на более действенную методику следующей ступени.
Резекционные методы лечения более травматичны, требуют больших резервов организма, однако они радикальны, сопровождаются меньшим числом послеоперационных осложнений, а нередко и меньшим сроком стационарного лечения. Их следует использовать как методы резерва при неэффективности мини-инвазивных способов, при гигантских, специфических (туберкулез, актиномикоз, сифилис), хронических абсцессах и нагноении паразитарных кист печени.
/11.jpg)
/12.jpg)
/13.jpg)

/13_2.jpg)
/14.jpg)