Резюме
Вивчення маркерів проліферації, що визначають поведінку пухлинних клітин, а також дослідження їх взаємного зв’язку й залежності від застосовуваних схем неоад’ювантного лікування хворих на інвазивний перехідно-клітинний рак сечового міхура є актуальним для оцінки ефективності лікування пацієнтів та прогнозу. Метою роботи була оцінка проліферативної активності інвазивного перехідно-клітинного раку сечового міхура та її значення для прогнозування ефективності неоад’ювантного хіміопроменевого лікування. Матеріал і методи. 62 пацієнти з інфільтративним перехідно-клітинним раком сечового міхура були розподілені на чотири групи: одну контрольну й три дослідні відповідно до схеми неоад’ювантного лікування. Групи пацієнтів були порівнянні за кількістю спостережень, віком, ступенем катаплазії перехідно-клітинного раку й стадією захворювання (р ≤ 0,005). Забір матеріалу проводився відразу після операції з видаленого препарату для вивчення змін, що відбуваються в тканині сечового міхура. Гістологічні препарати фарбували за загальногістологічними методиками й проводили імуногістохімічні дослідження з оцінкою проліферативної активності пухлинних клітин. Результати й висновки. Ступінь редукції перехідно-клітинного раку сечового міхура залежить від проведеної схеми неоад’ювантної терапії. Про це свідчить зниження відсотка клітин з позитивною реакцією до PCNА та індексу проліферації Кі-67 в пухлинній тканині, мітотичного індексу й наростання апоптотичного індексу, підвищення показника 5-річної виживаності й середньої тривалості життя хворих. Якщо в контрольній групі PCNА становив 82,5 ± 6,9 %, то в досліджуваних II–IV групах відсоток клітин з позитивною реакцією до PCNА був значно й вірогідно (р ≤ 0,05) знижений до 34,0 ± 3,7 %, 23,0 ± 5,9 % і 11,3 ± 4,5 % відповідно. Індекс проліферації Кі-67 вірогідно корелював із схемою застосованої неоад’ювантної терапії. Найменші значення визначалися після застосування ендолімфатичної хіміотерапії та променевого лікування. Висока ефективність лікування й надійність розроблених схем неоад’ювантної терапії у хворих на рак сечового міхура дозволяють рекомендувати їх для широкого впровадження в практику онкологічних та урологічних центрів, обласних і міських онкологічних диспансерів.
Изучение маркеров пролиферации, определяющих поведение опухолевых клеток, а также исследование их взаимной связи и зависимости от применяемых схем неоадъювантного лечения больных инвазивным переходно-клеточным раком мочевого пузыря является актуальным для оценки эффективности лечения пациентов и прогноза. Целью работы была оценка пролиферативной активности инвазивного переходно-клеточного рака мочевого пузыря и ее значения для прогнозирования эффективности неоадъювантного химиолучевого лечения. Материал и методы. 62 пациента с инфильтративным переходно-клеточным раком мочевого пузыря были разделены на четыре группы: одну контрольную и три исследовательские в соответствии со схемой неоадъювантного лечения. Группы пациентов были сопоставимы по количеству наблюдений, возрасту, степени катаплазии переходно-клеточного рака и стадии заболевания (р ≤ 0,005). Забор материала проводился сразу после операции с удаленного препарата для изучения изменений, происходящих в ткани мочевого пузыря. Гистологические препараты окрашивали по общегистологическим методикам и проводили иммуногистохимические исследования с оценкой пролиферативной активности опухолевых клеток. Результаты и выводы. Степень редукции переходно-клеточного рака мочевого пузыря зависит от проводимой схемы неоадъювантной терапии. Об этом свидетельствует снижение процента клеток с положительной реакцией к PCNА и индекса пролиферации Кi-67 в опухолевой ткани, митотического индекса и нарастание апоптотического индекса, повышение показателя 5-летней выживаемости и средней продолжительности жизни больных. Если в контрольной группе PCNА составил 82,5 ± 6,9 %, то в исследуемых II–IV группах процент клеток с положительной реакцией к PCNА был значительно и достоверно (р ≤ 0,05) снижен до 34,0 ± 3,7 %, 23 ± 5,9 % и 11,3 ± 4,5 % соответственно. Индекс пролиферации Кi-67 достоверно коррелировал со схемой применяемой неоадъювантной терапии. Наименьшие значения определялись после применения эндолимфатической химиотерапии и лучевого лечения. Высокая эффективность лечения и надежность разработанных схем неоадъювантной терапии у больных раком мочевого пузыря позволяют рекомендовать их для широкого внедрения в практику онкологических и урологических центров, областных и городских онкологических диспансеров.
Study of proliferation markers, which define the behavior of tumor cells, as well as the study of their mutual connection and dependence on the schemes of neoadjuvant treatment in patients with invasive transitional cell carcinoma of the bladder is relevant in terms of assessing the effectiveness of treatment of patients and prognosis. The objective of the work was to evaluate the proliferative activity of invasive transitional cell carcinoma of the bladder and its significance in the prediction of the effectiveness of neoadjuvant chemoradiotherapy. Materials and methods. 62 patients with infiltrating transitional cell carcinoma of the bladder were divided into four groups: one control and three research groups according to the scheme of neoadjuvant treatment. Groups of patients were compared by the number of observations, age, degree of dedifferentiation of transitional cell cancer and stage of disease (r ≤ 0.005). Sample collection was made immediately after surgery to study the changes in the bladder tissue. The histological slides were stained with common histological techniques, and immunohistochemical studies were performed to evaluate the proliferative activity of tumor cells. Results and conclusions. The degree of reduction of transitional cell carcinoma of the bladder depends on the regimens of neoadjuvant therapy. This is evidenced by reduced percentage of cells with positive reaction to PCNA and Ki-67 proliferative index in the tumor tissue, mitotic index and increased apoptotic index, increased 5-year survival rate and average life expectancy of patients. If in the control group PCNA was 82.5 ± 6.9 %, then in II–IV groups the number of cells with positive reaction to PCNA was reliably and significantly (r ≤ 0.05) reduced to 34.0 ± 3.7 %, 23.0 ± 5.9 % and 11.3 ± 4.5 %, respectively. Ki-67 proliferative index significantly correlated with the scheme of applied neoadjuvant therapy. The lowest values were determined after the application of endolymphatic chemotherapy and radiation treatment. High effectiveness and reliability of treatment schemes for neoadjuvant therapy in patients with bladder cancer allows to recommend them for widespread implementation in the practice of oncology and urology centers, regional and local cancer clinics.
Статтю опубліковано на с. 16-20
Актуальність проблеми
Дослідження функціонального й біохімічного стану пухлинних клітин, оцінка особливостей перебігу онкологічного захворювання й чутливості пухлини до проведеної терапії є актуальним завданням сучасної онкології [6, 7, 14]. Проліферативна активність клітин пухлини є одним з найбільш широко використовуваних показників, що дозволяють прогнозувати перебіг онкологічного захворювання. Проліферативний індекс служить незалежним прогностичним показником виникнення рецидиву й корелює із загальною та безрецидивною виживаністю при найрізноманітніших новоутвореннях [3, 6, 9], а також є передбачуваним чинником для визначення їх чутливості до хіміо- і променевої терапії [10, 13]. У даний час існують високоінформативні імуногістохімічні маркери проліферації. У першу чергу до них належить антиген Ki-67, що експресується практично в усіх фазах мітотичного циклу і відповідно до цього відображає проліферативний пул пухлини. Ядерний антиген Кi-67 уперше описаний Gerdes і спів–авт. у 1984 році, він складається з двох поліпептидних ланцюгів з молекулярною масою 345 і 395 кДа. Це основна частина нуклеарного матриксу, упродовж інтерфази асоційована з хромосомами фази мітозу. Ki-67-димерна молекула має тісний зв’язок з 10-ю хромосомою, конкретна роль цього протеїну в процесі клітинного поділу досі точно не з’ясована. Експресія Кi-67 дозволяє виділити пухлинні клітини, що знаходяться в активній фазі клітинного циклу, протягом усього циклу (G1-, S-, G2- і M-фази). Кi-67 відсутній тільки в G0-періоді [9, 11, 12]. Що стосується імуногістохімічного ядерного маркера проліферації PCNA, то він знайшов широке застосування в онкоморфології. Експресія PCNA починає виявлятися в ядрі клітини у фазі G1, досягає максимуму у фазі S і поступово знижується до кінця фази G2 [2, 4, 5]. Пухлинні клітини, що активно проліферують, є фракцією зростання новоутворення. Проліферативна активність є провідним чинником як у механізмі злоякісної трансформації клітин, так і в біологічній поведінці пухлин, що вже виникли. Це одна з найбільш важливих характеристик фенотипу пухлини, що значною мірою визначає швидкість росту новоутворення, ризик метастазування, потенційну відповідь на лікувальні заходи й результат онкологічного захворювання. Багато факторів, що впливають на перебіг і результат онкологічних захворювань, свою патогенетичну дію на пухлину опосередковують через зміну проліферативної активності [3, 7, 8].
Оцінювати проліферативну активність пухлинних клітин необхідно не тільки для визначення біологічних характеристик пухлин, але й для селективного підходу до вибору терапії. Індекс проліферативної активності в різних пухлинах має різні значення, будучи при цьому незалежною прогностичною ознакою, що визначає клінічний перебіг і прогноз захворювання. При Ki-67 менше ніж 15 % пухлина вважається менш агресивною, при показнику понад 30 % пухлина вважається високоагресивною. При високому рівні (вираженому у відсотках) Ki-67 пухлина з більш високою ймовірністю відповість на хіміотерапевтичне лікування [6, 8].
Вивчення маркерів проліферації, що визначають поведінку пухлинних клітин, а також дослідження їх взаємного зв’язку й залежності від застосовуваних схем неоад’ювантного лікування хворих на інвазивний перехідно-клітинний рак сечового міхура є актуальним для оцінки ефективності лікування пацієнтів та прогнозу.
Метою роботи була оцінка проліферативної активності інвазивного перехідно-клітинного раку сечового міхура та значення її у прогнозі ефективності неоад’ювантного хіміопроменевого лікування.
Матеріал і методи
Матеріалом дослідження були 62 спостереження інвазивного перехідно-клітинного раку сечового міхура. Пацієнти були розподілені на чотири групи: одну контрольну й три дослідницькі — відповідно до призначеної схеми неоад’ювантного лікування. Групи пацієнтів були порівнянні за кількістю спостережень, віком, ступенем катаплазії перехідно-клітинного раку й стадією захворювання (р ≤ 0,005). Для об’єктивної оцінки лікувального патоморфозу як еталон якісних і кількісних вихідних показників нами вивчена тканина інфільтративних форм раку сечового міхура 17 хворих, яким до операції не проводилося ні променеве, ні хіміотерапевтичне лікування (контрольна група, або група I). До II групи увійшли 14 пацієнтів, яким до операції проведений курс променевої терапії, до групи III — 15 пацієнтів, яким, окрім променевої терапії, внутрішньовенно вводилися хіміотерапевтичні препарати, а IV групу становили 16 пацієнтів, яким виконувалася ендолімфатична хіміотерапія та променева терапія.
Забір матеріалу проводився відразу після операції з видаленого препарату для вивчення змін, що відбуваються в тканині сечового міхура. Зразки пухлинної тканини фіксували в нейтральному забуференому формаліні зі звичайною стандартною проводкою та заливкою в парафін. Гістологічні препарати забарвлювали за загальнооглядовими методиками й проводили імуногістохімічні дослідження. При оцінці проліферативної активності використовували моноклональні антитіла (МКАТ, Novocastra і Dako) до антигену ядер проліферуючих клітин PCNA і до негістонного білка Ki-67, що визначається в ядрах клітин під час пізньої G-фази, S, G2 і M, але не в G0-фазі клітинного циклу. Проліферативну активність пухлини оцінювали як відсоток Ki-67+-клітин від загального числа пухлинних клітин. Для оцінки індексу проліферації за PCNA вираховували відсоток клітин, у ядрах яких виявляли експресію PCNA. Морфологічна оцінка пухлини проводилася згідно з класифікацією ВООЗ (2012) [14]. При цьому виконувався підрахунок кількості забарвлених візуалізованих агентом ядер клітин пухлини, враховувалось відсоткове співвідношення забарвлених/незабарвлених ядер клітин на 100 врахованих клітин у 10 репрезентативних полях зору при збільшенні в 40 разів. При кількісній оцінці питомого об’єму паренхіми, строми, вогнищ некрозу, судин мікрогемоциркуляторного русла, коефіцієнта васкуляризації, мітотичного індексу, відсотка патологічних мітозів ми ґрунтувалися на класичних принципах морфометрії, викладених у монографії Г.Г. Автанділова (2002) [1]. Гістологічне дослідження здійснювалось за допомогою мікроскопа Hund H500 (Німеччина).
Результати та обговорення
Зіставлення структури інфільтративних форм перехідно-клітинного раку сечового міхура до й після різних схем неоад’ювантної терапії показало, що лікувальний патоморфоз пухлини відбувається за однотипною схемою: зменшення питомої частки її паренхіми, зростання стромального компонента, а також коефіцієнта васкуляризації. Редукція паренхіми (зменшення питомого об’єму пухлинних клітин) супроводжується зниженням рівня проліферації пухлинних клітин, наростанням інтенсивності некробіотичних процесів, зростанням питомої частки вогнищ некрозу. Редукція паренхіми перехідно-клітинного раку сечового міхура, індукована передопераційною терапією, статистично вірогідна (р ≤ 0,001). Відповідно до перебудови паренхіматозно-стромальних співвідношень відбуваються зміни параметрів васкуляризації пухлинної тканини після проведеного лікування.
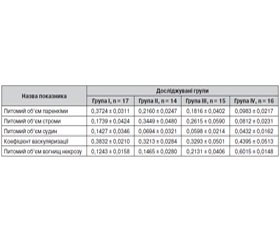
Морфометричні показники паренхіми й строми перехідно-клітинного раку сечового міхура без лікування й після застосування різних схем неоад’ювантної терапії подані в таблиці 1.
/18.jpg)
Порівняльне морфологічне вивчення структури перехідно-клітинного раку сечового міхура без лікування й після застосування різних схем неоад’ювантної терапії показало, що має місце пряма залежність між ступенем редукції паренхіми пухлини й схемою проведеного лікування. Ступінь редукції пухлини становив у II групі 42,0 ± 7,3 %, у ІІІ групі — 51,2 ± 8,5 % і в IV групі — 73,6 ± 6,1 %. Розбіжності значень питомого об’єму паренхіми до і після лікування статистично вірогідні (р ≤ 0,05, t-критерій Стьюдента 3,64). При цьому варто підкреслити, що розбіжності між II і III групами несуттєві й статистично невірогідні (р ≥ 0,005), тоді як у пацієнтів IV групи позитивний ефект у плані редукції пухлинної паренхіми має статистично вірогідну відмінність (р ≤ 0,05 при t-критерії Стьюдента, рівному 2,19, що суттєво перевищує граничне табличне значення).
Зменшення питомого об’єму паренхіми перехідно-клітинного раку сечового міхура під впливом різних схем неоад’ювантної терапії здійснюється за рахунок двох патогенетичних механізмів — зростання некробіотичних процесів і зниження рівня мітотичної активності пухлинних клітин. Збільшення питомого об’єму вогнищ некрозу, на наш погляд, обумовлене вираженими дистрофічними змінами стінок судин мікроциркуляторного русла у вигляді мукоїдного набрякання й фібриноїдних змін, аж до фібриноїдного некрозу, що виявляються при гістохімічному дослідженні та проявляються різко позитивною ШІК-реакцією й вираженою метахромазією при забарвленні толуїдиновим синім при рН 5,3. Крім того, слід відзначити високу частоту змішаних, а також аглютинаційних тромбів у судинах мікроциркуляторного русла поблизу вогнищ некрозу.
Зниження рівня проліферативної активності й наявність виражених дистрофічних змін, аж до некрозу, епітеліальних пухлинних клітин знаходять своє відображення в зменшенні розмірів їх ядер і зростанні ядерно-цитоплазматичного співвідношення. У значній частині пухлинних клітин паренхіми відзначаються некротичні та некробіотичні процеси. Крім гіаліново-крапельної дистрофії, особливо в периферичних відділах пухлинних комплексів, спостерігається вакуольна і навіть балонна дистрофія. Зменшення питомого об’єму паренхіми перехідно-клітинного раку сечового міхура позитивно корелює зі зростанням питомого об’єму вогнищ некрозу: у I групі об’єм некрозу становив 0,1243 ± 0,0158, у II групі — 0,1465 ± 0,0280, у III групі — 0,2131 ± 0,0406, і найбільший їх об’єм відзначений у IV групі — 0,6015 ± 0,0148.
Одним з найважливіших компонентів формули лікувального патоморфозу тканини раку є рівень проліферативної активності пухлинних клітин, прямим й непрямим маркером якого є мітотичний індекс. У всіх досліджуваних групах мало місце вірогідне (р ≤ 0,05) порівняно з I групою зменшення мітотичного індексу (у групі I він становив 24,2 ± 3,4 ‰, у II — 4,12 ± 1,30 ‰, у III — 3,03 ± 1,10 ‰ і в IV групі — 2,1 ± 0,4 ‰). Об’єктивним показником зменшення проліферативної активності клітин пухлинної паренхіми, поряд зі зниженням рівня мітотичного режиму, було прогресуюче статистично вірогідне (р ≤ 0,05) зростання в досліджуваних групах апоптотичного індексу з 4,1 ± 1,1 ‰ (I група) до 6,2 ± 0,8 ‰, 9,08 ± 1,36 ‰ і 14,5 ± 1,7 ‰ (групи II–IV відповідно).
Але поряд з описаною вище позитивною динамікою лікувального патоморфозу в досліджуваних групах пацієнтів із перехідно-клітинним раком сечового міхура практично у всіх хворих виявлялися комплекси пухлинної паренхіми, у яких не тільки формально зберігалася структура клітин, але й мали місце ознаки морфо-функціональної активності пухлинних клітин. Зокрема, йдеться про відсоток клітин з позитивною реакцією до PCNА, ядерного антигену проліферації. Без сумніву, він різко знижувався при всіх видах неоад’ювантної терапії. Що стосується індексу Кі-67, то він, безумовно, є оптимальним маркером проліферації, відображаючи величину проліферативного пулу пухлини. Перед початком лікування хворих індекс Кі-67 коливався від 5,7 до 94,6 %, його середнє значення становило 44,7 ± 3,2 %. Після застосування у хворих передопераційного хіміопроменевого лікування значення Кі-67 різко знижувалися, але його показники залежали від застосовуваних схем неоад’ювантного лікування. Середні значення показників проліферативної активності пухлинної тканини подано в таблиці 2.
/19.jpg)
Якщо в контрольній групі PCNА становив 82,5 ± 6,9 %, то в досліджуваних II–IV групах відсоток клітин з позитивною реакцією до PCNА був значно й вірогідно (р ≤ 0,05) знижений до 34,0 ± 3,7 %, 23,0 ± 5,9 % і 11,3 ± 4,5 % відповідно. Індекс проліферації Кі-67 вірогідно корелював із схемою застосовуваної неоад’ювантної терапії. Найменші значення відмічалися після застосування ендолімфатичної хіміотерапії та променевого лікування. Отримані нами дані узгоджуються з результатами робіт зарубіжних авторів [13, 14], які також відзначали зниження проліферативної активності пухлини під час застосовуваного лікування.
При виконанні трансуретральних резекцій у комбінованому лікуванні поверхневого раку сечового міхура найбільш ефективними схемами є розроблений у клініці спосіб неоад’ювантної терапії — променева терапія/ендолімфатична поліхіміотерапія/трансуретральна резекція, що дозволив досягти 5-річної виживаності 96,30 ± 3,63 %, середньої тривалості життя 4,98 ± 0,02 року. Що стосується виконання органозберігаючих резекцій, то найбільш ефективними схемами комбінованого лікування інвазивного раку сечового міхура є також розроблений спосіб неоад’ювантної терапії — променева терапія/ендолімфатична поліхіміотерапія/резекція, що дозволив досягти 5-річної виживаності 67,40 ± 8,91 %, середньої тривалості життя 3,86 ± 0,24 року.
Висновки
Отже, ступінь редукції перехідно-клітинного раку сечового міхура залежить від проведеної схеми неоад’ювантної терапії. Про це свідчить зниження відсотка клітин з позитивною реакцією до PCNА, індексу проліферації Кі-67 у пухлинній тканині пацієнтів, мітотичного індексу й наростання апоптотичного індексу, підвищення показника 5-річної виживаності й середньої тривалості життя хворих. Висока ефективність лікування та надійність розроблених схем неоад’ювантної терапії у хворих на рак сечового міхура дозволяють рекомендувати їх для широкого впровадження в практику онкологічних та урологічних центрів, обласних і міських онкологічних диспансерів.
Список литературы
1. Автандилов Г.Г. Основы количественной патологической анатомии: Учеб. пособие / Г.Г. Автандилов. — М.: Медицина, 2002. — 240 с.
2. Иммуногистохимические методы: Руководство: Пер. с англ. под ред. Г.А. Франка и П.Г. Малькова. — М., 2011. — 224 с.
3. Магер В.О. Прогностическое значение биологических маркеров у больных поверхностным и инвазивным раком мочевого пузыря / В.О. Магер, Н.В. Казанцева // Онкоурология. — 2006. — № 4. — С. 30-34.
4. Молчанов Р.Н., Шпонька И.С. Иммуногистохимическая оценка рака мочевого пузыря, протекающего на фоне хронического воспаления // Morphologia. — 2014. — Т. 8, № 3. — С. 42-49.
5. Оценка экспрессии маркеров клеточного цикла и межклеточной адгезии у пациентов с поверхностным раком мочевого пузыря / А.В. Люлько, Р.Н. Молчанов, И.С. Шпонька // Урологія. — 2012. — Т. 16, № 1. — С. 52-60.
6. Пожарисский К.М., Леенман Е.Н. Значение иммуногистохимических методик для определения характера лечения и прогноза опухолевых заболеваний // Архив патологии. — 2000. — № 5. — С. 3-11.
7. Роль антигенов Ki-67, Р53 и bcl-2 в прогнозировании клинического течения переходно-клеточного рака мочевого пузыря / Е.С. Завьялова, А.С. Аль-Шукри, И.А. Корнеев, О.Д.Ягмуров // Нефрология. — 2009. — Т. 13, № 1. — С. 90-94.
8. Франк Г.А., Завалишина Л.Э., Андреева Ю.Ю. Иммуногистохимическая характеристика и степень дифференцировки рака мочевого пузыря // Архив патологии. — 2002. — № 6. — С. 16-18.
9. Cell cycle analysis of a cell proliferation-associated human nuclear antigen defined by the monoclonal antibody Ki-67 / J. Gerdes, H. Lemke, H. Baisch, HH. Wacker, U. Schwab, H.J. Stein // Immunol. — 1984. — Vol. 133(4). — P. 1710-5.
10. Combination of CK20 and Ki-67 immunostaining analysis predicts recurrence, progression, and cancer-specific survival in pT1 urothelial bladder cancer / S. Bertz , W. Otto, S. Den–zinger // Eur. Urol. — 2014. — Vol. 65(1). — P. 218-26.
11. Ki-67 is an independent indicator in non-muscle invasive bladder cancer (NMIBC); combination of EORTC risk scores and Ki-67 expression could improve the risk stratification of NMIBC / W. Ding, Y. Gou, C. Sun et al. // Urol. Oncol. — 2014. — Vol. 32(1).
12. Margulis V., Shahrokh F. Shariat, Raheela Ashfaq, Arthur I. Sagalowsky, and Yair Lotan. Ki-67 is an independent predictor of bladder cancer outcome in patients treated with radical cystectomy for organ-confined disease // Clin. Cancer Res. — 2006. — Vol. 12 (24).
13. Neoadjuvant or Adjuvant Chemotherapy for Bladder Cancer? / M.C. Hupe, M.W. Kramer, M.A. Kuczyk, A.S. Merseburger // Aktuelle Urol. — 2015. — Vol. 46(3). — Р. 242-7.
14. Prognostic comparison of proliferation markers and World Health Organization 1973/2004 grades in urothelial carcinomas of the urinary bladder. / O.M. Mangrud, E. Gudlaugsson, I. Skaland et al. // Hum. Pathol. — 2014. — Vol. 45(7). — P. 1496-503.

/18.jpg)
/19.jpg)