Газета «Новости медицины и фармации» Акушерство и гинекология (569) 2016 (тематический номер)
Вернуться к номеру
Возможности метаболической терапии плацентарной дисфункции во втором триместре у беременных с синдромом задержки роста плода и маловодием
Авторы: Галич С.Р., Посохова С.П., Панчук Е.А.
Одесский национальный медицинский университет
Рубрики: Акушерство и гинекология
Разделы: Клинические исследования
Версия для печати
Статья опубликована на с. 11-16
Плацентарная дисфункция (ПД), манифестирующая синдромом задержки роста плода (СЗРП), — одна из главных причин перинатальной заболеваемости и смертности в современном акушерстве [1–3]. Актуальность проблемы мотивировала многочисленных исследователей к поиску путей и методов ее коррекции. Длительное время в отечественной практике лечение таких пациенток сопровождалось необоснованной полипрагмазией. Многочисленные публикации отечественных исследователей об эффективности отдельных медикаментозных и немедикаментозных влияний с целью ликвидации ПД не нашли подтверждения в работах ведущих зарубежных авторов, следовательно, не имеют доказательной базы, однако продолжают использоваться на практике. Накопившиеся убедительные научные данные и практические наблюдения позволили Европейской ассоциации акушеров-гинекологов еще в 1999 году сформулировать важнейший постулат современной перинатологии об отсутствии ожидаемого эффекта от антенатальных мероприятий по улучшению состояния плода в III триместре беременности вследствие их запаздывания и практической невозможности улучшения маточно-плацентарного кровотока [4, 5]. Именно поэтому уменьшение показателя перинатальной смертности при прогрессирующей ПД в настоящее время ассоциируется со своевременным родоразрешением [6, 7]. Упомянутая тактика не вызывает сомнений в сроках гестации после 30 недель, но диктует определенные опасения в более ранние сроки, что обусловлено известной незрелостью систем жизнеобеспечения глубоко недоношенных новорожденных. В настоящее время досрочное родоразрешение осуществляется при наличии доказанного дистресса плода или прогрессирующего замедления его роста [6, 7]. При этом безопасная продолжительность наблюдения за внутриутробным ребенком с замедленным ростом — важная практическая проблема, которая пока что не имеет одно–значного решения. Очевидно, что чем больше будет гестационный возраст внутриутробного пациента, тем он будет более зрелым, тем легче будет проходить его неонатальная адаптация. Следовательно, при отсутствии очевидных проблем у матери, требующих специального лечения (преэклампсия, угрожающие преждевременные роды), лечение ПД не проводится.
Исходя из вышеизложенного, исследователи логично переключили внимание на изучение возможностей воздействия на плаценту во втором триместре беременности. На наш взгляд, перспективным терапевтическим направлением может стать использование средств, направленных на улучшение метаболизма действующей плацентарной ткани, что позволит плаценте более длительное время выполнять свою функцию и обеспечить более длительное время пребывания плода в утробе матери, а значит, и его созревание.
Анализ имеющихся литературных данных позволил избрать в качестве средства метаболической терапии пренатальную добавку Омегами Заботливая мама Базис швейцарской компании MeCompany AG, которая была специально разработана согласно рекомендациям европейских сообществ о количестве и соотношении полиненасыщенных жирных кислот (ПНЖК) омега-3 для использования в рационах диетического питания женщин при планировании и на протяжении беременности, а также на первом году кормления грудью с целью улучшения репродуктивного здоровья, формирования и развития нервной системы плода, мозга, зрения и как профилактическое средство от невынашивания [8, 9] беременности, преждевременной отслойки плаценты, проявлений послеродовой депрессии. По мнению Европейской ассоциации перинатальной медицины, потребность в ПНЖК у беременных женщин составляет не менее 300 мг в сутки при соотношении кислот 5 : 1. Для беременных потребность в микронутриентах, в том числе и омега-3 ПНЖК, на 25 % выше, чем для небеременных женщин аналогичного возраста [10]. Имеются убедительные данные, свидетельствующие об участии ПНЖК в формировании, дозревании и правильном функционировании плаценты, в обеспечении антиагрегантного эффекта, в профилактике тромбофилических нарушений [11].
Цель исследования: обеспечить максимально длительное безопасное пролонгирование беременности и улучшить перинатальные исходы для недоношенных новорожденных детей у беременных с первичной ПД в виде СЗРП и маловодия, диагностированных во втором триместре беременности, путем использованием метаболической терапии пренатальной добавки Омегами Заботливая мама Базис.
Дизайн исследования
Осуществлено рандомизированное контролируемое исследование. Критериями включения пациенток в исследуемые группы были: наличие плацентарной дисфункции в виде синдрома задержки роста плода и маловодия; преждевременная частичная непрогрессирующая отслойка хориона в сроке от 8 до 12 недель беременности; срок беременности 22–28 недель; одноплодная беременность. Критерии исключения: тяжелая экстрагенитальная патология; беременность вследствие использования вспомогательных репродуктивных технологий; гипертензивные нарушения.
Всего под наблюдением находилось 80 беременных женщин. Пациентки основной группы (ОГ — 38 женщин) в качестве метаболической терапии при ПД получали пренатальную добавку Омегами Заботливая мама Базис по 1 капсуле в сутки (300 мг омега-3 ПНЖК и 12 мг витамина Е) в течение 4–6 недель. Указанная доза омега-3 ПНЖК обеспечивала суточную потребность для беременных. Контрольную группу 1 (КГ-1) составили 20 беременных женщин, соответствующих перечисленным критериям включения, не получавших никакой медикаментозной терапии. Контрольную группу 2 (КГ-2) составили беременные пациентки (22 женщины), получившие в указанных сроках беременности до госпитализации на III уровень оказания помощи внутривенные капельные вливания традиционных медикаментозных средств, улучшающих микроциркуляцию. С учетом срока гестации пациенткам всех групп осуществлена профилактика синдрома дыхательных расстройств (СДР) дексаметазоном по общепринятой схеме.
В процессе наблюдения контролировали показатели, характеризующие состояние фетоплацентарного комплекса (ФПК). С этой целью осуществляли ультразвуковую фето- и плацентометрию, допплерометрию кровотока в пупочной артерии (ПА), в аорте (АП) и в средней мозговой артерии плода (СМА). Контрольные исследования по перечисленным показателям осуществлялись до начала терапии, еженедельно и после ее окончания. Критериями досрочного родоразрешения при наличии СЗРП с маловодием и преходящих (или постоянных) нарушений допплерометрических показателей кровотока в ПА считали сочетание нарушения кровотока в АП, СМА и отсутствие недельного прироста фетометрических показателей плода. Учитывая неподготовленность родовых путей и риски повреждения плода при наличии СЗРП и маловодия, досрочное родоразрешение проводили путем операции кесарева сечения со спинальной аналгезией.
При анализе эффективности терапии учитывали продолжительность безопасного периода наблюдения до родоразрешения, выраженность СЗРП. Состояние новорожденных оценивали по традиционному показателю суммарной оценки по шкале Апгар на 1-й и 5-й минуте после рождения, выраженности дыхательной недостаточности по шкале Сильвермана, по частоте и выраженности признаков гипоксически-ишемической энцефалопатии (ГИЭ) в периоде адаптации, отмечали частоту внутрижелудочковых кровоизлияний (ВЖК), некротического энтероколита (НЭК). Осуществляли морфологическое исследование плацент (макро- и микроскопическое).
Статистический анализ полученных данных проводили с использованием компьютерной программы Statistica 10.0.
Результаты исследования и их обсуждение
Средний возраст пациенток составил 24,27 ± 0,15 года, по указанному параметру клинические группы не различались (р > 0,05). Гестационный срок на момент взятия пациенток под наблюдения в группах достоверно не различался и составил 24,71 ± 0,54 недели в ОГ, 25,29 ± 0,49 недели — в КГ-1 и 25,68 ± 0,62 недели — в КГ-2 (р > 0,05 для всех сравнений). В процессе исследования не были зарегистрированы случаи отказа беременных от приема препарата, не отмечались побочные реакции или его непереносимость.
Пациентки ОГ, несмотря на равнозначные с беременными обеих контрольных групп сроки гестации на момент начала наблюдения (24,71 ± 0,54 недели, р > 0,05), были вынужденно родоразрешены в сроке беременности 30,29 ± 0,52 недели, что достоверно отличалось от срока беременности в КГ-1 (пациентки не получали никакого лечения — 28,52 ± 0,50 недели; р < 0,05) и в КГ-2 (получали устаревшую терапию — 28,00 ± 0,55 недели; р < 0,05). Обращало на себя внимание отсутствие достоверных различий в сроке окончания беременности между контрольными группами (р > 0,05), что подтверждает принятое в перинатологии положение относительно неэффективности средств, улучшающих микроциркуляцию для коррекции ПД.
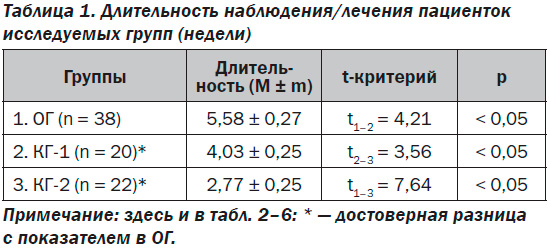
При наличии ПД и СЗРП длительность наблюдения до родоразрешения зависела от того, как долго плацента способна была обеспечить безопасное кровообращение плода. Учитывая наличие феномена централизации кровообращения при нарушениях кровотока в ПА (замедленный и нулевой), критериями родоразрешения, при которых устанавливался диагноз антенатального дистресса плода, были нарушение кровотока в АП или СМА в сочетании с отсутствием двухнедельной динамики роста плода. Статистический анализ длительности наблюдения (КГ-1) или лечения (ОГ и КГ-2) свидетельствовал о наличии достоверных различий в группах (табл. 1).
Таким образом, использование в качестве метаболической терапии пренатальной добавки Омегами Заботливая мама Базис обеспечивало более длительное наблюдение за беременными (5,58 ± 0,27 недели), чем отсутствие лечения (КГ-1 — 4,03 ± 0,25 недели), и значительно более длительное в сравнении с группой пациенток, получавших терапию, улучшающую микроциркуляцию (2,77 ± 0,25 недели). Достоверная разница в безопасной продолжительности наблюдения между контрольными группами (КГ-1 и КГ-2) при более длительном наблюдении пациенток, не получавших лечение (4,03 ± 0,25 недели), в сравнении с группой пациенток, которым проводилась терапия для улучшения микроциркуляции (2,77 ± 0,25 недели), свидетельствовала не только о неэффективности указанной терапии, но и о ее нецелесообразности (р < 0,05).
Выраженность СЗРП оценивалась по средним показателям (среднее арифметическое в каждой группе), которые вычисляли по данным измерения массы тела при рождении, сравнивая ее с должными показателями, соответствующими гестационному возрасту. Амплитуда вариантов составила от I до III степени. По показателю частоты формирования СЗРП исследуемые группы не различались (ОГ — 1,74 ± 0,11; КГ-1 — 1,65 ± 0,17; КГ-2 — 1,73 ± 0,18; р > 0,05), что подтверждает цитируемый ранее тезис об отсутствии методов эффективного лечения ПД (р > 0,05 для всех вариантов сравнения). Очевидно, что использование пренатальной добавки не повлияло на степень выраженности СЗРП, но позволило увеличить длительность пребывания плода в утробе матери, а значит, и его зрелость.
Оказалось, что максимальная продолжительность нарушений кровотока в ПА, не сопровождающаяся более глубокими нарушениями состояния плода за счет централизации кровотока, отмечалась в ОГ (5,58 ± 0,27 недели), минимальная — у пациенток КГ-2, получавших терапию, улучшающую микроциркуляцию (2,77 ± 0,25). На наш взгляд, данный факт обусловлен интенсификацией метаболических процессов в плацентарной ткани. Учитывая худшие показатели длительности компенсированного состояния у пациенток КГ-2 в сравнении с КГ-1, следует предположить, что использование указанной терапии у матери нарушает физиологические механизмы компенсации плода, что приводит к уменьшению периода компенсации и ускоряет необходимость досрочного родоразрешения.
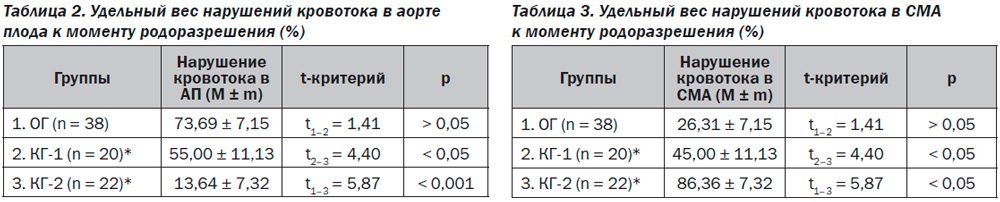
Большинство пациенток ОГ были прооперированы в связи с нарушениями кровотока в АП, сочетающимися с прекращением его роста (73,69 ± 7,15 %), в то время как подавляющее большинство пациенток КГ-2 были прооперированы в связи с нарушением кровотока в СМА (86,36 ± 7,32 %). Очевидно, что у пациенток ОГ более длительно сохранялся эффект централизации кровообращения, чем у испытуемых других групп, что также может быть обусловлено улучшением метаболизма в функционирующих отделах плаценты, вызванным препаратом Омегами Заботливая мама Базис (табл. 2, 3).
Неожиданным феноменом оказалось выявление исключительно у пациенток КГ-2 осложнения в виде преэклампсии (гипертензия, протеинурия), носившей не тяжелый, но прогрессирующий характер (22,73 ± 8,64 %), которая не отмечалась в других группах. Указанный феномен подлежит дополнительному анализу. В качестве предположения можно думать о ятрогенном влиянии терапии, улучшающей микроциркуляцию, на компенсацию кровообращения в ФПК (синдром обкрадывания).
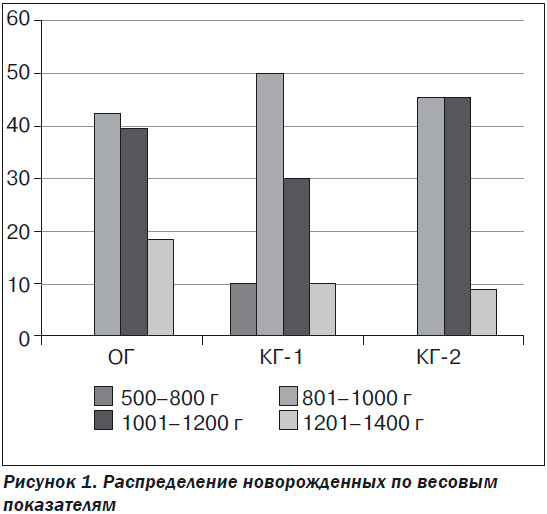
По массе тела новорожденные исследуемых групп не различались (ОГ — 1073,18 ± 25,00 г, КГ-1 — 1003,25 ± 40,91 г, КГ-2 — 1000,82 ± 34,08 г; р > 0,05), что является дополнительным подтверждением отсутствия влияния метаболической терапии непосредственно на рост плода. Однако распределение плодов внутри групп по показателю массы тела позволило установить некоторые тенденции. Так, плоды массой менее 800 г рождались исключительно в КГ-1 при максимальном количестве новорожденных массой тела более 1200 г у беременных ОГ (рис. 1).
Учитывая более продолжительное безопасное наблюдение за внутриутробными пациентами ОГ, достоверно больший срок их гестации при родоразрешении, логичной представляется достоверно более высокая оценка по шкале Апгар при рождении детей именно этой группы, при их более низкой оценке по шкале Сильвермана (табл. 4, 5).
В табл. 4, 5 приведены данные оценки новорожденных на 1-й минуте после рождения.
Несмотря на то, что все наблюдаемые беременные получили полный курс профилактики, частота развития СДР у недоношенных новорожденных была обусловлена сроком гестации (табл. 6). У трети из числа недоношенных детей ОГ (31,58 ± 7,54 %) СДР вообще не развился, а у подавляющего большинства из тех, у кого он имел место, определялась его начальная стадия (57,90 ± 8,01), с минимальным количеством детей с тяжелой и крайне тяжелой степенью выраженности СДР (5,26 ± 3,62).
У всех недоношенных новорожденных КГ-2 СДР носил тяжелый или крайне тяжелый характер. Указанные факты являются важным подтверждением целесообразности использования пренатальной добавки Омегами Заботливая мама Базис еще и в качестве средства, усиливающего эффективность профилактики СДР при недоношенной беременности. Очевидно, что терапия, улучшающая микроциркуляцию (в КГ-2), в сравнении с отсутствием какого-либо лечения (в КГ-1) выглядит как ятрогенный фактор, поскольку сопряжена со значительной частотой тяжелых форм СДР.
С частотой и степенью выраженности СДР связан и другой важный клинический показатель — частота использования сурфактанта (курасурф). Минимальной потребностью в сурфактантной терапии характеризовались новорожденные ОГ (39,47 ± 7,93 %), значительной — дети, матери которых не получали никакой терапии (КГ-1 — 75,00 ± 9,68 %), и абсолютной — дети, матерям которых осуществляли внутривенное улучшение микроциркуляции (КГ-2 — 100,0 %). Показания для использования курасурфа были типичными, методики — общепринятыми. Аналогично выглядит и показатель частоты потребности в искусственной вентиляции легких (ИВЛ), в отличие от контрольных групп (КГ-1 — 75,00 ± 9,68 % и КГ-2 — 100,0 %) потребность в ИВЛ была определена только у 36,84 ± 7,83 % новорожденных ОГ, что является весомым аргументом в пользу использованной терапии.
Максимальная частота ВЖК (90,9 ± 6,13 %) отмечена у детей от матерей КГ-2, минимальная — от матерей ОГ (21,05 ± 9,12 %). Данный факт, очевидно, обусловлен как большим сроком гестации недоношенных новорожденных, так и возможным влиянием пренатальной добавки Омегами Заботливая мама Базис на метаболизм плаценты, что обусловило оптимизацию процессов метаболизма и у внутриутробных детей. Отсутствие медикаментозных воздействий в меньшем числе случаев ассоциировалось с развитием ВЖК (КГ-1 — 50,0 ± 11,18 %) по сравнению с внутривенной терапией, улучшающая микроциркуляцию (КГ-2 — 90,9 ± 6,13 %), что не только подтверждает известное положение о неэффективности последней, но и свидетельствует о ее ятрогенном действии.
Гипоксически-ишемическая энцефалопатия достоверно чаще диагностирована среди новорожденных КГ-2 (90,9 ± 0,64 %), вдвое реже — у детей от матерей КГ-1 (45,00 ± 11,12 %, р < 0,05 ) и минимально — у новорожденных, матери которых получали пренатальную добавку Омегами Заботливая мама Базис (18,42 ± 6,29 %; р < 0,05 для всех сравнений).
Частота развития некротического энтероколита у новорожденных ОГ (18,42 ± 6,29 %) достоверно меньше, чем у детей от матерей, не получавших терапию (55,00 ± 11,12; р < 0,05 %), и значительно меньше, чем у детей пациенток, получавших внутривенно препараты для улучшения микроциркуляции (77,27 ± 1,01 %; р < 0,001).
Перинатальная смертность среди новорожденных детей в исследуемых группах достоверно не различалась (ОГ — 10,53 ± 4,98 ‰; КГ-1 — 25,00 ± 9,68 ‰; КГ-2 — 31,82 ± 9,93 ‰; р > 0,05).
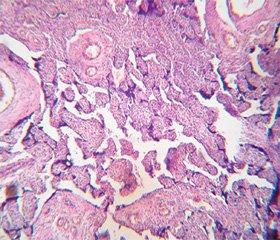
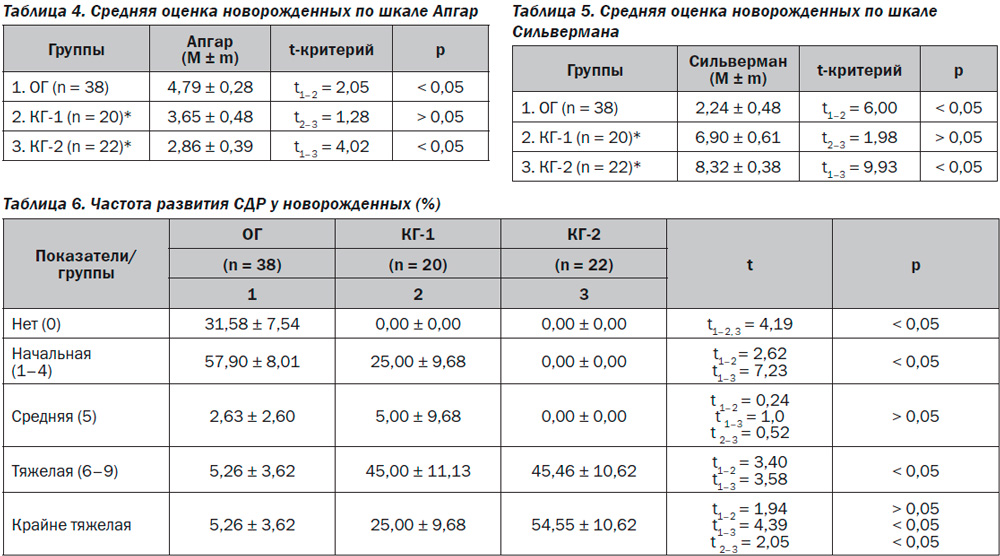
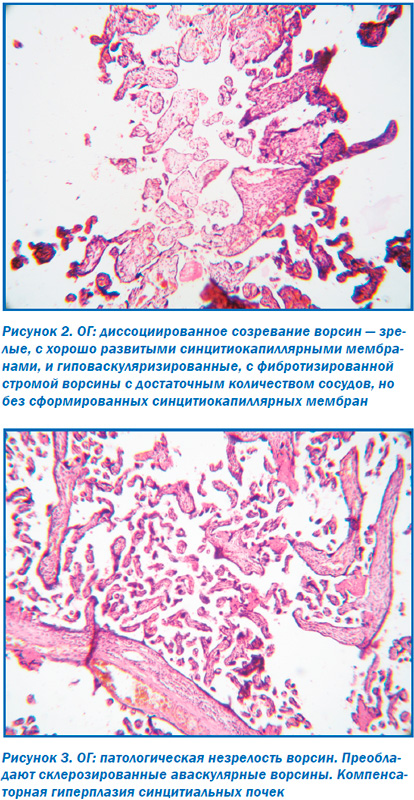
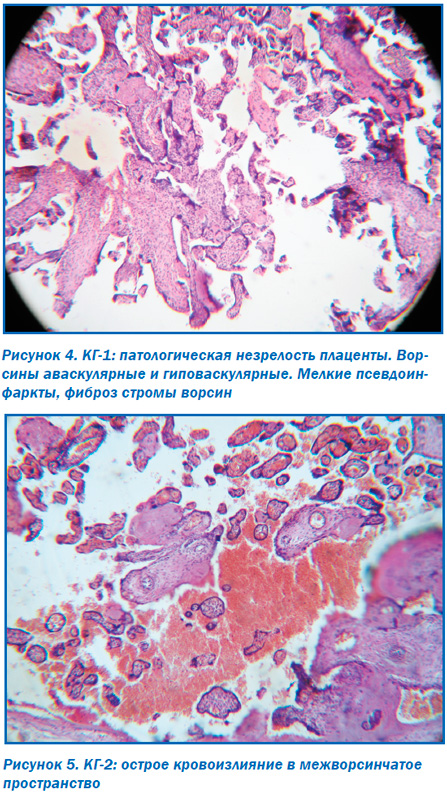
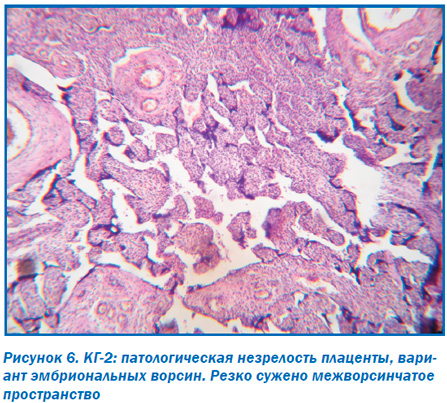
Морфологическое исследование плацент свидетельствовало об отсутствии достоверных макроскопических различий в размерах (р > 0,05), форме (р > 0,05), объемах (р > 0,05) и массе плацент (р > 0,05). При этом микроскопическое исследование плацент продемонстрировало некоторые морфологические преференции. Так, у большинства пациенток ОГ в плацентах отмечалось преимущественно диссоциированное созревание ворсин (75,00 ± 9,68 %) наряду со зрелыми ворсинами с хорошо развитыми синцитиокапиллярными мембранами, имелись гиповаскуляризированные, с фибротизированной –стромой ворсины с достаточным количеством сосудов, но без сформированных синцитиокапиллярных мембран (рис. 2). Для остальных плацент пациенток этой группы (25,0 ± 7,8 %) характерной была патологическая незрелость ворсин с преобладанием склерозированных аваскулярных ворсин и компенсаторной гиперплазией синцитиальных почек (рис. 3). При этом для плацент пациенток КГ-1, не получавших терапию, характерным была патологическая незрелость плаценты с аваскулярными и гиповаскулярными ворсинами, мелкими псевдоинфарктами, фиброзом стромы ворсин (рис. 4). Для плацент пациенток КГ-2 характерными были или острое кровоизлияние в межворсинчатое пространство (рис. 5), или патологическая незрелость плаценты с резким сужением межворсинчатого пространства (рис. 6).
Выводы
1. Метаболическая терапия пренатальной добавкой Омегами Заботливая мама Базис хорошо переносится беременными пациентками, за время исследования не было зарегистрировано каких-либо побочных действий препарата или отказа от его приема.
2. Использование пренатальной добавки Омегами Заботливая мама Базис у беременных женщин с плацентарной дисфункцией в виде СЗРП и маловодия в сроке гестации 22–28 недель позволяет достоверно более длительно осуществлять безопасное наблюдение за пациентками до момента вынужденного досрочного родоразрешения (5,58 ± 0,27 недели), что способствует достижению достоверно большего срока гестации (30,29 ± 0,52 недели) недоношенных новорожденных (р > 0,05).
3. Использование пренатальной добавки Омегами Заботливая мама Базис в сроке беременности 22–28 недель при наличии СЗРП и маловодия не влияет: на степень выраженности СЗРП (р > 0,05), частоту перинатальной смертности (р > 0,05), массу тела недоношенных новорожденных детей (р > 0,05).
4. При применении пренатальной добавки Омегами Заботливая мама Базис в качестве метаболической терапии при ПД в виде СЗРП и маловодия отмечаются такие благоприятные эффекты:
— более длительное безопасное пребывание плода в утробе матери до вынужденного родоразрешения (вероятно, за счет увеличения продолжительности эффекта централизации кровообращения)(р < 0,05);
— большая «зрелость» недоношенных новорожденных;
— более высокие оценки по шкале Апгар и низкие — по шкале Сильвермана (р < 0,05);
— меньшая частота и выраженность СДР новорожденных (р < 0,05);
— меньшая потребность в использовании ИВЛ и сурфактантной терапии (р < 0,05);
— меньшая частота ВЖК, ГИЭ и НЭК у новорожденных (р < 0,05 для всех сравнений).
— более длительное безопасное пребывание плода в утробе матери до вынужденного родоразрешения (вероятно, за счет увеличения продолжительности эффекта централизации кровообращения)(р < 0,05);
— большая «зрелость» недоношенных новорожденных;
— более высокие оценки по шкале Апгар и низкие — по шкале Сильвермана (р < 0,05);
— меньшая частота и выраженность СДР новорожденных (р < 0,05);
— меньшая потребность в использовании ИВЛ и сурфактантной терапии (р < 0,05);
— меньшая частота ВЖК, ГИЭ и НЭК у новорожденных (р < 0,05 для всех сравнений).
5. Морфологическое исследование плацент свидетельствовало о наличии выраженных компенсаторно-приспособительных морфологических признаков у пациенток ОГ в сравнении с плацентами пациенток, не получавших терапию (КГ-1), и минимальных признаков компенсации в плацентах пациенток, получавших внутривенную терапию, улучшающую микроциркуляцию (КГ-2).
6. Имеющиеся данные позволяют рекомендовать использовать пренатальную добавку Омегами Заботливая мама Базис в виде метаболической терапии при ПД с СЗРП и маловодием у пациенток в сроке беременности 22–28 недель, когда досрочное родоразрешение нецелесообразно вследствие раннего срока гестации, не позволяющего достичь оптимальных перинатальных результатов.
7. Перечисленные в данном исследовании подходы относятся исключительно к указанным срокам гестации, а использование препарата Омегами не может рассматриваться как метод лечения СЗРП или альтернатива досрочному родоразрешению в сроках гестации после 32 недель.
8. Целесообразны дальнейшие исследования возможностей применения пренатальной добавки Омегами Заботливая мама Базис в более ранние сроки гестации с указанной целью.
Список литературы
1. Медико-демографічна ситуація та основні показники медичної допомоги населенню в регіональному аспекті. 2013 рік. — К., 2014. — 168 с.
2. Рыбалка А.Н., Егорова Я.А. Плацентарная дисфункция и перинатальные потери // Крымский журнал экспериментальной и клинической медицины. — 2012. — Т. 2, № 3–4. — С. 7-8.
3. Моісеєнко Р.О. Аналіз захворюваності дітей першого року життя в Україні / Р.О. Моісеєнко // Перинатология и педиатрия. — 2010. — № 1(41). — С. 6-9.
4. Симрок В.В., Гордиенко Е.В., Симрок-Старчева Д.В. Плацентарная недостаточность: новый взгляд на старую проблему // Новости медицины и фармации. Гинекология. — 2008. — № 253.
5. ВОЗ, 1999, 2001. — www.early-nutrition.org
6. Наказ МОЗ України від 27.12.2006 № 900 «Дистрес плода».
7. Наказ МОЗ України від № 782 «Затримка росту плода».
8. Singh M. Essential fatty acids, DHA and human brain // Indian J. Pediatr. — 2005. — № 72. — Р. 239-242. — www.childrenvision.com
9. Dyall S.C., Michael-Titus A.T., 2008.
10. ВОЗ, 1999, 2001. — www.early-nutrition.org/perilip/
11. Сидельникова В.М. Применение Омега-3 ПНЖК для профилактики и комплексного лечения тромбофилитических нарушений при беременности // РМЖ. — 2005. — Т. 16, № 6. — С. 1-6.