Статья опубликована на с. 11-19
Над проблемой увеличения эффективности лечения головокружения уже долгие годы работают ведущие неврологи различных стран [5, 8–10, 19]. Однако много вопросов, имеющих высокое медико-социальное значение, остаются нерешенными [16, 25, 31]. Актуальность данной проблемы определяется высоким уровнем распространенности головокружения и значительным ухудшением качества жизни пациентов с этой патологией [28]. Головокружение — второй по частоте (после головной боли) симптом, причем встречающийся не только при заболеваниях нервной системы. По данным отечественных и зарубежных авторов, головокружением страдают до 40 % пациентов, посещающих врача-невролога или оториноларинголога, и до 25 % — врача общей практики [1, 15, 24, 27]. В последние годы отмечается значительный рост встречаемости данного симптома среди населения развитых стран [8, 9, 15, 32]. Численность больных с кохлеовестибулярными расстройствами составляет свыше 10 человек на 10 тысяч населения [2, 18], причем отоневрологическое обследование пациентов, страдающих нейросенсорной тугоухостью без субъективных нарушений статического и динамического равновесия, позволяет выявить заинтересованность вестибулярного анализатора более чем в 80 % случаев [1, 3, 21, 32]. Головокружение приводит к значительному ухудшению качества жизни больного, лишая его возможности вести привычный образ жизни и качественно выполнять профессиональные обязанности, нередко делая его зависимым от посторонней помощи в обиходе, может вызвать стойкую утрату трудоспособности либо стать причиной инвалидности. В связи с этим проблема лечения больных, страдающих головокружением, становится все более актуальной не только в медицинском, но и в социальном аспекте.
Головокружение сопровождает самые разные состояния, различающиеся по этиологии и требующие комплексного диагностического подхода [4, 17, 23]. Независимо от причины, вызвавшей головокружение, будь то физиологическая стимуляция (поездка в транспорте, взгляд с высоты) или патологическая дисфункция (одностороннее поражение лабиринта или вестибулярных путей в центральной нервной системе (ЦНС)), клинически, как правило, возникает схожий симптомокомплекс, включающий, помимо головокружения, тошноту, нистагм и атаксию [28, 29]. Эти симптомы обусловлены нарушением основных функций вестибулярной системы, контролируемых различными отделами головного мозга. Так, нарушение контроля за положением тела в пространстве вызывает головокружение, утрата способности фиксировать взор — нистагм, нарушение контроля за поддержанием позы — атаксию, повреждение вестибуловегетативных связей — тошноту [20].
Головокружение представляет собой иллюзию движения самого человека или окружающих предметов вокруг него и может быть отражением физиологической реакции или проявлением заболевания [29]. Наверное, нет человека, ни разу не испытавшего головокружения. Между тем нередко под головокружением понимают совершенно разные проявления: от легкой неустойчивости, чувства дурноты или опьянения до ощущения вращения собственного тела или окружающих предметов. Важным этапом диагностического поиска является дифференцирование типа головокружения. Выделяют системное (истинное, или вестибулярное) и несистемное (невестибулярное) головокружение. Невестибулярное головокружение, как правило, длительное, характеризуется отсутствием чувства вращения, редко сопровождается объективными признаками поражения вестибулярного анализатора или тугоухостью [3, 13, 23].
Пациенты, жалуясь на головокружение, описывают самые разнообразные ощущения, которые можно свести к трем основным понятиям:
1) предобморочное состояние и обморок: появляются потливость, тошнота, чувство страха, темнеет в глазах, затем наступает кратковременная потеря сознания;
2) нарушение равновесия невестибулярного происхождения: «шатает», «качает», «невозможно удержаться на ногах» (возникает при полисенсорной недостаточности, мозжечковых нарушениях, экстрапирамидной недостаточности, опухолях задней черепной ямки);
3) неопределенные ощущения: «туман в голове», «легкое опьянение», «земля уходит из-под ног» и т.д. (чаще при эмоциональных расстройствах).
Вестибулярное (истинное, системное) головокружение характеризуется специфическими жалобами на ощущение вращения собственного тела или окружающих предметов, часто в определенную сторону (вправо-влево — вращательное головокружение, вперед-назад — линейное головокружение), и обусловлено органическим поражением вестибулярного анализатора на различных уровнях. Патологические процессы, затрагивающие вестибулярную систему, сопровождаются нарушениями связей с другими структурами центральной нервной системы и вызывают системное головокружение, часто сочетающееся с психовегетативными расстройствами: тошнотой, рвотой, бледностью кожи, усиленным потоотделением, тревогой. Любое поражение вестибулярной системы немедленно приводит к вегетативным расстройствам [6, 7, 11].
Среди причин возникновения системного головокружения можно выделить:
1. Поражение вестибулярного анализатора периферического уровня (внутреннее ухо, вестибулярный узел, вестибулярная порция VIII нерва) в большинстве случаев обусловлено доброкачественным позиционным головокружением (ДПГ), острым вестибулярным нейронитом и болезнью Меньера, реже — сдавлением преддверно-улиткового нерва сосудом (вестибулярная пароксизмия), двусторонней вестибулопатией или перилимфатической фистулой, лабиринтитами различной этиологии (вирусные, бактериальные, токсические, термические, травматические), тромбозами или кровоизлияниями в области кровоснабжения лабиринтной артерией, травмами горизонтального (реже вертикального) полукружного канала, круглого или овального окна [21, 22, 32]. Периферическое вестибулярное головокружение проявляется сильнейшими приступами и сопровождается спонтанным нистагмом, падением в сторону, противоположную направлению нистагма, а также тошнотой и рвотой [14].
2. Центральное поражение вестибулярного анализатора обусловлено поражением волокон, связывающих вестибулярные ядра с медиальной зоной мозжечка, ядрами глазодвигательных нервов, таламусом, спинным мозгом и вестибулярными зонами коры. В одних случаях головокружение может быть основным проявлением повреждения центральных вестибулярных структур, например при синдромах, сопровождающихся нистагмом, направленным вверх или вниз. Такой нистагм возникает только при поражениях ствола мозга или мозжечка. В иных случаях головокружение сочетается с многочисленными проявлениями повреждения инфратенториальных образований, например надъядерными или ядерными глазодвигательными расстройствами, а также другими симптомами поражения ствола мозга (в частности, при латеральном синдроме продолговатого мозга). Центральное вестибулярное головокружение может продолжаться несколько секунд или минут (при базилярной или вестибулярной мигрени), несколько часов или суток (при инфаркте ствола мозга) или постоянно (при синдроме Арнольда — Киари с нистагмом, направленным вниз). Наиболее часто развитие центрального вестибулярного головокружения обусловлено сосудистыми и воспалительными заболеваниями ствола мозга и мозжечка (лакунарные инфаркты, бляшки демиелинизации при рассеянном склерозе), реже встречается базилярная и вестибулярная мигрень [2, 18, 26].
Таким образом, системное головокружение — распространенный симптом многих заболеваний, сопровождающихся поражением вестибулярной системы, с которыми сталкиваются в своей практике врачи различных специальностей.
Наиболее важным медиатором вестибулярной системы является гистамин. Его находят в разных отделах вестибулярной системы. Определенное значение в формировании связей вестибулярной системы имеет серотонинергическая, норадренергическая и дофаминергическая иннервация, однако передача импульсов от вестибулярных рецепторов и вестибулярных ядер обеспечивается преимущественно гистаминергическими нейронами. Основным источником гистаминергической иннервации являются задние отделы гипоталамуса, главным образом туберомамиллярное ядро. Его нейроны связаны с корой головного мозга, базальными ганглиями, мезэнцефальной областью, миндалевидными ядрами, ядрами среднего мозга, в частности с комплексом вестибулярных ядер; а также с мозжечком и ядрами продолговатого мозга. Во всех этих областях были идентифицированы гистаминергические рецепторы [28, 30]. Однако наиболее представлена гистаминергическая иннервация в медиальном вестибулярном ядре и в области сосудистой полоски внутреннего уха.
Различают три типа гистаминовых рецепторов: H1, H2 (постсинаптические), H3 (пресинаптические). Активация H1-рецепторов приводит к расширению капилляров, снижение активности — к вазоспазму и, соответственно, ухудшению кохлеарного и вестибулярного кровотока, т.е. областей с наибольшей плотностью расположения указанных рецепторов. H3-рецепторы локализуются на пресинаптических мембранах синапсов и регулируют высвобождение гистамина и других нейромедиаторов, в том числе серотонина. Серотонин, как известно, снижает активность вестибулярных ядер. Блокада H3-рецепторов вызывает ингибирование импульсной активации ампулярных клеток внутреннего уха и вестибулярных ядер ствола мозга. Кроме того, увеличение концентрации гистамина, отмечающееся при блокаде H3-рецепторов, также приводит к вазодилатации [22, 25, 28, 30].
Н3-рецепторы по механизму отрицательной обратной связи регулируют синтез и секрецию гистамина, тормозят передачу возбуждения на уровне окончаний симпатических сосудосуживающих волокон, вызывают вазодилатацию сосудов головного мозга.
Гистаминергические нейроны связаны со многими участками мозга, оказывают влияние не только на вестибулярную функцию, но и на регуляцию сна и пробуждения, поведения и локомоторных функций, регуляцию работы сердечно-сосудистой системы, терморегуляцию, мышечную активность, прием пищи, сексуальные отношения, обменные процессы в мозге, продукцию ряда гормонов и рилизинг-факторов (адренокортикотропный гормон, пролактин, вазопрессин) [12, 20, 31]. Гистаминергическая система также обеспечивает передачу возбуждения между вестибулярными ядрами и рвотным центром.
При периферических вестибулярных расстройствах наблюдается усиление спонтанной импульсации нейронов ипсилатеральных вестибулярных ядер, главным образом медиального. Одновременно отмечается снижение экспрессии рецепторов гамма-аминомасляной кислоты (ГАМК), что ведет к преобладанию возбуждающих гистаминергических влияний. Кроме того, происходит увеличение плотности ГАМК-рецепторов в контралатеральном медиальном вестибулярном ядре. Таким образом, считается, что основным нейрохимическим механизмом нарушения вестибулярной функции является активация гистаминовых рецепторов, находящихся в гипоталамической области и в различных отделах вестибулярной системы. При огромном разнообразии причин системного головокружения ряд патогенетических звеньев, в частности дисфункция гистаминергической системы, являются общими независимо от фактора, первично запустившего патологический каскад [4, 8, 16, 25, 30, 31].
Оптимизация лечебных мероприятий, например использование рациональной фармакотерапии, является одним из наиболее сложных направлений в проблеме головокружения. Для лечения головокружения используется большое число лекарственных препаратов различных фармакологических групп, однако лишь некоторые из них обладают доказанным в исследованиях вертиголитическим эффектом [28, 30, 31].
Одним из препаратов, имеющих структурное сходство с гистамином, аффинитет к блокированию Н3- и стимуляции Н1-рецепторов, является Тагиста (бетагистина гидрохлорид) [12, 29].
Вследствие избирательного взаимодействия с гистаминовыми рецепторами препарат Тагиста увеличивает высвобождение нейромедиаторов (гистамина) из нервных окончаний пресинаптической мембраны рецепторных клеток внутреннего уха в синапс. Нейромедиаторы действуют на прекапиллярные сфинктеры, вызывая вазодилатацию сосудов внутреннего уха, повышая проницаемость их и тем самым нормализуя внутрилабиринтное давление, т.е. устраняя гидропс. Кроме воздействия на рецепторы внутреннего уха, бетагистин оказывает влияние на рецепторы вестибулярных ядер, находящихся в стволе продолговатого мозга. В экспериментальных работах на животных показано повышение уровня серотонина в продолговатом мозге [28]. Также под влиянием бетагистина было выявлено уменьшение интенсивности и амплитуды импульсации нейронов латерального вестибулярного ядра как в покое, так и при стимуляции. Это приводит к снижению возбудимости вестибулярных ядер и к прекращению головокружения [20]. Тагиста также стимулирует синтез эндогенного гистамина, о чем, в частности, свидетельствует усиление синтеза матричной РНК, кодирующей гистидиндекарбоксилазу — основной фермент синтеза гистамина [30]. Необходимо отметить, что фармакологической активностью обладает также метаболит бетагистина — 2,2-аминоэтилпиридин, что, вероятно, является одной из причин длительного положительного эффекта препарата [31].
По данным клинических исследований, наряду с воздействием на гистаминовые рецепторы периферических и центральных вестибулярных образований, бетагистин активизирует микроциркуляцию, увеличивает кровоток в артериях внутреннего уха и в системе базилярной артерии, оказывает центральное действие на уровне ствола головного мозга (нормализует процессы нейрональной трансмиссии) при отсутствии седативного эффекта [25, 26]. Бетагистин также оказывает положительное влияние на процессы вестибулярной компенсации [6, 5, 20, 28].
В клинике острого вертиго, которое возникает в значительной степени из-за нарушений баланса электрических потенциалов в вестибулярных ядрах обоих полушарий, обнаруживается такая тенденция: во время острой фазы клетки мозжечка ингибируют вестибулярные ядра и тем самым облегчают симптомы. Это явление очень образно называют «мозжечковым зажимом». Постепенно, в течение нескольких недель, вестибулярные ядра неповрежденной стороны берут на себя функцию пораженных ядер. Это наблюдается анатомически как возникновение кросс-синапсов и приводит к балансу импульсной активности ядер обеих сторон. Как только это происходит, вестибулярные ядра постепенно освобождаются от эффекта «мозжечкового зажима». Весь процесс называют компенсацией, благодаря ей человек или животное, страдавшие острыми приступами головокружения, вновь обретают чувство равновесия, даже если исходная патология необратима.
Большинство лекарственных препаратов, применяемых для купирования головокружения, вызывают седацию и угнетение ЦНС. Это замедляет процесс компенсации, который столь необходим для реабилитации пациента. Препарат Тагиста, не вызывающий угнетения ЦНС, не мешает процессу компенсации. Тагиста не является седативным средством, поэтому не нарушает нормального образа жизни пациентов. Препарат действительно оказывает эффект «ускорения» на вестибулярную адаптацию, что жизненно необходимо для быстрой реабилитации пациентов с острой периферической вестибулярной катастрофой [20].
Таким образом, применение препарата Тагиста (бетагистина гидрохлорид) в дополнение к этиологической терапии является теоретически обоснованным при системном головокружении любой этиологии.
Целью данной работы явилось изучение эффективности применения препарата Тагиста в сравнении с плацебо у пациентов с поражениями вестибулярной системы на различных уровнях, вызванными различными причинами.
Задачами исследования являлись:
1. Изучение эффективности применения препарата Тагиста у больных с доброкачественным позиционным головокружением, острым вестибулярным нейронитом, центральным вестибулярным головокружением, при лакунарных инфарктах и рассеянном склерозе.
2. Сравнительный анализ эффективности использования препарата Тагиста при поражении центрального и периферического уровней вестибулярного анализатора.
Материалы и методы
В исследование было включено 200 человек, 105 из них были рандомизированы в группу исследуемого препарата, 95 — в группу плацебо. Все больные основной группы, кроме стандартной терапии, получали курс лечения препаратом Тагиста (24 мг 2 раза в день) в течение 14 дней. Независимо от группы проводилось этиотропное лечение в полном объеме согласно протоколам. Запрещенные к применению препараты на момент проведения исследования: циннаризин, танакан, фезам и винпоцетин. Все пациенты подписали информированное согласие. Для стандартизации получаемой информации была разработана индивидуальная регистрационная карта (ИРК).
Вся информация, внесенная в ИРК, вводилась в электронную базу данных и обрабатывалась с помощью компьютерной программы Microsoft Excel. Полученные результаты обрабатывались с расчетом абсолютных и относительных величин с использованием пакета статистических программ Statistica 6.0. Кроме того, рассчитывались средние величины, ошибки средних и относительных величин. Использовались методы параметрической (при нормальном распределении признаков) и непараметрической статистики (при ненормальном распределении признаков). Нормальность распределения признаков проверялась по тесту Колмогорова — Смирнова. При анализе межгрупповых различий в распределении качественных признаков использовался критерий Пирсона. При анализе межгрупповых различий в параметрических данных — дисперсионный анализ с расчетом поправки Бонферрони во избежание ошибки первого типа, связанной с множественностью сравнений при дальнейшем погрупповом сравнении. Степень вероятности определяли при помощи t-критерия Стьюдента. Все статистические тесты выполнялись при уровне статистической значимости р < 0,05.
Рандомизация проводилась с помощью случайного выбора лечащим врачом одного из запечатанных, перемешанных конвертов, внутри которого содержалось указание о назначении того или иного препарата.
Эффективность терапии определяли на основании анализа жалоб пациентов (ежедневная оценка частоты и выраженности приступов головокружения в течение суток, опросник Dizziness Handicap Inventory (DHI)), отоневрологического обследования, исследования вестибулярного анализатора с проведением комплекса вестибулярных проб. Для детальной оценки неврологического статуса применялись шкала оценки двигательной активности Тинетти, шкала выраженности депрессии Бека, а также шкала самооценки своего состояния Шихана (PGI-S). Оценку функциональных нарушений производили согласно Международной классификации функциональных нарушений: изменение симптоматики по шкале головокружения; тошнота, связанная с головокружением; ощущение падения; ходьба на дальние расстояния (1 балл — нет нарушений, 2 — легкие нарушения, 3 — умеренные нарушения, 4 — выраженные нарушения и 5 баллов — абсолютные нарушения). Качество жизни оценивали по вопросникам EQ-5D, SF-36.
Помимо общего клинического и неврологического обследований всем больным были проведены: аудиограмма, компьютерная и магнитно-резонансная томография головного мозга, ультразвуковая допплерография, а также дуплексное сканирование магистральных артерий головы, исследование акустических стволовых вызванных потенциалов.
Параллельно с оценкой эффективности препарата Тагиста выполнена сравнительная оценка его безопасности. На протяжении всего периода наблюдения за пациентами проводилось активное выявление и регистрация нежелательных побочных реакций.
Критерии эффективности
К первичным критериям эффективности были отнесены:
— оценка выраженности и длительности головокружения (опросник DHI (Jacobson G.P., Newman C.W., 1990));
— определение двигательной активности (шкала Тинетти);
— оценка качества жизни (SF-36, EQ-5D).
Шкала DHI состоит из 25 вопросов для самооценки. Ответ «да» оценивается в 4 балла, «иногда» — в 2 балла, «нет» — 0 баллов. Таким образом, возможная оценка варьирует от 0 до 100 баллов, указывая на выраженность головокружения (Jacobson, Newman, 1999) [33]. Балл по шкале DHI имеет высокую степень корреляции с результатами оценки стабилографии. Это позволяет использовать данную шкалу для оценки тяжести исходного состояния и эффективности лечения у пациентов с вестибулярными нарушениями.
Вторичными критериями эффективности были выбраны:
— оценка по шкале выраженности депрессии Бека;
— определение функциональных нарушений согласно международной классификации;
— шкала самооценки Шихана.
Общая характеристика больных
Больные основной и контрольной группы в начале исследования были сопоставимы по выраженности вестибулярных нарушений, а также по полу и возрасту.
В основную группу было включено 105 человек (54 женщины и 51 мужчина, средний возраст 42 года, разброс значений от 21 до 72 лет). В качестве контрольной группы было обследовано 95 больных (49 женщин и 46 мужчин, средний возраст 41 год, разброс значений от 22 до 70 лет). Распределение пациентов в группах в зависимости от нозологической формы, явившейся причиной системного головокружения, представлено в табл. 1.
Результаты и обсуждение
Клиническая картина вестибулярных расстройств была представлена периодическими приступами, длящимися от нескольких секунд до нескольких часов, или перманентным системным головокружением. Приступы головокружения возникали спонтанно или были связаны с изменением положения головы или тела (повороты и запрокидывание головы, наклоны туловища). Головокружение часто сопровождалось тошнотой и рвотой, падением, потерей сознания, иногда сочеталось со слуховыми симптомами — шумом в ушах или голове, заложенностью ушей, снижением слуха. Также отмечалось нарушение равновесия и координации движений, осциллопсии.
При отоневрологическом осмотре у пациентов с ДПГ и острым вестибулярным нейронитом был выявлен периферический вестибулярный синдром; у больных с лакунарными инсультами и рассеянным склерозом преобладал центральный вестибулярный синдром.
После проведения курса лечения в исследуемой группе у 101 (96,2 %) пациента было отмечено уменьшение выраженности субъективных жалоб и улучшение объективных показателей. В контрольной группе аналогичный показатель составил 67,4 % (p < 0,05).
Среднее количество эпизодов головокружения в группе, получавшей рутинную терапию, составило в начале лечения 8,3 ± 1,8 эпизода, через 7 суток терапии — 5,4 ± 0,7 эпизода, на 14-й день — 4,1 ± 1,2 эпизода. Среднее число эпизодов головокружения в группе, получавшей препарат Тагиста, в начале лечения было равно 8,6 ± 2,1 эпизода, через 7 дней терапии — 3,8 ± 0,9 эпизода, на 14-е сутки — 1,9 ± 0,8 эпизода. В результате статистического анализа была установлена статистическая достоверность различий между группами как на 7-й, так и на 14-й день терапии (t = 2,71; p < 0,01).
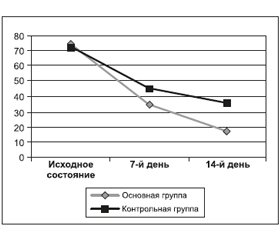
При определении состояния пациентов по шкале DHI выявлено следующее. Исходная оценка по шкале DHI в группе, получавшей рутинную терапию, составила 72,7 ± 8,2 балла, через 7 суток — 44,7 ± 5,8 балла, на 14-й день — 35,4 ± 3,2 балла.
Исходная оценка по шкале DHI в группе препарата Тагиста равнялась 73,9 ± 9,2 балла, через 7 дней — 35,1 ± 2,8 балла, на 14-е сутки — 17,4 ± 0,9 балла. В результате статистического анализа была установлена статистическая достоверность различий между группами как на 7-й, так и на 14-й день терапии (t = 15,63; p < 0,05) (рис. 1).
На 14-й день лечения отмечена положительная динамика по шкалам двигательной активности Тинетти и депрессии Бека в обеих группах независимо от нозологической формы, вызвавшей вестибулярные нарушения. Однако при применении препарата Тагиста положительный эффект был достоверно более значимым (p < 0,01). Показатели по шкале Тинетти на 14-й день лечения в группах представлены в табл. 2.
Степень выраженности головокружения, нарушений движения и эмоциональных расстройств уменьшалась параллельно с положительной динамикой качества жизни пациентов. Динамика балльной оценки по шкале депрессии Бека и SF-36 (физический и психологический компонент здоровья) в группах свидетельствует о достоверно более выраженном влиянии препарата Тагиста на 14-й день лечения по сравнению с группой контроля (p < 0,01) (табл. 3).
Фармакотерапия препаратом Тагиста была эффективна у всех пациентов, о чем свидетельствует снижение выраженности головокружения, а также частоты приступов в день. Достоверное улучшение показателей в группе больных, получавших препарат Тагиста, по сравнению с контрольной группой было зарегистрировано на седьмой день терапии (р < 0,02).
Для исключения возможности интерпретации положительного эффекта препарата Тагиста только за счет воздействия на периферический отдел вестибулярного анализатора был проведен сравнительный анализ эффективности применения препарата Тагиста у пациентов с центральным вестибулярным синдромом по сравнению с больными с периферическим вестибулярным синдромом.
Статистически значимых различий в эффективности препарата Тагиста при центральном и периферическом вестибулярных синдромах выявлено не было. Анализ действия препарата Тагиста свидетельствует о его разностороннем влиянии на различные патогенетические механизмы головокружения и, следовательно, о патогенетической обоснованности применения препарата при различных типах вестибулярного головокружения.
Статистически достоверная положительная динамика при терапии препаратом Тагиста в дозировке 48 мг в сутки у больных основной группы сопровождалась минимальным количеством побочных эффектов — не отмечалось сонливости и седативного эффекта, частота других побочных реакций была минимальной и статистически не отличалась от таковой в контрольной группе (табл. 4). Возникшие нежелательные реакции были легко выраженными, разрешились без последствий, не повлекли отмены исследуемого препарата.
Выводы
Проведенное исследование показало, что применение препарата Тагиста в комплексном лечении пациентов с вестибулопатией (в дополнение к этиотропной терапии и вестибулярной гимнастике) не только способствовало значительному уменьшению частоты приступов головокружения, снижению их интенсивности и продолжительности, но и достоверно улучшало качество жизни пациентов с головокружением, связанным с периферическими и центральными вестибулярными расстройствами. Таким образом, препарат Тагиста является эффективным лекарственным средством для купирования вестибулярных расстройств не только периферического, но и центрального уровня поражения и может с успехом применяться независимо от причины системного головокружения.
Список литературы
1. Бабияк В.И., Ланцов А.А., Базаров В.Г. Клиническая вестибулология. — СПб., 1996.
2. Белова А.Н. Шкалы, тесты, опросники в неврологии и нейрохирургии. — М., 2004. — С. 155.
3. Брандт Т., Дитерих М., Штрупп М. Головокружение: Пер. с англ.; Редактор пер. М. В. Замерград. — М.: Практика, 2009. — С. 18-23, 80-120, 140-142.
4. Верещагин Н.В. Недостаточность кровообращения в вертебрально-базилярной системе // Consilium Medicum. — 2003. — Т. 5, № 2. — С. 56-61.
5. Замерград М. В., Парфенов В. А., Мельников О. А. Лечение вестибулярного головокружения // Журнал неврологии и психиатрии имени С.С. Корсакова. — 2008. — Т. 108, № 11. — С. 86-92.
6. Овчинников Ю.М., Морозова С.В. Введение в отоневрологию: Учеб. пособие. — М.: Образовательно-издательское учреждение «Академия», 2006. — 224 с.
7. Штульман Д.Р. Головокружение и нарушение равновесия // Болезни нервной системы / Под ред. Н.Н. Яхно. — М.: Медицина, 2005. — С. 125-30.
8. Agrawal Y., Carey J.P., Della Santina C.C. Disorders of balance and vestibular function in US adults: data from the National Health and Nutrition Examination Survey, 2001–2004 // Arch. Int. Med. 2009; 169(10): 938-44.
9. Al Saif A., Al Senany S. The clinical and demographic features of dizziness related to general health among the Saudi population // J. Phys. Ther. Sci. 2015 Oct; 27(10): 3195-8. doi: 10.1589/jpts.27.3195. Epub 2015 Oct 30.
10. Aptikeeva N.V. Central and peripheral vestibular vertigo in neurological practice // Zh. Nevrol. Psikhiatr. Im. S.S. Korsakova. 2015; 115(5): 110-4. Review. Russian.
11. Balatsouras D.G., Korres S.G. Subjective benign paroxysmal positional vertigo // Otolaryngol. Head Neck Surg. 2012; 146: 98-103.
12. Berisavac I.I., Pavlović A.M., Trajković J.J., Šternić N.M., Bumbaširević L.G. Drug treatment of vertigo in neurological disorders // Neurol. India. 2015 Nov-Dec; 63(6): 933-9.
13. Bisdorff A. Migraine and dizziness // Curr. Opin. Neurol. 2014; 27: 105-110.
14. Cambi J., Astore S., Mandala M., Trabalzini F., Nuti D. Natural course of positional down-beating nystagmus of peripheral origin // J. Neurol. 2013; 260: 1489-1496.
15. Case Records of the Massachusetts General Hospital // N. Engl. J. Med. 2012; 366: 2306-2313.
16. Coutts S.B., Goyal M. Emergent Neurovascular Imaging: A Necessity for the Work-Up of Minor Stroke and TIA // American Journal of Neuroradiology. 2015; 36: 2194-2195.
17. Ehresmann A.M., Van H.C., Merlini L., Fluss J. Wallenberg Syndrome: An Exceptional Cause of Acute Vertigo in Children // Neuropediatrics. 2015, Nov 16.
18. Faralli M., Cipriani L., Del Zompo M.R., Panichi R., Calzolaro L., Ricci G. Benign paroxysmal positional vertigo and migraine: analysis of 186 cases // B-ENT. 2014; 10: 133-139.
19. Feil K., Böttcher N., Kremmyda O., Muth C., Teufel J., Zwergal A., Brandt T., Strupp M. Pharmacotherapy of Vestibular Disorders, Nystagmus and Cerebellar Disorders // Fortschr. Neurol. Psychiatr. 2015 Sep; 83(9): 490-8. doi: 10.1055/s-0035-1553667. Epub 2015 Sep 30. German.
20. Guneri E.A., Kustutan O. The effects of betahistine in addition to epley maneuver in posterior canal benign paroxysmal positional vertigo // Otolaryngol. Head Neck Surg. 2012; 146(1): 104-8.
21. Gupta S.K., Mundra R.K. Electronystagmography a Very Useful Diagnostic Tool in Cases of Vertigo // Indian J. Otolaryngol. Head Neck Surg. 2015 Dec; 67(4): 370-4. doi: 10.1007/s12070-015-0859-y. Epub 2015 May 17.
22. Kim J.S., Zee D.S. Clinical practice. Benign paroxysmal positional vertigo // N. Engl. J. Med. 2014; 370: 1138-1147.
23. Kerber K.A., Burke J.F., Skolarus L.E. et al. Use of BPPV processes in emergency department dizziness presentations: a population-based study // Otolaryngol. Head Neck Surg. 2013; 148: 425-430.
24. Nuti D., Zee D.S. Positional vertigo and benign paroxysmal positional vertigo // Bronstein A., ed. Oxford textbook of vertigo and imbalance. Oxford, England: Oxford University Press, 2013: 217-30.
25. Redon C., Lopez C., Bernard-Demanze L. Betahistine treatment improves the recovery of static symptoms in patients with unilateral vestibular loss // J. Clin. Pharmacol. 2011; 51(4): 538-48.
26. Smith E.E., Schneider J.A., Wardlaw J.M., Greenberg S.M. Cerebral microinfarcts: the invisible lesions // Lancet Neurol. 2012; 11: 272-282.
27. Soto-Varela A., Rossi-Izquierdo M., Santos-Pérez S. Benign paroxysmal positional vertigo simultaneously affecting several canals: a 46-patient series // Eur. Arch. Otorhinolaryngol. 2013; 270: 817-822.
28. Strupp M., Dieterich M., Zwergal A., Brandt T. Peripheral, central and functional vertigo syndromes // Nervenarzt. 2015 Dec; 86(12): 1573-87. doi: 10.1007/s00115-015-4425-3. German.
29. Strupp M., Thurtell M.J., Shaikh A.G. Pharmacotherapy of vestibular and ocular motor disorders, including nystagmus // J. Neurol. 2011; 258(7): 1207-22.
30. Thurtell M.J., Leigh Lezius F., Adrion C., Mansmann U. High-dosage betahistine dihydrochloride between 288 and 480 mg/day in patients with severe Meniere’s disease: a case series // Eur. Arch. Otorhinolaryngol. 2011; 268(8): 1237-40.
31. Venail F., Biboulet R., Mondain M. A protective effect of 5-HT3 antagonist against vestibular deficit? Metoclopramide versus ondansetron at the early stage of vestibular neuritis: A pilot study // Eur. Ann. Otorhinolaryngol. Head Neck Dis. 2012 Apr; 129(2): 65-8.
32. Von Brevern M., Neuhauser H. Epidemiological evidence for a link between vertigo and migraine // J. Vestib. Res. 2011; 21: 299-304.
33. Newman C.W., Jacobson G.P., Spitzer J.B. Development of the Tinnitus Handicap Inventory // Arch. Otolaryngol. Head Neck Surg. 1999; 122(2): 143-148.
/15.jpg)
/16.jpg)

/16_2.jpg)
/17.jpg)