Статтю опубліковано на с. 35-41
Вступ
У сучасному суспільстві однією з провідних медико-соціальних проблем є проблема депресивних розладів (ДР). Згідно з даними літератури, судинні та нейродегенеративні захворювання головного мозку призводять не лише до порушення когнітивних і рухових функцій, але й до розвитку ДР [10, 15], які, на жаль, є в таких випадках недостатньо добре діагностованими [25, 27]. Протягом останніх років все більше уваги приділяється депресії як незалежному фактору, який суттєво впливає на якість життя пацієнтів [20, 21]. В численних клінічних дослідженнях доведено, що ДР є значним предиктором кардіоваскулярних ускладнень [13, 18], а також поряд із такими факторами, як когнітивні порушення (КП), вік, чоловіча стать, наявність лакун у головному мозку, підвищують ризик смертності від цереброваскулярної патології [8].
У літературі було запропоновано кілька видів взаємозв’язку між депресією та КП: депресія може бути раннім симптомом або продромом виникнення КП; клінічне обстеження, необхідне для діагностики депресії дає можливість раніше виявити ранні прояви деменції; пацієнти, в яких виявлено початкові прояви когнітивного дефіциту, мають значно більшу ймовірність розвитку депресії [14, 22].
Значне зростання кількості ДР у популяції розвинутих країн світу виводить їх за рамки психіатрії і включає до сфери повсякденної діяльності неврологів, терапевтів, сімейних лікарів, що обумовлює нагальну потребу розробки нових антидепресантів, що мають розширений спектр клініко-фармакологічних ефектів та високий рівень безпеки [2, 11]. Саме до таких препаратів належить тразодон (Триттіко), унікальність якого полягає в його дозозалежних клінічних ефектах. В малих дозах (50–150 мг/добу) цей препарат чинить поєднану снодійну та анксіолітичну дію, у великих дозах (150–450 мг/добу) тразодон проявляє себе як ефективний антидепресант. Тразодон є інгібітором транспорту серотоніну й антагоністом 5-HT2A- та 5-HT2C-рецепторів, він також є антагоністом H1-гістамінових та α1-адренергічних рецепторів [29]. У малих дозах тразодон блокує тільки 5-НТ2а-серотонінові рецептори, а також (меншою мірою) α1-адренорецептори і гістамінові Н1-рецептори [12]. Саме через даний поєднаний механізм дії реалізуються гіпнотичний та анксіолітичний ефекти тразодону. Відомо, що 5-НТ2-рецептори концентруються в кортико-лімбічних структурах, що долучаються до регуляції психоемоційних і когнітивних функцій, при цьому їх щільність суттєво зростає у пацієнтів з ДР, особливо в поєднанні з тривогою [16]. Більшість антидепресантів (трициклічні, інгібітори моноаміноксидази, ряд селективних інгібіторів зворотного захвату серотоніну) блокують не лише 5-НТ-2с-рецептори, але й інший підтип серотонінових рецепторів — 5-НТ-1а, через який реалізуються фізіологічні ефекти серотоніну, з чим і пов’язана значна кількість побічних ефектів вищезазначених антидепресантів, у тому числі розвиток сексуальної дисфункції, шлунково-кишкових ускладнень, серотонінового синдрому та порушення сну. Тразодон не має таких недоліків, більше того, на відміну від інших антидепресантів цей препарат не змінює структуру сну, а отже, чинить максимально фізіологічну дію [29]. Антидепресивний ефект тразодону пов’язаний також з активацією вивільнення норадреналіну та дофаміну в корі головного мозку внаслідок усунення гальмівного впливу на ці процеси, що реалізуються через 5-НТ2а- і 5-НТ2с-рецептори [28]. У численних клінічних дослідженнях показана порівнянна з іншими антидепресантами висока ефективність тразодону у лікуванні ДР [6, 7, 9, 23].
Здебільшого лікування депресії сприяє покращенню когнітивного функціонування у пацієнтів, проте не призводить до відновлення когнітивних функцій до нормального рівня [22]. Питання щодо сприятливого впливу антидепресивної терапії на зменшення ризику розвитку можливих КП і ступеня вираженості існуючих КП потребує подальшого вивчення.
Метою нашого дослідження було вивчення ефективності антидепресивної терапії з використанням тразодону (Триттіко) для лікування ДР і можливої корекції когнітивного дефіциту у пацієнтів з дисциркуляторною енцефалопатією (ДЕ).
Матеріали та методи
Нами було обстежено 27 пацієнтів середнього та похилого віку (середній вік 59,6 ± 7,3 року) з ДЕ ІІ стадії. Діагноз ДЕ встановлювали за загальноприйнятими критеріями [3, 5]. Серед обстежених хворих було 14 жінок і 13 осіб чоловічої статі. Вищу освіту мали 17 пацієнтів, середню — 10 хворих. У всіх обстежених пацієнтів діагностовано ДР і КП різного ступеня вираженості.
У всіх хворих проведено клініко-неврологічне обстеження, загальні лабораторні тести (загальний аналіз крові, загальний аналіз сечі, біохімічний аналіз крові, ліпідограму, аналіз крові на гормони щитоподібної залози); інструментальні дослідження: електрокардіографічне обстеження, магнітно-резонансну томографію (МРТ) головного мозку.
Синдром легких КП визначався відповідно до діагностичних критеріїв Н.Н. Яхно та співавт. [4]. Для визначення синдрому помірних КП використано модифіковані діагностичні критерії R.C. Petersen [26]. Для оцінки когнітивних функцій пацієнтів використовували: коротку шкалу оцінки психічного статусу (Mini Mental State Examination, MMSE) (визначення орієнтування в часі, місці, стану короткочасної, довготривалої пам’яті, функції мови, гнозису, праксису) [17], методику заучування 10 слів (дослідження процесів запам’ятовування, збереження й відтворення інформації); тест заучування парних взаємопов’язаних слів (The Paired Associates Learning Test, PALT) (дослідження негайної та відстроченої розпізнавальної пам’яті на вербальні стимули) [24]; таблиці Шульте (визначення темпу сенсомоторних реакцій, розумової працездатності, об’єму активної уваги пацієнтів); тест кольорово-словесної інтерференції (Stroop Color-Word Interference Test, SСWT), який дозволив оцінити ефективність процесів обробки інформації та увагу (виконавчі функції) [30].
За даними MMSE 29–30 балів оцінювали як відсутність порушення когнітивних функцій, 28–27 — легкі КП, 24–26 — помірні КП, < 24 балів — як деменцію [1].
Для оцінки тяжкості ДР і терапевтичної динаміки застосовували шкалу Гамільтона [19]: 0–13 балів вказувало на відсутність депресії, 14–17 — на легку депресію, 18–25 — на помірну депресію, > 25 балів — на тяжку депресію.
Всі пацієнти отримували тразодон (Триттіко) в дозі 150 мг на ніч протягом 2 місяців, при цьому терапію хворі розпочинали з прийому 50 мг тразодону зі збільшенням дози протягом 7 днів до досягнення 150 мг на добу. Всі пацієнти протягом перших 2 тижнів отримували терапію в стаціонарі, в подальшому продовжували лікування в амбулаторних умовах. Пацієнти отримували також базисну терапію, що включала гіпотензивні засоби, антиагреганти, статини, вазоактивні засоби (вінпоцетин, пентоксифілін), вітаміни групи В.
Усім хворим проведено повне клініко-неврологічне обстеження із застосуванням MMSE, нейропсихологічного тестування (до початку лікування та через 2 місяці терапії), шкали Гамільтона (до початку лікування, через 1 та 2 місяці терапії).
Статистичну обробку отриманих результатів проводили з використанням пакета статистичного аналізу Microsoft Excel 2003. Вірогідність різниці між середніми кількісними значенням двох вибірок визначали за коефіцієнтом Стьюдента (t). Для перевірки статистичних гіпотез про різницю абсолютних і відносних частот, часток і відношень у двох незалежних вибірках використовувався критерій хі-квадрат (χ2). Для з’ясування характеру та ступеня взаємозв’язку між різними показниками визначався коефіцієнт парної кореляції (r).
Результати та обговорення
Всі хворі (100 %) до початку лікування скаржились на зниження настрою, підвищену дратівливість, тривожність, загальну слабкість і підвищену стомлюваність, зниження фізичної та розумової працездатності, порушення нічного сну, що полягали в утрудненому засинанні, поверхневому, переривчастому сні, ранньому пробудженні. Частою скаргою хворих на ДЕ був локальний або дифузний головний біль гнітючого характеру, що виявлявся у 25 (93 %) пацієнтів і локалізувався переважно в потиличній, лобній або скроневій ділянках. Запаморочення спостерігалось у 24 (89 %) хворих на ДЕ. Скарги на шум у голові пред’являли 25 (93 %) пацієнтів. На оніміння кінцівок досить часто скаржилися 20 (74 %) обстежених. Хворі відзначали зниження пам’яті та уваги на події недавнього минулого, поточні події, імена, дати тощо.
У неврологічному статусі в пацієнтів найчастіше відзначалися порушення черепної іннервації. Легкі окорухові розлади спостерігалися у всіх 27 (100 %) пацієнтів з ДЕ та проявлялися у вигляді слабкості конвергенції. Серед порушень рефлекторно-рухової сфери ознаки пірамідної недостатності виявлено у 24 (89 %) пацієнтів з ДЕ. Порушення статики та координації у вигляді похитування в позі Ромберга мали місце у 19 (70 %) хворих. Порушення чутливості виявлялися у 15 (56 %) пацієнтів і були представлені в основному парестезіями в дистальних відділах кінцівок у вигляді відчуття повзання мурашок, легкого оніміння на обличчі та в кінцівках. Вегетативні розлади, такі як підвищена пітливість, похолодіння та акроціаноз кінцівок, виявлялися у 13 (48 %) пацієнтів з ДЕ. Слід зазначити, що скарги хворих та дані об’єктивного обстеження відповідали ІІ стадії ДЕ.
Відповідно до результатів МРТ головного мозку, у переважної більшості хворих спостерігалися численні ділянки лейкоареозу перивентрикулярно і в субкортикальних відділах головного мозку, префронтальній корі, поодинокі вогнища ішемії в медіальних відділах скроневих часток, таламусі. Картина МРТ пацієнтів відповідала ДЕ ІІ стадії.
При вивченні стану когнітивних функцій у хворих обох клінічних груп встановлено зниження пам’яті та уваги на події недавнього минулого, поточні події, імена, дати тощо. В обстежених з ДЕ середнього та похилого віку синдром легких КП діагностовано у 14 (52 %) пацієнтів, синдром помірних КП — у 13 (48 %).
При проведенні клініко-психопатологічного обстеження у пацієнтів були виявлені астенодепресивні, тривожно-депресивні та апатодепресивні розлади. Більшість хворих скаржились на знижений фон настрою — 27 (100 %), песимістичні думки — 25 (93 %), дратівливість — 23 (85 %), відчуття постійної надмірної втомлюваності — 27 (100 %), порушення нічного сну (заважають заснути неспокійні думки) — 27 (100 %), погіршення апетиту — 17 (63 %), зниження маси тіла, що пов’язане з теперішньою хворобою, відзначали 6 (22 %) пацієнтів.
При обстеженні за шкалою Гамільтона ДР легкого ступеня спостерігали у 17 (63 %) пацієнтів (середній бал — 15,60 ± 0,87), ДР помірного ступеня — у 10 (37 %) хворих (середній бал — 18,60 ± 0,84).
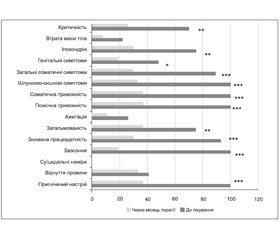
Максимальні порушення у пацієнтів відзначено за такими пунктами шкали Гамільтона: депресивний настрій, працездатність та активність, безсоння, загальмованість, соматична та психічна тривожність, шлунково-кишкові симптоми, загальні соматичні симптоми, генітальні симптоми (рис. 1).
Для уточнення наявності та характеру зв’язку між ДР і когнітивним дефіцитом у пацієнтів з ДЕ застосовано кореляційний аналіз. При цьому зареєстровано вірогідний обернений кореляційний зв’язок середньої сили між загальним балом MMSE та загальним балом за шкалою Гамільтона (r = –0,52; р < 0,01). Отже, чим більшою була вираженість ДР у хворих на ДЕ та МС, тим тяжчими були їх КП.
Ми оцінили ефективність і безпечність проведеного лікування через 1 місяць після початку прийому тразодону. За шкалою Гамільтона хворі відзначали вірогідне покращення самопочуття: зменшилась вираженість депресивного настрою (p < 0,001), покращився нічний сон (p < 0,001), підвищились працездатність та активність (p < 0,001), зменшилась психічна та соматична тривожність (p < 0,001), зменшилась вираженість загальних соматичних (p < 0,001), шлунково-кишкових (p < 0,001) та генітальних симптомів (p < 0,05), іпохондрії (p < 0,01).
На рис. 2 подана динаміка тяжкості ДР в обстежених пацієнтів через 1 та 2 місяці від початку терапії. Зокрема, за шкалою Гамільтона у хворих спостерігали вірогідну позитивну динаміку у вигляді зменшення вираженості ДР при порівнянні результатів до лікування та через 1 місяць (з 16,70 ± 0,33 бала до 13,30 ± 0,17 бала), а також до лікування та через 2 місяці терапії (з 16,70 ± 0,33 бала до 10,40 ± 0,31 бала; p < 0,001), а також показників через 1 місяць та через 2 місяці лікування (з 13,30 ± 0,17 бала до 10,40 ± 0,31 бала; p < 0,001). Слід зазначити, що в обстежених нами пацієнтів протягом всього періоду лікування тразодоном не виявлено побічних ефектів від застосуваня препарату. Пацієнти відзначали покращення загального самопочуття, зменшення головного болю, запаморочення, покращення настрою та нормалізацію сну.
/38_2.jpg)
Проведено оцінку динаміки КП за шкалою MMSE. Через 2 місяці від початку терапії виявлено вірогідне зменшення вираженості КП у пацієнтів з ДЕ на фоні прийому тразодону у вигляді зростання загального бала MMSE (з 26,20 ± 0,22 бала до 27,22 ± 0,34 бала; p < 0,05). Однак у загальній групі пацієнтів з ДЕ (n = 27) не виявлено вірогідної різниці до початку лікування та через 2 місяці після прийому тразодону щодо змін показників короткочасної вербальної та семантичної пам’яті за методикою заучування 10 слів, обсягу негайної та відстроченої пам’яті за методикою PALT, ефективності процесів обробки інформації за методикою SCWT, темпу сенсомоторних реакцій за таблицями Шульте (p > 0,05) (табл. 1).
У той же час у хворих на ДЕ ІІ стадії при наявності легких КП на фоні терапії тразодоном протягом 2 місяців встановлено вірогідне зростання показників короткочасної вербальної та семантичної пам’яті за методикою заучування 10 слів (p < 0,01); також спостерігалося вірогідне збільшення обсягу негайної (р < 0,05) і відстроченої (р < 0,001) пам’яті за методикою PALT. Крім того, у хворих на ДЕ з легкими КП на фоні тривалої терапії тразодоном зареєстровано вірогідне зростання ефективності процесів обробки інформації, уваги (р < 0,05) згідно з даними SCWT (табл. 2).
Висновки
Отже, з урахуванням отриманих нами результатів застосування тразодону (Триттіко) виявилося ефективним щодо зменшення вираженості ДР у всіх обстежених хворих на ДЕ ІІ стадії. Що стосується когнітивного дефіциту, то на фоні тривалого (2 місяці) прийому тразодону мало місце покращення когнітивного функціонування за даними MMSE в загальній групі та вірогідне зростання показників оперативної семантичної памяті, негайної і відстроченної асоціативної памяті та покращення ефективності процесів обробки інформації у хворих з легкими КП. Застосування тразодону (Триттіко) було безпечним, препарат добре переносився пацієнтами. Зважаючи на те, що антидепресивна терапія повинна бути призначена на тривалий термін, безпечність препарату та його добра переносимість є предиктором прихильності хворих до такої терапії при тривалому застосуванні.
З огляду на результати численних досліджень і багаторічний досвід застосування тразодон є високоефективним препаратом, що добре переноситься й відіграє важливу роль у лікуванні пацієнтів із депресією. Багатофункціональні властивості й механізм дії тразодону уможливлюють застосування цього препарату для корекції ряду пов’язаних із депресією симптомів, дозволяючи уникнути при цьому небажаних явищ, таких як безсоння й сексуальні розлади, що значно поширені серед пацієнтів, які одержують довгострокове лікування СІЗЗС. На практиці в тих країнах, де тразодон добре відомий, практикуючі лікарі стали використовувати тразодон у поєднанні з антидепресантами із групи СІЗЗС, що дає задовільний результат. Однією із причин такого комбінованого підходу стало пригнічення побічних ефектів СІЗЗС, викликаних блокадою 5-HT2-рецепторів, іншою — посилення антидепресивного ефекту.
Останніми роками в розробках препаратів для лікування депресії світова психофармакологія зосередила увагу на мультимодальних препаратах, що мають множинні терапевтичні властивості. Тразодон — це яскравий приклад мультимодального антидепресанту, що впливає на всі симптоми депресії. Однак цей факт не враховувався при укладанні українських рекомендацій щодо лікування депресії.
В Україні застосовується тразодон пролонгованої дії, і саме ця форма має доведену високу ефективність у лікуванні депресії, що підтверджують результати численних міжнародних досліджень і багаторічний досвід застосування в більшості країн ЄС і США.
Таким чином, на нашу думку, виявлена нами ефективність і безпечність тривалого застосування тразодону (Триттіко) дає підставу рекомендувати цей препарат для широкого використання в клінічній практиці з метою корекції ДР і легких КП у пацієнтів з ДЕ.
Список литературы
1. Бачинская Н.Ю. Синдром умеренных когнитивных нарушений / Н.Ю. Бачинская // Нейро News. — 2010. — № 2(1). — С. 12-17.
2. Бурчинский С.Г. Тразодон и его возможности в лечении депрессивных расстройств (Обзор литературы) / С.Г. Бурчинский // Український вісник психоневрології. — 2011. — Т. 19, № 4(69). — С. 57-60.
3. Дамулин И.В. Дисциркуляторная энцефалопатия: Метод. рекомендации / И.В. Дамулин, В.В. Захаров; под ред. Н.Н. Яхно. — М., 2003. — 32 с.
4. Захаров В.В. Когнитивные расстройства в пожилом и старческом возрасте / В.В. Захаров, Н.Н. Яхно // Метод. пособие для врачей. — М., 2005. — 71 с.
5. Мачерет Е.Л. Современные подходы к дефиниции дисциркуляторной энцефалопатии / Е.Л. Мачерет, И.С. Паламарчук // Зб. наук. праць співробітників КМАПО. — 2003. — Вип. 12, кн. 1. — С. 591-605.
6. A comparative, randomized, double-blind study of trazodone prolonged-release and paroxetine in the treatment of patients with major depressive disorder / S. Kasper, L. Olivieri, G. Di Loreto [et al.] // Curr. Med. Res. Opn. — 2005. — Vol. 21. — P. 1139-46.
7. A comparative, randomized, double-blind study of trazodone prolonged-release and sertraline in the treatment of major depressive disorder / C. Munizza, L. Olivieri, G. Di Loreto [et al.] // Curr. Med. Res. Opn. — 2006. — Vol. 22. — P. 1703-13.
8. Association of Depressed Mood and Mortality in Older Adults With and Without Cognitive Impairment in a Prospective Naturalistic Study / H. Lavretsky, L. Zheng, M.W. Weiner [et al.] // Am. J. Psy-chiatry. — 2010. — Vol. 167(5). — P. 589-597.
9. Cešková E. Trazodone modified-release (trazodone AC) in the treatment of moderate to severe depression / E. Cešková // Psychiatrie. — 2012. — Vol. 16. — P. 138-44.
10. Cognitive function and risk for depression in old age: A meta-analysis of published literature / C.Q. Huang, Z.R. Wang, Y.H. Li [et al.] // Int. Psychogeriatr. — 2010. — № 12. — P. 1-10.
11. Connolly K. R. Emerging drugs for major depressive disorder / K.R. Connolly, M.E. Thase // Expert. Opin. Emerging. Drugs. — 2012. — Vol. 17(1). — P. 105-126.
12. Cusack B. Binding of antidepressants to human brain receptors: focus on newer generation compounds / B. Cusack, A. Nelson, E. Richelson // Psychopharmacology. — 1994. — Vol. 114. — P. 559-564.8.
13. Depression and clinical outcomes in heart failure: an OPTIMIZE-HF analysi / N.M. Albert, G.C. Fonarow, W.T. Abraham [et al.] // Am. J. Med. — 2009. — Vol. 122. — P. 366-373.
14. Depression and risk for Alzheimer disease: systematic review, meta-analysis, and metaregression analysis / R.L. Ownby, E. Crocco, A. Acevedo [et al.] // Arch. Gen. Psychiatry. — 2006. — Vol. 63(5). — P. 530-538.
15. Depression in elderly patients with Alzheimer dementia or vascular dementia and its influence on their quality of life / Y. Winter, A. Korchounov, T.V. Zhukova, N.E. Bertschі // J. Neurosci. Rural. Pract. — 2011. — Vol. 2(1). — P. 27-32.
16. Dissociable hormonal, cognitive and mood responses to neuroendocrine challenge: evidence for receptor-specific serotoninergic dysregulation in depressed mood / W.J. Riedel, T. Klaassen, E. Griez [et al.] // Neuropsychopharmacology. — 2002. — Vol. 26. — P. 358-367.
17. Folstein M. Mini-mental state: a practical method for grading the cognitive state of patients for the clinical / M. Folstein, S. Folstein, P.R. McHugh // J. Psychiatr. Res. — 1975. — № 12. — P. 189-198.
18. Generalized anxiety disorder, major depressive disorder and their comorbidity as predictors of all-cause and cardiovascular mortality: the Vietnam experience study / A.C. Phillips, G.D. Batty, C.R.Gale [et al.] // Psychosom. Med. — 2009. — Vol.71. — P. 395-403.
19. Hamilton M. A rating scale for depression / M. Hamilton // J. Neurol. Neurosurg. Psychiatry. — 1960. — Vol. 23. — P. 56-62.
20. Health-related quality of life in patients with subarachnoid haemorrhage/ B. Meyer, F. Ringel, Y. Winter [et al.] // Cerebrovasc. Dis. — 2010. — Vol. 30. — P. 423-31.
21. Longitudinal study of the socioeconomic burden of Parkinson’s disease in Germany / Y. Winter, M. Balzer-Geldsetzer, A. Spottke [et al.] // Eur. J. Neurol. — 2010. — Vol. 17. — P. 1156-63.
22. Middleton L. Promising strategies for the prevention of dementia / L. Middleton, K. Yaffe // Arch. Neurol. — 2009. — Vol. 66 (10). — P. 1210-1215.
23. Papakostas G.L. A meta-analysis of clinical trials comparing the serotonin (5-HT)2-receptor antagonists trazodone and nefazodone with selective serotonin reuptake inhibitors for the treatment of major depressive disorder / G.L. Papakostas, M. Fava // Eur. Psychiat. — 2007. — Vol. 22. — P. 444-447.
24. Parmenter B.A. The cognitive perfomance of patients with multiple sclerosis during periods of high and low fatigue / B.A. Parmenter, D.R. Denney, S.G. Lynch // Multiple Sclerosis. — 2003. — № 9. — Р. 111-118.
25. Pattanayak R.D. Depression in dementia patients: issues and challenges for a physician / R.D. Pattanayak, R. Sagar // J. Assoc. Physicians India. — 2011. — Vol. 59. — P. 650-2.
26. Petersen R.C. Mild cognitive impairment as a diagnostic entity / R.C. Petersen // J. Intern. Med. — 2004. — Vol. 256. — P. 183-194.
27. Rickards H. Depression in neurological disorders: Parkinson’s disease, multiple sclerosis, and stroke / H. Rickards // J. Neurol. Neurosurg. Psychiatry. — 2005. — Vol. 76. — P. 48-52.
28. Role of 5-HT2c-receptors in the control of central dopamine function / V. Di Matteo, A. Deblasi, C. Di Grulio [et al.] // Trends Pharmacol. Sci. — 2001. — Vol. 22. — P. 229-232.
29. Stahl S.M. Mechanism of action of trazodone: a multifunctional drug / S.M. Stahl // CNS Spectr. — 2009. — Vol. 14. — P. 536-46.
30. Stroop J.R. Studies of interference in serial verbal reactions / J.R. Stroop // J. Exp. Psychol. — 1975. — Vol. 18. — P. 643-62.
/38_2.jpg)

/38.jpg)
/39.jpg)