Международный неврологический журнал 1 (79) 2016
Вернуться к номеру
Патогенетические аспекты превентивной коррекции патологической усталости в раннем восстановительном периоде ишемического инсульта у больных с метаболическим синдромом
Авторы: Насонова Т.И., Асауленко Е.И., Колосова Т.В., Клименко А.В., Слободин Т.Н. - Национальная медицинская академия последипломного образования имени П.Л. Шупика, г. Киев; Гончар О.Ю., Бугаев Ю.А., Тишкевич Е.В., Курочкин И.В. - Киевская городская клиническая больница № 9; Головченко Ю.И. - Национальная медицинская академия последипломного образования имени П.Л. Шупика, г. Киев
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
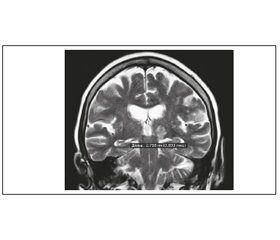
Мета дослідження: вивчити клінічну ефективність та безпечність препарату Армадин® у ранньому відновному періоді гострого ішемічного інсульту, його вплив на відновлення втрачених функцій та постінсультну втому в пацієнтів із метаболічним синдромом (МС). Особливістю роботи було визначення стратегічних ділянок мозку за даними магнітно-резонансної томографії (МРТ) при когнітивних та емоційних розладах у пацієнтів з ішемічним інсультом на фоні МС та порівняння з даними пацієнтів без МС. Матеріали і методи. Основну групу становили 28 пацієнтів віком від 44 до 79 років (у середньому 66,0 ± 4,2 року), які знаходились у ранньому відновному періоді ішемічного інсульту. Пацієнти основної групи крім базового лікування отримували Армадин®. Контрольну групу становили 16 хворих у ранньому відновному періоді ішемічного інсульту віком від 54 до 76 років (середній вік 63,0 ± 3,8 року), які отримували лише стандартне лікування. Стан пацієнтів оцінювали за шкалами NIHSS, Ренкіна, індексом Бартел. Когнітивний і емоційний стан — за шкалами HADS, MMSE. Кількісну оцінку постінсультної втоми проводили за шкалою оцінки втоми (FAS). МРТ-дослідження головного мозку виконувалось на апараті Siemens MAGNETOM Avanto 1.5T. Визначали розміри вогнищ, індекс гіпокампу. Результати. Патологічна постінсультна втома визначалась в обох групах: медіана вираженості втоми за опитувальником FAS становила 32,2 (Q1 = 16,5; Q3 = 51,5) в основній та 34,25 (Q1 = 14,5; Q3 = 48,5) у контрольній групі до лікування. У 95 % пацієнтів визначалась клінічно значима втома (FAS ≥ 22), а ознаки депресії (вираженої та помірної) мали близько 20 %. Не було визначено статистично вірогідної кореляційної залежності патологічної втоми й депресії. Патологічна втома за шкалою FAS була вірогідно більшою в жінок, ніж у чоловіків. Після проведеного лікування ознаки патологічної втоми зменшились за шкалою FAS в обох групах, але статистичної вірогідності досягли в групі, що додатково приймала Армадин®. За шкалою NIHSS та індексом Бартел вірогідне покращення після лікування визначалось серед хворих основної групи. Не було визначено залежності між вираженістю патологічної втоми за шкалою FAS і ступенем тяжкості інсульту за шкалою NIHSS. Покращення показників когнітивних функцій за період лікування визначалось в обох групах. Але в основній групі когнітивні функції покращились на 5 %, а в групі контролю — на 1,66 %. За методикою, що була запропонована Scheltens et al., виконано дослідження гіпокампу на 1,5 Tл МРТ у пацієнтів з МС (перша група) і пацієнтів без МС (друга група). У пацієнтів із МС визначалось вірогідне зменшення індексу гіпокампу праворуч і ліворуч порівняно з пацієнтами без МС: праворуч 0,50 [0,41; 0,54] проти 0,594 [0,58; 0,61] (р < 0,05); ліворуч 0,56 [0,52; 0,60] проти 0,61 [0,58; 0,63] (р < 0,05). Обговорення. Своєчасне діагностування патологічної постінсультної втоми має велике значення в лікуванні хворих з ішемічним інсультом. У нашому дослідженні патологічна втома була діагностована в 95,5 % хворих. Різниця з літературними даними, ймовірно, пов’язана з наявністю кластера МС у пацієнтів, які брали участь у дослідженні. Досить невелика кількість пацієнтів унеможливлює висновок про вплив МС на розвиток патологічної втоми. Слід враховувати, що патологічна втома може розвинутись і без депресії і вона потребує спеціального лікування без залучення антидепресантів. Покращення когнітивних функцій та зменшення проявів астенії в пацієнтів, які приймали Армадин®, ймовірно, можна пояснити, з одного боку, здатністю Армадину® підвищувати рівень дофаміну в головному мозку, а з іншого — наявністю у складі Армадину® янтарної кислоти, що сприяла, через ланцюг нейрохімічних реакцій, підвищенню в головному мозку рівня ГАМК. Отже, використання цього сучасного антиоксиданту сприяло зменшенню астенії й тим самим покращувало якість життя пацієнтів. Вимірювання гіпокампу показало вірогідно більше виражену атрофію в пацієнтів з ішемічним інсультом на фоні МС порівняно з показниками пацієнтів з ішемічним інсультом без МС (P < 0,05). Ймовірно, кластер МС, що поєднує артеріальну гіпертензію, інсулінорезистентність, дисліпідемію та ін., прискорює атрофічні процеси гіпокампу більше, ніж окремо кожний з цих компонентів, які визначали у пацієнтів з ішемічним інсультом без МС. Висновки. Призначення Армадину® в ранньому відновному періоді ішемічного інсульту сприяло зменшенню проявів патологічної втоми в пацієнтів з МС, відновленню функцій за шкалою NIHSS і індексом Бартел.
Цель исследования: изучить клиническую эффективность и безопасность препарата Армадин® в раннем восстановительном периоде острого ишемического инсульта, его влияние на восстановление утраченных функций и постинсультную усталость у пациентов с метаболическим синдромом (МС). Особенностью работы было определение стратегических участков мозга по данным магнитно-резонансной томографии (МРТ) при когнитивных и эмоциональных расстройствах у пациентов с ишемическим инсультом на фоне МС и сравнение с данными пациентов без МС. Материалы и методы. Основную группу составили 28 пациентов в возрасте от 44 до 79 лет (в среднем 66,0 ± 4,2 года), находившихся в раннем восстановительном периоде ишемического инсульта. Пациенты основной группы кроме базового лечения получали Армадин®. Контрольную группу составили 16 больных в раннем восстановительном периоде ишемического инсульта в возрасте от 54 до 76 лет (средний возраст 63,0 ± 3,8 года), получавших только стандартное лечение. Состояние пациентов оценивали по шкалам HADS, MMSE. Количественную оценку постинсультной усталости проводили по шкале оценки усталости (FAS). МРТ-исследование головного мозга выполнялось на аппарате Siemens MAGNETOM Avanto 1.5T. Определяли размеры очагов, индекс гиппокампа. Результаты. Патологическая постинсультная усталость определялась в обеих группах: медиана выраженности усталости по опроснику FAS составляла 32,2 (Q1 = 16,5; Q3 = 51,5) в основной и 34,25 (Q1 = 14,5; Q3 = 48,5) в контрольной группе до лечения. У 95 % пациентов отмечалась клинически значимая усталость (FAS ≥ 22), а признаки депрессии (выраженной и умеренной) имели около 20 %. Не было определено статистически достоверной корреляционной зависимости патологической усталости и депрессии. Патологическая усталость по шкале FAS была достоверно большей у женщин, чем у мужчин. После проведенного лечения признаки патологической усталости уменьшились по шкале FAS в обеих группах, но статистической достоверности достигли в группе, дополнительно принимавшей Армадин®. По шкале NIHSS и индексу Бартел достоверное улучшение после лечения определялось среди больных основной группы. Не была определена зависимость между выраженностью патологической усталости по шкале FAS и степенью тяжести инсульта по шкале NIHSS. Улучшение показателей когнитивных функций за период лечения определялось в обеих группах. Но в основной группе когнитивные функции улучшились на 5 %, а в группе контроля — на 1,66 %. По методике, предложенной Scheltens et al., выполнено исследование гиппокампа на 1,5 Tл МРТ у пациентов с МС (первая группа) и пациентов без МС (вторая группа). У пациентов с МС определялось достоверное уменьшение индекса гиппокампа справа и слева по сравнению с пациентами без МС: справа 0,50 [0,41; 0,54] против 0,594 [0,58; 0,61] (р < 0,05); слева 0,56 [0,52; 0,60] против 0,61 [0,58; 0,63] (р < 0,05). Обсуждение. Своевременное диагностирование патологической постинсультной усталости имеет большое значение в лечении больных с ишемическим инсультом. В нашем исследовании патологическая усталость была диагностирована у 95,5 % больных. Разница с литературными данными, вероятно, связана с наличием кластера МС у пациентов, участвовавших в исследовании. Достаточно небольшое количество пациентов исключает вывод о влиянии МС на развитие патологической усталости. Следует учитывать, что патологическая усталость может развиться и без депрессии и она требует специального лечения без привлечения антидепрессантов. Улучшение когнитивных функций и уменьшение проявлений астении у пациентов, принимавших Армадин®, вероятно, можно объяснить, с одной стороны, способностью Армадина® повышать уровень дофамина в головном мозге, а с другой — наличием в составе Армадина® янтарной кислоты, которая способствовала, через цепь нейрохимических реакций, повышению в головном мозге уровня ГАМК. Таким образом, использование этого современного антиоксиданта способствовало уменьшению астении и тем самым улучшало качество жизни пациентов. Измерение гиппокампа показало достоверно более выраженную атрофию у пациентов с ишемическим инсультом на фоне МС по сравнению с показателями пациентов с ишемическим инсультом без МС (P < 0,05). Вероятно, кластер МС, сочетающий АГ, инсулинорезистентность, дислипидемию и др., ускоряет атрофические процессы гиппокампа больше, чем отдельно каждый из этих компонентов, которые определяли у пациентов с ишемическим инсультом без МС. Выводы. Назначение Армадина® в раннем восстановительном периоде ишемического инсульта способствовало уменьшению проявлений патологической усталости у пациентов с МС, восстановлению функций по шкале NIHSS и индексу Бартел.
Aim of the study. To investigate clinical effectiveness and safety of Armadin® in the early recovery period after acute ischemic stroke, its impact on the restoration of impaired functions and stroke induced fatigue in the patients with metabolic syndrome. The study aimed to determine target brain areas by MRI data in cognitive and emotional impairments in patients with ischemic stroke against the metabolic syndrome and to compare with the data of the patients without metabolic syndrome. Materials and methods. The basic group consisted of 28 patients aged from 44 to 79 years old (mean age 66.0 ± 4.2) in the early recovery period after ischemic stroke. The patients of the basic group received Armadin® besides standard treatment. The control group involved 16 patients in the early period after ischemic stroke aged from 54 to 76 years old (mean age 63.0 ± 3.8) that received standard therapy only. The patients’ condition was estimated by the NIHSS, Renkin scale, Barthel index. Cognitive and emotional status was assessed by HADS, MMSE. The quantitative estimation of post-stroke fatigue was performed using Fatigue assessment scale (FAS). MRI of brain was conducted using Siemens MAGNETOM Avanto 1.5T. There were determined foci size and hippocampus index. Results. Stroke induced fatigue was in both groups: severity median value by FAS was 32.2 (Q1 = 16.5; Q3 = 51.5) in the basic group and 34.25 (Q1 = 14.5; Q3 = 48.5) in the control group before treatment. 95 % of the patients had clinically significant fatigue (FAS ≥ 22), about 20 % of the patients had depression signs. There was no statistically significant correlation between fatigue and depression. Fatigue level by FAS was more intensive in female in comparison with males. After the therapy fatigue symptoms reduced in both groups, but the reduction was statistically significant in the group received Armadin®. Expressed improvement after the therapy by NIHSS and Barthel index was determined in the basic group. There was not determined the dependence between fatigue intensity by FAS and stroke severity by NIHSS. Cognitive parameters improved due to treatment in both groups. However in the basic group there was 5 % improvement and in the control there was 1 % improvement. MRI 1.5 T by Scheltens et al. method was performed in the patients with metabolic syndrome and without it. The patients with metabolic syndrome had significant reduction of hippocampus index right side and left side compared with the patients without metabolic syndrome: right side 0.50 [0.41; 0.54] vs 0.594 [0.58; 0.61] (p < 0.05). Discussion. Early diagnosis of stroke induced fatigue is of great importance for the patients with ischemic stroke. In our study fatigue was diagnosed in 95 % patients. The diversity with literature data could be likely connected with cluster in the patients with metabolic syndrome which took part in the study. A small subset of the participants disables concluding about metabolic syndrome influence on fatigue development. We must consider that fatigue could form without depression background and it requires specific treatment without antidepressant medications. Improvement of cognitive functions and asthenia reduction in the patients received Armadin® could be likely explained by the opportunity of the drug to elevate dopamine brain level from one side, and succinate acid in its formula which increases GABA brain level due to neurochemical reaction, from the other side. So, the usage of this today antioxidant reduced asthenia and thereby improved quality of life of the patients. Hippocampus measurement demonstrated more intensive atrophy in the patients after ischemic stroke combined with metabolic syndrome compared with the patients without metabolic syndrome (P < 0.05). Metabolic cluster with underlying arterial hypertension, insulin resistance, dyslipidemia exc. might enhance hippocampus atrophy than each element severally determined in the patients with ischemic stroke and without metabolic syndrome. Conclusions. Armadin® usage in the early recovery period after ischemic stroke reduced fatigue signs in the patients with metabolic syndrome, improved functions by NIHSS and Barthel index.
ішемічний інсульт, астенія, гіпокамп.
ишемический инсульт, астения, гиппокамп.
ischemic stroke, asthenia, hippocampus.
Статтю опубліковано на с. 54-62
Реабілітаційні заходи в ранній та пізній постінсультний періоди традиційно передбачають насамперед медикаментозне та немедикаментозне лікування рухового дефіциту, афатичних розладів, головокружіння тощо. Поза увагою лікарів та науковців залишаються такі стани, як втома, астенія, тривога, депресія. Тому інколи не зрозуміло, чому залучення значних матеріальних, моральних ресурсів, застосування найсучасніших форм лікування не дають бажаного ефекту.
Матеріали й методи
Результати
Результати вимірювання структурних показників головного мозку
Обговорення
Висновки
1. Бикбулатова Л.Ф. Шкала оценки усталости: Перевод на русский язык, адаптация и оценка психометрических свойств в стационарах клиник неврологии и терапии / Бикбулатова Л.Ф., Кутлубаев М.А., Ахмадеева Л.Р // Медицинский вестник Башкортостана. — 2012. — № 1. — С. 37-42.
2. Torres-Harding S. What Is Fatigue? History and Epidemiology / Torres-Harding S., Jason LA. // Fatigue as a window to the brain / Ed. by J. DeLuca. — London: MIT Press, 2005.
3. Кутлубаев М.А. Постинсультные психоневрологические расстройства. Клинические и клинико-патогенетические корреляции, методы ранней диагностики и реабилитации: Авторефер. дис… д-ра мед. наук: спец.14.01.11 «Нервные болезни» / М.А. Кутлубаев. — Уфа, 2015. — 20 с.
4. Choi-Kwon S. Poststroke fatigue: an emerging, critical issue in stroke medicine / Choi-Kwon S., Kim J.S. // Int. J. Stroke. — 2011. — № 6. — Р. 328-336.
5. Duncan F. Frequency and natural history of fatigue after stroke: a systematic review of longitudinal studies / Duncan F., Wu S., Mead G.E. // J. Psychosom. Res. — 2012. — № 73. — Р. 18-27.
6. Staub F. Poststroke fatigue // The behavioral and cognitive neurology of stroke / O. Godefroy, J. Bogousslavsky (eds.). — Cambridge University Press, 2007. — 664 p.
7. Zwarts M.J. BGM. Clinical neurophysiology of fatigue / Zwarts M.J., Bleijenberd G., van Engelen // Clinical Neurophisiology. — 2008. — 119. — Р. 2-10.
8. Lynch J. Fatigue after stroke: the development and evaluation of a case definition / Lynch J., Mead G., Greig C. et al // J. Psychosom. Res. — 2007. — № 63. — Р. 539-544.
9. Кутлубаев М.А. Симптомы патологической усталости, апатии и депрессии у пациентов после церебрального инсульта / Кутлубаев М.А., Ахмадеева Л.Р. // Неврология, нейропсихиатрия, психосоматика — 2015. — Т. 7, № 2. — С. 16-21.
10. Christinsen D. Dimensions of poststroke fatigue: a two-year follow-up study / Christinsen D., Johansen S.P., Wau T. et al. // Cerebrovasc. Dis. — 2008. — № 26. — Р. 134-141.
11. Lerdal A. Physical impairment, depressive symptoms and pre-stroke fatigue are related to fatigue in the acute phase after stroke / Lerdal A., Bakken L.N., Rasmussen E.F. et al. // Disabil Rehabil. — 2011. — № 33. — Р. 334-342.
12. Appelros P. Prevalence and predictors of pain and fatigue after stroke: apopulation-based study / Appelros P. // Int. J. Rehabil. Res. — 2006. — № 29. — Р. 329-333.
13. Choi-Kwon S. Poststroke fatigue: characteristics and related factors / Choi-Kwon S., Han S.W., Kwon U. et al. // Cerebrovasc. Dis. — 2005. — № 19. — Р. 84-90.
14. Ingles J.L. Fatigue after stroke / Ingles J.L., Eskes G.A., Phillips S.J. // Arch. Phys. Med. Rehabil. — 1999. — № 80. — Р. 173-178.
15. Naess H. Fatigue at long-term follow-up in young adults with cerebral infarction / Naess H., Nyland H.I., Thomassen L. et al. // Cerebrovasc Dis. — 2005. — № 20. — Р. 245-250.
16. Carlsson G.E. Consequences of mild stroke in persons < 75 years — A 1 year follow-up / Carlsson G.E., Moller A., Blomstrand C. // Cerebrovasc. Dis. — 2003. — № 16. — Р. 383-388.
17. Glader E.L. Poststroke fatigue: a 2 year follow up study of stroke patients in Sweden / Glader E.L., Stegmayr B., Asplund K. // Stroke. — 2002. — № 33. — Р. 1327-1333.
18. Shepers V.P. Post-stroke fatigue course and its relation to personal and stroke related factors / Shepers V.P., Visser-Meily A.M., Ketelaar M. et al. // Arch. Phys. Med. Rehabil. — 2006. — № 87. — Р. 184-188.
19. Tseng B.Y. Exertion fatigue and chronic fatigue are two distinct constructs in people post-stroke / Tseng B.Y., Billinger S.A., Gajewski B.J. et al. // Stroke. — 2010. — № 41. — Р. 2908-2912.
20. Van der Mast R.C. Vascular disease and apathy in old age. The Leiden 85-Plus Study. Int / Van der Mast R.C., Vinkers D.J., Stek M.L. et al. // J. Geriatr. Psychiatry. — 2008. — № 23(3). — Р. 266-271.
21. Choi-Kwon S. Fluoxetin is not effective in the treatment of post-stroke fatigue: a double-blind, placebo-controlled study / Choi-Kwon S., Choi J., Kwon S.U. et al. // Cerebrovasc. Dis. — 2007. — № 23. — Р. 103-108.
22. Scheltens P. Atrophy of medial temporal lobes on MRI in «probable» Alzheimer’s disease and normal aging: diagnostic value and neuropsychological correlations / P. Scheltens, D. Leys, F. Barkhof // Journal of Neurology Neurosurgery and Psychiatry. — 1992. — № 55. — Р. 967-972.

/57.jpg)
/58.jpg)
/58_2.jpg)
/59.jpg)