Резюме
Вступ. Дослідження EPHES (Evaluation of influence of fixed dose combination Рerindopril/Amlodipine on target organ damage in patients with arterial HypErtension with or without iSchemic heart disease) мало на меті оцінити ефективність фіксованої комбінації периндоприл/амлодипін щодо зниження артеріального тиску (АТ) та динаміки вираженості ураження органів-мішеней у хворих на артеріальну гіпертензію (АГ) з ішемічною хворобою серця (ІХС) та без неї. Ця стаття є результатом аналізу даних, отриманих у пацієнтів з АГ та клінічними ознаками ІХС. Матеріали та методи. У даний первинний аналіз включені дані 30 пацієнтів з АГ та верифікованою ІХС віком понад 30 років. Рівень систолічного (САТ) та/або діастолічного АТ (ДАТ) у хворих, які до цього не лікувалися, на момент включення мав бути ≥ 160/100 мм рт.ст., але < 200/120 мм рт.ст.; у тих, хто перебував на монотерапії або подвійній комбінованій терапії, — ≥ 140/90 мм рт.ст., але < 200/120 мм рт.ст. Усім пацієнтам у день рандомізації призначали фіксовану комбінацію периндоприл/амлодипін у початковій дозі 5/5 мг один раз на добу. При необхідності (АТ > 140/90 мм рт.ст.) дози компонентів фіксованої комбінації збільшували поступово кожні 2 тижні до 10/10 мг, а після 6 тижнів лікування додавався індапамід 1,5 мг. 96,7 % пацієнтів отримували бета-адреноблокатори. Усім пацієнтам проводили: вимірювання маси тіла та зросту, офісних рівнів САТ, ДАТ та ЧСС, проводили добове моніторування АТ, визначення швидкості поширення пульсової хвилі в артеріях еластичного (ШППХе) та м’язового типів, центрального САТ, біохімічне дослідження крові, електрокардіографію, ехокардіографію з допплерографією, вимірювання гомілково-плечового індексу, визначення товщини комплексу інтима-медіа (ТКIМ). Тривалість спостереження становила 12 місяців. Результати та обговорення. Лікування за допомогою фіксованої комбінації периндоприл/амлодипін (у дозах від 5/5 до 10/10 мг/добу) пацієнтів з ІХС та АГ, що не контролювалась на фоні прийому бета-блокаторів та інших антигіпертензивних препаратів, забезпечувало досягнення цільового рівня САТ і ДАТ у 76,7 % випадків на етапі 6 тижнів. Додавання індапаміду 1,5 мг на добу (n = 7) забезпечило контроль офісного САТ і ДАТ у 100 % пацієнтів на етапі 6 місяців лікування. Зниження офісного АТ супроводжувалося достовірним зменшенням середньодобового, денного та нічного САТ/ДАТ на 20,70 ± 0,08 мм рт.ст., 16,4 ± 0,2 мм рт.ст., 25,1 ± 0,1 мм рт.ст. та 12,6 ± 0,1 мм рт.ст., 14,10 ± 0,09 мм рт.ст., 11,5 ± 0,1 мм рт.ст. відповідно. Цільовий середньодобовий АТ (менше від 130/80 мм рт.ст.) було досягнуто у 28 (93,3 %) пацієнтів. При цьому зменшилася варіабельність денного та нічного САТ/ДАТ, середня величина ранкового підйому САТ та частка пацієнтів з величиною ранкового підйому САТ понад 55 мм рт.ст. Центральний САТ на фоні призначеного лікування достовірно знизився з 141,8 ± 3,5 мм рт.ст. до 121,3 ± 2,7 мм рт.ст. (Р < 0,001). Паралельно відбулося достовірне (Р < 0,02) зменшення індексу приросту з 29,9 ± 3,2 % до 20,1 ± 1,8 %. Ефективна щодо контролю АТ терапія протягом року призводила до достовірного регресу ураження органів-мішеней: зменшення гіпертрофії лівого шлуночка, рівня альбумінурії, ТКІМ, покращення діастолічної функції лівого шлуночка та пружно-еластичних властивостей аорти. Зміни рівня альбумінурії та величини ТКІМ достовірно та незалежно від змін рівня АТ (і офісного, і центрального) корелювали із змінами ШППХе. Проведена антигіпертензивна терапія добре переносилася хворими — із 31 пацієнта, яким призначили фіксовану комбінацію периндоприл/амлодипін, побічні явища зареєстровані в 3 (10 %), припинення лікування було лише в 1 (3,3 %) пацієнта. На фоні лікування спостерігалося зменшення кількості пацієнтів з такими скаргами, як головний біль, запаморочення та болі в ділянці серця, з 60, 20 та 80 % до 3,3; 0 та 46,7 % відповідно. Серед пацієнтів, які мали стенокардію на початку дослідження, значно зменшилася кількість приступів стенокардії за тиждень — з 2,5 ± 0,4 до 1,2 ± 0,2 (Р < 0,01).
Исследование EPHES (Evaluation of influence of fixed dose combination Рerindopril/Amlodipine on target organ damage in patients with arterial HypErtension with or without iSchemic heart disease) имело целью оценить эффективность фиксированной комбинации периндоприл/амлодипин в отношении снижения артериального давления (АД) и динамики поражения органов-мишеней у больных с артериальной гипертензией (АГ) с ишемической болезнью сердца (ИБС) и без нее. Эта статья является результатом анализа данных, полученных у пациентов с АГ и ИБС. Материалы и методы. В данный первичный анализ включены данные 30 пациентов с АГ и верифицированной ИБС в возрасте старше 30 лет. Уровень систолического (САД) и/или диастолического АД (ДАД) у пациентов, которые до этого не лечились, на момент включения должен был быть ≥ 160/100 мм рт.ст., но < 200/120 мм рт.ст.; у тех, кто находился на терапии, — ≥ 140/90 мм рт.ст., но < 200/120 мм рт.ст. Всем пациентам в день рандомизации назначали фиксированную комбинацию периндоприл/амлодипин в начальной дозе 5/5 мг один раз в сутки. При необходимости (АД > 140/90 мм рт.ст.) дозы компонентов фиксированной комбинации увеличивали постепенно каждые 2 недели до 10/10 мг, а после 6 недель лечения добавляли индапамид 1,5 мг. 96,7 % пациентов принимали также бета-адреноблокаторы. Всем пациентам проводили: измерение массы тела и роста, офисных уровней САД, ДАД и ЧСС, проводили суточное мониторирование АД, определение скорости распространения пульсовой волны по артериям эластического (СРПВэ) и мышечного типов, центрального САД, биохимическое исследование крови, электрокардиографию, эхокардиографию с допплерографией, измерение лодыжечно-плечевого индекса, определение толщины комплекса интима-медиа (ТКИМ). Длительность наблюдения составила 12 месяцев. Результаты и обсуждение. Лечение с помощью фиксированной комбинации периндоприл/амлодипин (в дозах от 5/5 до 10/10 мг) пациентов с ИБС и АГ, которая не контролировалась на фоне приема бета-блокаторов и других антигипертензивных препаратов, обеспечивало достижение целевого уровня САД и ДАД в 76,7 % случаев на этапе 6 недель. Добавление индапамида 1,5 мг в сутки (n = 7) обеспечило контроль офисного САД и ДАД у 100 % пациентов на этапе 6 месяцев лечения. Снижение офисного АД сопровождалось достоверным уменьшением среднесуточного, дневного и ночного САД/ДАД на 20,70 ± 0,08 мм рт.ст., 16,4 ± 0,2 мм рт.ст., 25,1 ± 0,1 мм рт.ст. и 12,6 ± 0,1 мм рт.ст., 14,10 ± 0,09 мм рт.ст., 11,5 ± 0,1 мм рт.ст. соответственно. Целевое среднесуточное АД (меньше 130/80 мм рт.ст.) было достигнуто у 28 (93,3 %) пациентов. При этом уменьшилась вариабельность дневного и ночного САД/ДАД, средняя величина утреннего подъема САД и доля пациентов с величиной утреннего подъема САД больше 55 мм рт.ст. Центральное САД на фоне назначенного лечения достоверно снизилось с 141,8 ± 3,5 мм рт.ст. до 121,3 ± 2,7 мм рт.ст. (Р < 0,001). Параллельно достоверно (Р < 0,02) уменьшился индекс прироста с 29,9 ± 3,2 % до 20,1 ± 1,8 %. Эффективная в отношении контроля АД терапия на протяжении года приводила к достоверному регрессу поражения органов-мишеней: уменьшению гипертрофии левого желудочка, уровня альбуминурии, ТКИМ, улучшению диастолической функции левого желудочка и упруго-эластических свойств аорты. Изменение альбуминурии и величины толщины комплекса интима-медиа достоверно и независимо от изменений уровня АД (и офисного, и центрального) коррелировало с изменениями СРПВэ. Антигипертензивная терапия хорошо переносилась пациентами — из 31 пациента, которым назначали фиксированную комбинацию периндоприл/амлодипин, побочные явления были зарегистрированы у 3 (10 %), прекращение лечения было только у 1 (3,3 %) пациента. На фоне лечения наблюдалось уменьшение количества пациентов с такими жалобами, как головная боль, головокружение и боль в области сердца, с 60, 20 и 80 % до 3,3, 0 и 46,7 % соответственно. Среди пациентов, которые имели стенокардию в начале лечения, значительно уменьшилось количество приступов стенокардии за неделю — с 2,5 ± 0,4 до 1,2 ± 0,2 (Р < 0,01).
Introduction. EPHES (Evaluation of influence of fixed dose combination Рerindopril/Amlodipine on target organ damage in patients with arterial HypErtension with or without iSchemic heart disease) trial was intended to evaluate the efficacy of a fixed dose combination of perindopril/amlodipine in terms of reducing blood pressure (BP) and dynamics of target organs damage in patients suffering from arterial hypertension (AH) with ischemic heart disease (IHD) and without it. This article is the result of an analysis of data obtained in patients with AH and clinical signs of IHD.
Materials and methods. The study included 30 patients with AH and verified IHD aged over 30 years. Systolic (SBP) and/or diastolic (DBP) blood pressure level in patients, who had not been treated before, had to be ≥ 160/100 mmHg, but < 200/120 mmHg at baseline; in those, who were on monotherapy or dual combination therapy, — ≥ 140/90 mmHg, but < 200/120 mmHg. All patients on the day of randomization were prescribed a fixed dose combination of perindopril/amlodipine at an initial dose of 5.5 mg once a day. If necessary (BP > 140/90 mmHg), the dose of components of fixed dose combination was increased gradually every 2 weeks up to 10/10 mg, and after 6 weeks of treatment, indapamide 1.5 mg was added. 96.7 % of patients received beta-blockers. All patients underwent: measurement of body weight and height, office levels of SBP, DBP and heart rate, daily BP monitoring, determination of pulse wave velocity in elastic (PWVe) and muscle arteries, central SBP, biochemical blood tests, electrocardiography, echocardiography with Doppler, measurement of ankle-brachial index, intima-media thickness (IMT). The duration of follow-up was 12 months.
Results and discussion. Treatment with a fixed dose combination of perindopril/amlodipine (in doses ranging from 5/5 to 10/10 mg/day) in patients with IHD and AH, which was not controlled in patients receiving beta-blockers and other antihypertensive drugs, provided achieving the target level of SBP and DBP in 76.7 % of cases within 6 weeks. Adding indapamide 1.5 mg daily (n = 7) provided office SBP and DBP control in 100 % of patients during 6 months of treatment. Reduction of office BP was associated with a significant decrease in average daily, day and night SBP/DBP by 20.70 ± 0.08 mmHg, 16.4 ± 0.2 mmHg, 25.1 ± 0.1 mmHg and 12.6 ± 0.1 mmHg, 14.10 ± 0.09 mmHg, 11.5 ± 0.1 mmHg, respectively. Target average daily BP (less than 130/80 mmHg) was achieved in 28 (93.3 %) patients. This reduced variability in day and night SBP/DBP, the average increase of morning SBP and the proportion of patients with morning increase in SBP over 55 mmHg.
Central SBP against the background of this treatment significantly decreased from 141.8 ± 3.5 mmHg to 121.3 ± 2.7 mmHg (P < 0.001). In parallel, there was a significant (P < 0.02) decrease in augmentation index from 29.9 ± 3.2 % to 20.1 ± 1.8 %. Therapy effective in terms of BP control during the year resulted in significant regression of target organ damage: reduced left ventricular hypertrophy, albuminuria level, IMT, improved left ventricular diastolic function and elastic properties of the aorta. Changes in albuminuria level and IMT reliably and regardless of BP changes (both office and central) correlated with changes in PWVe. Antihypertensive therapy was well tolerated by patients — among 31 patients, who received a fixed dose combination of perindopril/amlodipine, adverse events were reported in 3 (10 %), and treatment discontinuation was only in 1 (3.3 %) patient. During treatment, the number of patients with such complaints, as headaches, dizziness, pain in the heart, decreased from 60, 20 and 80 % to 3.3; 0 and 46.7 %, respectively. Among patients, who had angina at baseline, the number of angina attacks per week significantly decreased — from 2.5 ± 0.4 to 1.2 ± 0.2 (P < 0.01).
Статтю опубліковано на с. 77-92
Вступ
Ураження органів-мішеней є проявом артеріальної гіпертензії (АГ), фактором, що впливає на прогноз, та маркером ефективного лікування. Як правило, від рівня артеріального тиску (АТ) залежить ступінь цього ураження, а від його зниження — регрес. У ряді досліджень було показано прямий кореляційний зв’язок між ступенем зниження АТ та регресом гіпертрофії лівого шлуночка (ГЛШ) [34, 38, 42], альбумінурії [20, 27], жорсткості аорти [56]. При цьому зменшення ураження на фоні терапії може позитивно асоціюватися з прогнозом. Так, зменшення індексу маси міокарда лівого шлуночка (ІММЛШ) на кожні 25 г/м2 у дослідженні LIFE забезпечувало зменшення ймовірності виникнення комбінованої кінцевої точки на 22 %, серцево-судинної смерті — на 38 %, інфаркту міокарда — на 15 %, інсульту — на 24 %, загальної смерті — на 28 %. Пацієнти, у яких і на початку, і через рік терапії зберігалася висока протеїнурія, мали значно більшу частоту ускладнень, ніж пацієнти, які на початку дослідження мали високу протеїнурію, а через рік терапії — низький рівень у дослідженні LIFE [18, 24]. У дослідженні ADVANCE призначення комбінації периндоприл/індапамід хворим із цукровим діабетом достовірно знижувало загальну смертність на 14 % та зменшувало рівень альбумінурії [44]. У дослідженні із хворими з нирковою недостатністю продемонстровано, що зниження швидкості поширення пульсової хвилі (ШППХ) по аорті на 1 м/с супроводжується зменшенням ризику смерті на 29 % [16].
Вважається, що всі препарати, які знижують АТ, a priorі зменшують ураження органів-мішеней, але ступінь цього зменшення може залежати від вибору терапії. І, окрім того, виявляється, що на фоні не всіх антигіпертензивних засобів даний регрес асоціюється з покращенням прогнозу. Так, у дослідженні ROADMAP олмесартан запобігав виникненню мікроальбумінурії, але не призводив до зменшення частоти виникнення кінцевих точок [49]. У дослідженні ELSA лацидипін запобігав збільшенню товщини комплексу інтима-медіа (ТКІМ) достовірно більшою мірою, ніж атенолол, але не було різниці за кінцевими точками. Тому пошуки найбільш оптимальної терапії, яка б запобігала виникненню та прогресуванню, сприяла регресу змін в органах при АГ і при цьому супроводжувалася покращенням прогнозу щодо розвитку ускладнень, є актуальною проблемою сучасної медицини.
Ішемічна хвороба серця (ІХС) є багатофакторним захворюванням, але рівень АТ завдяки тривалому впливу є одним з важливих факторів, значення якого різко зростає при рівні систолічного АТ (САТ) понад 140 мм рт.ст. [4] Дослідження INTERHEART продемонструвало, що близько 50 % ризику виникнення інфаркту міокарда для населення можна пов’язати з ліпідами, а 25 % припадає на АГ [65]. Вважається, що АГ, з одного боку, може прискорювати розвиток атеросклерозу, а іншого боку, здатна призводити до ураження органів-мішеней, що, у свою чергу, погіршує перебіг ІХС. Окрім того, АГ може бути пов’язана з ІХС через інші фактори ризику серцево-судинних ускладнень. Так, відомо, що й дисліпідемія (фактор ризику ІХС), і рівень АТ тісно пов’язані з індексом маси тіла [47].
Oсновним чинником запобігання ускладненням АГ, в тому числі й при поєднанні ІХС, є зниження АТ до цільового рівня. У літературі існує багато робіт, присвячених вивченню особливостей контролю АГ в різних популяціях пацієнтів. При цьому наявність ІХС розглядається як фактор, що може впливати на ефективність антигіпертензивної терапії. Залишається невідомим, чи є відмінності в ураженні органів-мішеней між гіпертензивними пацієнтами з ІХС або без неї, чи однаково відбувається регрес цього ураження на фоні антигіпертензивної терапії.
Наше дослідження EPHES (Evaluation of influence of fixed dose combination Рerindopril/Amlodipine on target organ damage in patients with arterial HypErtension with or without iSchemic heart disease — оцінка впливу фіксованої комбінації периндоприл/амлодипін на ураження органів-мішеней у пацієнтів з АГ та з ішемічною хворобою серця або без неї) мало за мету оцінити ефективність фіксованої комбінації периндоприл/амлодипін щодо зниження АТ та динаміки вираженості ураження органів-мішеней у хворих на АГ з ІХС та без неї. Вибір даної комбінації базувався на двох основних критеріях. По-перше, для того щоб оцінити особливості регресу ураження органів-мішеней у різних когортах хворих, необхідно, щоб пацієнти отримували порівнянну (краще однакову) антигіпертензивну терапію. По-друге, у великих дослідженнях ALLHAT, ASCOT та EUROPA було доведено високу ефективність периндоприлу, амлодипіну та їх комбінації як при АГ, так і при ІХС. Тому фіксована комбінація периндоприл/амлодипін показана хворим як з АГ, так і з поєднанням АГ з ІХС. У попередній статті [3] ми подавали первинні результати дослідження в пацієнтів з АГ без ІХС. Ця стаття є результатом аналізу отриманих даних у пацієнтів з АГ та клінічними ознаками ІХС.
Матеріали та методи
Матеріали. У дослідження EPHES було включено 60 пацієнтів з АГ віком понад 30 років. Рівень САТ та/або діастолічного АТ (ДАТ) у хворих, які до цього не лікувалися, на момент включення мав бути ≥ 160/100 мм рт.ст., але < 200/120 мм рт.ст.; у тих, хто перебував на монотерапії або подвійній комбінованій терапії — ≥ 140/90 мм рт.ст., але < 200/120 мм рт.ст. Кожен пацієнт підписував інформовану згоду на участь у даному дослідженні. Протокол дослідження був схвалений локальною комісією з етики ДУ «ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України».
В аналіз, результати якого подано в даній статті, було включено 30 пацієнтів, які мали ІХС та завершили однорічне спостереження згідно з протоколом. Характеристика пацієнтів подана в табл. 1.
/79.jpg)
У дослідження не включали пацієнтів з рівнем САТ та/або ДАТ > 200 та/або 120 мм рт.ст., інфарктом міокарда та інсультом в анамнезі, вродженими або набутими вадами серця, неконтрольованими порушеннями ритму, серцевою недостатністю III–IV функціональних класів NYHA або фракцією викиду лівого шлуночка < 50 %, хронічною обструктивною хворобою легень, неконтрольованим цукровим діабетом, хронічною хворобою нирок 3В стадії (ШКФ < 45 мл/хв), печінковою недостатністю або підвищенням рівнів печінкових ферментів більше ніж у 3 рази порівняно із верхньою межею норми, симптоматичною АГ, білатеральним стенозом ниркових артерій або стенозом артерії єдиної нирки, онкологічними та психічними захворюваннями, тих, які мали побічні явища на фоні прийому амлодипіну (або інших антагоністів кальцію) або інгібіторів ангіотензинперетворюючого ферменту (АПФ), тих,
які відмовилися підписати форму інформованої згоди або брали участь у іншому клінічному дослідженні. Критерієм виключення також був вік менше за 30 років, адже групи з ІХС та без неї мали бути порівнянними за віком, а у віці до 30 років ІХС серця зустрічається рідко.
Діагноз ІХС встановлювався при наявності типової стенокардії та/або типових змін на ЕКГ при навантажувальних тестах та/або даних коронарографії (прямої або спіральної комп’ютерної томографії високої роздільної здатності). У 10 (30 %) пацієнтів до включення в дослідження було проведено стентування (переважно 1–2 стенти). Виключалися хворі, які перенесли інфаркт міокарда або потребували стентування в найближчі 12 місяців (наявність стенозів > 70 % у коронарних артеріях). Детальна характеристика подана в табл. 1.
Пацієнт виключався із дослідження у випадках: відкликання інформованої згоди, недосягнення цільового АТ протягом 6 місяців лікування, виникнення побічних явищ, що не дозволяли продовжувати участь у спостереженні, погіршення стану пацієнта, яке не було пов’язане із терапією, проте вимагало проведення додаткових обстежень або призначення супутніх препаратів, що не дозволені протоколом.
Методи лікування. Усім пацієнтам, і тим, які до цього не лікувалися, і тим, які приймали антигіпертензивну терапію, у день рандомізації відразу призначали фіксовану комбінацію периндоприл/амлодипін (Бі-Престаріум®, виробництво компанії «Серв’є», Франція) у початковій дозі 5/5 мг один раз на добу. У подальшому при недостатній ефективності терапії (АТ > 140/90 мм рт.ст.) дози компонентів фіксованої комбінації збільшували поступово кожні 2 тижні до 10/10 мг. При недосягненні цільового рівня АТ протягом 6 тижнів лікування додавався індапамід 1,5 мг (Арифон® ретард, виробництво компанії «Серв’є» Франція) строком на 4 тижні. Для лікування стенокардії пацієнтам дозволялося призначати бета-адреноблокатори та нітрати. Окрім того, для покращення контролю АТ призначались альфа-адреноблокатори. Усі препарати пацієнти купляли в аптеках самостійно.
Якщо протягом 6 місяців не вдавалося досягнути цільового рівня АТ, пацієнт виключався із дослідження для додаткового більш розширеного обстеження й встановлення причин резистентності. На місце виключеного через побічні явища або недостатню ефективність терапії рандомізували іншого пацієнта, який відповідав критеріям включення і не мав критеріїв виключення.
Обов’язково всім пацієнтам призначалися такі супутні препарати, як статини та ацетилсаліцилова кислота у профілактичних дозах (75–100 мг/добу). Можливим було також призначення препаратів поліненасичених жирних кислот. Нітрати дозволялося приймати пацієнтам лише за необхідності. Якщо пацієнт мав потребу в постійному прийомі нітратів, то він виключався із дослідження.
Методи дослідження. Усім пацієнтам проводили такі дослідження: вимірювання маси тіла та зросту, офісних рівнів САТ, ДАТ та частоти серцевих скорочень (ЧСС), добове моніторування АТ (ДМАТ), визначення швидкості поширення пульсової хвилі в артеріях еластичного (ШППХе) та м’язового (ШППХм) типів, центрального САТ (цСАТ), біохімічне дослідження крові (рівні калію, натрію, креатиніну, сечової кислоти, АЛТ, АСТ, білірубіну, глюкози, загального холестерину, тригліцеридів, холестерину ліпопротеїдів високої та низької щільності сироватки крові), електрокардіографію (ЕКГ), ехокардіографію (ЕхоКГ) з допплерографією, вимірювання гомілково-плечового індексу, визначення товщини комплексу інтима-медіа. Протокол дослідження подано в табл. 2. Тривалість спостереження становила 12 місяців, адже в багатьох дослідженнях показано, що зворотний розвиток ураження органів-мішеней відбувається у строках, як правило, понад 6 місяців лікування [14].
/81_2.jpg)
Офісні рівні САТ і ДАТ реєстрували на початку дослідження за допомогою автоматичного осцилометричного апарата OMRON-705IT (виробництво компанії Omron Health care Co., Японія). Вираховували середнє з трьох вимірювань. ЧСС визначали після другого вимірювання.
Антропометричні вимірювання проводили з використанням ростоміра та ваг SECA (виробництво компанії SECA, Німеччина). Індекс маси тіла (ІМТ) обчислювали за формулою: ІМТ = маса тіла/зріст2.
Реєстрацію ЕКГ у пацієнтів до та в кінці лікування проводили на шестиканальному самописці «Юнікард» (Україна). Визначали наявність загальноприйнятих ознак ГЛШ: індекс Соколова (SV1 + RV5/RV6) > 35 мм, вольтажний індекс Корнела (R aVL + S V3) > 28 мм у чоловіків та > 20 мм — у жінок, індекс тривалості Корнела (вольтаж помножити на тривалість) > 2400 мм • мс, індекс Ромхілт — Estes > 5 балів та порушення ритму.
ДМАТ проводили на портативному апараті АВРМ-04 (Meditech, Угорщина). При цьому вивчали такі показники: середньодобовий (24-г), денний (д), нічний (н) САТ і ДАТ, ЧСС; варіабельність САТ (вар.САТ) і ДАТ (вар.ДАТ), що вираховувалася за допомогою офісного забезпечення приладу як стандартне відхилення від середнього значення; добовий індекс (ДІ) для САТ — ступінь зниження нічного САТ порівняно з денним, що відображався у відсотках. Залежно від ДІ для САТ пацієнти розподілялися на диперів (зниження нічного САТ порівняно з денним більше ніж на 10 %) та нон-диперів (зниження нічного САТ порівняно з денним менше ніж на 10 %). Величину ранкового підйому САТ визначали як різницю між максимальним САТ у період з 6:00 до 12:00 та мінімальним САТ у нічний час. За нормальне значення показника вважали його величину менше від 55 мм рт.ст. [26]. Моніторування відбувалося у режимі кожні 15 хв в денний час та кожні 30 хв у нічний (з 22:00 до 6:00 — кожні 30 хв). Хворі вели звичайний спосіб життя, маючи побутові фізичні й психоемоційні навантаження [63].
Біохімічні аналізи виконували на автоматичному фотометрі Livia (Сormay, Польща) в лабораторії ДУ «ННЦ «Інститут кардіології ім. акад. М.Д. Стражеска» НАМН України. Визначали рівень креатиніну, електролітів (калію та натрію), глюкози, загального холестерину та тригліцеридів. ШКФ розраховували за формулою CKD-EPI, затвердженою рекомендаціями KDIGO 2013 р. [31]:
ШКФ = 141 • мін. (креатинін/k, 1)α • макс. (креатинін/k, 1)1,209 • 0,993вік • 1,018 (якщо жінка) ×
× 1,159 (якщо належить до негроїдної раси),
де ШКФ — швидкість клубочкової фільтрації, креатинін — концентрація креатиніну в сироватці крові в мг/дл (для переведення показник поділено на 88,4), k = 0,7, якщо жінка, k = 0,8, якщо чоловік, α = 0,329, якщо жінка, α = 0,411, якщо чоловік, мін. — мінімальне значення показника креатинін/k або 1, макс. — максимальне значення показника креатинін/k або 1.
Альбумінурію визначали за допомогою методу імунотурбометрії на аналізаторі Siemens (Німеччина, США) у добовій порції сечі.
ШППХ, цСАТ та індекс приросту (Aix75), стандартизований до ЧСС 75 за 1 хв, визначали на апараті Sphygmocor-PVx (AtCor Medical Pty Ltd, Австралія), з’єднаному з персональним комп’ютером. П’єзодатчики встановлювали на загальній правій сон-ній, стегновій артеріях та на радіальній артерії правого передпліччя під візуальним (на моніторі) та автоматичним контролем якості, що здійснювався за відповідної програми приладу. Час запізнювання пульсової хвилі та ШППХ, центральний АТ визначалися автоматично за допомогою програмного забезпечення приладу після введення величини відстані між датчиками, що вимірювалася сантиметровою смужкою. Для оцінки пружно-еластичних властивостей артерій еластичного типу ШППХе реєстрували на сегменті «сонна артерія — стегнова артерія», для оцінки пружно-еластичних властивостей артерій м’язового типу (ШППХм) — на сегменті «сонна артерія — радіальна артерія». Центральний АТ визначали за допомогою програмного забезпечення приладу на основі АТ на плечовій артерії та форми отриманої пульсової хвилі у висхідній аорті (формула визначена виробником, проведена стандартизація при інтрааортальному вимірюванні АТ), а також з урахуванням даних епідеміологічних досліджень, на підставі яких розроблено індивідуальні норми тиску в аорті, визначення яких також було закладено в алгоритмі програми.
Вимірювання ТКІМ проводили згідно з консенсусом Американського товариства з ехокардіографії 2008 р. [57] тричі з розрахунком середнього значення почергово у правій та лівій сонній артерії.
Гомілково-плечовий індекс визначали за допомогою автоматичного приладу OMRON-705IT (виробництво компанії Omron Health care Co., Японія). Вираховували середнє з трьох вимірювань.
ЕхоКГ з допплерографією виконували на апараті Sonos 5500 (Hewlett Packard, США) за розширеним протоколом відповідно до рекомендацій Європейської асоціації фахівців із візуалізації серцево-судинної системи та із визначенням основних розмірів і об’ємів камер серця й магістральних судин, фракції викиду лівого шлуночка, діастолічної функції та ІММЛШ за формулою Американського товариства з ехокардіографії [22], використання якої було рекомендоване Європейським товариством з артеріальної гіпертензії у 2013 р. [4].
Діастолічну функцію лівого шлуночка досліджували за допомогою постійної допплерехокардіографії спектра трансмітрального діастолічного потоку із визначенням швидкості кровотоку в систолу лівого передсердя А, інтегралу швидкості кровотоку раннього діастолічного наповнення Е. Як основні критерії використовували співвідношення Е/А, час сповільнення раннього трансмітрального потоку, пікову швидкість хвиль Е і А та час ізоволюмічного розслаблення. Використовували тканинну допплерографію із розміщенням контрольного об’єму на септальній частині мітрального кільця із визначенням амплітуди E’ та співвідношення Е/Е’.
Для верифікації ІХС навантажувальний тест проводився на тредмілі із використанням системи постійного ЕКГ моніторування (Сardio PC, Innomed Medical, Угорщина). Коронарографія проводилася при прямій катетеризації або за допомогою спіральної комп’ютерної томографії високої роздільної здатності.
Усі інструментальні методи дослідження проводилися лікарями, які є спеціалістами у своїй галузі і які не були зацікавлені в результатах дослідження. Дослідження проводили на одному й тому ж апараті, одним і тим же фахівцем.
Кінцеві точки дослідження. Первинними кінцевими точками дослідження були: ступінь зниження АТ (офісного, амбулаторного, центрального); достовірна динаміка показників, що характеризують ураження органів-мішеней; переносимість призначеної терапії. За вторинні кінцеві точки вважали: частку пацієнтів, які досягли цільового офісного АТ; зміни показників ДМАТ (ранковий підйом, ДІ, варіабельність); нормалізацію цСАТ; зміни біохімічних показників; динаміку скарг хворого.
Методи статистичної обробки. Статистичну обробку результатів проводили за допомогою програмного забезпечення IBM Statistics SPSS 21.0 з розрахунком середньої арифметичної величини (М) та середньої абсолютної похибки (m). Достовірність різниці показників на етапах лікування визначали за допомогою парного тесту для середніх. Для встановлення зв’язку динаміки параметрів, що вивчалися, проводили кореляційний аналіз за Spearman та мультирегресійний аналіз.
Результати дослідження
Зниження офісного АТ. Динаміка офісного САТ, ДАТ та ЧСС подана на рис. 1. Спостерігалося значне зниження офісних САТ/ДАТ вже на першому місяці лікування з 148,4 ± 2,2/91,1 ± 1,1 мм рт.ст. до 138,8 ± 1,8/87,3 ± 0,9 мм рт.ст. (Р < 0,005/0,02). У подальшому на етапах 2, 3, 6 та 12 місяців лікування АТ продовжував знижуватися до 136,3 ± 1,7 мм рт.ст., 134,0 ± 2,0 мм рт.ст., 134,7 ± 1,5 мм рт.ст., 133,3 ± 1,2 мм рт.ст. та 85,1 ± 0,8 мм рт.ст., 82,0 ± 0,9 мм рт.ст., 80,0 ± 1,2 мм рт.ст. та 77,2 ± 1,2 мм рт.ст. відповідно для САТ і ДАТ (Р < 0,001 порівняно із початком для всіх показників). Офісна ЧСС достовірно не змінилася, лише на першому місяці прийому спостерігалася тенденція до збільшення ЧСС, що, ймовірно, пов’язано з активацією симпатоадреналової системи на фоні прийому амлодипіну. Проте на 2-му та 3-му місяцях терапії цей показник почав знижуватися та в кінці дослідження був достовірно (Р < 0,005) меншим, ніж після першого місяця прийому.
/82.jpg)
Тільки фіксовану комбінацію периндоприл/амлодипін було призначено 23 (76,7 %) хворим. 7 пацієнтів (23,3 %) потребували додаткової терапії індапамідом. При цьому 29 (96,7 %) пацієнтів приймали бета-блокатори (22 — бісопролол, 7 — метопролол). Загалом цільовий АТ (менше від 140/90 мм рт.ст.) було досягнуто у всіх пацієнтів, включених у дослідження.
Динаміка показників ДМАТ подана в табл. 3. Як видно з табл. 3, на фоні лікування достовірно знизилися рівні САТ та ДАТ за добу, день та ніч на 20,70 ± 0,08 мм рт.ст., 16,4 ± 0,2 мм рт.ст., 25,1 ± 0,1 мм рт.ст. та 12,6 ± 0,1 мм рт.ст., 14,10 ± 0,09 мм рт.ст., 11,5 ± 0,1 мм рт.ст. відповідно. ЧСС достовірно не змінилася. Цільовий середньодобовий АТ (менше від 130/80 мм рт.ст.) було досягнуто у 28 (93,3 %) пацієнтів.
На початку дослідження 53,3 % пацієнтів характеризувалися як нон-дипери. Під впливом призначеної терапії спостерігалося недостовірне зниження кількості таких пацієнтів до 40 %. Середній рівень ДІ для САТ достовірно не змінився. Середня варіабельність денного та нічного САТ і ДАТ була на початку вищою за нормальні показники. На фоні лікування спостерігалося достовірне зменшення варіабельності денних САТ/ДАТ та нічних САТ/ДАТ, що в подальшому, як показало дослідження ASCOT, може позитивно вплинути на прогноз у даних пацієнтів [52].
Середня величина ранкового підйому САТ достовірно зменшилася під впливом терапії, що поряд із зниженням варіабельності свідчить про забезпечення жорсткого та достатнього 24-годинного контролю АТ. Кількість пацієнтів з величиною ранкового підйому САТ більше ніж на 55 мм рт.ст. достовірно (Р < 0,005) зменшилася з 25 (83,3 %) до 14 (46,7 %)
Динаміка центрального АТ. На початку дослідження цСАТ був дещо нижчим за офісний — 141,8 ± 3,5 мм рт.ст. проти 148,4 ± 2,2 мм рт.ст. Через 12 місяців лікування відбулося достовірне зниження його рівня до 121,3 ± 2,7 мм рт.ст. (Р < 0,001). Нормального для відповідного віку тиску (згідно з номограмами, інтегрованими в прилад) досягнули всі пацієнти. У середньому цСАТ знизився більше, ніж офісний, — 20,3 ± 1,8 мм рт.ст. проти 15,2 ± 2,1 мм рт.ст. (P = НД). Паралельно відбулося достовірне (Р < 0,02) зменшення індексу приросту з 29,9 ± 3,2 % до 20,1 ± 1,8 %.
/83.jpg)
Динаміка показників, що характеризують ураження органів-мішеней, подана в табл. 4. Як видно з табл. 4, на початку дослідження середні показники, що характеризують ураження судин (ТКІМ, ШППХе, гомілково-плечовий індекс), були більші за нормальні величини, що, з одного боку, могло бути пов’язане з впливом тривало підвищеного АТ на пружно-еластичні властивості артерій (розглядається як ураження органів-мішеней при АГ), а з іншого боку, з розвитком атеросклеротичного ураження судин (ТКІМ часто розглядається як ранній предиктор ІХС [39]). На фоні лікування достовірної позитивної зміни зазнала середня величина ШППХе та ТКІМ, що стало можливим за рахунок як ефективного зниження АТ, так і прямого впливу препаратів на еластичні властивості артерій.
Функція нирок, яку оцінювали за величиною ШКФ, достовірно не змінилася, але значно зменшилася протеїнурія. При цьому кількість пацієнтів, які на початку дослідження мали рівень альбуміну в добовій сечі, більший за норму (для чоловіків понад 20 мг/добу, для жінок понад 30 мг/добу), достовірно (Р < 0,05) зменшилася з 18 (60 %) до 10 (33,3 %).
Відбувалися значні позитивні зміни показників, що характеризують ураження серця: достовірно зменшилися на 14 та 8,9 % відповідно середні величини ІММЛШ та індексу тривалості Корнела (тобто спостерігався регрес гіпертрофії лівого шлуночка), збільшився показник Е/А та зменшилося співвідношення Е/Е’ (покращилася діастолічна функція лівого шлуночка), що призвело до достовірного зменшення розмірів лівого передсердя.
Динаміка біохімічних показників. Ми не спостерігали достовірної зміни жодного показника, який контролювався в наших пацієнтів (табл. 5), окрім достовірного зменшення рівня загального холестерину та тригліцеридів, що, скоріше за все, було обумовлено призначенням статинів пацієнтам (n = 30).
Оцінка безпеки терапії. Загалом до дослідження було залучено 31 пацієнта. В одного пацієнта виник кашель, що призвело для виключення його із дослідження. На його місце було взято іншого пацієнта, який мав критерії включення і не мав критеріїв виключення. На фоні лікування у 2 пацієнтів виникли периферичні набряки, але це не призвело до припинення їх участі у дослідженні. Отже, з 31 пацієнта, яким призначили фіксовану комбінацію периндоприл/амлодипін, побічні явища було зареєстровано в 3 (10 %).
На фоні лікування спостерігалося зменшення кількості пацієнтів з такими скаргами, як головний біль (з 18 (60 %) осіб до 1 (3,3 %), Р < 0,001), запаморочення (з 6 (20 %) до 0 осіб, P < 0,05) та болі в ділянці серця (з 24 (80 %) до 14 (46,7 %) осіб, P < 0,01). Окрім того, у пацієнтів, які мали стенокардію на початку дослідження, значно зменшилася кількість приступів стенокардії за тиждень — з 2,5 ± 0,4 до 1,2 ± 0,2 (Р < 0,01).
Кореляція показників, що характеризували ураження органів-мішеней, зі зниженням АТ. Майже всі показники, що характеризували ураження органів-мішеней, на початку дослідження корелювали як з офісним, так і з центральним САТ (табл. 6). Розмір лівого передсердя достовірно не корелював із величиною ні офісного, ні центрального АТ, але він достовірно корелював з ІММЛШ (r = 0,62, P < 0,001) та Е/Е’(r = 0,43, P = 0,02). Гомілково-плечовий індекс корелював лише з центральним АТ. Величина ШКФ не корелювала із жодним показником, що вивчався.
Зміни ураження органів-мішеней, як і слід було очікувати, залежали від динаміки рівня АТ як в аорті, так і на плечовій артерії. Проте в попередньому аналізі нами було продемонстровано [3], що у хворих з АГ без ІХС покращення діастолічної функції лівого шлуночка та зменшення альбумінурії незалежно корелювали тільки із зменшенням ШППХе та центрального САТ. Це частково підтвердилося й для пацієнтів з ІХС (табл. 7). Так, при звичайному кореляційному аналізі за Spearman зменшення оСАТ, цСАТ та ШППХе корелювало із збільшенням Е/А, Е/Е’ та зменшенням рівня мікроальбумінурії. Проте при проведенні мульваріантного регресійного аналізу виявилося (табл. 7), що ΔЕ/Е’ та зменшення рівня альбумінурії незалежно (у тому числі незалежно від зміни ІММЛШ) корелювали із зменшенням величини цСАТ, а не оСАТ.
/85.jpg)
Окрім того, зменшення ШППХе збільшувало ймовірність зниження альбумінурії в 1,78 раза. Зменшення Аіх75 асоціювалося із збільшенням ймовірності зростання Е/А на 35 % та зменшенням альбумінурії в 1,42 раза. Окрім того, із зниженням тільки центрального САТ також корелювало зменшення ТКІМ, що не було відмічено в пацієнтів без ІХС.
Обговорення отриманих результатів
Останнім часом багато уваги приділяється вивченню впливу саме центрального АТ на прогноз та ураження органів-мішеней при АГ. Встановлено, що як мінімум 70 % хворих із так званим високим нормальним рівнем CАТ (130–139/85–89 мм рт.ст.) на плечовій артерії мають центральний АТ, який відповідає 1-му ступеню підвищення АТ. Більше того, у 30 % чоловіків та 10 % жінок з нормальним АТ на плечовій артерії (< 130/85 мм рт.ст.) центральний тиск також може бути підвищеним до рівня, що відповідає 1-му ступеню АГ [35]. Це може визначати різний прогноз у даних осіб при наявності однакового офісного АТ.
Відомо, що позитивний вплив антигіпертензивної терапії на прогноз в основному пов’язаний із її здатністю знижувати АТ: чим більше знижується тиск, тим менша вірогідність виникнення ускладнень. Проте в пацієнтів з АГ в деяких дослідженнях було показано, що при однаковому ступені зниження офісного АТ деякі препарати забезпечують кращий вплив на прогноз [14, 15]. У подальшому з’ясувалося, що існувала різниця між препаратами у впливі на додаткові показники контролю АТ (нічний АТ, варіабельність, центральний АТ). Так, у дослідженні ASCOT лікування на основі амлодипіну (+ периндоприл) забезпечувало зниження ризику інсульту на 23 %, смертності від серцево-судинних захворювань — на 24 %, загальної смерті — на 11 % порівняно з лікуванням на основі атенололу (+ тіазид) [58]. При цьому виявилося, що перша комбінація забезпечувала кращий контроль нічного АТ протягом майже всього періоду спостереження, зменшувала ранковий підйом САТ та варіабельність АТ. Різниця в 4,3 мм рт.ст. у рівнях центрального САТ у кінці також була на користь терапії амлодипіном (+ периндоприл).
Вважається, що практично всі антигіпертензивні препарати знижують центральний АТ. Проте ступінь цього зниження може відрізнятися й не завжди корелювати із ступенем зменшення офісного АТ. Так, за даними одного з перших метааналізів [37], антагоністи кальцію та діуретики однаково знижують центральний та периферичний АТ. Інгібітори АПФ знижують центральний тиск більшою мірою, ніж периферичний. Тому інколи говорять про недооцінку ефективності інгібіторів АПФ. Бета-блокатори, особливо без вазодилатуючого ефекту, знижують центральний АТ меншою мірою, ніж АТ на плечовій артерії. Вважається, що ці препарати, сповільнюючи ЧСС, сприяють поверненню відображеної пульсової хвилі в систолу та додатковому збільшенню систолічного центрального АТ. Виходячи з цього, можна говорити про те, що найбільш вигідними подвійними комбінаціями антигіпертензивних препаратів щодо зниження аортального АТ є антагоніст кальцію + діуретик або блокатор РАС. У нашому дослідженні ми тестували саме таку ефективну фіксовану комбінацію периндоприл/амлодипін. Проте майже всі хворі, включені у дослідження, також отримували бета-блокатори згідно із сучасним рекомендаціям з лікування АГ та ІХС, і нам було цікаво, чи може це вплинути на контроль саме центрального АТ. Виявилося, що додавання фіксованої комбінації периндоприл/амлодипін до бета-блокатора сприяло зниженню центрального АТ у всіх хворих до нормальних величин відповідно до віку пацієнтів. При цьому ступінь зниження цСАТ був недостовірно більшим порівняно із зниженням офісного САТ — 20,3 ± 1,8 мм рт.ст. проти 15,2 ± 2,1 мм рт.ст. Тобто ефективність комбінації не залежала від додаткового прийому бета-блокаторів. На практиці це означає, що якщо при призначенні цієї комбінації пацієнтам з АГ та ІХС, які вимушені приймати бета-блокатори, досягається цільовий офісний АТ, то це означає, і без спеціального вимірювання, нормалізацію аортального АТ.
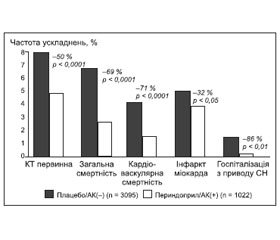
Як вже вказувалося вище, позитивні ефекти поєднаного призначення периндоприлу та амлодипіну у хворих з ІХС були продемонстровані у дослідженні EUROPA [7]. Додавання периндоприлу до антагоністів кальцію призводило до зменшення загальної смертності на 46 %, виникнення первинної кінцевої точки (кардіоваскулярна смерть, нефатальний інфаркт міокарда, кардіальний арешт з успішною реанімацією) — на 35 %, серцево-судинної смерті — на 41 %, госпіталізацій з приводу серцевої недостатності — на 54 %, інфаркту міокарда — на 28 % [7]. Ще більш вражаючим було зниження кінцевих точок у цьому дослідженні в групі комбінації периндоприл/антагоніст кальцію порівняно з групою плацебо без антагоністів кальцію (рис. 2) [46].
/86.jpg)
Пояснень такого позитивного синергізму периндоприлу та амлодипіну може бути декілька. По-перше, обидва препарати добре знижують АТ, а зниження САТ на кожні 10 мм рт.ст., як продемонстровано в останньому метааналізі, забезпечує достовірне зменшення ризику всіх серцево-судинних ускладнень на 20 %, коронарних подій — на 17 %, інсульту — на 27 %, серцевої недостатності — на 28 %, загальної смерті — на 13 % [21]. По-друге, як показало дослідження ASCOT та наше дослідження, обидва препарати не просто знижують офісний АТ, але й забезпечують всебічний контроль АТ: нормалізують середньодобовий, нічний та центральний АТ; зменшують варіабельність АТ, що визначалася за даними ДМАТ, та величину ранкового підйому АТ. По-третє, периндоприл, як інгібітор АПФ (через вплив на ангіотензин ІІ, активацію брадикинінової системи, симпатолітичні властивості, вплив на фібринолітичну систему), призводить до зменшення впливу оксидативного стресу на ендотелій, покращення ендотеліальної функції, модифікації агрегації тромбоцитів, зменшення вазоконстрикції в атеросклеротичних коронарних артеріях та ішемії міокарда [8]. Так, у піддослідженні дослідження EUROPA PERTINENT спостерігали на фоні прийому периндоприлу достовірне зменшення рівнів біомаркерів атеросклеротичних ускладнень — D-димеру та прозапального цитокіну TNF-a [11]. Окрім того, під впливом периндоприлу збільшувалася активність ендотеліальної NO-синте-тази на 27 % та зменшувався апоптоз на 31 %. Усе це супроводжувалось зменшенням рівнів ангіотензину ІІ, підвищенням рівня брадикініну, зменшенням рівня туморнекротичного фактора та збільшенням співвідношення нітрити/нітрати [12]. Амлодипін також має антиатеросклеротичну дію, яка реалізується через відновлення порушеного судинного тонусу та стану стінки судин, що пов’язано із покращенням функції ендотелію та зменшенням міграції гладком’язових клітин. Клінічне підтвердження цьому було отримано в дослідженнях PREVENT та CAMELOT, у яких амлодипін зменшував атеросклеротичне ураження артерій [40, 45]. По-четверте, завдяки вищевказаним властивостям обидва препарати можуть викликати регрес ураження органів-мішеней, що позитивно впливає на прогноз. Причому цей ефект може залежати як від ступеня зниження АТ, так і від додаткових (плейотропних) властивостей препаратів.
Останнім часом вважається, що центральний АТ має більше значення для ураження органів-мішеней та виникнення кардіоваскулярних ускладнень, ніж АТ, виміряний на плечовій артерії [30, 35, 50, 58]. Адже саме тиск в аорті безпосередньо діє на органи-мішені. У деяких інших дослідженнях, як і в нашому (табл. 6), спостерігався більш тісний кореляційний зв’язок центрального АТ з такими сурогатними маркерами серцево-судинного ризику, як ТКІМ та ІММЛШ, ніж офісного АТ [10, 13, 51, 62, 64]. Окрім того, в нашому дослідженні центральний АТ, на відміну від офісного, корелював із величиною гомілково-плечового індексу. Центральний АТ залежить від змін еластичних властивостей аорти, що змінюються під впливом багатьох факторів, а не тільки тиску. Саме тому, можливо, у деяких людей при нормальному офісному АТ може спостерігатися підвищений центральний. Величина гомілково-плечового індексу також залежить як від АТ, так і атеросклеротичного процесу (який змінює еластичні властивості судин). Тому зв’язок АТ в аорті з гомілково-плечовим індексом є більш тісним, ніж АТ на плечовій артерії.
Наш кореляційний аналіз (табл. 7) підтвердив дані попередніх досліджень [9, 17, 48]: зменшення ступеня ураження органів-мішеней (гіпертрофії та діастолічної дисфункції лівого шлуночка, альбумінурії, ТКІМ та жорсткості артерій) пов’язане перш за все з позитивним впливом фіксованої комбінації периндоприл/амлодипін на рівень аортального САТ. Збережена достовірна кореляція із рівнем офісного САТ пояснюється тим, що визначення аортального САТ відбувається непрямим методом на основі калібрування кривої пульсової хвилі за даними вимірювання АТ на плечовії артерії. Проте ця кореляція частково зникала при проведенні мультирегресійного аналізу.
Кращий контроль АТ є не єдиним способом, що сприяє регресу ознак ураження органів-мішеней. Можливо, мають значення й так звані плейотропні (незалежні від зниження АТ) ефекти препаратів, про які говорилося вище. Адже в деяких дослідженнях (LIVE, MARVAL, PREMIER) було показано, що при однаковому контролі АТ деякі препарати краще, ніж препарат контролю, зменшували ураження органів-мішеней [23, 36, 61].
Результати нашого дослідження щодо змін показника Е/Е’ відрізняються від результатів піддослідження дослідження ASCOT [6]. Показано, що на двох етапах спостереження на фоні терапії і амлодипіном (+ периндоприл), і атенололом (+ тіазид) відбувалося майже однакове зменшення ІММЛШ (Р = НД). Показник Е/Е’ достовірно не змінився в групі антагоністу кальцію та спостерігалося достовірне його збільшення у групі бета-блокатора. У нашому ж дослідженні величина Е/Е’ достовірно зменшилася на фоні комбінації периндоприл/амлодипін. Можливо, це було пов’язано з дизайном дослідження. Адже ми спостерігали хворих до та через рік лікування. У вказаному піддослідженні обстеження почали робити в середньому через 1,5 року прийому терапії (фаза 1) та через 2 роки після першого обстеження (фаза 2). Тому неможливо чітко прослідкувати, чи змінився показник Е/Е’, можна тільки говорити, що протягом 3,5 року він залишався незмінним на фоні терапії амлодипіном (+ периндоприл), а на фоні терапії атенололом (+ тіазид) діастолічна функція лівого шлуночка погіршувалася.
У нашому дослідженні ми виявили зв’язок змін рівня альбумінурії та ТКІМ із ШППХе. Незалежне значення величини ШППХе для виникнення мікроальбумінурії було продемонстроване в декількох дослідженнях [19, 28, 53, 60]. При цьому ураження аорти розглядається і як ознака ураження органа-мішені при АГ (тобто йде паралельний процес змін і в судинах, і в серці, і в нирках), і як патогенетичний фактор для збільшення ступеня ураження інших органів-мішеней. Антагоністи кальцію та інгібітори АПФ позитивно впливають на жорсткість артерій незалежно від їх впливу на тиск розтягування (залежить від рівня АТ) [32, 33, 43, 59]. Ступінь впливу інгібіторів АПФ на артерії може бути частково генетично детермінованим. Так, поліморфізм гена ангіотензину ІІ типу 1 рецепторів впливає на можливість периндоприлу знижувати АТ та ШППХ [5, 54].
Величина ТКІМ, як і гомілково-плечовий індекс, є показником, що залежить і від АТ, і від активності атеросклеротичного процесу. У попередньому нашому дослідженні у хворих без ІХС ми не спостерігали достовірних змін величини даного показника на фоні призначеного лікування. Проте слід зазначити, що початково в тих хворих величина ТКІМ була значно меншою, ніж у хворих з ІХС у нашому дослідженні. Окрім того, всі пацієнти з ІХС приймали статини, причому ще до включення в дослідження, і протягом року спостереження в ефективних дозах, згідно з рекомендаціями Українського товариства кардіологів [2], на відміну від хворих без ІХС, з яких тільки 63,3 % отримували дані препарати. А статини як раз і є тими препаратами, що можуть викликати зворотний розвиток атеросклеротичного ураження і підсилювати позитивний вплив фіксованої комбінації на ТКІМ [25, 29, 41, 55].
Отже, можна стверджувати, що наше дослідження продемонструвало високу ефективність фіксованої комбінації периндоприл/амлодипін у хворих з ІХС та АГ щодо всебічного контролю АТ та забезпечення регресу таких показників ураження органів-мішеней, як гіпертрофія та діастолічна дисфункція лівого шлуночка, ШППХе, ТКІМ та мікроальбумінурія.
Обмеження дослідження
Проведене дослідження мало певні обмеження. По-перше, воно було одноцентровим та включало невелику кількість пацієнтів. Проте статистичні методи обробки результатів були валідними для даної кількості пацієнтів. По-друге, дослідження не було сліпим щодо прийому препарату. Проте участь усіх фахівців, які проводили інструментальні методи дослідження, обмежувалася тільки проведенням конкретного дослідження і вони не були прямо зацікавлені у позитивних результатах і не займалися призначенням антигіпертензивної терапії. По-третє, ми не мали групи порівняльної терапії. Можливо, що призначення іншої терапії також призводило б до регресу ураження органів-мішеней та забезпечувало якісний контроль АТ. Але ці результати є даними лише частини дослідження EPHES, метою якого було не просто оцінити ефективність фіксованої комбінації периндоприл/амлодипін, а порівняти, як відбувається регрес ураження органів-мішеней у хворих на АГ з ІХС або без неї. Для цього пацієнти мали отримувати відносно схожу антигіпертензивну терапію. Такою терапією стало застосування фіксованої комбінації периндоприл/амлодипін, що показана як хворим з АГ, так і хворим з ІХС [1]. По-четверте, протягом року пацієнти додатково лікувалися статинами, які, з одного боку, могли вплинути на показники, що характеризують пружно-еластичні властивості артерій, з іншого боку, могли підсилювати дію антигіпертензивних препаратів, у тому числі щодо зниження АТ [25, 55].
Висновки
1. Лікування за допомогою фіксованої комбінації периндоприл/амлодипін (у дозах від 5/5 до 10/10 мг/добу) пацієнтів з ІХС та АГ, що була не контрольована на фоні прийому бета-блокаторів та інших антигіпертензивних препаратів, забезпечувало досягнення цільового рівня і САТ, і ДАТ в 76,7 % випадків на етапі 6 тижнів. Додавання індапаміду 1,5 мг на добу (n = 7) забезпечило контроль офісного САТ і ДАТ у 100 % пацієнтів на етапі 6 місяців лікування.
2. Зниження офісного АТ супроводжувалося достовірним зменшенням середньодобового, денного та нічного САТ/ДАТ на 20,7 ± 0,08 мм рт.ст., 16,4 ± 0,2 мм рт.ст., 25,1 ± 0,1 мм рт.ст. та 12,6 ± 0,1 мм рт.ст., 14,1 ± 0,09 мм рт.ст., 11,5 ± 0,1 мм рт.ст. відповідно. Цільовий середньодобовий АТ (менше від 130/80 мм рт.ст.) було досягнуто у 28 (93,3 %) пацієнтів. При цьому зменшилася варіабельність денних та нічних САТ/ДАТ, середня величина ранкового підйому САТ та частка пацієнтів з величиною вранішнього підйому САТ понад 55 мм рт.ст.
3. Центральний САТ на фоні призначеного лікування, що базувалося на фіксованій комбінації периндоприл/амлодипін та бета-блокаторах, достовірно знизився з 141,8 ± 3,5 мм рт.ст. до 121,3 ± 2,7 мм рт.ст. (Р < 0,001). Паралельно відбулося достовірне (Р < 0,02) зменшення індексу приросту з 29,9 ± 3,2 % до 20,1 ± 1,8 %.
4. Ефективна щодо зниження офісного, амбулаторного та центрального АТ терапія протягом року приводила до достовірного регресу ураження органів-мішеней: зменшення гіпертрофії лівого шлуночка, рівня альбумінурії, величини ТКІМ, покращення діастолічної функції лівого шлуночка та пружно-еластичних властивостей аорти.
5. Зміни рівня альбумінурії та величини ТКІМ достовірно та незалежно від змін рівня АТ (і офісного, і центрального) корелювали із змінами ШППХе.
6. Проведена антигіпертензивна терапія добре переносилася хворими — з 31 пацієнта, яким призначили фіксовану комбінацію периндоприл/амлодипін, побічні явища зареєстровані у 3 (10 %), припинення лікування було лише в 1 (3,3 %) пацієнта. На фоні лікування спостерігалося зменшення кількості пацієнтів з такими скаргами, як головний біль, запаморочення та болі в ділянці серця з 60, 20 та 80 % до 3,3, 0 та 46,7 % відповідно. Серед пацієнтів, які мали стенокардію на початку дослідження, значно зменшилася кількість нападів стенокардії за тиждень — з 2,5 ± 0,4 до 1,2 ± 0,2 (Р < 0,01).
Спеціальна подяка та конфлікт інтересів. Проведення дослідження стало можливим завдяки освітньому гранту, наданому компанією «Серв’є Україна» (Франція). Автори цієї статі не отримували грошової винагороди при проведенні даного дослідження. Автори Г.Д. Радченко та Ю.М. Сіренко отримували грошові винагороди від компанії «Серв’є Україна» (Франція) за проведення освітніх лекцій для лікарів.
Список литературы
1. Компендіум. Лікарські засоби / Під редакцією акад. В.М. Коваленка та проф. А.П. Вікторова. — К.: Моріон, 2010. — С. Л-219.
2. Методичні рекомендації Асоціації кардіологів України. Дисліпідемії: діагностика, профілактика та лікування. — К., 2011. — 49 с.
3. Радченко Г., Муштенко Л.О., Торбас О.О. та ін. Оцінка впливу фіксованої комбінації периндоприл + амлодипін на ураження органів-мішеней у пацієнтів з артеріальною гіпертензією (первинні результати дослідження EPHES) // Артеріальна гіпертензія. — 2015. — № 4. — С. 27-41.
4. 2013 ESH/ESC Guidelines for the management of arterial hypertension The Task Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC)// Journal of Hypertension. — 2013. — Vol. 31. — P. 1281-1357.
5. Balkestein E.J., Staessen J.A., Wang J.G. et al. Carotid and femoral artery stiffness in relation to three candidate genes in a white population // Hypertension. — 2001. — Vol. 38. — P. 1190-1197.
6. Barron A., Hughes A., Sharp A. et al. Long-Term Antihypertensive Treatment Fails to Improve E/e’ Despite Regression of Left Ventricular Mass An Anglo-Scandinavian Cardiac Outcomes Trial Substudy // Hypertension. — 2014. — Vol. 63. — P. 252-258.
7. Bertrand M.E., Ferrari R., Remme W.J. et al. Clinical synergy of perindopril and calcium-channel blocker in the prevention of cardiac events and mortality in patients with coronary artery disease. Post hoc analysis of the EUROPA study // Am. Heart J. — 2010. — Vol. 159(5). — P. 795-802.
8. Bots M., Remme W., Luscher T. еt al. PERindopril — Function of the Endothelium in Coronary Artery Disease Trial: The PERFECT Study — SubStudy of EUROPA // Rationale and Design Cardiovascular Drugs and Therapy. — 2002. — Vol. 16. — P. 227-236.
9. Boutouyrie P., Bussy C., Tropeano A. et al. Local pulse pressure and regression of arterial wall hypertrophy during antihypertensive treatment. Celimene study. The celiprolol intima-media enalapril efficacy study // Archives des maladies du couer et des vaisseaux. — 2000. — Vol. 93. — P.911-915
10. Boutouyrie P., Bussy C., Lacolley P. et al. Assosiation between local pulse pressure, mean blood pressure and large-artery remodeling // Circulation. — 1999. — Vol. 100. — P. 1387-1393.
11. Ceconi C., Fox K.M., Remme W.J. et al. ACE inhibition with perindopril and biomarkers of atherosclerosis and thrombosis: results from the PERTINENT study // Atherosclerosis. — 2009. — Vol. 204. — P. 273-275.
12. Ceconi C., Fox K.M., Remme W.J. et al. ACE inhibition with perindopril and endothelial function. Results of a substudy of the EUROPA study: PERTINENT // Cardiovasc. Res. — 2007. — Vol. 73(1). — P. 237-246.
13. Covic A., Goldsmith D., Panaghiu L. et al. Analysis of the effect of hemodialysis on peripheral and central arterial pressure waveforms // Kidney Int. — 2000. — Vol. 57. — P. 2634-2643.
14. Dahlof B., Devereux R., Kjeldsen S. еt al. for the LIFE Study Group. Cardiovascular morbidity and mortality in losartan interventional for endpoint reduction in hypertension study (LIFE): a randomized trial against atenolol // Lancet. — 2002. — Vol. 359. — P. 995-1003.
15. Dahlöf B., Sever P.S., Poulter N.R. et al. Prevention of cardiovascular events with an antihypertensive regimen of amlodipine adding perindopril as required versus atenolol adding bendroflumethiazide as required, in the Anglo-Scandinavian Cardiac Outcomes Trial-Blood Pressure Lowering Arm (ASCOT-BPLA): a multicentre randomised controlled trial // Lancet. — 2005. — Vol. 366(9489). — P. 895-906.
16. De Loach S.S., Townsend R.R. Vascular stiffness: its measurement and significance for epidemiologic and outcome studies // Clin. J. Am. Soc. Nephrol. — 2008. — Vol. 3(1). — P. 184-192.
17. de Luca N., Asmar R., London G. et al. Selective reduction of cardiac mass and central blood pressure on low-dose combination perindopril/indapamide in hypertensive subjects // J. Hypertens. — 2004. — Vol. 22. — P. 1623-1630.
18. Devereux R., Wachtell K., Gerdts E. et al. Prognostic significance of left ventricular mass change during treatment of hypertension // JAMA. — 2004. — Vol. 292(19). — P. 2350-2356
19. Dong I Shin, Ki-Bae Seung, Hye Eun Yoon, Byung-Hee Hwang et al. Microalbuminuria is Independently Associated with Arterial Stiffness and Vascular Inflammation but not with Carotid Intima-Media Thickness in Patients with Newly Diagnosed Type 2 Diabetes or Essential Hypertension // J. Korean Med. Sci. — 2013. — Vol. 28. — P. 252-260
20. Epstein M., Tobe S. What is the optimal strategy to intensify blood pressure control and prevent progression of renal disease? // Current Hypertension Reports. — 2001. — Vol. 3. — P. 422-428.
21. Ettehad D., Emdin C.A., Kiran A. et al. Blood pressure lowering for prevention of cardiovascular disease and death: A systematic review and meta-analysis // Lancet. — 2015; DOI:10.1016/S0140-6736(15)01225-8.
22. Foppa M., Duncan B., Rohde L. Echocardiography-based left ventricular mass estimation. How should we define hypertrophy? // Cardiovasc. Ultrasound. — 2005. — Vol. 3. — P.17.
23. Gosse Ph., Sheridan D., Zannad F. et al. on behalf of the LIVE investigators. Regression of left ventricular hypertrophy in hypertensive patients treated with indapamide SR 1.5 mg versus enalapril 20 mg: the LIVE study // Journal of Hypertension. — 2000. — Vol. 18. — P. 1465-1475.
24. Ibsen H., Olsen M.H., Wachtell K. et al. Reduction in albuminuria translates to reduction in cardiovascular events in hypertensive patients: losartan intervention for endpoint reduction in hypertension study // Hypertension. — 2005. — Vol. 45(2). — P. 198-202
25. Kamberi L.S., Bakalli A.B., Budima N.M. et al. Pleiotropic and Lipid-lowering Effects of Statins in Hypertension // Mater. Sociomed. — 2012. — Vol. 24 (2). — Р. 84-86.
26. Kario K., Pickering T., Umeda Y. et al. Morning surge in blood pressure as a predictor of silent and clinical cerebrovascular disease in elderly hypertensives: a prospective study // Circulation. — 2003. — Vol. 18. — Vol. 107(10). — P. 1401-1416.
27. Klag M.J., Whelton P.K., Randall B.L. et al. Blood pressure and end-stage renal disease in men // N. Engl. J. Med. — 1996. — Vol. 334. — P. 13-18.
28. Kim B.J., Lee H.A., Kim N.H. et al. The association of albuminuria, arterial stiffness, and blood pressure status in nondiabetic, nonhypertensive individuals // J. Hypertens. — 2011. — Vol. 29(11). — P. 2091-2098.
29. La Rosa J.C., Grundy S.M., Waters D.D. et al. Intensive lipid lowering with atorvastatin in patients with stable coronary disease // N. Engl. J. Med. — 2005. — Vol. 352(14). — P. 1425-1435.
30. Laurent S., Boutouyrie P., Asmar R. et al. Aortic stiffness is an independent predictor of all-cause and cardiovascular mortality in hypertensive patients // Hypertension. — 2001. — Vol. 37. — P. 1236-1241.
31. Levey A., Stevens L., Schmid C. et al. CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration). A new equation to estimate glomerular filtration rate // Ann. Intern. Med. — 2009. — Vol. 150 (9). — P. 604-612.
32. London G.M., Pannier B., Guerin A.P. et al. Cardiac hypertrophy, aortic compliance, peripheral resistance, and wave reflection in end-stage renal disease: comparative effects of ACE inhibition and calcium channel blockade // Circulation. — 1994. — Vol. 90. — P. 2786-2796.
33. Mahmud A., Feely J. Reduction in arterial stiffness with angiotensin II antagonist is comparable with and additive to ACE inhibition // Am. J. Hypertens. — 2002. — Vol. 15. — P. 321-325.
34. Mancia G., Carugo S., Grassi G. et al. Prevalence of Left Ventricular Hypertrophy in Hypertensive Patients Without and With Blood Pressure Control Data From the PAMELA Population // Hypertension. — 2002. — Vol. 39. — P. 744-749.
35. McEniery C., Yasmin, McDonnell B. et al. on behalf of the ACCT Investigators. Central pressure: variability and impact of cardiovascular risk factors. The anglo-cardiff collaborative trial II // Hypertension. — 2008. — Vol. 51. — P. 1476-1482.
36. Mogensen C.E., Viberti G., Halimi S. et al. Effect of low-dose perindopril/indapamide on albuminuria in diabetes: preterax in albuminuria regression: PREMIER // Hypertension. — 2003. — Vol. 41(5). — P. 1063-1071.
37. Мorgan T., Lauri J., Bertram D., Anderson A. Effect of different antihypertensive drug classes on central aortic pressure // Am. J. Hypertens. — 2004. — Vol. 17. — 118.
38. Moser M., Herbert P. Prevention of disease progression, left ventricular hypertrophy and congestive heart failure in hypertension treatment trials // J. Am. Coll. Cardiol. — 1996. — Vol. 27. — P. 1214-1218.
39. Nair S., Malik R., Khattar R. Carotid intima-media thickness: ultrasound measurement, prognostic value and role in clinical practice // Postgrad. Med. J. — 2012. — Vol. 88 (1046). — P. 694-699.
40. Nissen S.E., Tuzcu E.M., Libby P. et al. Effect of antihypertensive agents on cardiovascular events in patients with coronary disease and normal blood pressure: the CAMELOT study: a randomized controlled trial // JAMA. — 2004. — Vol. 292. — P. 2217-2225.
41. Nissen S.E., Tuzcu E.M., Schoenhagen P. et al. Effect of intensive compared with moderate lipid-lowering therapy on progression of coronary atherosclerosis: a randomized controlled trial // JAMA. — 2004. — Vol. 291(9). — P. 1071-1080.
42. Palmieri V. Reliability of echocardiographic assessment of left ventricular structure and function: the PRESERVE study. Prospective Randomised Study Evaluating Regression of Ventricular enlargement // J. Am. Coll. Cardiol. — 1999. — Vol. 34. — P. 1625-1632.
43. Pannier B.M., Guerin A.P., Marchais S.J., London G.M. Different aortic reflection wave responses following long-term angiotensin-converting enzyme inhibition and beta-blocker in essential hypertension // Clin. Exp. Pharmacol. Physiol. — 2001. — Vol. 28. — P. 1074-1077
44. Patel A.; ADVANCE Collaborative Group et al. Effects of a fixed combination of perindopril and indapamide on macrovascular and microvascular outcomes in patients with type 2 diabetes mellitus (the ADVANCE trial): a randomised controlled trial // Lancet. — 2007. — Vol. 370. — P. 829-840.
45. Pitt B., Byington R., Furberg C. et al. Effect of Amlodipine on the Progression of Atherosclerosis and the Occurrence of Clinical Events // Circulation. — 2000. — Vol. 102. — P. 1503-1510.
46. Poulter N.R. A new dimension in hypertension management with the amlodipine/perindopril combination // J. Hypertens. — 2011. — Vol. 29, Suppl. 1. — S. 15-21.
47. Prospective Study Collaboration. Body-mass index and cause-specific mortality in 900 000 adults: collaborative analyses of 57 prospective studies // Lancet. — 2009. — Vol. 373. — P. 1083-1096.
48. Protogerou A., Blacher J., Stergiou G. et al. Blood Pressure Response Under Chronic Antihypertensive Drug Therapy The Role of Aortic Stiffness in the REASON (Preterax in Regression of Arterial Stiffness in a Controlled Double-Blind) Study // Journal of the American College of Cardiology. — 2009. — Vol. 53. — P. 445-451.
49. Ritz E., Menne J., Haller H. Prevalence of microalbuminuria in type 2 diabetes: lessons learned from the ROADMAP study // Nephrol. Dial. Transplant. — 2012. — Vol. 27, Suppl. 4. — P. 28-30.
50. Roman M., Devereux R., Kizer J. et al. High Central Pulse Pressure Is Independently Associated With Adverse Cardiovascular Outcome The Strong Heart Study // J. Am. Coll. Cardiol. — 2009. — Vol. 54. — P. 1730-173.
51. Roman M., Okin P., Kizer J. et al. Relation of central and brachial blood pressure to left ventricular hypertrophy and geometry: the strong heart study // J. Hypertens. — 2010. — Vol. 28. — P. 384-388.
52. Rothwell P., Howard S.C., Dolan E. Et al. ASCOT-BPLA and MRC Trial Investigators Prognostic significance of visit-to-visit variability, maximum systolic blood pressure, and episodic hypertension // Lancet. — 2010. — Vol. 375. — P. 895-905.
53. Ryotaro Bouchi, Tetsuya Babazono, Michino Mugishima et al. Arterial Stiffness Is Associated With Incident Albuminuria and Decreased Glomerular Filtration Rate in Type 2 Diabetic Patients // Diabetes Care. — 2011. — Vol. 34. — P. 2570-2575.
54. Safar M. Macro- and Microcirculation in Hypertension. — London: Lippincott Williams & Wilkins, 2005. — 151 p.
55. Sever P., Dahlöf B., Poulter N. et al. Potential synergy between lipid-lowering and blood-pressure-lowering in the Anglo-Scandinavian Cardiac Outcomes Trial // Eur. Heart J. — 2006. — Vol. 27. — P. 2982-2988.
56. Smulyan H., Lieber A., Safar M.E. Hypertension, Diabetes Type II, and Their Association: Role of Arterial Stiffness // Am. J. Hypertens. — 2015. — Jul 8. pii: hpv107. [Epub ahead of print]
57. Stein J., Korcarz C., Hurst R. et al. American Society of Echocardiography Carotid Intima-Media Thickness Task Force. Use of carotid ultrasound to identify subclinical vascular disease and evaluate cardiovascular disease risk: a consensus statement from the American Society of Echocardiography carotid intima-media thickness task force endorsed by the society of vascular medicine // J. Am. Society Echoc. — 2008. — Vol. 21 (2). — P. 93-111.
58. The CAFE Investigators, for the Anglo-Scandinavian Cardiac Outcomes Trial (ASCOT) Investigators CAFE Steering Committee and Writing Committee. Differential Impact of Blood Pressure-Lowering Drugs on Central Aortic Pressure and Clinical Outcomes Principal Results of the Conduit Artery Function Evaluation (CAFE) Study // Circulation. — 2006. — Vol. 113. — P. 1213-1225
59. Tomiyama H., Kimura Y., Sakuma Y. et al. Effects of an ACE inhibitor and a calcium channel blocker on cardiovascular autonomic nervous system and carotid distensibility in patients with mild to moderate hypertension // Am. J. Hypertens. — 1998. — Vol. 11. — P. 682-689.
60. van den Meiracker Anton H., Mattace-Raso Francesco U.S. Large artery stiffness and microalbuminuria: a causal relationship? // Journal of Hypertension. — 2009 — Vol. 27 — P. 1355-1357.
61. Viberti G., Wheeldon N.M. MicroAlbuminuria Reduction with VALsartan (MARVAL) Study Investigators. Microalbuminuria reduction with valsartan in patients with type 2 diabetes mellitus: a blood pressure-independent effect // Circulation. — 2002. — Vol. 106(6). — P. 672-678.
62. Wang K., Cheng H., Chuang S. еt al. Central or peripheral systоlic or pulse pressure: which best related to target organs and future mortality? // J. Hypertens. — 2009. — Vol. 27. — P. 461-467.
63. White W. Blood pressure monitoring in Cardiovascular Medicine and Therapeutics. — N. Jersy: Humana Press, 2001. — P. 308.
64. Wohlfahrt P., Wichterle D., Seidlerova J. et al. Relation of central and brachial blood pressure to left ventricular hypertrophy: the czech post-monica study // J. Human Hypertens. — 2012. — Vol. 26. — P. 14-19.
65. Yusuf S., Hawken S., Ounpuu S., Dans T., Avezum A., Lanas F. et al., INTERHEART Study Investigators. Effect of potentiallymodifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study // Lancet. — 2004. — Vol. 364. — P. 937-952
/82.jpg)
/86.jpg)

/79.jpg)
/81_2.jpg)
/83.jpg)
/84.jpg)
/85.jpg)