Статья опубликована на с. 43-48
Анализ заболеваемости цереброваскулярной патологией в Украине свидетельствует об увеличении частоты инсультов, которые занимают одно из первых мест в Европе и встречаются в украинской популяции втрое чаще, чем инфаркт миокарда. При этом прослеживается негативная тенденция: в 1991 году было зарегистрировано 233 случая инсульта на 100 тысяч населения, а в 2005 году этот показатель составил около 250. Таким образом, ишемический инсульт — высокоинвалидизирующее заболевание. После него только 20 % больных возвращаются к прежнему уровню социально-бытовой и трудовой активности, около 80 % требуют постоянной медико-социальной поддержки, а 25–30 % остаются глубокими инвалидами [1]. Высокий процент инвалидизации среди лиц, перенесших ишемический инсульт, определил актуальность проблемы нейрореабилитации этой категории больных. В настоящее время для восстановления нарушенных функций у лиц, перенесших ишемический инсульт, наряду с физическими и физиотерапевтическими методами реабилитации используются препараты, характеризующиеся мультимодальным действием.
Значительное место в терапии больных в восстановительном периоде ишемического инсульта занимают препараты с комплексным метаболическим и вазоактивным действием. Поскольку ранний восстановительный период ишемического инсульта характеризуется активацией репаративных процессов в мозге, одним из ведущих направлений при лечении является применение ноотропных препаратов, улучшающих мозговой кровоток и метаболизм. Эти средства оказывают нейропротективный эффект, прямое активирующее влияние на структуры головного мозга, улучшают память и когнитивные функции, а также повышают устойчивость центральной нервной системы к повреждающим воздействиям [2–4].
В настоящее время признано клинически обоснованным применение в постинсультной реабилитационной терапии нейротрофических препаратов, особенность которых состоит в гармонизации эндогенных нейробиологических процессов защиты и восстановления, функционально объединенных фундаментальным понятием «эндогенная защитная активность» (ЭЗА). Церебролизин — нейротрофический препарат с мультимодальным действием. Его терапевтический эффект обусловлен содержанием в его составе низкомолекулярных нейропептидов, по свойствам подобных естественным нейротрофическим факторам, являющимся ключевым функциональным компонентом системы ЭЗА. Церебролизин способен модулировать нейротрофический и Shh-сигнальные пути, усиливать естественные процессы нейронального ремоделинга (нейрогенез, нейропластичность), управляемые ЭЗА посредством изменения экспрессии генов [5]. Результаты нескольких мультицентровых двойных слепых контролированных рандомизированных клинических исследований доказывают позитивное влияние Церебролизина на функциональное восстановление пациентов после острого ишемического инсульта. Особый интерес вызывает новое мультицентровое контролированное рандомизированное исследование CARS, результаты которого были опубликованы в начале 2016 года в журнале «Stroke» [6]. Результаты показали, что комбинация Церебролизина с ранней реабилитационной терапией с высокой достоверностью на 88 % улучшает восстановление моторики верхней конечности (оценка по ARAT на 90-й день). Кроме того, численность пациентов, восстановившихся до полной функциональной независимости (оценка по mRS на 90-й день), в группе Церебролизина в три раза выше, чем в группе плацебо. Также имеются убедительные доказательства положительного эффекта препарата на клинические исходы тромболитической терапии при инсульте: лечение Церебролизином, начатое сразу после внутривенного тромболизиса rt-PA, обусловливает более быстрое нивелирование неврологического дефицита [7].
Целью нашего исследования стала оценка эффективности лечения группы больных в раннем восстановительном периоде после каротидного ишемического инсульта препаратом Церебролизин в сочетании с базисной терапией в сравнении с группой больных, получавших базисную терапию, путем сопоставления клинических и электрофизиологических (электромиография — ЭМГ и вызванные потенциалы — ВП) показателей.
Материалы и методы
Первую группу составили 19 больных — 11 мужчин и 8 женщин в возрасте от 39 до 63 лет (средний возраст 48,4 ± 3,7 года), которые получали 10-дневный курс базисной терапии. Вторая группа из 15 больных, 8 мужчин и 7 женщин, сопоставимых по возрасту, получали 10-дневный курс базисной терапии в сочетании с препаратом Церебролизин 10 мл внутривенно 1 раз в день. Все больные были обследованы в раннем восстановительном периоде каротидного ишемического инсульта согласно украинскому протоколу и специальным методам обследования: регистрации когнитивных вызванных потенциалов, связанных с событием (ВПСС), и реакции поверхностной электромиографии. Исследование проводилось в неврологическом отделении областной клинической больницы города Харькова в день поступления в стационар и на 11-й день, после 10-дневного курса лечения.
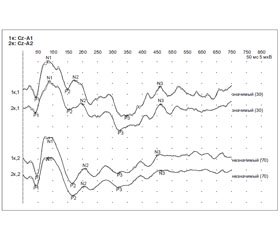
Анализ табл. 1 показал, что в обеих группах преобладали больные с локализацией ишемического очага в левом каротидном бассейне. При проведении нейровизуализации с помощью магнитно-резонансной томографии головного мозга очаги ишемии корково-подкорковой локализации также были выявлены у пациентов обеих групп. В настоящее время несомненным фактом является наличие когнитивных расстройств у лиц, перенесших ишемический инсульт. Инструментальным подтверждением когнитивных нарушений является определение параметров когнитивного вызванного потенциала Р300.
Считается, что вызванные потенциалы головного мозга являются индикаторами электрических процессов работы мозга, связанных с механизмами восприятия информации и ее обработки. Регистрация вызванных потенциалов, связанных с событием, по методике Р300 проводилась по 2-канальной схеме, в соответствии с рекомендациями [14], на электронейромиографе с функцией усреднения «НейроВМП‑4 (LPT)» фирмы «Нейрософт», Россия.
В ходе исследования был проведен анализ пиков N2, Р3, N3. Основными параметрами для анализа являлись латентность и амплитуда компонента Р3, измеренная как межпиковая амплитуда N2/P3, которые зарегистрированы одновременно над пораженным и над интактным полушарием [13, 17]. Регистрация вызванных потенциалов Р300 проводилась в день поступления и на 11-й день, после 10-дневного курса лечения.
Регистрация поверхностной ЭМГ проводилась с использованием электронейромиографа «Нейро–ВМП‑4(LPT)» фирмы «Нейрософт», Россия. Применяли двухканальную систему отведения по типу мышца-мышца. Электроды устанавливали над брюшком мышцы на расстоянии 2 см от мышц-антагонистов 1-й зоны (Kimura, Николаев).
Для объективизации пирамидного синдрома, помимо балльной оценки мышечной силы в сегментах пораженной верхней и нижней конечности, нами был использован метод поверхностной ЭМГ. Производилась поочередная регистрация интерференционных кривых максимальной произвольной активации мышц-антагонистов плеча и голени на стороне пареза, с последующим вычислением коэффициентов адекватности и реципрокности. Эти коэффициенты возрастают при пирамидном синдроме [13].
Регистрация ЭМГ проводилась в день поступления и на 11-й день, после 10-дневного курса лечения.
Оценка адекватности активации мышц позволяет характеризовать мышцу при различных формах ее активации — при произвольной и непроизвольной. Изучение координационных отношений мышц позволяет оценить взаимоотношения между произвольно активируемыми и находящимися в относительном покое мышцами. Координационные отношения мышц выражают в показателях коэффициента адекватности и реципрокности. В норме коэффициенты адекватности и реципрокности не превышают 15 %, в то время как при сформировавшемся синдроме спастического пареза они могут быть значительно повышены [12, 13].
В восстановительном периоде ишемического инсульта немаловажную роль отводят снижению системной воспалительной реакции и в зоне ишемического повреждения. В этой связи важную защитную роль отводят цитокинам [20], ряд которых отражает повреждение, а другие — восстановление.
К группе цитокинов относятся интерлейкины, факторы некроза опухоли (ФНО), хемокины и другие макромолекулы [21]. Определение их концентрации в крови дает информацию о функциональной активности различных типов иммунокомпетентных клеток, о тяжести воспалительного процесса, его переходе на системный уровень, об эффективности лечебных и профилактических мероприятий и о прогнозе заболевания [16, 18].
В нашей работе мы определяли фактор некроза опухоли (ФНО-α) и интерлейкин‑4 (IL‑4) сыворотки крови. У больных, перенесших каротидный ишемический инсульт в раннем восстановительном периоде, в день поступления и на 11-й день лечения из локтевой вены натощак брали 2 мл крови.
Концентрация цитокинов ФНО-α и интерлейкин‑4 определялась с использованием наборов реагентов для количественного определения фактора некроза опухоли альфа и интерлейкина‑4 фирмы «Вектор-Бест», Россия, по рекомендованной производителем методике.
Статистическая обработка результатов исследования проведена с помощью статистического пакета MS Exсel 2007. Определялись средние значения, стандартное отклонение, скос, эксцесс и ошибка среднего, достоверность результатов оценивалась с помощью критерия Стьюдента.
Результаты исследований
Для удобства интерпретации полученных данных основные клинико-инструментальные показатели были сведены в табл. 2.
Обсуждение результатов исследований
К моменту завершения исследования терапевтический эффект разной степени выраженности в раннем восстановительном периоде наблюдали у всех пациентов, перенесших ишемический каротидный инсульт. Клиническая эффективность отмечалась у пациентов обеих групп за счет повышения уровня функционального состояния больных (по данным шкалы Бартел, уменьшения неврологических полушарных и вертебробазилярных синдромов, улучшения когнитивных вызванных потенциалов и ЭМГ). Отмечалось также снижение коэффициентов адекватности и реципрокности у больных обеих групп. Этому способствовала комплексная лечебная и физическая реабилитация, включающая дополнительно миорелаксанты, физиопроцедуры на паретичные конечности и ЛФК.
/46.jpg)
Недостаточное влияние на динамику парезов у пациентов обеих групп, вероятно, можно объяснить небольшой длительностью проведенного курсового лечения. Тем не менее у больных первой группы (получавших Церебролизин) по сравнению со второй группой значимо улучшились показатели по шкале Бартел, ускорились когнитивные процессы, в большей степени нормализовались ЭМГ-коэффициенты. Кроме того, выявлено небольшое, но достоверно более выраженное уменьшение степени пареза в правом предплечье и левой голени (табл. 2). Для наглядности полученных данных концентрацию цитокинов у больных обеих групп мы представили в табл. 3.
/46_2.jpg)
Как видно из табл. 3, концентрация провоспалительного цитокина ФНО-α перед курсом лечения была в равной степени повышена (в 3,25 раза у больных 1-й группы и в 2,98 раза у больных 2-й группы, при верхних границах, рекомендованных производителем, до 6 пг/л). После курса лечения концентрация провоспалительного цитокина ФНО-α в первой группе снизилась в 1,86 раза, а во второй группе — в 1,45 раза. Концентрация провоспалительного цитокина IL‑4 была сравнима в обеих группах (в 1-й группе уровень цитокинов IL‑4 был в 1,87 раза ниже нормы, а во 2-й группе — в 1,61 раза ниже нормы), в то время как после курса лечения в первой группе она повысилась, однако все еще была в 1,29 раза ниже нормы, а во второй — превысила норму в 1,35 раза (при верхних границах, рекомендованных производителем, до 20 пг/л). Таким образом, у больных из группы Церебролизина и у больных 2-й группы отмечаются признаки снижения концентрации в сыворотке крови провоспалительных цитокинов с одновременным повышением концентрации противовоспалительных цитокинов в динамике лечения.
/47.jpg)
Значимых побочных эффектов и ухудшения общесоматического состояния у исследованных больных не зарегистрировано. У 2 пациентов на 7–8-й день приема Церебролизина были жалобы на плохой сон, трудности при засыпании. Эти жалобы не требовали дополнительного лечения или отмены препарата.
Выводы
1. У больных, перенесших каротидный ишемический инсульт, базисная терапия в комбинации с Церебролизином оказывает положительное влияние на показатели клинической и ЭМГ-картины, параметры когнитивных процессов по методике Р300. Выявлено повышение мобильности и способности к самообслуживанию, бытовой активности (оценка по индексу Бартел).
2. У больных, принимавших Церебролизин, отмечена большая тенденция к снижению уровня провоспалительных цитокинов в крови с одновременным повышением уровня противовоспалительных цитокинов, который, однако, был выше у больных 2-й группы.
3. Церебролизин в дозе 10 мл в/в кап. может быть рекомендован в комплексе лечебно-реабилитационных мероприятий в раннем восстановительном периоде каротидного ишемического инсульта.
Список литературы
1. Мищенко Т.С. Эпидемиология мозговых инсультов в Украине.
2. Мищенко Т.С., Шестопалова Л.Ф., Трищинська М.А. Клінічні шкали і психодіагностичні тести у діагностиці судинних захворювань головного мозку: Метод. рекомендації. — Харків, 2008. — 36 с.
3. Гехт А.Б. Лечение больных инсультом в восстановительном периоде // Consilium medicum. — 2000. — Т. 2, № 12.
4. Гусев Е.И., Скворцова В.И. Нейропротективная терапия ишемического инсульта // Атмосфера. — 2002. — № 1. — С. 3-7.
5. Мурешану Д. и др. «Путеводитель» по нейропротекции и нейрорегенерации // Международный неврологический журнал. — 2013. — № 5 (59) — С. 24-36.
6. Мурешану Д., Хейсс В.-Д., Хомберг Ф. и др. Церебролизин и восстановление после инсульта (исследование CARS) // Международный неврологический журнал. — 2016. — № 2 (80) — С. 22-37.
7. Ланг В. и др. Эффективность комбинированной терапии rt-PA и Церебролизином у пациентов с острым ишемическим инсультом. // Междунар. неврологич. журнал — 2013. — № 1 (55) — С. 111-116.
8. Гусев Е.И., Гехт А.Б., Белоусов Ю.Б. и др. Клинические и фармакоэкономические особенности применения Церебролизина в восстановительном лечении ишемического инсульта // Журнал неврологии и психиатрии им. С.С. Корсакова. — 2007. — № 10. — С. 26-33.
9. Боголепова А.Н. Когнитивные вызванные потенциалы P300 у больных в раннем восстановительном периоде ишемического инсульта: Нейродиагностика / Боголепова А.Н. // Журнал неврологии и психиатрии: спец. вып. — 2003. — С. 19-23.
10. Боголепова А.Н. Когнитивные вызванные потенциалы у больных, перенесших ишемический инсульт / А.Н. Боголепова // Журнал неврологии и психиатрии им. С.С. Корсакова. — 2003. — № 9. — С. 144.
11. Захаров В.В., Яхно Н.Н. Нарушения памяти. — М.: ГеотарМед, 2003. — 150 с.
12. Виленский Б.С. Лечение ишемического инсульта Церебролизином и актовегином. — СПб., 1998.
13. Команцев В.Н. Методические основы клинической электронейромиографии: Руководство для врачей. — СПб., 2006. — 355 с.
14. Гнездицкий В.В. Вызванные потенциалы мозга в клинической практике. — М.: МЕД пресс-информ, 2003. — 264 с.
15. Näätänen R., Pakarinen S., Rinne T., Takegata R. The mismatch negativity (MMN): towards the optimal paradigm // Finland. Clin. Neurophysiol. — 2004. — 140-4.
16. Hillyard S.A., Hink R.F., Schwent V.L., Picton T.W. Electrical signs of selective attention in the human brain // Science. — 1973. — 182 (4108). — 177-180.
17. Зенков Л.Р., Ронкин М.А. Функциональная диагностика нервных болезней. — М.: МЕДпресс, 2004. — 488 с.
18. Коппи С. Применение Церебролизина в терапии ишемического инсульта / Коппи С., Баролин Г.С. // Журн. неврологии и психиатрии им. С.С. Корсакова. — 1998. — № 10. — С. 30-33.
19. Zierath D., Thullbery М., Hadwin J. CNS Immune Responses Following Experimental Stroke // Neurocritical. Care. — 2011. — Vol. 14. — P. 274-284.
20. Esmon С.Т. Does inflammation contribute to thrombotic events? // Haemostasis. — 2000. — Vol. 30, Suppl. 2. — P. 34-40.
21. Хаитов P.M. Иммунология. — М.: Медицина, 2000. — 432 с.
/46.jpg)

/44.jpg)
/45.jpg)
/46_2.jpg)
/47.jpg)