Резюме
Метою дослідження є оцінка антигіпертензивної ефективності телмісартану та його впливу на активність системного запалення і показники вуглеводного та ліпідного метаболізму у хворих на гіпертонічну хворобу (ГХ). Матеріали та методи. Обстежено 29 пацієнтів із ГХ І–ІІ стадії, 1–2-го ступеня, яким після 7-денного безмедикаментозного періоду та через 6 місяців терапії телмісартаном проводили комплексне клінічне дослідження, амбулаторне моніторування артеріального тиску (АТ), визначення вмісту С-реактивного протеїну (СРП), интерлейкіну-6 (ІЛ-6) і фактора некрозу пухлини α (ФНП-α), показників вуглеводного (глюкоза, інсулін, НОМА, глікований гемоглобін (HbA1с)) та ліпідного метаболізму. Результати. Монотерапія телмісартаном дозволила досягти цільового АТ у 75,6 % пацієнтів; через 6 місяців лікування зниження систолічного АТ становило 20 мм рт.ст., діастолічного АТ — 13 мм рт.ст. Препарат сприяв відновленню нормального двофазного ритму АТ у пацієнтів з вихідними його порушеннями та зменшував варіабельність систолічного АТ в нічні години. Обговорення. Під впливом телмісартану відбулось поліпшення показників вуглеводного обміну, що проявлялось достовірним зменшенням базальної інсулінемії на 21,5 %, зниженням рівня глюкози з 5,5 ± 0,2 ммоль/л до 5,3 ±
± 0,1 ммоль/л (р = 0,04) і HbA1c з 5,6 ± 0,1 % до 5,4 ± 0,1 % (р = 0,04). На фоні прийому телмісартану зменшився вміст у крові тригліцеридів на 17 % (р = 0,03), спостерігалась тенденція до зниження рівня загального холестерину та холестерину ліпопротеїдів низької щільності. Встановлено, що лікування телмісартаном сприяє зниженню сироваткового рівня СРП на 13,9 % (р = 0,04) та ІЛ-6 на 36,4 % (р = 0,02), проте не впливає на вміст ФНП-α в крові хворих на ГХ. Висновки. Отримані дані свідчать про високу антигіпертензивну ефективність і сприятливі метаболічні ефекти телмісартану, а також його здатність пригнічувати активність запалення низької градації. В статті також обґрунтовано поєднане використання телмісартану та фіксованої комбінації «S-амлодипін/аторвастатин» з точки зору поліпшення прогнозу хворих на ГХ за рахунок синергізму антигіпертензивного та ліпідознижуючого потенціалу і плейотропних ефектів цих препаратів, дія яких направлена на сповільнення прогресування ГХ і атеросклерозу.
Целью исследования является оценка антигипертензивной эффективности телмисартана и его влияния на активность системного воспаления, показатели углеводного и липидного метаболизма у больных гипертонической болезнью (ГБ). Материалы и методы. Обследованы 29 пациентов с ГБ I–II стадии, 1–2-й степени, которым после 7-дневного безмедикаментозного периода и через 6 месяцев терапии телмисартаном проводили комплексное клиническое исследование, амбулаторное мониторирование артериального давления (АД), определение содержания С-реактивного протеина (СРП), интерлейкина-6 (ИЛ-6) и фактора некроза опухоли α (ФНО-α), показателей углеводного (глюкоза, инсулин, НОМА, гликозилированный гемоглобин (HbA1с)) и липидного метаболизма. Результаты. Монотерапия телмисартаном позволила достичь целевого АД у 75,6 % пациентов; через 6 месяцев лечения снижение систолического АД составило 20 мм рт.ст., диастолического АД — 13 мм рт.ст. Препарат способствовал восстановлению нормального двухфазного ритма АД у пациентов с исходными его нарушениями и уменьшал вариабельность систолического АД в ночные часы. Обсуждение. Под влиянием телмисартана произошло улучшение показателей углеводного обмена, что проявлялось достоверным уменьшением базальной инсулинемии на 21,5 %, снижением уровня глюкозы с 5,5 ± 0,2 ммоль/л до 5,3 ± 0,1 ммоль/л (р = 0,04) и HbA1с с 5,6 ± 0,1 % до 5,4 ± 0,1 % (р = 0,04). На фоне приема телмисартана уменьшилось содержание в крови триглицеридов на 17 % (р = 0,03), наблюдалась тенденция к снижению уровня общего холестерина и холестерина липопротеидов низкой плотности. Установлено, что лечение телмисартаном способствует снижению сывороточного уровня СРП на 13,9 % (р = 0,04) и ИЛ-6 на 36,4 % (р = 0,02), однако не влияет на содержание ФНО-α в крови больных ГБ. Выводы. Полученные данные свидетельствуют о высокой антигипертензивной эффективности и благоприятных метаболических эффектах телмисартана, а также его способности подавлять активность воспаления низкой градации. В статье также обосновано сочетанное использование телмисартана и фиксированной комбинации «S-амлодипин/аторвастатин» с точки зрения улучшения прогноза больных ГБ за счет синергизма антигипертензивного и липидоснижающего потенциала и плейотропних эффектов этих препаратов, действие которых направлено на замедление прогрессирования ГБ и атеросклероза.
The objective of the study is to assess antihypertensive efficacy of telmisartan and its impact on the activity of systemic inflammation and carbohydrate and lipid metabolism in patients with essential hypertension (EH). Materials and methods. The study involved 29 patients with EH stage I–II, degree 1–2, who after a 7-day non-drug period and after 6 months of telmisartan therapy underwent a comprehensive clinical examination, ambulatory blood pressure (BP) monitoring, determination of
C-reactive protein (CRP), interleukin-6 (IL-6) and tumor necrosis factor α (TNF-α), parameters of carbohydrate (glucose, insulin, HOMA, glycated hemoglobin (HbA1C)) and lipid metabolism. Results. Monotherapy with telmisartan made it possible to achieve target BP in 75.6 % of patients; after 6 months of treatment, a decrease in systolic BP was 20 mmHg, in diastolic BP — 13 mmHg. The drug helped to restore the normal two-phase rhythm of BP in patients with its initial disturbances and to reduce variability in systolic BP at night. Discussion. Under the influence of telmisartan, there was an improvement in carbohydrate metabolism manifested by a significant decrease of basal insulinemia by 21.5 %, reduction in glucose levels from 5.5 ± 0.2 mmol/l to 5.3 ± 0.1 mmol/l (p = 0.04) and HbA1c from 5.6 ± 0.1 % to 5.4 ± 0.1 % (p = 0.04). Against the background of telmisartan use, the blood levels of triglycerides have decreased by 17 % (p = 0.03), there was a tendency to lower levels of total cholesterol and low-density lipoprotein cholesterol. It was found that telmisartan treatment reduces serum CRP level by 13.9 % (p = 0.04) and IL-6 by 36.4 % (p = 0.02), but does not affect the content of TNF-α in the blood of patients with EH. Conclusions. The findings indicate a high antihypertensive efficacy and favorable metabolic effects of telmisartan, as well as its ability to inhibit the activity of low-grade inflammation. The article also supports a combined use of telmisartan and a fixed combination S-amlodipine/atorvastatin in terms of improving the prognosis of patients with EH due to the synergy of antihypertensive and lipid-lowering potential and pleiotropic effects of these drugs, whose action is aimed at slowing the progression of EH and atherosclerosis.
Статтю опубліковано на с. 11-17
Досягнення та утримання цільового рівня артеріального тиску (АТ) є першочерговим заходом для запобігання серцево-судинним катастрофам. Проте максимальний захист від розвитку ускладнень неможливий без впливу на інші фактори серцево-судинного ризику, а саме дисліпідемію, паління, ожиріння, цукровий діабет. Саме тому підходи до лікування хворих на артеріальну гіпертензію (АГ) визначаються на підставі стратифікації ризику серцево-судинних захворювань і полягають у багатофакторній профілактиці серцево-судинних ускладнень. Неодмінним компонентом терапії пацієнтів з АГ високого ризику є статинотерапія, ефективність якої в первинній профілактиці серцево-судинних катастроф доведена в ряді масштабних клінічних досліджень [4–6].
Сучасні підходи до вибору антигіпертензивного препарату ґрунтуються на оцінці індивідуальних особливостей пацієнта — наявності субклінічного ураження органів-мішеней та супутніх станів і захворювань. Блокатори ренін-ангіотензинової системи (інгібітори ангіотензинперетворюючого ферменту (ІАПФ) і блокатори АТ1-рецепторів ангіотензину ІІ (БРА)) мають найширший спектр застосування з огляду на доведені кардіо-, церебро- та нефропротекторні властивості та позитивний вплив на кардіометаболічні показники. Одним із найбільш вивчених представників БРА є телмісартан. У масштабному рандомізованому дослідженні ONTARGET переконливо продемонстровано поліпшення прогнозу пацієнтів високого ризику під впливом тривалої терапії телмісартаном [7].
Крім того, цей препарат має переваги над іншими представниками класу БРА у поліпшенні показників вуглеводного обміну, що проявляється більш суттєвим порівняно з іншими сартанами зниженням рівня інсуліну натще та зростанням індексів чутливості до нього [8]. Порушення вуглеводного та ліпідного обміну тісно пов’язані з системним запаленням, що є патогенетичною ланкою атеросклерозу. Активація запалення низької градації є також однією з характерних рис гіпертонічної хвороби (ГХ), що й зумовлює актуальність вивчення впливу антигіпертензивних препаратів на маркери та медіатори системного запального процесу.
З метою оцінки антигіпертензивної ефективності телмісартану та його впливу на активність системного запалення і показники вуглеводного й ліпідного метаболізму було проведено дослідження у хворих на ГХ.
Матеріал і методи
У дослідження включено 29 пацієнтів із ГХ І і ІІ стадії, 1-го ступеня (24 особи) та 2-го ступеня (5 осіб), середній вік яких становив 59,4 ± 2,0 року, серед них 48,3 % чоловіків. Після 7-денного безмедикаментозного періоду хворим призначали монотерапію телмісартаном (препарат Хіпотел виробництва компанії «Кусум Фарм», Україна) в дозі 40 мг/добу протягом 2 тижнів; якщо через 2 тижні лікування за даними офісних вимірювань АТ ≥ 140/90 мм рт.ст., дозу препарату збільшували до 80 мг/добу. Лікування тривало протягом 6 міс., контроль офісного АТ здійснювали через 2 тижні, 1, 3 та 6 міс. терапії телмісартаном. До початку терапії та наприкінці лікувального періоду хворі підлягали комплексному клінічному і лабораторному обстеженню. Для оцінки характеристик циркадного ритму АТ проводили добове моніторування АТ (ДМАТ) за допомогою монітору ABPM-04 (Meditech, Угорщина) згідно зі стандартним протоколом.
Активність системного запалення оцінювали на підставі дослідження вмісту в крові С-реактивного протеїну (СРП) та прозапальних цитокінів — інтерлейкіну-6 (ІЛ-6) та фактора некрозу пухлини α (ФНП-α). Вміст у крові високочутливого СРП визначали імунотурбідиметричним методом. Імуноферментний метод ELISA був застосований для визначення концентрації ІЛ-6 та ФНП-α.
Вміст глюкози в крові, загального холестерину (ЗХС), тригліцеридів (ТГ) і холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ) проводили з використанням відповідних тест-систем на біохімічному автоматичному аналізаторі Biosystems A25 (Іспанія). Рівень холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ) та холестерину ліпопротеїнів дуже низької щільності (ХС ЛПДНЩ) розраховували за формулою Фривальда. Для визначення концентрації імунореактивного інсуліну використовували ІРМА-набори (Immunotech, Чехія). Інсулінорезистентність оцінювали за індексом НОМА, який розраховували за формулою:
НОМА = [інсулін (мкОд/мл) × глюкоза (ммоль/л)]/22,5 (ум.од.).
Статистичну обробку результатів дослідження проводили за допомогою програми SPSS, версія 13. Всі змінні, що підлягали аналізу, підпорядковувались нормальному розподілу за результатом тесту Колмогорова — Смирнова для однієї вибірки. При порівняльному аналізі використовували t-критерій Стьюдента. Всі значення наведені у вигляді M ± m, де М — середнє арифметичне значення показника, m — стандартна помилка середньої величини. Різниця між сукупностями порівнюваних даних вважалася достовірною при р < 0,05.
Результати
Лікування препаратом Хіпотел протягом 2 тижнів сприяло нормалізації АТ у 10 пацієнтів (37,9 % від загальної кількості), через 1 міс. терапії на фоні збільшення дози препарату до 80 мг/добу у 19 пацієнтів, кількість ефективно лікованих хворих збільшилась до 19 осіб (65,5 %), а через 6 міс. у 75,6 % хворих було досягнуто цільового АТ. Протягом всього періоду лікування спостерігали стабільний антигіпертензивний ефект телмісартану (рис. 1), про що свідчить зниження офісного систолічного АТ (САТ) на 20 мм рт.ст., діастолічного АТ (ДАТ) на 13 мм рт.ст. наприкінці лікувального періоду.
Результати амбулаторного ДМАТ свідчать про сприятливий вплив телмісартану на добовий профіль АТ. Через 6 міс. терапії зареєстровано достовірне зниження середньодобового САТ і ДАТ за рахунок дії препарату як у денний (на 11,8 %, p < 0,001), так і в нічний (на 10,7 %, p < 0,001) періоди (табл. 1).
Препарат Хіпотел сприяв відновленню нормального двофазного ритму АТ у пацієнтів з його вихідним недостатнім зниженням вночі — non-dipper, кількість яких на початку дослідження становила 10 осіб.
Трансформацію добового ритму у тип dipper через 6 міс. лікування відзначено у 5 пацієнтів цієї групи, при цьому добовий індекс САТ у середньому збільшився з 5,9 ± 0,9 % до 8,4 ± 0,8 % (p < 0,001), ДАТ — з 6,4 ± 1,5 % до 12,2 ± 2,4 % (p < 0,01). Під впливом лікування спостерігали достовірне зменшення варіабельності АТ у нічний період (табл. 1), а також зниження ранкового приросту САТ на 33,7 % (p < 0,001) і ДАТ — на 23,1 % (p < 0,01).
Аналіз стану вуглеводного метаболізму під впливом тривалої терапії препаратом Хіпотел свідчив про суттєве поліпшення його показників, а саме зменшення вмісту в сироватці крові імунореактивного інсуліну на 21,5 % (р = 0,001), що супроводжувалось достовірним зниженням рівня глюкози з 5,5 ± 0,2 ммоль/л до 5,3 ± 0,1 ммоль/л (р = 0,04) і HbA1c з 5,6 ± 0,1 % до 5,4 ± 0,1% (р = 0,04). Позитивна динаміка з боку показників вуглеводного обміну зареєстрована переважно у пацієнтів з вихідною інсулінорезистентністю (n = 14), критерієм якої був показник НОМА ≥ 2,77 ум.од. У цій групі під впливом телмісартану відбулось суттєве поліпшення чутливості тканин до інсуліну, про що свідчила нормалізація індексу НОМА, який зменшився з 3,51 ± 0,2 ум.од. до 2,70 ± 0,2 ум.од. (р = 0,01), на фоні зниження рівня інсуліну з 13,9 ± 0,1 мкОд/мл до 11,5 ± 1,1 мкОд/мл (р = 0,01) і глюкози з 5,6 ± ± 0,1 ммоль/л до 5,3 ± 0,2 ммоль/л (р = 0,02); достовірно також зменшився вміст у крові HbA1c з 5,6 ± ± 0,2 % до 5,3 ± 0,1 % (р = 0,03).
За результатами аналізу динаміки показників ліпідного метаболізму встановлено, що терапія телмісартаном призвела до зниження рівня тригліцеридів із 1,59 ± 0,1 ммоль/л до 1,32 ± 0,1 ммоль/л (р = 0,03), з боку ЗХС спостерігалась лише тенденція до зменшення його вмісту в крові (з 5,9 ± 0,2 ммоль/л до 5,6 ± 0,2 ммоль/л; р > 0,05) переважно за рахунок зниження рівня ХС ЛПНЩ (з 4,3 ± 0,2 ммоль/л до 3,9 ± 0,2 ммоль/л; р > 0,05).
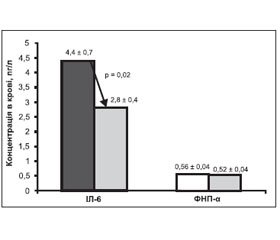
Переважна більшість включених у дослідження хворих на ГХ, а саме 21 особа, мали ознаки активації хронічного запалення (критерій — вміст у крові СРП > 3 мг/л). Під впливом лікування спостерігали достовірне зменшення вмісту маркера запалення СРП на 13,9 % (з 3,6 ± 0,3 мг/л до 3,1 ± 0,2 мг/л; р = 0,04) та прозапального цитокіну ІЛ-6 на 36,4 % (з 4,4 ± 0,7 пг/л до 2,8 ± 0,4 пг/л; р = 0,02). Лікування не впливало на вміст у крові ФНП-α (рис. 2).
/14.jpg)
У проведеному дослідженні препарат Хіпотел продемонстрував сприятливий метаболічний профіль і здатність до пригнічення активності системного запалення низької градації на фоні ефективного контролю АТ. При застосуванні монотерапії телмісартаном цільового рівня АТ вдалось досягти у 75,6 % пацієнтів, що є порівнянним із результатами об’єднаного аналізу досліджень PRISMA I та PRISMA II, в якому ефективне зниження офісного САТ було зафіксовано у 76,2 % хворих, ДАТ — у 69,1 % через 14 тижнів монотерапії телмісартаном в дозі 80 мг [9]. Тривалий період напіввиведення телмісартану (20–24 години) зумовлює надійний контроль АТ протягом доби при однократному застосуванні, що продемонстровано у вищенаведеному аналізі. Наші дані також вказують на тривалу антигіпертензивну дію телмісартану та його корегуючий вплив на порушений добовий ритм АТ: у половини пацієнтів із вихідним типом non-dipper відбулась його трансформація в нормальний двофазний ритм АТ. Відомо, що порушення нормальної фазності добового ритму асоціюється з суттєвим зростанням ризику серцево-судинних ускладнень, а його нормалізація, очевидно, сприятиме поліпшенню прогнозу пацієнтів з ГХ [10].
Встановлені нами сприятливі метаболічні ефекти телмісартану продемонстровано як в експериментальних, так і в інших клінічних роботах [11, 12]. Крім того, результати метааналізу, що включив 10 досліджень, які охопили 546 пацієнтів із метаболічним синдромом, свідчать, що терапія телмісартаном має переваги над іншими представниками БРА і амлодипіном у зниженні рівня глікемії натще, HbA1с, індексу НОМА та підвищенні вмісту адипонектину в крові [13]. Виражений позитивний вплив телмісартану на вуглеводний метаболізм пов’язують з його унікальними властивостями щодо активації PPAR-γ-рецепторів, які відіграють важливу роль у регуляції не тільки вуглеводного, а й ліпідного метаболізму, шляхом модуляції ядерних факторів транскрипції генів, що регулюють ці процеси [11]. Саме тому, окрім підвищення чутливості тканини до інсуліну, телмісартан здатен також поліпшувати й показники ліпідного обміну, що в нашому дослідженні проявлялось зменшенням вмісту в крові тригліцеридів, хоча в інших клінічних дослідженнях спостерігалась також позитивна динаміка з боку ЗХС, ХС ЛПНЩ та ХС ЛПВЩ [14].
Зниження активності запалення низької градації під впливом телмісартану було продемонстровано в пацієнтів із гострим коронарним синдромом і цукровим діабетом [15, 16]. Нами отримані переконливі дані про значне зменшення концентрації в крові СРП і прозапального цитокіну ІЛ-6 при застосуванні телмісартану протягом 6 міс. монотерапії. На сьогодні доведено, що активація системного запалення сприяє розвитку атеротромботичних ускладнень (інфаркт міокарда, мозковий інсульт) [17] та є фактором розвитку і прогресування ГХ. Саме тому пригнічення цієї активності поряд зі зменшенням проявів дисліпідемії та інсулінорезистентності може мати сприятливі прогностичні наслідки у хворих на ГХ.
Однак досить значний відсоток пацієнтів із ГХ для досягнення цільового АТ потребує комбінованої терапії. З огляду на результати дослідження ACCOMPLISH оптимальною комбінацією для контролю АТ і запобігання серцево-судинним ускладненням є комбінація на основі блокатора ренін-ангіотензин-альдостеронової системи (РААС) і антагоніста кальцію: на фоні її застосування зменшення відносного ризику серцево-судинних ускладнень та смерті від них становило 19,6 % (р < 0,001) порівняно з терапією блокатором РААС та гідрохлортіазидом [19]. У дослідженні ASCOT комбінація блокатора РААС з амлодипіном продемонструвала прогностичні переваги у вигляді зменшення загальної та серцево-судинної смертності над так званим старим підходом, поєднанням атенололу з тіазидним діуретиком [19]. У ліпідознижуючій гілці цього дослідження (ASCOT-LLA) на фоні застосування аторвастатину у хворих на ГХ високого ризику з метою первинної профілактики було встановлено суттєве зниження ризику серцево-судинних катастроф (всі серцево-судинні події — на 21 % (р = 0,0005), фатальний і нефатальний інсульт — на 27 % (р = 0,02) та інфаркт міокарда — на 29 % (р = 0,0005) [4]. При цьому було показано, що додавання аторвастатину до комбінації «блокатор РААС/амлодипін» сприяло більш значному поліпшенню прогнозу хворих на ГХ, ніж його комбінування з атенололом/гідрохлортіазидом [20].
Нещодавно опубліковані результати дослідження НОРЕ-3 надають переконливі докази раціональності застосування статинотерапії навіть в осіб без серцево-судинних захворювань з помірним ризиком їх розвитку. Зменшення вмісту в крові ХС ЛПНЩ на 26,5 % супроводжувалось достовірним зниженням ризику мозкового інсульту на 30 % (р = 0,02) та інфаркту міокарда на 35 % (р = 0,02) [6]. Спираючись на наведені дані, у пацієнтів з ГХ видається доцільним поєднане застосування комбінованої антигіпертензивної терапії на основі телмісартану та амлодипіну зі статинотерапією. Такий підхід виправданий з точки зору як ефективного контролю АТ, так і сповільнення прогресування атеросклерозу, що в сукупності сприятиме максимальному зниженню ризику серцево-судинних ускладнень. За таких умов раціонально поєднувати препарат Хіпотел (телміcартан) з фіксованою комбінацією «S-амлодипін/аторвастатин». Клінічні дослідження вказують на високу антигіпертензивну ефективність комбінації телмісартану з амлодипіном за даними офісних та амбулаторних вимірювань. Так, зниження середньодобового САТ і ДАТ при застосуванні комбінації телмісартану і амлодипіну в максимальних дозах становило 22,4 та 14,6 мм рт.ст. [21].
За результатами клінічних випробувань фіксованої комбінації S-амлодипіну з аторвастатином (препарат Амлостат виробництва «Кусум Фарм», Україна) було продемонстровано її ефективність у контролі АТ та корекції показників ліпідного спектра в пацієнтів високого та дуже високого ризику серцево-судинних ускладнень. Дозозалежний антигіпертензивний і ліпідознижуючий ефекти цього препарату зареєстровані в дослідженні М.І. Лутая та співавт. [1]. Цільового рівня АТ вдалось досягти у 92 та 94 % хворих високого та дуже високого ризику серцево-судинних ускладнень відповідно, тоді як зниження ХС ЛПНЩ на 50 % і більше досягнуто відповідно у 60 та 30 % пацієнтів зазначених категорій ризику.
Результати дослідження Л.Г. Воронкова та спів-авт. показали, що через 12 тижнів лікування 92 % хворих переважно з м’якою АГ ефективно контролювали АТ при середній дозі амлодипіну 4,3 мг/добу. Прийом аторвастатину у складі препарату Амлостат (середня його доза становила 17,3 мг) супроводжувався нормалізацією рівня загального ХС, причому ступінь зниження останнього (на 20 %) виявився аналогічним тому, що спостерігався у вищецитованому дослідженні ASCOТ-LLA. Ще більшою мірою, а саме на 38,5 %, знизився рівень ХС ЛПНЩ — з 3,4 ± 0,3 ммоль/л до 2,1 ± 0,2 ммоль/л, що нижче за цільовий рівень для хворих високого ризику, що становить 2,5 ммоль/л [2].
Інтерес являють результати клінічного випробування даної фіксованої комбінації у хворих на ГХ із м’яким і помірним підвищенням АТ, в якому було проведено порівняльний аналіз впливу S-амлодипіну та його комбінації з аторвастатином на маркери запалення низької градації. Було встановлено, що додавання аторвастатину значно посилює сприятливий вплив амлодипіну на показники ліпідного профілю та активність запалення низької градації [3].
Ще одним аргументом на користь фіксованої комбінації антигіпертензивного препарату зі статином є підвищення прихильності до терапії останнім. За результатами опитувань пацієнтів встановлено, що в чималої кількості випадків вони відміняють статин, бо не відчувають його дії, тоді як відчутність ефекту зниження АТ у багатьох випадках сприяє регулярному використанню препарату, в складі якого є статин.
Підсумовуючи отримані нами дані щодо клінічної ефективності препарату Хіпотел (телмісартан) та результати досліджень препарату Амлостат (фіксована комбінація S-амлодипіну з аторвастатином), можна стверджувати, що їх поєднане використання сприятиме поліпшенню прогнозу хворих на ГХ за рахунок синергізму антигіпертензивного та ліпідознижуючого потенціалу і плейотропних ефектів цих препаратів, дія яких направлена на сповільнення прогресування ГХ та атеросклерозу.
Список литературы
1. Лутай М.И. Эффективность фиксированной комбинации S-амлодипина и аторвастатина у пациентов с высоким и очень высоким сердечно-сосудистым риском / М.И. Лутай, И.П. Голикова, А.Ф. Лысенко, В.В. Товстуха // Український кардіологічний журнал. — 2013. — № 2. — C. 86-94.
2. Воронков Л.Г. Ефективність і переносимість фіксованої комбінації S(–) амлодипін/аторвастатин у пацієнтів з артеріальною гіпертензією високого серцево-судинного ризику / Л.Г. Воронков, Л.П. Паращенюк, А.В. Ляшенко, Н.А. Ткач // Український медичний часопис. — 2013. — № 1. — С. 73-75.
3. Заремба Є.Х. Клінічна ефективність лікування хворих на артеріальну гіпертензію: фокус на покращення прогнозу / Є.Х. Заремба, О.М. Голик, О.В. Заремба-Федчишин // Практикуючий лікар. — 2012. — № 3. — С. 37-39.
4. Sever P.S. Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or lower-than-average cholesterol concentrations, in the Anglo-Scandinavian Cardiac Outcomes Trial — Lipid Lowering Arm (ASCOT-LLA): a multicentre randomised controlled trial / P.S. Sever, B. Dahlóf, N.R. Poulter [et al.] // Lancet. — 2003. — Vol. 361. — P. 1149-1158.
5. Ridker P.M. Rosuvastatin to Prevent Vascular Events in Men and Women with Elevated C-Reactive Protein / P.M. Ridker, E. Danielson, F. Fonseca [et al.] // N. Engl. J. Med. — 2008. — Vol. 359. — P. 2195-2207.
6. Yusuf S. Cholesterol Lowering in Intermediate-Risk Persons without Cardiovascular Disease / S. Yusuf, D. Phil., J. Bosch [et al.] // N. Engl. J. Med. — 2016. — Vol. 374. — P. 2021-2031.
7. Telmisartan, Ramipril, or both for patients of high risk of vascular events / S. Yusuf, P. Sleight, C. Anderson [et al.] // New Engl. J. Med. — 2008. — Vol. 358. — P. 1547-1559.
8. Takagi H. Telmisartan improves insulin sensitivity: A meta-analisys of randomized head-to-head trials / H. Takagi, T. Umemoto // Int. J. Cardiol. — 2012. — Vol. 156. — P. 92-96.
9. Antihypertensive efficacy of telmisartan vs ramipril over the 24-h dosing period, including the critical early morning hours: a pooled analysis of the PRISMA I and II randomized trials / B. Williams, Y. Lacourcie`re, H. Schumacher [et al.] // J. Hum. Hypertens. — 2009. — Vol. 23. — P. 610-619.
10. Verdecchia P. Ambulatory blood pressure monitoring day-night dip and early-morning surge in blood pressure in hypertension prognostic implications / P. Verdecchia, F. Angeli, G. Mazzotta [et al.] // Hypertension. — 2012. — Vol. 60. — P. 34-42.
11. Identification of telmisartan as an unique angiotensin II receptor antagonist with selective PPAR-gamma-modulating activity / S.C. Benson, H.A. Pershadsingh, C.I. Ho [et al.] // Hypertension. — 2004. — Vol. 43. — P. 993-1002.
12. Effects of telmisartan on hypertensive patients with dyslipidemia and insulin resistance / D. Xu, J. Liu, C. Ji [et al.] // J. Geriatr. Cardiol. — 2007. — Vol. 4. — P. 149-152.
13. Telmisartan as a metabolic sartan: the first meta — analisys of randomized control trials in metabolic syndrome / H. Takagi, M. Niva, Y. Mizuno [et al.] // J. Am. Society of Hypertens. — 2013. — Vol. 7. — P. 229-235.
14. Vanitha M. Effect of telmisartan on serum lipid profile in patients with hypertension and dyslipidemia / M. Vanitha, K. Vijayal // Int. J. Med. Res. Health Sci. — 2013. — Vol. 2. — P. 745-749.
15. Comparison of the effects of ramipril versus telmisartan on high-sensitivity C-reactive protein and endothelial progenitor cells after acute coronary syndrome / I. Porto, L. Di Vito, G.L. De Maria [et al.] // Am. J. Cardiol. — 2009. — Vol. 103. — P. 1500-1505.
16. Comparison of the effects of ramipril versus telmisartan in reducing serum levels of high-sensitivity C-reactive protein and oxidized low-density lipoprotein cholesterol in patients with type 2 diabetes mellitus / S. Koulouris, P. Symeonides, K. Triantafyllou [et al.] // Am. J. Cardiol. — 2005. — Vol. 95 — P. 1386-1388.
17. Emerging Risk Factors Collaboration. C-reactive protein concentration and risk of coronary heart disease, stroke, and mortality: an individual participant meta-analysis / Emerging Risk Factors Collaboration, S. Kaptoge, E. Di Angelantonio, G. Lowe // Lancet. — 2010. — Vol. 375. — P. 132-40.
18. Jamerson K. Benazepril plus amlodipine or hydrochlorothiazide for hypertension in high-Risk patients / K. Jamerson, M.A. Weber, G.L. Bakris [et al.] // N. Engl. J. Med. — 2008. — Vol. 359. — P. 2417-2428.
19. Dahlf B. Prevention of cardiovascular events with an antihypertensive regimen of amlodipine adding perindopril as required versus atenolol adding bendroflumethiazide as required, in the Anglo-Scandinavian Cardiac Outcomes Trial-Blood Pressure Lowering Arm (ASCOT-BPLA): a multicentre randomised controlled trial // B. Dahlóf, P.S. Sever, N.R. Poulter [et al.] // Lancet. — 2005. — Vol. 366. — P. 895-906.
20. Sever P. Potential synergy between lipid-lowering and blood-pressure-lowering in the Anglo-Scandinavian Cardiac Outcomes Trial / P. Sever, B. Dahlóf, N. Poulter // Eur. Heart J. — 2006. — Vol. 27. — P. 2982-2988.
21. White W.B. Effects of telmisartan and amlodipine in combination on ambulatory blood pressure in stages 1-2 hypertension / W.B. White, T.W. Littlejohn, C.R. Majul [et al.] // Blood. Press. Monit. — 2010. — Vol. 15. — P. 205-212.
/12.jpg)
/14.jpg)

/13.jpg)