Статья опубликована на с. 43-47
Актуальность проблемы
Внутриутробные инфекции являются одной из ведущих проблем неонатального периода. Они не только приводят к высоким показателям смертности, особенно в течение первого года жизни, но и являются причиной инвалидизации, обусловленной врожденными пороками развития (ВПР) и фоновыми хроническими заболеваниями [1, 4]. Увеличение количества инфицированных беременных женщин и числа врожденных аномалий у новорожденных детей в современных условиях — показатель актуальности этой проблемы. В настоящее время во многих исследованиях по эпидемиологии, лечению и профилактике ВПР значительное внимание уделяется инфекционной этиологии врожденных пороков. Считается, что инфекционные осложнения и факторы, способствующие инфицированию, особенно в первом триместре беременности, наблюдаются у подавляющего большинства детей с пороками развития [7, 13].
До сегодняшнего дня не существует препаратов, способных полностью элиминировать возбудителей герпесвирусов из организма человека [10]. Это определяется в первую очередь их внутриклеточным циклом развития и способностью к иммунной мимикрии с развитием вторичного иммунодефицита [18]. Лечение герпесвирусных инфекций направлено:
— на угнетение репродукции герпесвирусов в период обострения;
— формирование адекватного длительного иммунного ответа для предотвращения реактивации вируса в очаге персистирования — противорецидивная терапия;
— предупреждение развития или возобновления нарушений, вызванных герпесвирусами как на уровне клеток, так и на органном уровне [9, 17, 19].
Цель — изучить влияние препарата иммунофлазид на состояние активности иммунной системы у детей с врожденными пороками желудочно-кишечного тракта (ЖКТ) при различном течении инфекционного процесса, обусловленного персистирующими внутриклеточными возбудителями.
Материал и методы
В основу работы положен анализ обследования 87 новорожденных, которые находились на лечении по поводу врожденных обструктивных пороков развития дигестивной системы. Пациенты были разделены на 2 группы. В основную группу вошли 43 пациента, инфицированных персистирующими внутриклеточными возбудителями. В контрольную группу вошло 44 пациента. Всем больным была проведена хирургическая коррекция порока развития желудочно-кишечного тракта. С целью выявления инфицированности и идентификации персистирующих внутриклеточных возбудителей — Herpes Simplex Virus 1/2, Cytomegalovirus, Epstein — Barr Virus, Chlamydia Trahomatis, Toxoplasma gondіі — использовали полимеразную цепную реакцию. Для выделения ДНК использовали набор реактивов «РИБО-преп» производства AmpliSens ЦНИИ эпидемиологии (г. Москва, Россия). Амплификацию проводили на приборе Rotor-Gene (Австралия) с детекцией в режиме реального времени. Выявление ДНК исследуемых возбудителей проводили в биологическом интраоперационном материале (слюна, содержимое пищевода, желудка, тонкой и толстой кишки) и сыворотке крови наблюдавшихся детей. Уточнение степени активности инфекционного процесса проводили путем выявления специфических IgG при помощи иммуноферментного анализа с использованием стандартного коммерческого набора реактивов ЗАО «Вектор-Бест» (Россия). Результаты регистрировали при помощи планшетного ридера Labsystems iEMS Reader MF, BioRad (Финляндия). Также был проведен тест на определение авидности специфических IgG. Индекс авидности (ИА) антител исследуемых образцов сывороток рассчитывали в процентах по формуле, предложенной S. Іnouye et al. [16]:
ИА = ОП1 • 100/ОП2,
где ОП1 — оптическая плотность в лунках с антителами после обработки денатурирующим агентом; ОП2 — оптическая плотность в лунках с той же сывороткой после обработки раствором сравнения.
С целью изучения функционального состояния системы иммунных, регуляторных и эффекторных факторов межклеточного взаимодействия, которые отвечают за сбалансированный иммунный ответ, эффективность противовирусного (антибактериального) иммунитета у детей с ВПР ЖКТ, ассоциированными с разного рода течением и степенью активности персистирующей внутриклеточной инфекции (ПВИ), проводили оценку активности провоспалительных и противовоспалительных интерлейкинов, интерферонов, фактора некроза опухоли α как основных эндогенных полипептидных медиаторов, регулирующих течение физиологических процессов и расстройства гомеостаза.
Для изучения цитокинового статуса: интерлейкинов (IL-1, IL-2, IL-6, IL-8, IL-10); интерферона (ИНФ)-α, -γ; фактора некроза опухоли (ФНО) α — использовали стандартный набор реактивов ProCon, ООО «Протеиновый контур» (Россия, Санкт-Петербург).
Обработку полученных данных проводили на основании банка формализованных историй болезни. Полученные клинические показатели обрабатывались методом вариационной статистики. Уровни анализируемых показателей в группах обследованных представлены как среднее плюс-минус стандартное отклонение. Различия между группами считали достоверными при значениях р < 0,05. При обработке результатов использовался персональный компьютер с привлечением пакета программ Microsoft Excel.
Результаты и обсуждение
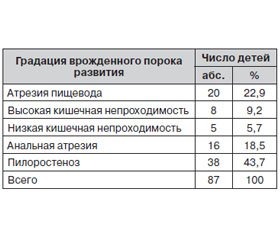
В течение 2013–2014 гг. в ОДКБ г. Донецка на лечении находились 87 детей с врожденными обструктивными пороками развития ЖКТ. Возраст пациентов составлял от суток до 3 месяцев. Мальчиков было 63 (73,4 %), девочек — 24 (26,6 %). Среди наблюдавшихся пациентов недоношенными родились 22 ребенка, что составило 25,3 %. Нозологическая характеристика врожденных пороков развития ЖКТ у обследованных детей представлена в таблице 1.
/44.jpg)
В результате исследования интраоперационного биологического материала и сыворотки крови у 87 пациентов иммунобиологические маркеры персистирующих внутриклеточных инфекций выявили у 43 детей (49,4 %) с врожденными пороками ЖКТ. Наличие ДНК в исследуемом материале пациентов свидетельствовало об активной (репликативной) стадии ПВИ. Среди обследованного контингента больных с ВПР ЖКТ активную стадию инфекционного процесса документировали у 21 пациента (24,1 %). При этом репликативная стадия микст-инфекции была выявлена только у 4 детей (4,6 %) с пороками развития ЖКТ. Латентное течение инфекции, обусловленной персистирующими внутриклеточными возбудителями, документировали у 22 пациентов (25,3 %).
Длительное пребывание возбудителей персистирующих внутриклеточных инфекций в организме человека наблюдается не только в органах-мишенях, но и в иммуноцитах, вызывая напряженность иммунной системы и постоянную ее активность. Это способствует развитию иммунного дисбаланса с нарушением клеточного и гуморального звеньев иммунитета, главными регуляторами которого являются цитокины. У пациентов группы исследования изучалась активность различных групп цитокинов, способных контролировать и определять длительность течения воспалительного процесса.
Показатели цитокинового статуса у пациентов с пороками развития ЖКТ, ассоциированными с различной степенью активности инфекционного процесса, обусловленного персистирующими внутриклеточными возбудителями, и детей группы контроля представлены в таблице 2.
/45.jpg)
Согласно данным таблицы 2, у пациентов исследуемой группы с активной стадией инфекционного процесса выявлено увеличение средних величин показателей провоспалительных интерлейкинов (IL-1, IL-2, IL-6), ИНФ-γ и ФНО-α в сыворотке крови с одномоментным снижением противовоспалительных интерлейкинов (IL-8 и IL-10), ИНФ-α. У пациентов с пороками развития ЖКТ и активной стадией ПВИ средние концентрации IL-1, IL-6, ИНФ-γ и ФНО-α были выше по сравнению с пациентами с латентной стадией. Средний уровень титра ИНФ-α, IL-10 не имел расхождений в сравниваемых группах. У ДНК-отрицательных пациентов с ВПР ЖКТ средние показатели активности IL-8 были выше, чем у пациентов с активной стадией инфекционного процесса, обусловленного персистирующими внутриклеточными возбудителями.
Сравнение средних величин показателей провоспалительных и противовоспалительных цитокинов у ДНК-положительных пациентов и детей группы контроля показало, что уровень IL-1, IL-2, IL-6, ФНО-α и ИНФ-γ выше у инфицированных детей с ВПР ЖКТ, ассоциированными с активной стадией инфекционного процесса, обусловленного персистирующими внутриклеточными возбудителями.
Данные, которые приведены в таблице 2, свидетельствуют, что у пациентов с латентной стадией ПВИ средние уровни концентрации провоспалительных интерлейкинов (IL -1, IL-2), ФНО-α, а также ИНФ-γ были выше по сравнению с пациентами контрольной группы.
А.А. Халдин с соавт. (2008) [14], Т. Брязжикова с соавт. (2004) [2], В.В. Иванова с соавт. (2008) [12] считают, что одной из основных практических проблем в лечении персистирующих внутриклеточных инфекций остается отсутствие единого подхода к терапии и вторичной профилактике рецидивов. Несмотря на большой выбор противогерпесвирусных препаратов, направленных как на купирование обострений, так и на восстановление иммунного статуса при латентном состоянии вируса, лечение назначают в большинстве случаев эмпирически [3].
Показанием к назначению этиотропной терапии было наличие активной (репликативной) стадии и/или нарушения в цитокиновом статусе. Сравнительный анализ показателей изменений в цитокиновом статусе проводили в группах детей с активной, латентной стадией инфекционного процесса, обусловленной персистирующими внутриклеточными возбудителями, и детьми группы контроля.
Специфическую этиотропную терапию получил 21 инфицированный пациент (24,1 %) с репликативной стадией ПВИ. Как препараты выбора для этиотропной терапии герпесвирусных инфекций, с точки зрения эффективности и безопасности, а также отсутствия возрастных ограничений, использовали ациклические нуклеозиды. Также в основной курс мы включали комбинированный иммунотропный растительный препарат иммунофлазид, который объединяет в себе противовирусное, интерфероногенное и иммуномодулирующее действие с высоким уровнем безопасности [11, 15]. Данный препарат обладает также апоптозмоделирущим, церебропротективным, антиоксидантным и дезинтоксикационным действием, активирует систему фагоцитоза и повышает неспецифическую резистентность организма. Препарат назначали по 0,5 мл за 30 минут до еды 2 раза в сутки на протяжении одного месяца.
После основного курса этиотропной терапии и у пациентов с латентной формой инфекционного процесса ПВИ, у которых документировали наличие дисбаланса цитокинового статуса, назначали 3-месячный курс препарата иммунофлазид в возрастных дозах согласно инструкции. Данное лечение получили 43 пациента (49,4 %). После этого проводили определение степени активности инфекционного процесса и цитокинового статуса пациентов.
После проведения первого этапа этиотропной терапии исчезновение активности инфекционного процесса, обусловленного персистирующими внутриклеточными возбудителями, было отмечено у 14 детей (27,9 %). У 7 пациентов (11,6 %) сохранялись показатели активности инфекционного процесса, им провели повторный курс этиотропной терапии. Контроль после окончания лечения свидетельствовал об отсутствии активности инфекционного процесса. Это подтверждалось отсутствием маркеров возбудителей ПВИ в сыворотке крови и снижением уровня специфических иммуноглобулинов, которые до лечения превышали верхнюю границу максимально допустимого показателя в 8–9 раз. Пациентам основной группы в связи с сохраняющимся дисбалансом цитокинового статуса и увеличением показателей провоспалительных интерлейкинов (IL-1, IL-2, IL-6), ИНФ-γ и ФНО-α в сыворотке крови и снижением противовоспалительных интерлейкинов (IL-8 и IL-10), ИНФ-α назначали 3-месячный курс препарата иммунофлазид в возрастных дозах согласно инструкции. После этого проводили повторное изучение цитокинового статуса. Динамика показателей цитокинового статуса у пациентов с пороками развития ЖКТ, ассоциированными с различной степенью активности инфекционного процесса, обусловленного персистирующими внутриклеточными возбудителями, через 3 месяца после лечения представлена в таблице 3.
/46.jpg)
Как показывают данные таблицы 3, показателем эффективности применения препарата иммунофлазид служило достоверное снижение активности провоспалительных цитокинов (IL-1, IL-2, IL-6), ИНФ-γ и ФНО-α и повышение активности противовоспалительных цитокинов IL-10 и ИНФ-α.
По мнению Е.И. Юлиша с соавт. (2006) [15], Ф.И. Ершова с соавт. (2005) [6], С.О. Крамарева с соавт. (2007) [8], Ф.И. Ершова с соавт. (2006) [5], при лечении хронических форм герпесвирусных инфекций возникают определенные трудности. При помощи этиотропной терапии не всегда возможно достичь положительного результата, если у пациента имеются иммунные расстройства. Поэтому комплекс лечебно-реабилитационных мероприятий должен включать иммуномодулирующие препараты. Этиотропные средства разрушают, блокируют или подавляют функциональную активность возбудителя. Иммуномодулятор прямо или опосредованно повышает функциональную активность фагоцитов, усиливая их бактерицидный эффект, стимулирует реакции клеточного и гуморального звена иммунной системы. По возбудителю заболевания наносится двойной удар, за счет чего и достигается большая эффективность комплексного лечения.
Таким образом, полученные нами результаты свидетельствуют о том, что комбинированный иммунотропный растительный препарат иммунофлазид является эффективным средством в комплексном лечении активной стадии инфекции, обусловленной персистирующими внутриклеточными возбудителями. Как препарат монотерапии иммунофлазид эффективен при нарушениях в цитокиновом статусе у детей с латентным течением ПВИ. Его применение как в комплексе, так и в качестве монотерапии позволяет в более короткие сроки восстановить дисбаланс иммунной системы, а также способствует сокращению сроков применения специфической этиотропной терапии.
Выводы
Применение препарата иммунофлазид у 43 пациентов с пороками развития ЖКТ, инфицированных персистирующими внутриклеточными возбудителями, доказало его высокий уровень безопасности и эффективности. Иммунофлазид может быть рассмотрен как препарат выбора для проведения длительного как комплексного противовирусного, так и противорецидивного лечения у детей с герпесвирусными инфекциями для формирования длительного иммунного ответа и восстановления возникших нарушений как на органном, так и на клеточном уровне.
Список литературы
1. Антонов О.В. Идентификация и анализ причинно-следственных связей в системе инфекционная заболеваемость — частота и характер врожденных пороков развития / О.В. Антонов, И.В. Антонова, Д.В. Турчанинов // Эпидемиология и инфекционные болезни. — 2009. — № 5. — С. 20-25.
2. Брязжикова Т. Герпетическая инфекция: профилактика и лечение / Т. Брязжикова, Т. Юрлова // Врач. — 2004. — № 2. — С. 47-48.
3. Герпесвирусные инфекции. Современные аспекты клиники, диагностики и лечения / А.Д. Дюдюн, Н.Н. Полион, Т.Н. Полишко [и др.] // Клінічна імунологія. Алергологія. Інфектологія. — 2007. — № 2. — С. 55-58.
4. Дегтярев Ю.Г. Факторы риска в возникновении врожденных пороков развития // Медицинский журнал. — 2014. — № 2. — С. 4-10.
5. Ершов Ф.И. Индукторы эндогенного интерферона в лечении вирусных инфекций. Результаты клинических испытаний нового индуктора интерферона — препарата кагоцел / Ф.И. Ершов, В.Г. Нестеренко, А.Н. Ловенецкий. — М.: Ниармедик плюс, 2006. — 14 с.
6. Ершов Ф.И. Интерфероны и их индукторы (от молекулы до лекарств) / Ф.И. Ершов, О.И. Киселев. — М.: ГЭОТАР-Медиа, 2005. — 368 с.
7. Инфекции матери — одно из звеньев мультифакторной природы врожденных дефектов / О.В. Островская, Н.М. Ивахнишина, Н.М. Бутко и др. // Справочник педиатра. — 2010. — № 4. — С. 31-34.
8. Крамарев С.О. Обґрунтування застосування препаратів інтерферонів при гострих респіраторних інфекціях у дітей / С.О. Крамарев, О.В. Виговська, О.Й. Гриневич // Клінічна імунологія. Алергологія. Інфектологія. — 2007. — № 5 (10). — С. 69-71.
9. Крамарев С.О. Сучасні підходи до лікування герпесвірусних інфекцій у дітей / С.О. Крамарев // Современная педиатрия. — 2004. — Vol. 3, № 4 — С. 121-125.
10. Львов А.Н. Рецидивирующий простой герпес: клинико-психоиммунные соотношения на фоне комплексной терапии / А.Н. Львов, А.А. Халдин, Е.В. Федякова // Герпес. — 2006. — № 1. — С. 36-40.
11. Новые пути санации внутриклеточной инфекции в педиатрии / Л.С. Овчаренко, А.А. Вартегел, Т.Г. Андриенко [и др.] // Современная педиатрия. — 2004. — № 4 (5). — С. 82-84.
12. Современные принципы диагностики и лечения перинатальных герпесвирусных инфекций / В.В. Иванова, М.В. Иванова, А.С. Левина [и др.] // Российский вестник перинатологии и педиатрии. — 2008. — Т. 53, № 1. — С. 10-18.
13. Тарамонова Н.С., Янковская Н.И., Конюх Е.А. Современные представления о этиопатогенезе, клинике, диагностике и лечении внутриутробных инфекций у новорожденных: Учебное пособие. — Гродно: ГрГМУ, 2005. — 49 с.
14. Халдин А.А. Алгоритм ведения больных рецидивирующим простым герпесом / А.А. Халдин, М.А. Самгин, А.Н. Львов // Герпес. — 2008. — № 1. — С. 21-25.
15. Юлиш Е.И. Врожденные и приобретенные TORCH-инфекции у детей / Е.И. Юлиш, А.П. Волосовец. — Донецк, 2006. — 225 с.
16. Changes in antibody avidity after virus infections: detection by an immunosorbent assay in which a mild protein-denaturing agent is employed / S. Inouye, A. Hasegava, S. Matsuno, S. Katwo // J. Clin. Microbiol. — 1984 — Vol. 20. — P. 525-529.
17. Cost-effectiveness analysis of herpes simplex virus testing and treatment strategies in febrile neonates / А.С. Caviness, G.J. Demmler, J.M. Swint [et al.] // Arch. Pediatr. Adolesc. Med. — 2008. — Vol. 162, № 7. — Р. 665-674.
18. Sacks S.L. Фамцикловир в терапии простого генитального герпеса у пациентов с устойчивостью к ацикловиру или валацикловиру / S.L. Sacks, F.Y. Aoki // Герпес. — 2008. — № 1. — С. 39-41.
19. Seroprevalence of herpes simplex virus type 1 in children in the United States / F. Xu, F.K. Lee, R.A. Morrow [et al.] // J. Pediatric. — 2007. — Vol. 151, № 4. — P. 374-377.
/44.jpg)

/45.jpg)
/46.jpg)