Статтю опубліковано на с. 29-34
За даними ВООЗ, у Європі щорічно переносять інсульт понад один мільйон осіб. Актуальна ця проблема й для України. За статистичними даними, в Україні трапляється близько 100 тис. випадків інсульту, а помирає від 33 до 40 тис. осіб [1, 2]. Частота інвалідизації постінсультних хворих сягає 60 %, стороннього догляду потребують 20 % хворих, і тільки 20 % осіб повертаються до трудової діяльності. При цьому якщо у 20 % пацієнтів порушені функції відновлюються спонтанно або не втрачаються зовсім, то 80 % хворих потребують реабілітації [1]. Однією з ключових проблем наслідків мозкового інсульту є рухові порушення, біль та спастичність, що становлять одну з найбільш частих причин тяжкої інвалідизації хворих. Тому реабілітація хворих з руховими порушеннями є актуальним завданням сучасної реабілітології.
Проблема постінсультної спастичності стає все більш актуальною й в Україні в зв’язку з високою частотою цереброваскулярної патології серед населення.
Відомо, що відновлення втрачених рухів максимально ефективне протягом перших двох-трьох місяців від моменту захворювання. Подальші позитивні зміни найбільш істотні до шостого місяця, і меншою мірою ефективність лікування спостерігається до року. Через рік після розвитку інсульту зменшення ступеня парезу малоймовірне, проте можливе покращення рухових функцій і зменшення ступеня інвалідності шляхом адаптації пацієнтів до наявного дефекту, корекції підвищеного м’язового тонусу в уражених кінцівках, а також за рахунок тренування рівноваги й освоєння навичок ходьби з використанням спеціальних пристосувань для пересування. Відновлення здатності до самостійного пересування може відбутись навіть у тих хворих, які в гострому періоді мають повну втрату рухів у кінцівках з одного боку [3].
Болі, контрактури й трофічні зміни в паретичних кінцівках, що приєднуються в пізньому періоді хвороби, при постінсультних геміпарезі або геміплегії привертають увагу фахівців у зв’язку з тим, що вони обтяжують перебіг основного захворювання, обмежують рухи, перешкоджають проведенню відновлювальних заходів. Больовий синдром у паретичних кінцівках пов’язують з різними факторами як центрального, так і периферичного генезу [4, 5].
Тяжкість постінсультних розладів рухів визначається не тільки ступенем парезу, наявністю больового синдрому, а й, значною мірою, вираженістю тонічних розладів (спастичністю). Під спастичністю мають на увазі особливе стійке патологічне підвищення м’язового тонусу, що включає м’язову слабкість, втрату спритності рухів, підвищення м’язового тонусу, м’язові спазми, підвищення сухожильних рефлексів. У цілому ряді експериментальних досліджень наочно демонструється, що ізольоване ураження пірамідного тракту не викликає спастичності, а призводить лише до парезу в дистальних відділах кінцівок. У той же час спастичність пов’язують з порушенням цілого ряду нейрофізіологічних механізмів, серед яких вирішальна роль відводиться порушенню диференційованої регуляції α- і γ-мотонейронів, гіперзбудливості спінальних α-мотонейронів, зменшенню активності деяких інгібіторних механізмів. У низці робіт доведено, що підвищення м’язового тонусу є наслідком гіперактивності не пірамідних волокон, а волокон кортикоруброспінальних, кортикоретикулоспінальних і кортиковестибулоспінальних трактів. Саме вони і є основним регулятором тонусу антигравітаційних м’язів, що вказує на комбіноване ураження пірамідних і екстрапірамідних структур відділів головного мозку [6, 7].
Відомо, що без лікування спастичності протягом тривалого часу в м’язах, сухожиллях і суглобах розвиваються вторинні зміни. Прикладом негативного впливу спастичності на тканини великих суглобів є формування постінсультних больових синдромів, обумовлених, наприклад, формуванням періартрозу плечового суглоба, частота якого, за даними різних авторів, становить від 48 до 84 % випадків [7].
Найчастіше спастичність виявляється одночасно у верхній і нижній кінцівках (68 %), проте можлива й ізольована поява цього симптому в руці (15 %) або нозі (18 %) [8].
Спастичність формується в 72,3 % хворих на 3–4-му тижні інсульту в результаті посилення збудливості α-мотонейронів за рахунок порушення інгібіторних механізмів в умовах уповільнення провідності й зниження потужності імпульсного потоку по надсегментарних рухових волокнах. Для «пірамідної» гіпертонії при інсульті характерне підвищення тонусу переважно в певних м’язових групах. На верхніх кінцівках це пронатори й згиначі передпліччя, кисті, пальці, на нижніх кінцівках — розгиначі гомілки, згиначі стопи. Виникають типові пози з характерним зовнішнім виглядом пацієнта (поза Верніке — Манна), при яких не тільки значно ускладнюється самостійне обслуговування хворого, але й хворі можуть падати. Протягом 6 місяців після інсульту падіння відзначаються в 73 % хворих, значно підвищуючи ризик виникнення переломів. Так, серед пацієнтів з даним видом перелому в 40 % випадків є вказівки на перенесений раніше інсульт [9].
Останнім часом змінилось уявлення про постінсультну реабілітацію — раніше акцент у реабілітації ставився на компенсацію порушень (наприклад, максимальне використання здорової руки для зменшення потреби в сторонній допомозі). Сучасний підхід спрямований як на покращення функціонального результату захворювання, так і на стимуляцію функціональної реорганізації мозку [10].
Підвищення м’язового тонусу істотно впливає на процес відновлення порушених функцій. З одного боку, висока спастичність перешкоджає реалізації збережених функцій і поліпшенню порушених, а з іншого — деяке підвищення м’язового тонусу може мати при паралічі компенсаторне значення. Тому, перш ніж почати лікування, необхідно вирішити, наскільки необхідне й доцільне зниження м’язового тонусу кінцівки [11].
При наявності м’язової спастичності, що супроводжується больовим синдромом, і особливо при її зростанні у програму реабілітації хворих повинні включатися заходи, спрямовані на її подолання. Усе це обумовлює пошук найбільш ефективних методів та схем корекції порушення м’язового тонусу. При цьому всі зусилля мають бути спрямовані на нормалізацію тонусу мускулатури хребта, формування балансу між згиначами та розгиначами, стабілізацію регіонів хребта та кінцівок, залучених у патологічний процес. У комплекс заходів боротьби зі спастичністю зазвичай включають фізіотерапію, гідропроцедури, лікування позицією, спеціальні лікувально-гімнастичні прийоми, спрямовані на розслаблення, біологічний зворотний зв’язок, вибірковий масаж, голкорефлексотерапію, вживання міорелаксантів. Найбільш часто для досягнення ефекту доводиться використовувати декілька перерахованих вище процедур [3, 11].
Основними препаратами, що використовуються для зниження м’язового тонусу, є міорелаксанти. За механізмом дії розрізняють міорелаксанти центральної дії (впливають на синаптичну передачу збудження в центральній нервовій системі) і периферичної (пригнічують пряму збудливість поперечносмугастих м’язів). При виборі антиспастичних препаратів враховують в основному їх здатність гальмувати полісинаптичні рефлекси (зменшення спастики), чинячи при цьому найменший вплив на моносинаптичні рефлекси. Перевагу потрібно віддавати антиспастичному препарату, що повинен зменшувати м’язову спастичність при мінімальному зниженні м’язової сили, мати доступну ціну й мінімальну вираженість побічних ефектів [12]. При застосуванні міорелаксантів можуть виникати досить значущі побічні дії, які при виборі препарату треба ретельно оцінювати [5, 12]. Вибір препаратів, що знижують м’язовий тонус — міорелаксантів центральної дії, невеликий. Лікування проводиться тривало.
З метою блокування м’язового спазму вже декілька десятиріч у клінічній практиці лікарів різних спеціальностей широко застосовується препарат Мідокалм. Мідокалм (міжнародна назва Tolperisone, толперизон), виробник «Гедеон Ріхтер Нрт», протягом багатьох десятиліть використовують як центральний міорелаксант для порушень міофасціального генезу. Він наділений усіма вищеперерахованими якостями. Центральна міорелаксуюча дія Мідокалму реалізується за рахунок дозозалежного зниження входу натрію в клітину, таким чином знижується частота формування потенціалів дії. Препарат також блокує підвищення активності задніх корінців спинного мозку, що викликається стимуляцією С-волокон (ноцицептивних аферентних нервів), нормалізує підвищену частоту формування викликаних потенціалів дії, завдяки чому послаблює болісний спазм м’язів і перешкоджає хронізації болю. Центральна аналгетична дія Мідокалму реалізується шляхом пригнічення проведення збудження по ретикулоспінальному шляху на рівні стовбура мозку. Тому аналгетична активність препарату не пов’язана з блокадою опіоїдних рецепторів [14–16]. Дія Мідокалму має периферичний аналгетичний вплив, подібний до дії місцевого анестетика, надаючи мембраностабілізуючу дію як на мотонейрони й клітини спинномозкових гангліїв, так і на периферичні нерви. Встановлено, що Мідокалм (толперизон) гальмує поширення потенціалу дії по С-волокнах [17], що відображає позитивну антиноцицептивну дію препарату на гострий біль. Окрім того, Мідокалм підсилює периферичний кровообіг за рахунок блокади βα1-адреноблокаторів судин, що є додатковим чинником усунення м’язового спазму.
Отже, препарат має потрійну дію: зменшує м’язовий спазм, покращує кровообіг, усуває біль.
Мідокалм випускається у двох формах — таблетки 50 та 150 мг та розчин для ін’єкцій по 1 мл в ампулах, що містить толперизону гідрохлориду 100,0 мг, лідокаїну гідрохлориду — 2,5 мг.
Проведено багато досліджень стосовно ефективності та безпеки застосування препарату Мідокалм у відновленні руху у хворих після інсульту [8, 11, 14, 16].
У зв’язку з цим становили інтерес дослідження особливостей лікування хворих та оцінка безпеки й переносимості застосування Мідокалму у хворих із наслідками ішемічних інсультів зі спастичними геміпарезами.
Тому метою нашого дослідження було оцінити клінічну ефективність та безпеку лікування спастичності й больового синдрому, з нею пов’язаного, у хворих з наслідками ішемічного інсульту.
Завдання дослідження:
1. Вивчити клінічну ефективність препарату Мідокалм («Гедеон Ріхтер Нрт») у пацієнтів з постінсультною спастичністю.
2. Оцінити переносимість та безпеку препарату Мідокалм у пацієнтів з постінсультною спастичністю.
Методи дослідження
Для вирішення поставлених завдань дослідження використовувалися клініко-неврологічний, статистичний методи дослідження. Оцінка інтенсивності больового синдрому пацієнтами здійснювалася за візуальним і вербальним критеріями в балах від 0 до 10 (візуально-аналогова шкала болю (ВАШ)). Спастичність визначалася за шкалою Ашворта (Modified Ashworth Scale for Grading Spasticity). Ступінь порушення рухових функцій оцінювався за індексом мобільності Ріверміда.
Результати дослідження
Нами було обстежено 58 хворих із постінсультною спастичністю. Усі хворі проходили курс нейрореабілітації після перенесеного ішемічного (атеротромботичного) інсульту у пізньому відновлювальному періоді захворювання. В основному (45 осіб, 77,6 %) це були хворі, яким проводили курс стаціонарного відновного лікування; курс лікування для всіх пацієнтів становив від 14 до 18 днів. Оцінка досліджуваних пацієнтів здійснювалась до початку проведення реабілітаційного лікування. Через 1 місяць від початку проведення реабілітаційних заходів була проведена повторна оцінка результатів лікування.
Середній вік хворих становив 62,2 ± 4,7 року (від 48 до 57,5 року), з них чоловіків було 33 (56,0 %), жінок — 25 (44,0 %). Розподіл хворих за віком подано в табл. 1.
/31.jpg)
Шляхом випадкової вибірки хворі з наслідками ішемічного інсульту зі спастичним геміпарезом та больовим синдромом були поділені на 2 групи (табл. 1). У першу групу увійшли 30 (45,6 %) хворих, які отримували комплексну базисну реабілітаційну терапію, що включала препарати вторинної профілактики, а саме гіпотензивні, антитромбоцитарні та гіполіпідемічні, та препарат Мідокалм 1,0 мл 2 рази на добу протягом 7 діб з переходом на пероральне застосування 150 мг у таблетках 3 рази на день 14 днів. У другу групу було включено 28 хворих (54,4 %), які отримували базисне комплексне лікування й не отримували міорелаксантів. Відмінності між групами виявлялися тільки відносно розподілу за показником «стать» (більше пацієнтів чоловічої статі в першій групі). Проте ці відмінності оцінювалися як незначущі, оскільки терапевтичні групи були однорідними за всіма іншими початковими показниками. Діагноз підтверджувався за допомогою даних нейровізуалізації (комп’ютерна томографія, магнітно-резонансна томографія).
Статистична обробка проводилася з використанням методів варіаційної статистики. Вірогідність відмінностей між середніми значеннями досліджуваних показників визначали за критерієм Стьюдента, оцінюючи ймовірність на рівні значущості не менше від 95 % (р ≤ 0,05).
Аналіз клінічного матеріалу показав, що вперше церебральний інсульт перенесли 49 осіб (84,5 % хворих); повторно — 9 осіб (15,5 %) із загальної кількості хворих. Ураження правої півкулі головного мозку мало місце у 24 (41,4 %) хворих; лівої — у 34 (58,6 %) пацієнтів. У більшості хворих — 51 (87,9 %) порушення мозкового кровообігу виникло в басейні середньої мозкової артерії, у решти — у вертебробазилярному басейні. Давність перенесеного порушення мозкового кровообігу була в інтервалі від 1 до 5 років. Переважали хворі з помірним ступенем спастичності.
Виявлений парез у 14 (24,1 %) хворих був вираженим, у 27 (46,5 %) — помірно вираженим, у 17 (29,3 %) — легким. При цьому парези були більш виражені в руці у 48 хворих (82,7 %), на той час як у нозі — у 10 (17,3 %).
Після закінчення курсу лікування загалом спостерігалася позитивна динаміка неврологічного стану хворих. Однак особливо наочний ефект проявлявся у хворих групи І порівняно з групою ІІ.
Для оцінки спастичності ми використовували шкалу Ашворта. Шкала Ашворта є визнаним інструментом реєстрації й контролю клінічної динаміки спастичності під час лікування.
На початку дослідження спастичність було виявлено в переважної більшості пацієнтів (табл. 2).
Після завершення курсу лікування стан рухової системи суттєво покращився в усіх досліджуваних хворих. Середній бал спастичності за шкалою Ашворта становив у 1-й групі 2,8 ± 0,4. При завершенні дослідження бал за шкалою Ашворта знизився на 0,7. Відповідний показник у 2-й групі становив 3,2 ± 0,4 бала. Середній бал спастичності за шкалою Ашворта знизився на 0,5 бала.
Наприкінці дослідження в 1-й групі хворих, які отримували Мідокалм разом із базисною терапією, спастичність знизилась за шкалою Ашворта на 3 бали у 4 % випадків, на 2 бали — у 23,0 % та на 1 бал — у 63,0 % хворих.
Як показали результати дослідження, включення Мідокалму в комплекс реабілітаційних заходів у хворих із спастичним геміпарезом внаслідок ішемічного інсульту сприяє покращенню рухових функцій (індекс мобільності Ріверміда становив 12,6 ± 0,9 бала, p < 0,01) (табл. 3).
Суб’єктивна оцінка результатів лікування хворих за ВАШ показала, що хороші й відмінні результати отримали 19 (32,8 %) пацієнтів, задовільні — 11 (19,0 %) осіб 1-ї групи та 15 (25,9 %) й 13 (22,3 %) хворих 2-ї групи відповідно.
Найбільш вираженими ці зміни були в пацієнтів 1-ї групи.
Інтенсивність больового синдрому, обумовленого спастичним геміпарезом, оцінювалася за 10-бальною ВАШ (табл. 4).
За ВАШ вихідна суб’єктивна оцінка болю в пацієнтів першої групи становила в середньому 2,8 ± 0,4 бала. Після лікування цей показник становив 1,9 ± 0,2 бала. У пацієнтів другої групи початкове значення в середньому становило 3,2 ± 0,4 бала, після лікування — 2,7 ± 0,3 бала.
Усім досліджуваним проводили оцінку рухових розладів за модифікованою шкалою м’язової спастичності Ашворта.
За результатами аналізу показників неврологічного статусу було виявлено, що препарат Мідокалм був ефективним при застосуванні у хворих з больовим синдромом, пов’язаним із спастикою в паретичних кінцівках. Можна відмітити значне усунення больового синдрому при терапії препаратом Мідокалм у хворих із спастичним геміпарезом на тлі наслідків мозкового інсульту. У всіх хворих відмічався позитивний вплив терапії не лише на спастичність і об’єм виконання рухів у паретичних кінцівках, але й на інтенсивність больового синдрому, що обумовлювало збільшення реабілітаційного потенціалу пацієнтів у цілому в обох групах, особливо в першій (при застосуванні Мідокалму).
Отже, після лікування відмічалась позитивна динаміка показників за ВАШ, шкалою Ашворта та індексом мобільності Ріверміда у хворих з постінсультною спастичністю в обох групах (особливо в першій).
Огляд та опитування пацієнтів у ході проведеного клінічного дослідження не виявили жодних скарг, неочікуваних побічних реакцій, ускладнень або явищ непереносимості препарату Мідокалм при його щоденному призначенні за ступінчастою схемою 1,0 мл 2 рази на добу протягом 7 діб із переходом на пероральне застосування 150 мг в таблетках 3 рази на день протягом 14 днів.
Жоден пацієнт не пред’являв скарг і не мав ніяких неприємних відчуттів, які можна було б пов’язати з дією досліджуваного препарату. У 2 хворих відмічалась підвищена м’язова слабкість при застосуванні комбінації Мідокалму та антидепресанту або антиконвульсанту. Жоден хворий, який отримував Мідокалм, не припинив лікування внаслідок побічних ефектів.
У результаті проведеного лікування було з’ясовано, що переносимість препарату Мідокалм була доброю або задовільною (табл. 5).
Прийом препарату був безпечним у хворих із наслідками ішемічного інсульту та спастичністю (табл. 6).
Як видно з табл. 5, переносимість препарату була доброю в 55 (94,8 %) хворих та задовільною в 3 (5,2 %) хворих.
У цілому можна відзначити ефективність препарату Мідокалм у комплексному лікуванні хворих з наслідками ішемічного інсульту та спастичністю. Мідокалм рекомендовано до застосовування в комбінації з препаратами інших груп, що збільшує його клінічну ефективність. За нашими даними, застосування препарату Мідокалм знижує не тільки ступінь спастичності, але й рівень больового синдрому, а також покращує повсякденну активність хворих, полегшує їх догляд за собою при відсутності небажаних явищ.
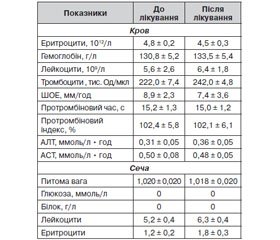
Зміни морфологічних і біохімічних показників крові та сечі в обстежених хворих у ході застосування препарату Мідокалм подано в табл. 6.
Призначення препарату Мідокалм не впливало негативно на показники морфологічного складу периферичної крові, на рівні її основних біохімічних констант і не відбилося на показниках клінічного аналізу сечі (табл. 6).
У цілому на підставі результатів об’єктивних клінічних та лабораторних досліджень переносимість препарату Мідокалм характеризувалася як добра в усіх пацієнтів.
Висновки
Спастика та пов’язаний з нею больовий синдром у хворих в пізньому відновлювальному періоді ішемічного інсульту значно ускладнює відновлення рухових функцій, посилює обмеження хворих у повсякденній активності. Включення Мідокалму в комплексну терапію наслідків ішемічного інсульту з метою усунення спастики та пов’язаного з нею больового синдрому призводить до збільшення м’язової сили й обсягу рухів у паретичних кінцівках, сприяє реабілітації, покращує адаптацію хворих з руховими порушеннями після перенесеного церебрального інсульту.
Список литературы
1. Сашина М.Б. Реабилитация больных с центральным постинсультным болевым синдромом: Автореф. дис… канд. мед. наук. — М., 2005.
2. Міщенко Т.С. Стан неврологічної служби України в 2014 році. — Харків, 2015. — 29 с.
3. Стаднік С.М. Мультидисциплінарний підхід при реабілітації пацієнтів із мозковим інсультом / С.М. Стаднік, Р.І. Данилков // Міжнародний неврологічний журнал. — 2010. — № 8. — С. 28-32.
4. Хабиров Ф.А. Комплексный подход к реабилитации постинсультных больных с двигательным дефицитом в раннем восстановительном периоде / Ф.А. Хабиров, Т.И. Хайбуллин, О.В. Григорьева // Журнал неврологии и психиатрии им. С.С. Корсакова. — 2011. — T. 111, № 4 (Вып. 2. Инсульт). — С. 32-36.
5. Гусев А.О. Семейное положение пациентов отделений восстановительного лечения неврологического и кардиологического профилей как важная часть их социально-гигиенической характеристики / А.О. Гусев // Медико-социальная экспертиза и реабилитация. — 2011. — № 2. — С. 49-50.
6. Кранчюкайте-Бутылкиниене Д. Влияние перенесенного церебрального инсульта на состояние здоровья и повседневную активность / Д. Кранчюкайте-Бутылкиниене // Журнал неврологии и психиатрии им. С.С. Корсакова. — 2011. — T. 111, прил. к № 4 (Вып. 2. Инсульт). — С. 37-41.
7. Бугрова С.Г. Реабилитация больных, перенесших инсульт, в условиях городской поликлиники / С.Г. Бугрова // Міжнародний неврологічний журнал. — 2011. — № 3. — С. 95-98.
8. Boyd R. Physiotherapy management of spasticity / Boyd R. // Upper motor neuron syndrome and spasticity. — Cambridge University Press, 2001. — P. 96-121.
9. Марутенков Г.Л. Снижение риска падений и повышение уровня повседневной жизненной активности пациентов после инсульта с помощью занятий на тренажере «Баланс-система SD» / Г.Л. Марутенков, В.В. Ковальчук // Медико-социальная экспертиза и реабилитация. — 2010. — № 1. — С. 16-19.
10. Brainin M. Organization of Stroke Care: Education, Referral, Emergency Management and Imaging, Stroke Units and Rehabilitation / M. Brainin, T.S. Olsen, A. Chamorro et al. // Cerebrovascular Diseases. — 2004. — Vol. 17, Suppl. 2. — P. 1-14.
11. Козелкин А.А. Современные аспекты нейрореабилитации постинсультных больных / А.А. Козелкин [и др.] // Міжнародний неврологічний журнал. — 2010. — № 8. — С. 20-24.
12. Суслина З.А. Инсульт: оценка проблемы (15 лет спустя) / З.А. Суслина, М.А. Пирадов, М.А. Домашенко // Журн. неврологии и психиатрии им. С.С. Корсакова. — 2014. — Т. 114, № 11. — С. 5-13.
13. Живолупов С.А. Современная парадигма нейропластичности (теоретические аспекты и практическая значимость) / С.А. Живолупов, И.Н. Самарцев, Ф.А. Сыроежкин // Журнал неврології ім. Б.М. Маньковського: наук.-практ. видання. — 2014. — Т. 2 (4). — С. 5-15.
14. Парфенов В.А. Мидокалм в лечении болезненного мышечного спазма при болях в спине / В.А. Парфенов // Неврологический журнал. — 2004. — № 6. — С. 39-42.
15. Svensson P. Effect of muscle relaxants on experimental jaw-muscle pain and jaw-stretch reflexes: a double-blind and placebo-controlled trial / P. Svensson, K. Wang and L. Arendt-Nielsen // Eur. J. Pain. — 2003. — № 7. — С. 449-456.
16. Dulin J. Evaluation of sedative effects of single and repeated doses of 50 mg and 150 mg tolperisone hydrochloride. Results of a prospective, randomized, double blind, placebocontrolled trial / J. Dulin, L. Kovacs, S. Ramm et al. // Pharmacopsychiat. — 1998. — 31. — Р. 137-142.
17. Парфенов В.А. Лечение постинсультной спастичности, применение мидокалма / В.А. Парфенов // Неврология, нейропсихиатрия, психосоматика. — 2011. — № 3. — С. 65-69.
18. Костенко Е.В. Комплексная реабилитация пациентов с постинсультной спастичностью руки в амбулаторно-поликлинических условиях / Е.В. Костенко, Л.В. Петрова, А.В. Лебедева, А.Н. Бойко // Нервные болезни. — 2013. — № 3. — С. 30-38.
19. Gaudreault J. Pharmacokinetics and Anticonvulsant Effect of a New Hypnotic, CL 284, 846, in Rats / J. Gaudreault, F. Varin, G. Pollack // Pharmaceutical Research. — 1995 Nov. — Vol. 12, № 11. — Р. 1592-1597.
/31.jpg)
/32.jpg)
/32_2.jpg)
/33.jpg)
/33_2.jpg)