Международный неврологический журнал 6 (84) 2016
Вернуться к номеру
Вплив імплантації NeuroGelTM в асоціації з ксеногенними стовбуровими клітинами кісткового мозку на відновлення рухової функції задньої кінцівки щура після спінальної травми
Авторы: Цимбалюк В.І.(1), Медведєв В.В.(2), Рибачук О.А.(3, 5), Козявкін В.І.(4), Драгунцова Н.Г.(1)
(1) — ДУ «Інститут нейрохірургії ім. акад. А.П. Ромоданова НАМН України», м. Київ, Україна
(2) — Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
(3) — ДУ «Інститут генетичної та регенеративної медицини НАМН України», м. Київ, Україна
(4) — Міжнародна клініка відновного лікування, м. Трускавець, Україна
(5) — Інститут фізіології імені О.О. Богомольця НАН України, м. Київ, Україна
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
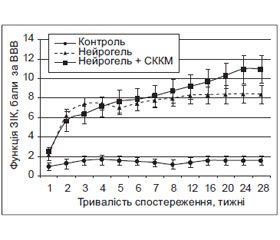
Мета — дослідити вплив імплантації NeuroGelTM в асоціації зі стовбуровими клітинами кісткового мозку (СККМ) на відновлення рухової функції задніх кінцівок щура після експериментальної травми спинного мозку. Матеріали та методи. Тварини — білі безпородні щури-самці (5 міс., 250 г); групи: 1-ша — травма спинного мозку (n = 16); 2-га — травма спинного мозку + гомотопічна імплантація фрагмента NeuroGelTM (n = 20); 3-тя — травма спинного мозку + гомотопічна імплантація фрагмента NeuroGelTM, асоційованого з ксеногенними СККМ миші (n = 16). Модель травми — лівобічний перетин половини спинного мозку на рівні Т11; термін спостереження — 28 тиж., оцінка показника функції задньої іпсилатеральної кінцівки (ПФ ЗІК) — за шкалою Basso — Beattie — Bresnahan. Результати. Ксенотрансплантація СККМ у комплексі з NeuroGelTM подовжує в часі, однак зменшує інтенсивність приросту ПФ ЗІК у гострому та ранньому періодах травматичного процесу, пролонгує фазу значимого збільшення ПФ ЗІК до 6-го місяця включно. У групі 1 значуще (р < 0,05) збільшення ПФ ЗІК спостерігали лише протягом 3–4-го тижня, у групі 2 — протягом 1–2-го та 5–6-го тижня експерименту, у групі 3 — протягом 1–2-го, 4–5-го та 8–24-го тижня. Станом на 28-й тиждень ПФ ЗІК у групі 1 становив 1,6 ± 0,5 бала, у групі 2 — 8,4 ± 0,9 бала, у групі 3 — 11,0 ± 1,5 бала за шкалою Basso — Beattie — Bresnahan. Значущу різницю ПФ ЗІК між групами 2 та 1 відмічали протягом 2–28-го тижня (р < 0,001), між групами 3 та 1 — протягом 1–28-го тижня (р ≤ 0,02). Максимальну різницю ПФ ЗІК між групами 3 та 2 на користь першої відмічали на 24-му тижні (р = 0,055). Висновок. Ксенотрансплантація СККМ змінює динаміку відновлення рухової функції паретичної кінцівки за умови імплантації NeuroGelTM, обумовлює тенденцію до потенціювання позитивного впливу матриксу на перебіг спінальної травми.
Цель — изучить влияние имплантации NeuroGelTM в ассоциации со стволовыми клетками костного мозга (СККМ) на восстановление двигательной функции задних конечностей крысы после экспериментальной травмы спинного мозга. Материалы и методы. Животные — белые беспородные крысы-самцы (5 мес., 250 г); группы: 1-я — травма спинного мозга (n = 16); 2-я — травма спинного мозга + гомотопическая имплантация фрагмента NeuroGelTM (n = 20); 3 — травма спинного мозга + гомотопическая имплантация фрагмента NeuroGelTM, ассоциированного с СККМ мыши (n = 16). Модель травмы — левостороннее пересечение половины спинного мозга на уровне Т11; длительность наблюдения — 28 нед., оценка показателя функции задней ипсилатеральной конечности (ПФ ЗИК) — по шкале Basso — Beattie — Bresnahan. Результаты. Ксенотрансплантация СККМ в комплексе с NeuroGelTM удлиняет во времени, но уменьшает интенсивность прироста ПФ ЗИК в остром и раннем периодах травматического процесса, пролонгирует фазу значимого роста двигательной функции до 6-го месяца включительно. В группе 1 достоверное (р < 0,05) увеличение ПФ ЗИК наблюдали лишь в течение 3–4-й недели, в группе 2 — в течение 1–2-й и 5–6-й недель, в группе 3 — в течение 1–2-й, 4–5-й и 8–24-й недель. По состоянию на 28-ю неделю ПФ ЗИК в группе 1 составил 1,6 ± 0,5 балла, в группе 2 — 8,4 ± 0,9 балла, в группе 3 — 11,0 ± 1,5 балла по шкале Basso — Beattie — Bresnahan. Достоверную разницу ПФ ЗИК между группами 2 и 1 отмечали в течение 2–28-й недель (р < 0,001), между группами 3 и 1 — в течение 1–28-й недель (р ≤ 0,02). Максимальную разницу ПФ ЗИК групп 3 и 2 в пользу первой отмечали на 24-й неделе (р = 0,055). Вывод. Ксенотрансплантация СККМ в комплексе с NeuroGelTM в целом изменяет динамику восстановления двигательной функции паретической конечности, обусловливает тенденцию к потенцированию положительного влияния матрикса на течение спинальной травмы.
Objective. To examine NeuroGelTM with bone marrow stem cells (BMSC) implantation on rat’s hind limb motor function recovery after experimental spinal cord injury. Materials and methods. Animals: outbred albino male rats (5.5 months, 250 g); experimental groups: 1st — spinal cord injury only (n = 16); 2nd — spinal cord injury + immediate homotopical transplantation of NeuroGelTM (n = 20); 3rd — spinal cord injury + analogous transplantation of NeuroGelTM in association with adult mouse BMSC (n = 16). Model of injury: left-side spinal cord hemisection at Т11; the ipsilateral hindlimb function indicator (IHL FI) was detected using the Вasso — Вeattie — Вresnahan scale (BBB). Results. Xenotransplantation of the BMSC together with NeuroGelTM extends the period, but reduces the intensity of IHL FI growth in the acute and early period of traumatic process, prolongs a phase of significant IHL FI growth to the 6th month inclusive. In group 1 significant (p < 0.05) increase of IHL FI was observed during 3rd — 4th week only, in group 2 — during 1st — 2nd and 5th — 6th week, in group 3 — during 1st — 2nd, 4th — 5th and 8th — 24th week. At the 28th week in group 1 IHL FI was 1.6 ± 0.5 points, in group 2 — 8.4 ± 0.9 points, in group 3 — 11.0 ± 1.5 points by ВВВ scale. Significant difference in IHL FI between groups 2 and 1 was being registered for 2nd — 28th weeks (р < 0.001), between groups 3 and 1 — during 1st — 28th week (р ≤ 0.02). The maximal difference between groups 2 and 3 in favor of the first one was noted on the 24th week (р = 0.055). Conclusion. BMSC-xenotransplantation in association with NeuroGelTM changes the dynamics of the paretic limb function recovery, it provides a tendency towards intensification of the NeuroGelTM positive impact on the course of the spinal cord injury.
травма спинного мозку; відновне лікування; тканинна нейроінженерія; штучний тканинний матрикс; стовбурові клітини кісткового мозку
травма спинного мозга; восстановительное лечение; тканевая нейроинженерия; искусственный тканевый матрикс; стволовые клетки костного мозга
spinal cord injury; recovery treatment; tissue neuroengineering; artificial tissue scaffold; bone marrow stem cells
Статтю опубліковано на с. 13-19
Вступ
Матеріали та методи
Результати та їх обговорення
Висновки
1. Hydrogels and cell based therapies in spinal cord injury regeneration [Text] / R.C. Assunção-Silva et al. // Stem Cells International. — 2015. — Vol. 2015, Article 948040. — P. 1-24.
2. Siebert J.R. Biomaterial approaches to enhancing neurorestoration after spinal cord injury: strategies for overcoming inherent biological obstacles [Text] / J.R. Siebert, A.M. Eade, D.J. Osterhout // BioMed Res. Int. — 2015. — Vol. 2015, Article 752572. — P. 1-20.
3. Tsintou M. Advances in regenerative therapies for spinal cord injury: a biomaterials approach [Text] / M. Tsintou, K. Dalamagkas, A.M. Seifalian // Neural. Regen. Res. — 2015. — Vol. 10, № 5. — P. 726-742.
4. Using extracellular matrix for regenerative medicine in the spinal cord [Text] / Volpato F.Z. et al. // Biomaterials. — 2013. — Vol. 34, № 21. — P. 4945-4955.
5. Gait speed using powered robotic exoskeletons after spinal cord injury: a systematic review and correlational study / D.R. Louie, J.J. Eng, T. Lam, SCIRE Research Team // J. Neuroeng. Rehabil. — 2015. — Vol. 12, Article 82. — P. 1-10.
6. Control of an ambulatory exoskeleton with a brain-machine interface for spinal cord injury gait rehabilitation / E. López-Larraz et al. // Front. Neurosci. — 2016. — Vol. 10, Article 359. — P. 1-15.
7. Miller L.E. Clinical effectiveness and safety of powered exoskeleton-assisted walking in patients with spinal cord injury: systematic review with metaanalysis / L.E. Miller, A.K. Zimmermann, W.G. Herbert // Med. Devices (Auckl). — 2016. — Vol. 9. — P. 455-466.
8. Changes in locomotor muscle activity after treadmill training in subjects with incomplete spinal cord injury [Text] / M.A. Gorassini et al. // J. Neurophysiol. — 2009. — Vol. 101, № 2. — P. 969-979.
9. Nogo-A antibodies and training reduce muscle spasms in spinal cord-injured rats [Text] / R.R. Gonzenbach et. al. // Ann. Neurol. — 2010. — Vol. 68, № 1. — P. 48-57.
10. Fouad K. Rehabilitative training and plasticity following spinal cord injury [Text] / K. Fouad, W. Tetzlaff // Exp. Neurol. — 2012. — Vol. 235. — P. 91-99.
11. Knikou M. Neural control of locomotion and training-induced plasticity after spinal and cerebral lesions [Text] / M. Knikou // Clin. Neurophysiol. — 2010. — Vol. 121, № 10. — P. 1655-1668.
12. Recovery of neuronal and network excitability after spinal cord injury and implications for spasticity [Text] / J.M. D’Amico et al. // Front. Int. Neurosci. — 2014. — Vol. 8, Article 36. — P. 1-24.
13. Цимбалюк В.І. Реконструктивно-відновна хірургія спинного мозку [Текст] / В.І. Цимбалюк, Ю.Я. Ямінський. — К.: Авіцена, 2009. — 248 с.
14. Цымбалюк В.И. Нейрогенные стволовые клетки [Текст] / В.И. Цымбалюк, В.В. Медведев. — К.: Коваль, 2005. — 596 с.
15. Neurorehabilitation with neural transplantation [Text] / M. Döbrössy, et al. // Neurorehabil. Neural. Repair. — 2010. — Vol. 24, № 8. — P. 692-701.
16. Spinal cord reconstruction using NeuroGel implants and functional recovery after chronic injury [Text] / S. Woerly et al. // J. Neurosci. Res. — 2001. — Vol. 66, № 6. — Р. 1187-1197.
17. Reconstruction of the transected cat spinal cord following NeuroGel implantation: axonal tracing, immunohistochemical and ultrastructural studies [Text] / S. Woerly et al. // Int. J. Dev. Neurosci. — 2001. — Vol. 19, № 1. — Р. 63-83.
18. Spinal cord repair with PHPMA hydrogel containing RGD peptides (NeuroGel) [Text] / S. Woerly et al. // Biomaterials. — 2001. — Vol. 22, № 10. — Р. 1095-1111.
19. Цымбалюк В.И. Спинной мозг. Элегия надежды: монография [Текст] / В.И. Цымбалюк, В.В. Медведев. — Винница: Нова Книга, 2010. — 944 с.
20. Kaneko A.A. 3D nanofibrous hydrogel and collagen sponge scaffold promotes locomotor functional recovery, spinal repair, and neuronal regeneration after complete transection of the spinal cord in adult rats [Text] / A. Kaneko, A. Matsushita, Y. Sankai // Biomed Mater. — 2015. — Vol. 10, № 1. — ID: 015008, doi: 10.1088/1748-6041/10/1/015008.
21. Multichannel silk protein/laminin grafts for spinal cord injury repair [Text] / Q. Zhang et al. // J. Biomed. Mater. Res. A. — 2016, Jul. 30 [Epub ahead of print]. — doi: 10.1002/jbm.a.35851.
22. Neurotrophin‑3 gradients established by lentiviral gene delivery promote short-distance axonal bridging beyond cellular grafts in the injured spinal cord [Text] / L. Taylor, L. Jones, M.H. Tuszynski, A. Blesch // J. Neurosci. — 2006. — Vol. 26, № 38. — P. 9713-9721.
23. Vector-induced NT‑3 expression in rats promotes collateral growth of injured corticospinal tract axons far rostral to a spinal cord injury [Text] / N. Weishaupt et al. // Neuroscience. — 2014. — Vol. 272. — P. 65-75.
24. Exogenous neuritin promotes nerve regeneration after acute spinal cord injury in rats [Text] / R. Gao et al. // Hum. Gene Ther. — 2016. — Vol. 27, № 7. — P. 544-554.
25. Sustained release of Neurotrophin‑3 via calcium phosphate-coated sutures promotes axonal regeneration after spinal cord injury [Text] / A. Hanna et al. // J. Neurosci. Res. — 2016. — Vol. 94, № 7. — P. 645-652.
26. Human iPS cell-derived astrocyte transplants preserve respiratory function after spinal cord injury [Text] / K. Li et al. // Exp. Neurol. — 2015. — Vol. 271. — P. 479-492.
27. Respiratory outcomes after mid-cervical transplantation of embryonic medullary cells in rats with cervicalspinal cord injury [Text] / B.J. Dougherty et al. // Exp. Neurol. — 2016. — Vol. 278. — P. 22-26.
28. Functional recovery after cervical spinal cord injury: role of neurotrophin and glutamatergic signaling in phrenic motoneurons [Text] / L.C. Gill, H.M. Gransee, G.C. Sieck, C.B. Mantilla // Respir. Physiol. Neurobiol. — 2016. — Vol. 226. — P. 128-136.
29. Ex-vivo expanded human blood-derived CD133+ cells promote repair of injured spinal cord [Text] / N. Kamei et al. // J. Neurol. Sci. — 2013. — Vol. 328, № 1–2. — P. 41-50.
30. Safety and neurological assessments after autologous transplantation of bone marrow mesenchymal stem cells in subjects with chronic spinal cord injury [Text] / Mendonça M.V.P. et al. // Stem Cell Res. Ther. — 2014. — Vol. 5, Art. 126. — P. 1-11.
31. Transplantation of human amniotic mesenchymal stem cells promotes functional recovery in a rat model of traumatic spinal cord injury [Text] / H.-L. Zhou et al. // Neurochem. Res. — 2016, Jun 28 [Epub ahead of print]. — doi: 10.1007/s11064-016-1987-9.
32. Oliveri R.S. Mesenchymal stem cells improve locomotor recovery in traumatic spinal cord injury: Systematic review with meta-analyses of rat models [Text] / R.S. Oliveri, S. Bello, F. Biering-Sørensen // Neurobiol. Dis. — 2014. — Vol. 62. — P. 338-353.
33. Dennie D. Migration of bone marrow progenitor cells in the adult brain of rats and rabbits [Text] / D. Dennie, J. — P. Louboutin, D.S. Strayer // World J. Stem Cells. — 2016. — Vol. 8, № 4. — P. 136-157.
34. Huang B. Fate determination in mesenchymal stem cells: a perspective from histone-modifying enzymes [Text] / B. Huang, G. Li, X.H. Jiang // Stem Cell Res. Ther. — 2015. — Vol. 6, Article 35. — P. 1-9.
35. Mesenchymal stem cells overexpressing Akt dramatically repair infarcted myocardium and improve cardiac function despite infrequent cellular fusion or differentiation [Text] / N. Noiseux et al. // Mol. Ther. — 2006. — Vol. 14, № 6. — P. 840-850.
36. Xin H. Exosomes/miRNAs as mediating cell-based therapy of stroke [Text] / H. Xin, Y. Li, M. Chopp // Front. Cell. Neurosci. — 2014. — Vol. 8, Article 377. — P. 1-11.
37. Karantalis V. Use of mesenchymal stem cells for therapy of cardiac disease [Text] / V. Karantalis, J.M. Hare // Circ. Res. — 2015. — Vol. 116, № 8. — P. 1413-1430.
38. Bone marrow mesenchymal stromal cells and olfactory ensheathing cells transplantation after spinal cord injury — a morphological and functional comparison in rats [Text] / A. Torres-Espіn, E. Redondo-Castro, J. Hernandez, X. Navarro // Eur. J. Neurosci. — 2014. — Vol. 39. — P. 1704-1717.
39. Prevention of gliotic scar formation by NeuroGel allows partial endogenous repair of transected cat spinal cord [Text] / S. Woerly et al. // J. Neurosci. Res. — 2004. — Vol. 75, № 2. — P. 262-272.
40. Expression of heat shock protein (HSP)-25 and HSP‑32 in the rat spinal cord reconstructed with Neurogel [Text] / S. Woerly et al. // Neurochem. Res. — 2005. — Vol. 30, № 6–7. — P. 721-735.
41. Модель пересічення половини поперечника спинного мозку. І. Технічні, патоморфологічні та клініко-експериментальні особливості [Текст] / В.І. Цимбалюк та ін. // Укр. нейрохірург. журнал. — 2016. — № 2. — С. 18-27.
42. Basso D.M. A sensitive and reliable locomotor rating scale for open field testing in rats [Text] / D.M. Basso, M.S. Beattie, J.C. Bresnahan // J. Neurotrauma. — 1995. — Vol. 12, № 1. — P. 1-21.
43. Early inflammatory responses following cell grafting in the CNS trigger activation of the subventricular zone: a proposed model of sequential cellular events [Text] / J. Praet et al. // Cell Transplant. — 2015. — Vol. 24, № 8. — P. 1481-1492.
44. Immunosuppression of allogenic mesenchymal stem cells transplantation after spinal cord injury improves graft survival and beneficial outcomes [Text] / A. Torres-Espin, E. Redondo-Castro, J. Hernandez, X. Navarro // J. Neurotrauma. — 2015. — Vol. 32. — P. 367-380.
45. Immune remodelling of stromal cell grafts in the central nervous system: therapeutic inflammation or (harmless) side-effect? [Text] / D. Le Blon et al. // J. Tissue Eng. Regen. Med. — 2016 [Epub ahead of print].
46. Concise review: spinal cord injuries — how could adult mesenchymal and neural crest stem cells take up the challenge? [Text] / V. Neirinckx et al. // Stem Cells. — 2014. — Vol. 32, № 4. — P. 829-843.

/16.jpg)