Статья опубликована на с. 29-38
Боли в спине являются второй по частоте причиной обращения за медицинской помощью после респираторных заболеваний. Одной из наиболее частых причин острого вертеброгенного болевого синдрома является остеохондроз, к развитию и прогрессированию которого приводят врожденные костные аномалии, избыточные физические нагрузки и другие причины, способствующие изнашиванию хрящевой ткани [1, 2].
Распространенность вертеброгенных болезней в популяции, по данным различных авторов, составляет от 40 до 80 %, со стойкой тенденцией к росту. В большинстве регионов до 14,7 % работающего населения ежегодно оказываются временно нетрудоспособными из-за данной патологии, что определяет актуальность проблемы и необходимость поиска способов ее решения [3–5].
В соответствии с МКБ‑10 все формы патологии позвоночника обозначаются как дорсопатии (М40–М54) — группа заболеваний костно-мышечной системы и соединительной ткани, в клинике которых ведущим является болевой и/или функциональный синдром в области туловища и конечностей невисцеральной этиологии [3–7].
Согласно МКБ‑10, дорсопатии подразделяются на следующие группы: 1) дорсопатии, вызванные деформацией позвоночника, дегенерациями межпозвоночных дисков (МПД) без их протрузии, спондилолистезами; 2) спондилопатии; 3) дорсалгии.
Для постановки диагноза дорсопатии необходимо учитывать следующие диагностические критерии [7]: 1) вертеброгенный болевой синдром; 2) чувствительные, двигательные нарушения в зоне иннервации пораженного корешка; 3) наличие относительно глубоких биомеханических расстройств компенсации двигательного акта; 4) данные электронейрофизиологического исследования, которые регистрируют нарушения проводимости по корешку, результаты игольчатой электромиографии, позволяющие установить денервационные изменения в мышцах пораженного миотома; 5) соответствующие данные компьютерной томографии (КТ), магнитно-резонансной томографии (МРТ) или рентгенологического исследования позвоночника.
Дорсалгия — болевой синдром в различных отделах спины и конечностей невисцеральной этиологии вследствие рефлекторных и/или компрессионных осложнений, дистрофических и функциональных изменений позвоночника, проксимальных суставов, а также миофасциального синдрома или фибромиалгии [3, 4]. Выделяют первичные и вторичные дорсалгии.
Первичная дорсалгия — болевой синдром в спине, обусловленный дистрофическими и функциональными изменениями в тканях позвоночно-двигательных сегментов (ПДС) (дугоотростчатых суставах позвонков, МПД, фасциях, мышцах, сухожилиях, связках) с возможным вовлечением смежных структур [3, 4].
Вторичная дорсалгия может быть связана с врожденными аномалиями, травмами позвоночника, опухолевыми и инфекционными процессами, остеопорозом, заболеваниями внутренних органов. Существуют так называемые симптомы опасности, обычно указывающие на вторичный (симптоматический) характер дорсалгии: 1) впервые возникшие и быстро нарастающие боли; 2) значительная интенсивность боли; 3) независимость интенсивности боли от положения тела и движений; 4) усиление боли ночью; 5) лихорадка и/или резкое похудение; 6) недавняя травма, возникновение болей в связи с травмой; 7) очаговые неврологические нарушения, которые выходят за рамки типичной радикулопатии; 8) признаки злокачественного новообразования, онкологическое заболевание в анамнезе; 9) общая слабость; 10) дебют острого болевого синдрома в возрасте моложе 20 или старше 55 лет [3, 4].
Выделяют следующие патофизиологические механизмы развития вертеброгенных болевых синдромов [8, 9]:
1. Периферическая сенситизация болевых рецепторов, связанная с их травмой или другим патологическим воздействием. При остеохондрозе эти рецепторы находятся в фиброзном кольце межпозвоночного диска, задней продольной связке, дугоотростчатых и фасеточных суставах, спинальных корешках и в паравертебральных мышцах. Сенситизация указанных рецепторов происходит при травматизации мышечно-скелетных тканей спины, вызывающей выделение провоспалительных и алгогенных веществ (простагландины, брадикинин), включающих механизмы периферической сенситизации.
2. Повреждение нервных структур (нерва, корешка, межпозвоночного ганглия) при различных патологических процессах (травма, воспаление, сосудистая недостаточность), в результате которого развивается невропатическая боль.
3. Центральная сенситизация, которая на первых этапах является защитным механизмом, а при длительно существующей боли способствует ее усилению.
В современной клинической практике выделяют две основные группы синдромов — компрессионные и рефлекторные [1, 2, 10–12].
Компрессионные вертеброгенные синдромы связаны со сдавлением корешков (радикулопатией) и характеризуются следующими особенностями [2, 9, 10]: 1) локализацией боли в позвоночнике, иррадиацией в конечность, вплоть до пальцев кисти или стопы; 2) усилением боли при движениях в позвоночнике, кашле, чихании, натуживании; 3) регионарными вегетативно-сосудистыми расстройствами, часто зависящими от положения тела; 4) симптомами выпадения функции компрессированных корешков — нарушением чувствительности, гипотрофией мышц, снижением сухожильных рефлексов.
Рефлекторные вертеброгенные синдромы обусловлены раздражением рецепторов, заложенных в тканях позвоночника, создающих мощный поток афферентации, который приводит к возникновению зон гипертонуса и трофических изменений в мышечной ткани, и характеризуются [1, 2, 9, 10]: 1) локальными тупыми болями без иррадиации; 2) усилением болевых ощущений при глубокой пальпации мышцы, ее растяжении или нагрузке на спазмированную мышцу; 3) отсутствием симптомов выпадения.
Выделение этих синдромов имеет существенное значение для выбора терапевтической тактики и определения прогноза заболевания [9, 10].
Основными задачами лечения пациентов с острыми вертеброгенными болевыми синдромами являются максимально быстрое и полное купирование болей, безопасность проводимой терапии и обеспечение условий для проведения полноценного курса реабилитационных мероприятий [6–12].
Наиболее распространенным методом лечения пациентов с вертеброгенными болевыми синдромами является применение нестероидных противовоспалительных препаратов (НПВП), эффективность которых подтверждена многочисленными клиническими исследованиями [7–15].
Когда речь заходит о безопасности в рамках проводимой с помощью НПВП терапии, стало привычным говорить о возможном токсическом влиянии веществ данного класса на органы системы пищеварения. В действительности за счет подавления образования защитных простагландинов слизистой ЖКТ возрастает риск язвообразования и/или даже желудочных кровотечений. Особенно выраженным гастротоксическим действием обладают НПВП с высоким уровнем селективности к изоформе фермента ЦОГ‑1: кеторолак, индометацин, аспирин. В то же время ввиду распространенности сердечно-сосудистых заболеваний (ССЗ) среди пациентов с вертеброгенным болевым синдромом (по некоторым источникам, эта цифра составляет до 71 %) весьма остро стоит вопрос кардиоваскулярной безопасности. С этой точки зрения есть смысл рассмотреть два фактора: международный клинический опыт, а также данные, полученные посредством проведенного исследования.
По оценкам ВОЗ, в 2012 году от ССЗ умерло 17,5 миллиона человек, что составило 31 % всех случаев смерти в мире. Из этого числа 7,4 миллиона человек умерли от ишемической болезни сердца и 6,7 миллиона человек — в результате инсульта.
Согласно метаанализу, в который вошло около 30 клинических исследований с общей численностью участников 2,7 млн человек, Напроксен был признан наиболее безопасным НПВП для сердечно-сосудистой системы.
С учетом вышеперечисленных особенностей и требований к препарату при лечении пациентов с болевым синдромом вертеброгенного происхождения актуальной является оценка терапевтической эффективности и переносимости препарата Налгезин форте, действующим веществом которого является напроксен.
Цель исследования: оценить эффективность и переносимость препарата Налгезин форте, таблетки, производства компании KRKA у пациентов с вертеброгенными болевыми синдромами.
Задачи исследования:
— изучить терапевтическую эффективность препарата Налгезин форте, его влияние на выраженность болевого синдрома у пациентов с вертеброгенными болевыми синдромами;
— изучить переносимость и возможные побочные эффекты исследуемого препарата.
Материалы и методы исследования
Клиническое исследование проводилось как рандомизированное, открытое, в соответствии с требованиями, предъявляемыми Государственным экспертным центром МЗ Украины к клиническим испытаниям.
Для проведения исследования было отобрано 30 пациентов обоих полов в возрасте от 20 до 60 лет с вертеброгенными болевыми синдромами, которые находились на стационарном или амбулаторном лечении в клинике Института неврологии, психиатрии и наркологии НАМН Украины.
Среди обследованных было 18 женщин (60 %) и 12 мужчин (40 %). Большинство относились к возрастной группе 35–55 лет, средний возраст больных составлял 43,8 ± 4,2 года.
Все пациенты получали исследуемый препарат Налгезин форте, таблетки, производства компании KRKA по 1 таблетке 2 раза в сутки. Курс применения лекарственного средства составлял 7, 14 или 21 день, в зависимости от редукции болевого синдрома.
Исследуемый препарат пациенты получали на втором визите. Препарат выдавался пациентам в количестве, необходимом для приема лекарственного средства от одного визита до следующего.
Пациенты получали сопутствующую терапию, включающую гипотензивные препараты, физиотерапию (массаж). В процессе исследования не разрешалось назначение других НПВП, анальгетиков, прегабалина, габапентина.
При наличии сопутствующих заболеваний пациенты продолжали получать постоянно используемые для лечения препараты.
В ходе клинического исследования каждый пациент проходил обследование в соответствии с приведенной схемой (табл. 1).
Согласно протоколу исследования оценка терапевтической эффективности и переносимости исследуемого препарата проводилась с использованием следующих методов.
Общеклинические методы:
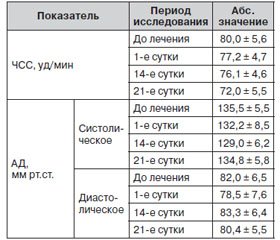
— объективный осмотр пациента (измерение ЧСС, АД, аускультация сердца и легких, пальпация и перкуссия живота, осмотр кожи и слизистых);
— регистрация субъективных жалоб пациента;
— неврологический осмотр.
Контроль эффективности терапии осуществляли на основании анализа динамики неврологического статуса, а также выраженности болевого синдрома с использованием показателя интенсивности боли на 7, 14 и 21-й дни исследования.
Психодиагностическое обследование включало оценку болевого синдрома по ВАШ и Мак-Гилловскому болевому вопроснику, оценку по шкале качества жизни (КЖ), шкале общего клинического впечатления.
Визуальная аналоговая шкала (ВАШ) предназначена для определения субъективного ощущения пациентом боли в момент исследования. Она представляет собой горизонтальную линию, под левым краем которой написано «нет боли», а под правым — «худшая возможная боль». Больной должен поставить вертикальную линию поперек указанной горизонтальной в том месте, которое более всего соответствует интенсивности боли.
Вопросник боли Мак-Гилла (McGill Pain Questionnaire, MPQ) и его краткая форма определяют сенсорные, аффективно-эмоциональные и другие аспекты болевого состояния пациента. Вопросник состоит из 11 сенсорных и четырех аффективных вербальных характеристик. Пациента просят оценить каждую из характеристик по шкале от 0 до 3. Высчитываются три параметра боли: сенсорный, аффективный и общий компоненты.
Шкала качества жизни используется для оценки КЖ, связанного со здоровьем. Его рассматривают как интегральную характеристику, на которую следует ориентироваться при оценке эффективности помощи. Пациентам предлагалось оценить 10 параметров по 10-балльной шкале, от 1 балла (плохо) до 10 баллов (очень хорошо). Оценивались такие показатели: физическое благополучие; психологическое, эмоциональное благополучие; самообслуживание и независимость в действиях; дееспособность; межличностное взаимодействие; социально-эмоциональная поддержка; гражданская и служебная поддержка; личностная реализация; духовная реализация; общее восприятие КЖ.
Шкала общего клинического впечатления (Clinical Global Impression Scale — CGI) состоит из 3 субшкал, отражающих оценку тяжести состояния, общую степень его улучшения по 7-балльной системе, и субшкалы индекса эффективности, который рассчитывается по совокупности одной из четырех степеней терапевтического эффекта (заметный, умеренный, минимальный, без изменений) и степени выраженности побочного эффекта препарата (отсутствует, незначительный, значительный, нивелирующий терапевтический эффект). Шкалу CGI используют после клинической оценки состояния больного по другим шкалам (сравнивают результаты оценки перед началом лечения и после завершения этапа или всего курса лечения).
Инструментальные методы исследования:
— рентгенография позвоночника;
— магнитно-резонансная томография.
Клинико-лабораторные методы:
— общий анализ крови (эритроциты, гемоглобин, цветной показатель, лейкоциты, СОЭ);
— общий анализ мочи (цвет, реакция, удельный вес, белок, сахар, цилиндры, лейкоциты, эритроциты);
— биохимический анализ крови (общий белок, билирубин, АЛТ, ACT, глюкоза, креатинин, печеночные пробы).
Заключительную оценку эффективности изучаемого препарата проводили по следующей шкале (табл. 2).
Переносимость препарата Налгезин форте оценивали на основании субъективных жалоб пациента и объективных данных, полученных в процессе лечения. Обобщенная оценка показателей переносимости проводилась по следующей шкале (табл. 3).
Статистическая обработка полученных данных проводилась с использованием методов параметрической статистики. Рассчитывались средние значения показателей и их стандартная ошибка. Достоверность различий между средними определяли по критерию Стьюдента. Вероятность полученных результатов оценивали на уровне значимости не менее 95 % (р < 0,05).
Результаты и их обсуждение
При первичном исследовании вертеброневрологического статуса наиболее часто встречались болевые рефлекторные синдромы поясничного уровня (люмбалгия, люмбоишиалгия) — у 18 пациентов (60 %); болевые синдромы шейно-воротниковой области (цервикалгия, цервикокраниалгия, цервикобрахиалгия) — у 7 пациентов (23,3 %), заднебоковой поверхности грудной клетки (торакалгия) — у 5 пациентов (16,7 %). Острое течение заболевания отмечалось у 6 пациентов (20 %), хроническое — у 24 (80 %). Признаки поражения периферической нервной системы (вертеброгенная радикулопатия) обнаружены у 6 пациентов (20 %), а именно вертеброгенные поражения корешков С6, С7, L5 и S1.
У всех больных рентгенологически был выявлен остеохондроз шейного, грудного или поясничного отдела позвоночника, при МРТ определялись протрузии дисков С6-С7, L5-S1.
Наиболее распространенными жалобами, помимо вертеброгенных, у больных были: головные боли, чувство тяжести, шум в голове, головокружение, шаткость (преимущественно позиционные), снижение внимания, работоспособности, изменения настроения, повышенная раздражительность, утомляемость. Ухудшение общего самочувствия сопровождалось ухудшением сна: трудности засыпания, беспокойный сон с частыми пробуждениями, ранним и окончательным пробуждением, отсутствием ощущения отдыха после сна.
При объективном неврологическом исследовании у всех больных отмечалась диффузная органическая симптоматика. Превалировали глазодвигательные нарушения: слабость конвергенции, ограничение взора вверх, недостаточность отводящих нервов. У больных выявлялись асимметрия лицевой мускулатуры, нистагм при крайних отведениях, нарушения статики и координации, чувствительные нарушения, анизорефлексия. Выявлялась группа симптомов: снижение корнеальных рефлексов, отечность языка с отпечатками зубов, болезненность глазных яблок при надавливании, которые расценивались как косвенные признаки ликворной гипертензии (как правило, у больных с болевыми синдромами шейно-воротниковой области).
Анализ субъективной и объективной неврологической симптоматики позволил выделить ведущие клинические синдромы.
Цефалгический синдром встречался у 23 пациентов (76,6 %). Он характеризовался выраженностью, монотонностью и однообразием головной боли, чаще затылочной локализации, иногда только в одной половине головы или без четкой локализации.
Вестибулоатактический синдром отмечался у 18 пациентов (60 %), характеризовался головокружениями, шаткостью при ходьбе, усиливающейся при взгляде на движущиеся предметы и изменении положения тела, сопровождался нарушениями статики и координации, легкой атаксией в пробе Ромберга.
Ликворно-гипертензионный синдром встречался у 9 больных (30 %). Он характеризовался головными болями распирающего характера, с чувством давления на глазные яблоки, тошнотой.
Астенический синдром отмечался у 27 больных (90 %) и был представлен в основном как выраженный компонент физической и психической утомляемости.
Сопутствующие заболевания наблюдались у 23 пациентов (76,6 %). Наиболее часто встречались гипертоническая болезнь — у 14 пациентов (46,6 %), вегетососудистая дистония — у 9 пациентов (30 %), хронический холецистопанкреатит (стадия ремиссии) отмечался у 3 пациентов (10 %), хронический гастрит (стадия устойчивой ремиссии) — у 1 пациента (3,3 %).
Длительность терапии препаратом Налгезин форте составляла 7, 14 или 21 день в зависимости от степени редукции болевого синдрома. Полная редукция болевого синдрома была основанием для прекращения лечения.
В результате из 30 обследованных пациентов 4 больных (13,4 %) прошли курс лечения длительностью 7 дней, 12 больных (40 %) — длительностью 14 дней, 14 больных (46,6 %) — 21 день. Полная редукция болевого синдрома отмечалась у 18 больных (60 %), значительное улучшение отмечали 10 больных (33,4 %), незначительное улучшение отметили 2 больных (6,6 %) (согласно вербальной оценке). Зависимость длительности курса лечения и степени редукции болевого синдрома от характера рефлекторного синдрома представлена в табл. 4.
Таким образом, полная редукция болевого синдрома отмечалась у 18 больных (60 %), причем у большинства из них — 12 больных (40 %) это происходило к 14-му
дню лечения, у 4 больных (13,4 %) — к 7-му дню лечения, и только у 2 больных (6,6 %) — к 21-му дню лечения. Из 14 больных (46,7 %), которые прошли 21-дневный курс лечения, только у 2 больных (6,6 %) отмечалась полная редукция болевого синдрома, а у 10 (33,4 %) из них имело место значительное улучшение, сохранялась незначительная боль, которая была непостоянной в течение дня, появлялась при незначительных физических нагрузках, позиционно. Это были больные с длительным анамнезом вертеброгенных болевых синдромов (более 3 лет), преимущественно женщины (7 из 10 больных), и более выраженными изменениями при рентгенографии позвоночника и МРТ (выраженность остеохондроза, наличие протрузий дисков). У 2 больных (6,6 %) имело место незначительное улучшение, которое проявлялось в изменении характера боли: если до начала лечения пациенты описывали боль как постоянную, ноющую, периодически усиливающуюся, стреляющую, пронизывающую, то после лечения осталась только постоянная ноющая боль. Это были пациенты с люмбоишиалгией, которая носила хронический характер (длительность заболевания около 5 лет), при МРТ-исследовании имели место протрузии дисков.
Динамика субъективной неврологической симптоматики и выраженности ведущих неврологических синдромов у исследованных больных до и после лечения препаратом Налгезин форте представлена в табл. 5, 6.
На фоне проводимого лечения препаратом Налгезин форте отмечалось уменьшение выраженности таких симптомов, как головная боль, нарушение сна, раздражительность, снижение фона настроения. Уменьшилась выраженность цефалгического и астенического синдрома. Улучшилось общее самочувствие пациентов.
Оценка боли по Мак-Гилловскому болевому вопроснику
Вербальная характеристика боли выглядела следующим образом: из предложенных характеристик болевого синдрома по сенсорной шкале более половины пациентов (60 % (18 больных)) описывали испытываемую боль как ноющую. Четверть обследованных (23,3 % (7 больных)) представляли свои страдания в терминах «сводящая», «дергающая», «ломящая». Реже встречались другие определения боли: «подобна удару тока» — в 16,7 % случаев (5 больных). Аффективная шкала: более половины пациентов (66,7 % (20 больных)) при описании чувства, которое вызывает боль, использовали дескрипторы «изматывает», «обессиливает», «утомляет». 40 % обследованных (12 больных) для вербальной характеристики болевого синдрома выбрали определения «боль-помеха», «боль-мучение». И только 13,3 % пациентов (4 больных) отмечали дескрипторы «боль-пытка» и «приводит в отчаяние». Дескрипторы эвалюативной шкалы (термины оценки интенсивности боли пациентом) использовались со следующей частотой: более половины обследованных (63,3 % (19 больных)) характеризовали боль как сильную, а 20 % (6 больных) — как умеренную, 16,7 % (5 больных) — как сильнейшую.
Интересно отметить, что наиболее часто встречающимися характеристиками болевого синдрома являлись дескрипторы: по сенсорной шкале — «ноющая», по аффективной шкале — «изматывающая», «обессиливающая». Вместе с тем по эвалюативной шкале большинство пациентов оценивали интенсивность боли термином «сильная», т.е. имелось несоответствие между эмоциональным восприятием и степенью выраженности субъективной характеристики боли. Отмеченный диссонанс можно объяснить тем, что большинство пациентов имели хроническое течение заболевания, которое на момент обследования было в фазе обострения, а хроническая боль обрамляется множеством сопутствующих расстройств, таких как хроническая усталость, нарушения сна, ухудшение настроения.
После проведенного лечения определялась положительная динамика: снижение значений ранговых показателей по аффективной и эвалюативной шкале (р < 0,05). Однако сохранялось преобладание сенсорного компонента (сенсорно-аффективного).
Оценка по визуальной аналоговой шкале боли
При оценке по ВАШ 19 больных (63,3 %) ставили точку на отметке, которая соответствовала 6–8 см, 9 больных (30 %) — 8–10 см, и только 2 (6,7 %) — 4–5 см. После окончания курса лечения точку на отметке «боли нет» поставили 17 больных, на отметке от 2 до 3 см — 9 больных, от 3 до 4 см — 4 больных. Таким образом, полная редукция болевого синдрома по ВАШ отмечалась у 56,7 % больных, значительное его уменьшение — у 30 % больных, незначительное — у 13,3 % больных.
Оценка по шкале общего клинического впечатления
По шкале общего клинического впечатления тяжесть заболевания была квалифицирована как умеренно выраженное расстройство у 21 больного, как значительное расстройство — у 7 больных, как нерезко выраженное расстройство — у 2 больных. В ходе исследования под влиянием терапии у больных существенно уменьшался объем жалоб, отмечалась положительная количественная динамика показателей субъективной и объективной неврологической симптоматики. Высокой степени выраженности признака по завершении курса лечения не отметил никто из пациентов, в отдельных случаях признаки оценивались больными как «средней выраженности». Значительное улучшение отметили 60 % больных, умеренное улучшение — 33,3 % больных. Эффективность терапии представлена в табл. 7.
Оценка по шкале качества жизни
Все больные прошли тестирование с помощью вопросника КЖ для уточнения степени снижения качества жизни в результате заболевания, его изменения на фоне проводимой терапии. Результаты исследования приведены в табл. 8.
Таким образом, в результате проведенного лечения значительно улучшилось физическое благополучие, самообслуживание и независимость в действиях, трудоспособность, общее восприятие качества жизни. В меньшей степени проведенное лечение повлияло на психологическое и эмоциональное благополучие, личностную реализацию.
Оценка переносимости препарата Налгезин форте
Осмотр и опрос пациентов в ходе настоящего клинического исследования не выявил каких-либо жалоб, неожиданных побочных реакций, осложнений или явлений непереносимости препарата Налгезин форте.
Отсутствие побочных и токсических эффектов терапии препаратом Налгезин форте подтверждает данные объективных клинических и лабораторных исследований (табл. 9, 10).
Ни один из пациентов в обеих сравниваемых группах не предъявлял жалоб и не испытывал каких-либо неприятных ощущений, которые можно было бы связать с действием изучаемого препарата.
Назначение курсом до 21 дня исследуемого препарата не оказало какого-либо влияния на показатели морфологического состава периферической крови, на уровни ее основных биохимических констант и не отразилось на показателях клинического анализа мочи.
Представленные в табл. 10 результаты изучения показателей морфологического состава периферической крови, ее основных биохимических констант и показателей клинического анализа мочи в ходе клинического исследования свидетельствуют об отсутствии каких-либо нежелательных изменений со стороны системы крови и мочевыделения.
Незначительные колебания показателей по сравнению с исходным уровнем не имели закономерного характера, всегда были недостоверными и их можно интерпретировать как индивидуальные реакции крови и мочевыделительной системы в пределах физиологической нормы в процессе исследования.
Обобщенная оценка показателей переносимости препарата Налгезин форте в соответствии с протоколом клинического исследования характеризуется как хорошая у всех пациентов.
Выводы
1. Препарат Налгезин форте, таблетки, производства компании KRKА является высокоэффективным средством для лечения больных с вертеброгенными болевыми синдромами. Благодаря особой форме — натриевая соль напроксена — препарат Налгезин форте оказывает быстрый анальгезирующий эффект, который развивается уже с 15-й минуты после приема препарата.
2. Препарат Налгезин форте хорошо переносится пациентами и не вызывает побочных эффектов при назначении его по 1 таблетке 2 раза в сутки в течение 7–21 дня.
3. Выраженная противоболевая активность в сочетании с высокой скоростью наступления эффекта от приема Налгезина форте дополнительно оказывали положительное влияние на уровень физического благополучия, способствовали повышению трудоспособности и общего восприятия качества жизни пациентов.
Список литературы
1. Никифоров А.С. Неврологические осложнения остеохондроза позвоночника / А.С. Никифоров, Г.Н. Авакян, О.И. Мендель. — 2-е изд. — М.: ГЭОТАР-Медиа, 2015. — 272 с.
2. Турбина Л.Г. Дорсалгия /Л.Г. Турбина // Лечащий врач. — 2007. — № 5. — С. 12-16.
3. Садоха К.А., Паторская И.А. Первичные дорсалгии: актуальность и путь решения проблемы / К.А. Садоха, И.А. Паторская // Медицинские новости. — 2010. — № 11. — С. 113-117.
4. Бова А.А. Современные подходы к проблеме боли в нижней части спины / А.А. Бова // Мед. новости. — 2008. — № 1. — С. 36-40.
5. Крыжановский В.Л. Боль в спине: диагностика, лечение и реабилитация / В.Л. Крыжановский: пособие для врачей. — Мн.: ДД, 2004. — 28 с.
6. Кузнецов В.Ф. Справочник по вертеброневрологии: клиника, диагностика / В.Ф. Кузнецов. — Мн.: Беларусь, 2000. — 351 с.
7. Методики рентгенологического и радиологического исследования позвоночника и крупных суставов / Г.А. Зедгенидзе, П.Л. Жарков. — Ташкент: Медицина УзССР, 1979. — 207 с.
8. Никифоров А.С. Остеохондроз и спондилоартроз позвоночника как проявления единого дегенеративного процесса. Современные подходы к лечению / А.С. Никифоров, О.И. Мендель // РМЖ. — 2006. — № 23 (14). — С. 1708-1713.
9. Путилина М.В. Особенности диагностики и лечения дорсопатий в неврологической практике / М.В. Путилина // Сопsilium medicum. — 2006. — № 8 (8). — С. 44-48.
10. Кукушкин М.Л. Механизмы развития и принципы этиопатогенетической терапии хронической боли / М.Л. Кукушкин // Журнал неврологии и психиатрии им. С.С. Корсакова. — 2012. — № 2. — С. 89-94.
11. Подчуфарова Е.В., Яхно Н.Н. Боль в спине / Е.В. Подчуфарова, Н.Н. Яхно. — М.: ГЭОТАР-Медиа, 2013. — 372 с.
12. Патогенез, методи дослідження та лікування больових синдромів: Посібник / Є.Л. Мачерет, Г.М. Чуприна, О.Г. Морозова та ін. — Харків: Контраст, 2006. — 168 с.
13. Соловьева Э.Ю. Дорсопатия: совместное применение декскетопрофена и нимесулида в стадии обострения / Э.Ю. Соловьева, А.Н. Карнеев, А.И. Федин // Соnsilium medicum. — 2007. — № 2 (9). — С. 42-46.
14. Морозова О.Г. Острая боль в спине: подходы к терапии / О.Г. Морозова // Здоров’я України. — 2007. — № 6/1. — С. 22-23.
15. Козачок Н.Н., Селюк М.М., Бычкова С.А., Бычкова Н.Г. Нестероидные противовоспалительные препараты: кто лидирует в современной клинике? / Н.Н. Козачок, М.М. Селюк, С.А. Бычкова, Н.Г. Бычкова // Новости медицины и фармации. — 2008. — № 4 (235). — С. 3-6.
16. Колосова Т.В. Применение нестероидных противовоспалительных средств в неврологической практике / Т.В. Колосова // Новости медицины и фармации. — 2007. — № 215. — С. 5.
17. Клименко А.В., Головченко Ю.И., Калищук-Слободин Т.Н. Особенности ведения больных с хроническим вертеброгенным болевым синдромом пояснично-крестцовой локализации / А.В. Клименко, Ю.И. Головченко, Т.Н. Калищук-Слободин // Здоров’я України. — 2007. — № 2 (159). — С. 38-39.
18. Devereaux M.W. Low back pain // Prim. Care Clin. Office Pract. — 2004. — Vol. 31. — P. 33-51.
19. Depression and anxiety as major determinantsof neck pain: a cross-sectional study ingeneral practice / E. Blozik, D. Laptinskaya, C. Hermann-Lingen et al. // Musculoskeletal Disorders. — 2009. — № 10. — Р. 13.
20. Грачев Ю.В., Шмырев В.И. Вертебральная поясничная боль: полифакторное происхождение, симптоматология, принципы лечения / Ю.В. Грачев, В.И. Шмырев // Лечащий врач. — 2008. — № 5. — С. 6-10.
21. Van Middelkoop M., Rubinstein S., Kuijpers T. et al. A systematic review on the effectiveness ofphysical and rehabilitation interventions forchronic non-specific low back pain / M. Van Middelkoop, S. Rubinstein, T. Kuijpers et al. // European Spine Journal. — 2011. — № 20 (1). — Р. 19-39.
22. Bogduk N., McGuirk B. Medical management ofacute and chronic low back pain / N. Bogduk, B. McGuirk. — Amsterdam: Elsevier, 2002. — 224 p.
23. Haldeman S., Kopansky-Giles D., Hurwitz E. et al. Advancements in themanagement of spine disorders / S. Haldeman, D. Kopansky-Giles, E. Hurwitz et al. // Best Practice Res. Clinical Rheumatology. — 2012. — № 26. — P. 263-280.
24. Hill J., Whitehurst D., Lewis M., et al. Comparison of stratified primary care management for low back pain with current best practice (STarT Back): a randomised controlled trial. / J. Hill, D. Whitehurst, M. Lewis, et al. // Lancet. — 2011. — № 378. — P. 1560-1571.
/31.jpg)
/34_2.jpg)
/35.jpg)
/35_2.jpg)
/36.jpg)

/32.jpg)
/33.jpg)
/34.jpg)
/36_2.jpg)