Статья опубликована на с. 41-48
Введение
Сосудистые заболевания головного мозга — одна из главных причин смерти и инвалидизации населения в развитых странах. Согласно традиционным представлениям, дисциркуляторная энцефалопатия (ДЭ) относится к хроническим формам нарушений мозгового кровообращения. По современным представлениям, ДЭ — это синдром хронического прогрессирующего многоочагового или диффузного поражения головного мозга различной этиологии, проявляющийся разнообразными неврологическими, нейропсихологическими и психическими нарушениями, который развивается в результате повторных острых нарушений мозгового кровообращения и/или хронической недостаточности кровоснабжения головного мозга [1, 6, 15].
Патогенез ДЭ является сложным и многофакторным процессом. В его основе лежит ишемия мозга. Ишемия сопровождается снижением уровня высокоэнергетических фосфатов, увеличением возбуждающих аминокислот, накоплением ионов кальция внутри нейронов, морфофункциональным нарушением клеточных мембран, накоплением свободных радикалов и нейромедиаторным дисбалансом [10, 23, 25]. При ДЭ наиболее часто поражаются гиппокамп, таламус, перикаллозальные области, чечевицеобразное ядро, некоторые участки теменной и височной коры, т.е. отделы мозга, которые в большей степени ответственны за формирование эмоционально-мнестических процессов и вегетативных функций [3, 5, 17].
Лечение ДЭ представляет одну их наиболее актуальных проблем современной неврологии. При определении стратегии терапии ДЭ необходимо учитывать гетерогенность патогенеза ДЭ и использовать препараты с мультимодальным действием [11, 13, 25].
Значительный вклад в терапевтические и реабилитационные стратегии ДЭ внесла систематизация структуры биохимического каскада, возникающего при ишемии мозга. Особое место в этом биохимическом каскаде занимает нарушение содержания и обмена нейротрансмиттерных систем — ацетилхолина, дофамина, серотонина и др. Применение препаратов, корригирующих нейромедиаторный обмен в центральной нервной системе, значительно повысило эффективность терапии цереброваскулярных заболеваний [2, 20, 26].
При хронических цереброваскулярных заболеваниях с целью нейропротекции используется препарат цитиколин. Цитиколин состоит из цитидина и холина — участвует в синтезе фосфатидилхолина, основного мозгового фосфолипида. ЦДФ-холин является донором холина в биосинтезе нейромедиатора ацетилхолина [12]. Цитиколин улучшает мнестические функции у пациентов с болезнью Альцгеймера за счет увеличения синтеза ацетилхолина. Цитиколин повышает экспрессию антиапоптозного гена Bol‑2 после церебральной ишемии. При ишемии головного мозга происходит снижение уровня аденозинтрифосфата (АТФ), что приводит к деполяризации мембран, нарушению нейромедиаторного обмена и фосфолипидов. Цитиколин уменьшает потерю фосфолипидов, снижает образование полиненасыщенных жирных кислот, повышает энергетическое обеспечение головного мозга [7, 8, 26].
Продемонстрировано нейропротекторное действие цитиколина при острых и хронических нарушениях мозгового кровообращения. Цитиколин улучшает репарацию после ишемического повреждения нейронов и повышения содержания ацетилхолина и дофамина [22]. Препарат является нормальным клеточным метаболитом, обладает антиоксидантными, мембраностабилизирующими свойствами, нормализуя энергетику митохондрий и восстанавливая функционирование Na+-К+-АТФазы [24].
Цитиколин приводит к мобилизации эндотелиальных прогениторных клеток из костного мозга у пациентов с инсультом, тем самым улучшая функциональное восстановление после острого ишемического инсульта. Увеличение содержания эндотелиальных прогениторных клеток в периферической крови, индуцированное цитиколином, ассоциировано с лучшим функциональным исходом у пациентов, перенесших острый ишемический инсульт [21].
В Кокрейновском обзоре, включающем 14 исследований с участием 884 пожилых пациентов с разнообразными мнестическими нарушениями, проведен клинико-нейропсихологический анализ действия цитиколина. В соответствии с полученными результатами продемонстрирована высокая эффективность цитиколина в улучшении памяти, поведения и эмоционального фона [25].
У пациентов пожилого возраста прием цитиколина в течение 6 недель приводил к значительному повышению содержания в лобной доле (передней части поясной извилины коры головного мозга) фосфокреатинина (+17 %), бета-нуклеозидтрифосфатов, в основном АТФ, в головном мозге (+14 %) и увеличению отношения фосфокреатинина к неорганическому фосфату (+32 %) по данным фосфорной магнитно-резонансной спектроскопии [9, 14, 18].
Таким образом, многочисленные фундаментальные исследования доказывают эффективность цитиколина в защите от повреждений нейронов и в восстановлении нейрометаболизма мозга при различных цереброваскулярных заболеваниях.
Однако при проведении детального анализа клинико-функциональных данных о механизмах действия цитиколина обращает на себя внимание тот факт, что оценка эффективности действия этого препарата базируется преимущественно на динамике показателей психоэмоциональных, мнестических функций, состояния церебральной гемодинамики, биоэлектрической активности головного мозга. К сожалению, ни в одном исследовании не определяется действие цитиколина на системную и кардиальную гемодинамику. Учитывая, что у больных с церебральным атеросклерозом происходит не только патологическая реорганизация функционально-биохимического состояния мозга, но и трансформация кардиоцеребральных взаимосвязей, в определении механизмов действия цитиколина информативным является и анализ влияния цитиколина на кардиоцеребральные взаимосвязи.
Исходя из вышеуказанного, целесообразно проведение комплексного анализа влияния цитиколина на функциональное состояние мозга и сердца и их взаимосвязи.
Цель настоящей работы: комплексный анализ курсового влияния цитиколина на эмоционально-мнестические функции, мозговое кровообращение, биоэлектрическую активность головного мозга, морфофункциональное состояние сердца и межсистемные взаимосвязи у больных пожилого возраста с церебральным атеросклерозом.
Материалы и методы
В комплексном клинико-неврологическом исследовании приняли участие 30 больных (16 женщин, 14 мужчин) с атеросклеротической ДЭ 1–2-й ст. Средний возраст исследуемой группы составил 58,3 ± 3,4 года. Критериями исключения служили: инсульт, сердечная недостаточность III–IV функционального класса по NYHA, инфаркт миокарда, приобретенные пороки сердца. До и после курсового приема препарата Кванил (табл. 500 мг № 30, «КУСУМ ХЕЛТХКЕР ПВТ. ЛТД») всем больным проводили комплексное клинико-неврологическое и нейропсихологическое обследование, включающее:
— оценку кратковременной слуховой памяти (тест запоминания 10 слов А.Р. Лурия);
— определение устойчивости внимания (корректурная проба Бурдона);
— оценку уровня тревожности (шкала Спилбергера — Ханина);
— определение состояния когнитивных функций (краткая шкала оценки психического статуса Mini Mental State Examination (MMSE));
— оценку умственной работоспособности по Крепелину;
— биохимический анализ крови, липидограмму, коагулограмму;
— электроэнцефалографию (ЭЭГ) (показатели интенсивности основных ритмов ЭЭГ и частоты альфа-ритма) на аппарате Neurofax EEG‑1100 (Nihon Kohden, Япония);
— исследование мозгового кровотока методом ультразвукового дуплексного сканирования экстра- и интракраниальных отделов магистральных артерий головы и шеи на приборе Toshiba Aplio 300;
— электрокардиографию с оценкой вариабельности ритма сердца (с помощью аппарата Schiller AT‑10 plus);
— трансторакальную эхокардиографию (Toshiba Aplio 300).
Статистическую обработку данных проводили с помощью программного обеспечения Statistica 6.0.
Общая продолжительность наблюдения за пациентом составила 90 дней от начала приема лекарственного средства Кванил производства «Кусум Хелтхкер ПВТ. ЛТД» (Индия) (цитиколин, таблетки, покрытые оболочкой, по 500 мг). Пациент принимал препарат по 500 мг (1 табл.) 2 раза в день.
Результаты и обсуждение
Одним из проявлений хронической ишемии мозга являются эмоционально-мнестические изменения. В 1993 году V.C. Hachinsky предложил термин «сосудистые когнитивные расстройства» (англ. vascular cognitive impairment) для обозначения нарушений высших мозговых функций вследствие цереброваскулярной патологии. Различные шкалы, тесты и опросники являются способом объективизации субъективных показателей для стандартизации оценки общего и неврологического статуса пациента, динамики восстановления тех или иных функций у конкретного больного либо для определения результативности лечебных мероприятий или реабилитационных программ [19].
Учитывая нейрометаболическое действие препарата Кванил (табл. 500 мг № 30, «КУСУМ ХЕЛТХКЕР ПВТ. ЛТД»), проведен анализ влияния препарата на нейропсихологическое состояние у больных ДЭ 1–2-й ст.
Шкала MMSE используется во всем мире для определения состояния когнитивных функций. Так, на фоне курсового применения препарата Кванил (табл. 500 мг № 30, «КУСУМ ХЕЛТХКЕР ПВТ. ЛТД») статистически достоверно увеличивается количество баллов по шкале MMSE у больных ДЭ 1–2-й ст., а также уменьшается количество пациентов с начальными когнитивными нарушениями (рис. 1, табл. 1).
Установлено, что под влиянием препарата Кванил (табл. 500 мг № 30, «КУСУМ ХЕЛТХКЕР ПВТ. ЛТД») отмечается улучшение кратковременной и долговременной памяти (рис. 2).
У больных ДЭ 1–2-й ст. курсовой прием препарата Кванил (табл. 500 мг № 30, «КУСУМ ХЕЛТХКЕР ПВТ. ЛТД») вызывает статистически достоверное снижение реактивной и личностной тревоги (табл. 2).
У больных церебральным атеросклерозом Кванил (табл. 500 мг № 30, «КУСУМ ХЕЛТХКЕР ПВТ. ЛТД») вызывает реорганизацию биоэлектрической активности головного мозга, характеризующуюся статистически достоверным снижением мощности в отдельных областях мозга в диапазоне медленных ритмов на фоне увеличения мощности альфа‑1-, альфа‑2-ритмов. Так, Кванил (табл. 500 мг № 30, «КУСУМ ХЕЛТХКЕР ПВТ. ЛТД») статистически достоверно уменьшает мощность в диапазоне дельта-ритма в затылочной и височной областях 2 полушарий.
/44.jpg)
В то же время в лобной и центральной областях правого и левого полушария статистически достоверно снижается мощность в диапазоне тета-ритма. У больных ДЭ 1–2-й ст. под влиянием препарата Кванил (табл. 500 мг № 30, «КУСУМ ХЕЛТХКЕР ПВТ. ЛТД») регистрируется изменение мощности в диапазоне альфа‑1-, альфа‑2-ритмов: увеличивается мощность в диапазоне альфа‑1-ритма в лобной, центральной и височной областях двух полушарий и мощность в диапазоне альфа‑2-ритма в центральной и затылочной областях (рис. 3).
У больных ДЭ 1–2-й ст. Кванил (табл. 500 мг № 30, «КУСУМ ХЕЛТХКЕР ПВТ. ЛТД») не оказывает статистически достоверного влияния на мощность в диапазоне быстрых ритмов ЭЭГ — бета‑1-, бета‑2- и на частоту альфа-ритма.
Изменения мощности основных ритмов ЭЭГ у больных ДЭ под влиянием препарата Кванил (табл. 500 мг № 30, «КУСУМ ХЕЛТХКЕР ПВТ. ЛТД») свидетельствуют о том, что препарат улучшает функциональное состояние подкорковых структур мозга, активизирует таламокортикальные связи, что подтверждается ростом мощности в диапазоне альфа‑1- и альфа‑2-ритмов и ее снижением в диапазоне медленных ритмов.
/44_2.jpg)
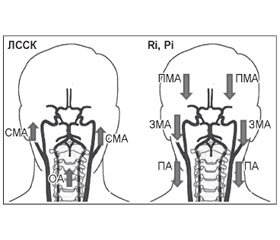
Принимая во внимание то, что структура и мощность основных ритмов ЭЭГ в определенной степени обусловлена состоянием церебральной гемодинамики, был проведен анализ изменения показателей мозгового кровотока в экстра- и интракраниальных сосудах каротидного и вертебробазилярного бассейнов. Установлено, что у больных ДЭ под влиянием препарата Кванил (табл. 500 мг № 30, «КУСУМ ХЕЛТХКЕР ПВТ. ЛТД») статистически достоверно увеличивается линейная систолическая скорость кровотока (ЛССК) в двух средних мозговых (СМА), задних мозговых (ЗМА) и основной артерии (ОА) и статистически достоверно снижается периферическое сопротивление в передней мозговой (ПМА), позвоночной артерии (ПА), ЗМА (рис. 4, табл. 3–5). Итак, Кванил (табл. 500 мг № 30, «КУСУМ ХЕЛТХКЕР ПВТ. ЛТД») не относится к вазоактивным препаратам, но улучшает мозговой кровоток, вероятно, за счет нейрометаболического действия.
/45.jpg)
Анализ морфофункционального состояния сердца у больных ДЭ 1–2-й ст. показал, что основные показатели интракардиальной и системной (конечно-диастолический объем (КДО), конечно-систолический (КСО), ударный объем (УО), общее периферическое сопротивление сосудов (ОПСС), сердечный индекс (СИ), минутный объем крови (МОК) и фракция выброса (ФВ)) гемодинамики на фоне лечения препаратом Кванил (табл. 500 мг № 30, «КУСУМ ХЕЛТХКЕР ПВТ. ЛТД») не изменялись и находились в пределах нормальных значений (табл. 6).
Для оценки влияния препарата Кванил (табл. 500 мг № 30, «КУСУМ ХЕЛТХКЕР ПВТ. ЛТД») на вегетативный статус был проведен анализ вариабельности ритма сердца (ВРС) до и после применения данного препарата. Исследование вариабельности ритма сердца является одним из наиболее информативных методов оценки вегетативного статуса. Нарушения ВРС могут рассматриваться в качестве предикторов сердечно-сосудистых осложнений. Для оценки вегетативного баланса рассчитывали временные и спектральные показатели ВРС. При анализе исходных данных до лечения препаратом Кванил (табл. 500 мг № 30, «КУСУМ ХЕЛТХКЕР ПВТ. ЛТД») у больных ДЭ 1–2-й ст. отмечено снижение спектральных показателей, в частности низкочастотных колебаний (НЧ) (603 ± 113, нормальное значение — 1170 ± 416) и высокочастотных колебаний (ВЧ) (573 ± 87, норма — 975 ± 203), что может свидетельствовать о недостаточной суммарной ВРС. Данное уменьшение общей ВРС может быть связано не только с ростом симпатической активности, но и с ослаблением всех вегетативных влияний на сердце. Необходимо отметить, что при этом показатель НЧ/ВЧ до лечения препаратом Кванил (табл. 500 мг № 30, «КУСУМ ХЕЛТХКЕР ПВТ. ЛТД») был выше нормальных значений (2,3 ± 0,2 при норме 1,5–2,0), что характерно для смещения симпато-парасимпатического баланса в сторону превалирования симпатического отдела центральной нервной системы и активизации подкоркового парасимпатического центра. Следует подчеркнуть, что после курсового лечения препаратом Кванил (табл. 500 мг № 30, «КУСУМ ХЕЛТХКЕР ПВТ. ЛТД») у больных ДЭ 1–2-й ст. показатель НЧ/ВЧ нормализовался (НЧ/ВЧ = 1,9 ± 0,3).
Кванил (табл. 500 мг № 30, «КУСУМ ХЕЛТХКЕР ПВТ. ЛТД») — препарат с выраженным парасимпатическим действием за счет активизации холинергических систем. У больных ДЭ Кванил (табл. 500 мг № 30, «КУСУМ ХЕЛТХКЕР ПВТ. ЛТД») вызвал изменение временной структуры ритма сердца: увеличивался триангулярный индекс, характеризующий общую мощность спектра и являющийся маркером парасимпатической активности вегетативной нервной системы (до лечения — 121 ± 18, после — 153 ± 22). Эти изменения при спектральном и временном анализе ВРС свидетельствуют о гармонизации симпато-парасимпатического баланса вегетативной нервной системы у данной категории больных после лечения препаратом Кванил (табл. 500 мг № 30, «КУСУМ ХЕЛТХКЕР ПВТ. ЛТД»).
После установления типа влияния препарата Кванил (табл. 500 мг № 30, «КУСУМ ХЕЛТХКЕР ПВТ. ЛТД») на церебральную гемодинамику, биоэлектрическую активность головного мозга, структурно-функциональное состояние сердца и системную гемодинамику целесообразно провести анализ состояния межсистемных взаимосвязей до и после приема препарата Кванил (табл. 500 мг № 30, «КУСУМ ХЕЛТХКЕР ПВТ. ЛТД»). Выполнен корреляционный анализ показателей мощности основных ритмов ЭЭГ и характеристик морфофункционального состояния сердца и системной гемодинамики. Статистически достоверные связи установлены только в отношении мощности дельта-ритма. Отмечается некоторая асимметрия количества корреляционных связей мощности дельта-ритма с показателями морфофункционального состояния сердца и системной гемодинамики. Мощность дельта-ритма в лобной области правого и левого полушария, центральной области левого полушария отрицательно коррелирует (r = –0,77; –0,63) со структурно-функциональными показателями сердца (конечно-диастолический (КДР), конечно-систолический размер (КСР), масса миокарда левого желудочка (ММЛЖ)) и показателями системной гемодинамики (КДО, КСО, ФВ, УО) (рис. 5). Так, количество корреляционных связей с мощностью дельта-ритма в правом полушарии составляет 14, в левом — 24.
/46.jpg)
После курсового приема препарата Кванил (табл. 500 мг № 30, «КУСУМ ХЕЛТХКЕР ПВТ. ЛТД») происходит резкая реорганизация структуры корреляционных связей, характеризующаяся нивелированием корреляционных связей с мощностью дельта-ритма в левом полушарии и констатацией только одной корреляционной связи мощности дельта-ритма в височной области со структурно-функциональным состоянием сердца (с диаметром МЖП (МЖПд) — r = –0,76). У больных с ДЭ 1–2-й ст. в правом полушарии мощность дельта-ритма в лобной, центральной и височной областях положительно коррелирует (r = 0,81) только с показателями диастолической дисфункции левого желудочка (DT, E/A, E/E) (рис. 6).
/46_2.jpg)
Итак, под влиянием курсового приема препарата Кванил (табл. 500 мг № 30, «КУСУМ ХЕЛТХКЕР ПВТ. ЛТД») у больных ДЭ 1–2-й ст. уменьшается общее количество корреляционных связей (до лечения — 38, после — 12) преимущественно за счет связей мощности дельта-ритма в левом полушарии, нивелируются парадоксальные связи мощности дельта-ритма с показателями структурно-функционального состояния сердца и системной гемодинамики. Такой тип реорганизации межсистемных взаимосвязей может свидетельствовать об уменьшении их «жесткости» и расширении автономности биоэлектрической активности головного мозга от структурно-функционального состояния сердца и системной гемодинамики.
Выводы
1. У больных с ДЭ 1–2-й ст. под влиянием курсового приема препарата Кванил (табл. 500 мг № 30, «КУСУМ ХЕЛТХКЕР ПВТ. ЛТД») активизируются когнитивные функции (повышаются внимание, краткосрочная и долговременная память) и улучшается эмоциональная сфера (снижается уровень реактивной и личностной тревожности).
2. Под влиянием курсового приема препарата Кванил (табл. 500 мг № 30, «КУСУМ ХЕЛТХКЕР ПВТ. ЛТД») у пациентов с ДЭ 1–2-й ст. происходит положительная реорганизация биоэлектрической активности головного мозга, характеризующаяся снижением мощности медленных ритмов (в затылочной и височной области — в диапазоне дельта-ритма, в лобной и центральной области — тета-ритма) на фоне роста мощности в диапазоне альфа-ритма в отдельных областях двух полушарий.
3. У больных ДЭ 1–2-й ст. Кванил (табл. 500 мг № 30, «КУСУМ ХЕЛТХКЕР ПВТ. ЛТД») оказывает вазоактивное действие на церебральную гемодинамику — увеличиваются скоростные показатели кровотока (ЛССК) и снижается периферическое сопротивление в отдельных сосудах каротидного (СМА) и вертебробазилярного бассейна (ОА, ПА, ЗМА).
4. Кванил (табл. 500 мг № 30, «КУСУМ ХЕЛТХКЕР ПВТ. ЛТД»), по данным спектрального и временного анализа ВРС, гармонизирует симпато-парасимпатическое взаимоотношение у пациентов с ДЭ 1–2-й ст.
5. Положительное влияние препарата Кванил (табл. 500 мг № 30, «КУСУМ ХЕЛТХКЕР ПВТ. ЛТД») на клинико-неврологическое состояние, нейропсихологические функции, церебральный кровоток, биоэлектрическую активность головного мозга и вариабельность ритма сердца дает основание рекомендовать включение данного препарата в схему комплексного лечения больных с ДЭ 1–2-й ст.
Список литературы
1. Бойко А.Н., Сидоренко Т.В. Хроническая ишемия мозга (дисциркуляторная энцефалопатия) // Consilium medicum. — 2004. — Т. 6, № 8.
2. Вознесенская Т.Г. Некогнитивные нервно-психические расстройства при когнитивных нарушениях в пожилом возрасте // Неврологический журнал. — 2010. — № 2. — С. 4-18.
3. Дамулин И.В. Сосудистая деменция // Неврологический журнал. — 1999. — № 4. — С. 4-11.
4. Евтушенко С.К. Кардионеврологические и нейрокардиологические синдромы // Мат-лы XII Международной конференции. — Судак, 2010. — C. 56-60.
5. Кадыков А.С., Манвелов Л.С., Шахпаронова Н.В. Хронические сосудистые заболевания головного мозга: дисциркуляторная энцефалопатия: Руководство для врачей. — 2-е изд. — М.: ГЭОТАР-Медиа, 2013. — 232 с.
6. Камчатнов П.Р., Зайцев К.А., Денисов Д.Б. Хронические расстройства мозгового кровообращения: возможности нейротрофической терапии // Consilium medicum. — 2011. — № 6.
7. Кузнецова С.М. Сердце и мозг: органы-мишени метаболической цитопротекции / С.М. Кузнецова, М.С. Егорова // Материалы международной научно-практической конференции «Сердце и мозг». — Севастополь, 2012.
8. Преображенская И.С., Яхно Н.Н. Сосудистые когнитивные нарушения: клинические проявления, диагностика, лечение // Неврологический журнал. — 2007. — № 5 (12). — С. 45-50.
9. Ройтберт Г.Е., Струтынский А.В. Внутренние болезни сердечно-сосудистой системы: Учебное пособие для системы послевузовской подготовки врачей. — М.: БИНОМ, 2003. — 856 с.
10. Руководство по функциональной межполушарной асимметрии / Под ред. В.Ф. Фокина, И.Н. Боголеповой, Б. Гутника, В.И. Кобрина, В.В. Шульговского. — М.: Научный мир, 2009. — 836 с.
11. Суслина З.А. Очерки ангионеврологии. — М.: Атмосфера, 2005. — 386 с.
12. Яхно Н.Н., Захаров В.В., Локшина А.Б. Синдром умеренных когнитивных нарушений при дисциркуляторной энцефалопатии // Журнал неврол. и психиатр. им. С.С. Корсакова. — 2005. — № 2 (105). — С. 13-17.
13. Яхно Н.Н., Захаров В.В., Локшина А.Б., Коберская Н.Н., Мхитарян Э.А. Деменции: Руководство для врачей. — 2-е изд. — М.: МЕДпресс-информ, 2010. — 272 с.
14. Яхно Н.Н., Преображенская И.С., Захаров В.В., Степкина Д.А., Локшина А.Б., Мхитарян Э.А., Коберская Н.Н., Савушкина И.Ю. Распространенность когнитивных нарушений при неврологических заболеваниях (анализ работы специализированного амбулаторного приема) // Неврология, нейропсихиатрия, психосоматика. — 2012. — № 2. — С. 30-35.
15. Erkinjuntti T., Roman G., Gauthier S. et al. Emerging therapies for vascular dementia and vascular cognitive impairment // Stroke. — 2004. — Vol. 35. — Р. 1010-1017.
16. Garcia-Cobos R., Frank-Garcia A., Gutierrez-Fernandez M., Diez-Tejedor E. Citicoline, use in cognitive decline: vascular and degenerative // J. Neurol. Sci. — 2010. — 299. — 188-192.
17. Heart rate variability, standards of measurement, physiological interpretation and clinical use. Task force of the European Society of Cardiology and the North American Society of pacing and electrophysiology // Eur. Heart J. — 1996. — Vol. 17. — Р. 354-381.
18. Hurtado O., Cardenas A., Pradillo J.M., Morales J.R., Ortego F., Sobrino T., Castillo J., Moro M.A., Lizasoain I. A chronic treatment with CDP-choline improves functional recovery and increases neuronal plasticity after experimental stroke // Neurobiol. Dis. — 2007. — 26. — 105-111.
19. Ivan C.S., Seshadri S., Beiser A., Au R., Kase C.S., Kelly-Hayes M., Wolf P.A. Dementia after stroke: the Framingham Study // Stroke. — 2004. — 35. — 1264-1268.
20. Korczyn A.D. Mixed Dementia — the Most Common Cause of Dementia // Ann. N.Y. Acad. Sci. — 2002. — Vol. 977. — Р. 129-134.
21. Lee H.J., Kang J.S., Kim Y.I. Citicoline protects against cognitive impairment in a rat model of chronic cerebral hypoperfusion // J. Clin. Neurol. — 2009. — 5. — 33-38.
22. Leys D., Henon H., Mackowiak-Cordoliani M.A., Pasquier F. Poststroke dementia // Lancet Neurol. — 2005. — 4. — 752-759.
23. O’Brien J.T., Erkinjuntti T., Reisberg B., Roman G., Sawada T., Pantoni L., Bowler J.V., Ballard C., DeCarli C., Gorelick P.B., Rockwood K., Burns A., Gauthier S., DeKosky S.T. Vascular cognitive impairment // Lancet Neurol. — 2003. — 2. — 89-98.
24. Rasquin S.M., Verhey F.R., Lousberg R., Winkens I., Lodder J. Vascular cognitive disorders: memory, mental speed and cognitive flexibility after stroke // J. Neurol. Sci. — 2002. — 203-204. — 115-119.
25. Roman G. Perspectives in the treatment of vascular dementia // Drugs Today. — 2000. — Vol. 36. — Р. 641-653.
26. Savva G.M., Stephan B.C. Alzheimer’s Society Vascular Dementia Systematic Review Group. Epidemiological studies of the effect of stroke on incident dementia: a systematic review // Stroke. — 2010. — 41. — e41-e46.
/43.jpg)
/43_2.jpg)
/43_3.jpg)
/44.jpg)
/44_2.jpg)
/46.jpg)
/46_2.jpg)

/45.jpg)