Статтю опубліковано на с. 51-57
Вступ
У зв’язку зі швидким технічним прогресом, урбанізацією зростає й кількість хворих з органічними ураженнями центральної нервової системи (ЦНС) [4, 8]. Як правило, це хворі на дитячий церебральний параліч (ДЦП), особи з наслідками перенесеної черепно-мозкової та спинномозкової травми, гострих порушень мозкового кровообігу. Так, щороку в Україні зазнають травми спинного мозку понад 2500 осіб. 87 % з них — люди працездатного віку, 80–85 % постраждалих після травми стають інвалідами 1-ї та 2-ї груп [12]. Популяційні дослідження показують, що частота ДЦП у різних країнах світу коливається від 1,5 до 2,7 на 1000 дітей. В Україні частота ДЦП становить від 2,3 до 4,5 на 1000 дитячого населення [13].
З метою покращення уніфікації порушень, що виникають в гострому періоді при ішемічних інсультах, використовуються різноманітні шкали [2].
Безумовно, сучасні консервативні й оперативні методи довели свою ефективність і доцільність у гострому періоді захворювання. При своєчасній діагностиці та виборі оптимального методу лікування смертність від вищевказаних захворювань значно знизилась. Але поряд зі зменшенням летальності збільшується показник інвалідизації, тому що далеко не всі пацієнти у віддаленому періоді спроможні повернутися до повноцінного життя, а тим більше до роботи. У випадку ж ДЦП проблеми в міру росту та розвитку дитини лише поглиблюються.
Покращення якості життя хворих з органічними ураженнями ЦНС у віддаленому періоді сьогодні стає актуальною проблемою. Однією з основних причин низької якості життя цих хворих є патологічна м’язова спастичність. Спастичність визначають як руховий розлад, що є частиною синдрому ураження кортикоспінального тракту й характеризується швидкісно-залежним підвищенням м’язового тонусу та супроводжується підвищенням сухожилкових рефлексів унаслідок гіперзбудливості рецепторів розтягу [5, 11].
Сама по собі спастичність відіграє як позитивну роль (запобігає атрофії м’язів, підтримується певне положення кінцівки, що іноді навіть дозволяє хворим стояти за повної відсутності рухів), так і негативну (слабкість м’язів, сповільненість рухів, неможливість виконання тонких рухів) [6, 7]. Тому спастичність поділяється на корисну та шкідливу залежно від ступеня вираженості.
Шкідлива спастичність може бути дифузною (задіяно декілька груп м’язів) або локальною (переважне ураження м’яза чи однієї групи м’язів) [10].
Вважається, що підвищення м’язового тонусу обумовлене ураженням не самих пірамідних волокон, а волокон екстрапірамідної системи. При цьому більшою мірою страждають волокна інгібуючі, тоді як активуючі зберігають свій вплив на м’язові веретена, звідки і виникає спастичність [1].
Такі хворі ледве пересуваються, догляд за ними ускладнюється. Спастичність у привідних м’язах стегна обтяжує догляд за хворим, унеможливлює формування кульшових суглобів хворих на ДЦП. Локальна спастичність у згиначах ступні та пальців обмежує функціональні можливості хворих, унеможливлює формування навичок стояння й ходьби, призводить до формування патологічної пози, викривлення хребта, утворення м’язово-сухожилкових і суглобових контрактур [9].
Залежно від локалізації патологічного спастичного процесу в тому чи іншому м’язовому сегменті розвивається специфічна клінічна картина захворювання: трицепс-синдром (триголовий м’яз гомілки) супроводжується еквінусом і, можливо, варусною деформацією ступні; ректус-синдром (передня група м’язів стегна) виникає внаслідок наявності нередукованих симетричного шийного тонічного та лабіринтного рефлексів і супроводжується нахилом тулуба вперед та вниз через підвищений тонус у m.rectus femoris; хамстринг-синдром (задньомедіальна група м’язів стегна) проявляється згинанням нижніх кінцівок у колінних суглобах при стоянні.
При лікуванні шкідливої локальної спастичності застосовуються консервативні та оперативні методи. До консервативних методів належить використання медикаментозних засобів (мідокалм, сирдалуд, баклофен), а також масаж, лікувальна фізкультура, фізіопроцедури. При локальних підвищеннях тонусу м’язів широко застосовують препарати ботулотоксинового ряду. Дослідження підтвердили безпечність, ефективність та функціональне покращання при їх застосуванні [14]. Тривалість ефекту визначається дозою введеного препарату, розмірами м’язів та іншими чинниками. Цей метод лікування має й недоліки, що обмежують його застосування. До них належать короткотривалість ефекту (2–4 місяці) та необхідність повторних введень ботулотоксину, розвиток звикання до препарату з необхідністю збільшення дозування, болючість при введенні та досить висока ціна.
За відсутності ефективності від консервативного лікування показане використання нейрохірургічних методів лікування локальної спастичності. Метою хірургічного лікування спастичності у хворих із частково збереженими рухами є збільшення обсягу цих рухів зі становленням або відновленням статокінетичної функції, у всіх інших випадках — полегшення догляду за хворими. На сьогодні не проведено аналізу ефективності застосування різних методів хірургічного лікування локальної спастичності, відсутній і алгоритм нейрохірургічного лікування.
Мета дослідження — розробка оптимальної диференціальної тактики лікування хворих із різними видами локальної спастичності в нижніх кінцівках на підставі розробки алгоритму лікування для усунення або запобігання формуванню необоротних змін у м’язово-суглобовому апараті.
Матеріали та методи
Усі пацієнти були розподілені на три великі групи залежно від ураження тієї чи іншої групи м’язів.
Першу групу (114 хворих) становили пацієнти з локальною спастичністю в привідних м’язах стегон. Середній вік пацієнтів становив 5,4 року. Причиною розвитку спастичності в 111 випадках був ДЦП, у 2 випадках — токсична мієлопатія, в одного пацієнта спастичність відмічалась на фоні розсіяного енцефаломієліту (РЕМ). Відповідно 111 хворих — діти віком від 2 до 8 років, з них 52 хлопчики та 59 дівчаток. Троє пацієнтів з токсичною мієлопатією та РЕМ були дорослими чоловіками віком від 32 до 34 років.
Методом хірургічного вибору в цій групі було проведення одно- або двобічної невротомії поверхневої гілки затульного нерва та міотомії привідних м’язів стегна.
До другої групи (23 пацієнти) увійшли хворі з переважним ураженням дистальних відділів нижніх кінцівок віком від 2 до 6 років (середній вік 3,8 року). Із них було 12 хлопчиків і 11 дівчаток. Причиною розвитку спастичності в усіх пацієнтів був ДЦП. Акцент зроблено на проведенні селективної фасцикулотомії великогомілкового нерва з подальшим накладанням фасцикулярного шва.
У третю групу (18 пацієнтів) увійшли хворі з локальною спастичністю дистальних відділів нижніх кінцівок у поєднанні з больовим синдромом віком від 4 до 8 років, середній вік становив 6,1 року, із них 10 хлопчиків та 8 дівчат. Причиною розвитку спастичності в 13 випадках був ДЦП, у 2 пацієнтів — РЕМ, у 3 випадках — наслідки хребтово-спинномозкової травми (ХСТ). Цим пацієнтам виконувалась селективна задня ризотомія на рівні поперекового потовщення спинного мозку.
Показаннями до оперативного лікування хворих із локальною спастичністю м’язів нижніх кінцівок були:
1) неефективність консервативного лікування;
2) позитивний бупівакаїновий тест, що дає можливість виявити грубі необоротні зміни в м’язах і суглобах;
3) відсутність грубих інтелектуальних змін у пацієнта.
Усім хворим проводився тест із параневральною блокадою бупівакаїном нервів, що іннервують спастичний м’яз. За відсутності необоротних фіброзно-дегенеративних змін у м’язах і збереженні рухливості в суглобах на час дії анестетика наставало суттєве покращення стану хворого, що супроводжувалось значним зниженням спастичності та збільшенням обсягу рухів у суглобах.
Усього було проліковано 155 пацієнтів, із них оперативні втручання за показаннями проведено у 134 хворих (табл. 1).
Родичі та батьки пацієнтів бачили очікуваний позитивний ефект після введення анестетика та давали згоду на проведення оперативного втручання.
Залежно від переважання тієї чи іншої форми локальної спастичності в нижніх кінцівках застосовувався диференційований підхід до вибору тактики оперативного втручання.
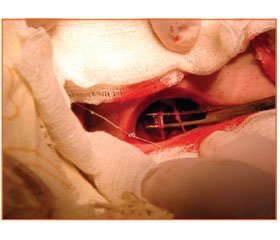
З приводу контрактур привідних м’язів стегна прооперовано 114 хворих. У 94 випадках проведено однобічну міотомію, у 20 хворих — двобічну. Для виконання операції використовували поперечний лінійний розріз шкіри у паховій ділянці на 2 см нижче від пупартової зв’язки, медіальніше від проекції стегнової артерії. Виділяли затульний нерв і пересікали його поверхневу гілку (рис. 1). При наявних склеротичних змінах у привідних м’язах виконували пересічення довгого, короткого та великого привідних м’язів стегна.
З приводу патологічної спастичності в нижніх кінцівках без наявного больового синдрому прооперовано 9 пацієнтів. У 5 випадках патологія мала двобічний характер, тому оперативні втручання проводились на двох кінцівках.
Перевагу віддавали виконанню селективної фасцикулотомії великогомілкового нерва. Цей метод лікування має певні недоліки (надмірна денервація, розвиток больового синдрому при утворенні невром на пересічених фасцикулах). У зв’язку з цим ми запропонували селективну фасцикулотомію рухових волокон доповнювати зшиванням пересічених фасцикул з метою часткового відновлення м’язового тонусу (рис. 2). Пересічення фасцикул виконували під контролем мікроскопа з використанням електродіагностики інтраопераційно. При цьому пересікались лише ті фасцикули, що відповідали за патологічну спастичність.
/53_2.jpg)
Хворим з локальною спастичністю в дистальних відділах нижніх кінцівок (n = 11) на фоні больового синдрому провели селективну задню ризотомію. Під загальним наркозом зі штучною вентиляцією легень на рівні поперекового потовщення спинного мозку (Th11-L1) пересікали частину відповідних задніх корінців (рис. 3). Після ідентифікації потрібних корінців проводилось пересічення кількох фасцикул, після чого ми проводили повторну пряму електронейроміографію. Якщо м’язова відповідь становила понад 30 % від початкового показника, продовжували пересічення фасцикул до досягнення показника на рівні 25–30 % від початкового.
У дітей з метою запобігання розвитку післяопераційної нестабільності хребта проводили остеопластичну ламінотомію, у дорослих — стандартну ламінектомію без стабілізуючого етапу.
Результати
Результати лікування до і після оперативного втручання оцінювали за такими критеріями: ступінь спастичності уражених м’язів за шкалою Ashworth; оцінка м’язової сили за шкалою ASIA; ступінь вираженості рухових розладів за критеріями класифікації великих моторних функцій (Gross Motor Function Classification for Cerebral Palsy — GMFCS); ступінь обмеження в суглобах — за 5-ступеневою шкалою [3].
У 12 пацієнтів з контрактурою привідних м’язів стегна було проведено мікроскопічне дослідження біоптату спазмованих м’язів, встановлено чітку позитивну кореляцію між давністю захворювання та ступенем фіброзного переродження м’язових волокон, при цьому відзначалось чітке зростання площі, зайнятої компонентами сполучної тканини, щодо загальної площі поперечного зрізу спастичного м’яза.
В усіх пацієнтів у післяопераційному періоді відзначалось зниження рівня спастичності, наростання м’язової сили, збільшення обсягу активних і пасивних рухів у суглобах.
У всіх хворих з привідними контрактурами зникло перехрещення ніг, що сприяло становленню навичок стояння й ходьби (рис. 4). У всіх хворих з контрактурами дистальних відділів кінцівки у післяопераційному періоді покращився естетичний вигляд ступні, полегшився догляд за хворими. Протягом 8–10 місяців 7 дітей почали ходити самостійно, а двоє пацієнтів — з незначною сторонньою допомогою.
Призначення комплексного реабілітаційного лікування в післяопераційному періоді, що включало лікувальну фізичну культуру, масаж уражених кінцівок, фізіотерапевтичне лікування, сприяло значному покращанню щодо відновлення втрачених функцій. Ступінь відновлення пасивної та активної рухливості в ураженому сегменті напряму залежав від повноцінності та адекватності призначеного реабілітаційного лікування, тому що за відсутності останнього, навіть на фоні зниження спастичності м’язів та збільшення обсягу рухів в уражених суглобах, не відбувалося відновлення втрачених статомоторних функцій.
З метою зіставлення значень показників обсягу рухів у кульшових суглобах хворих на ДЦП до операції та на різних етапах післяопераційного періоду для множинного міжгрупового порівняльного аналізу використаний параметричний критерій Шеффе. Згідно з критерієм Шеффе, даний показник суттєво покращується відразу після операції (рис. 5, табл. 2) — наявне статистично значуще підвищення відносно доопераційного періоду в 4,3 раза — і в подальшому залишається статистично значущим без особливої динаміки, коли між термінами 6 місяців і 1 рік після операції статистично значущих відмінностей не спостерігається. При цьому в динаміці віддаленого післяопераційного періоду спостерігається статистично значуще підвищення даного показника порівняно з тими ж хворими до операції в 4,75 і 4,75 раза відповідно.
/55_5.jpg)
У ранньому післяопераційному періоді в усіх хворих виявлено вірогідне зниження м’язового тонусу та значне збільшення обсягу рухів у суглобах (табл. 3) Завдяки цьому зникли спастичні синдроми, що вже на цьому етапі дало можливість проводити ранню реабілітацію, починати формувати статомоторні навички.
Обговорення
Зниження м’язового тонусу, збільшення обсягу активних і пасивних рухів в уражених кінцівках, зменшення патологічної установки сприяли в подальшому суттєвому покращенню якості життя хворих, значно полегшували догляд за ними, а з часом прискорювали формування навичок стояння та ходьби.
Позитивні зміни в післяопераційному періоді мали стійкий характер, з часом патологічна спастичність не поверталась, на відміну від результатів застосованих перед цим консервативних методик.
Інтенсивне використання в цей період комплексу реабілітаційних заходів у разі відсутності необоротних склеротичних змін у суглобово-м’язовому комплексі сприяло формуванню навиків стояння та ходьби у хворих вже в ранньому післяопераційному періоді.
На підставі даних досліджень, з огляду на існуючі показання та протипоказання щодо різних методів лікування, беручи до уваги результати спостереження за прооперованими пацієнтами, розроблено алгоритм нейрохірургічного лікування хворих із локальною спастичністю в м’язах нижніх кінцівках (рис. 6).
Висновок
Отже, інкурабельна локальна спастичність м’язів нижніх кінцівок призводить до формування м’язово-суглобових контрактур, що потребують нейрохірургічного лікування до розвитку в них необоротних змін.
Вибір оптимальної тактики оперативного втручання залежить від особливостей клінічного перебігу захворювання, локалізації патологічного процесу, ступеня фіброзного переродження м’язів і обсягу обмеження активної та пасивної рухливості в уражених суглобах.
Проведення оперативного втручання на ранніх стадіях захворювання в разі відсутності необоротних змін у м’язах та суглобах ураженої кінцівки може мати найбільші сприятливі прогностичні результати порівняно з тими втручаннями, що виконуються на пізніх стадіях захворювання.
Зниження локальної спастичності та збільшення обсягу рухливості в ураженому сегменті в ранньому післяопераційному періоді дозволяє ефективно залучати до комплексного лікування неврологів та реабілітологів, що значно збільшує ефективність відновного лікування.
Запропонована тактика диференційовного підходу до вибору методу нейрохірургічного лікування хворих із локальною спастичністю в нижніх кінцівках є оптимальною, сприяє значному покращенню результатів лікування й якості надання допомоги таким пацієнтам.
Список литературы
1. Євтушенко О.С., Лісовський Є.В. Сучасні методи лікування м’язової спастичності у дітей з органічними ураженнями нервової системи / Євтушенко О.С., Лісовський Є.В.: Методичні рекомендації МОЗ України. — К., 2006. — 35 с.
2. Евтушенко С.К. Шкалы в общей и детской неврологии / О.С. Евтушенко, Н.В. Яновская, О.Ю. Сухоносова — К.: Издательский дом «Заславский», 2015. — 11 с.
3. Качмар О.О. Система класифікації великих моторних функцій у дітей з церебральним паралічем / О.О. Качмар // Міжнародний неврологічний журнал. — 2008. — № 1(17). — С. 90-94.
4. Кислицын Ю.В., Новиков К.Г. Качество жизни пациентов с тяжелым ушибом головного мозга в отдаленном периоде / Кислицын Ю.В., Новиков К.Г. // Журнал неврологии и психиатрии им. С.С. Корсакова. — 2009. — T. 109, № 11. — С. 94-96.
5. Никифоров А.С. Двигательная система: строение, функция, терминология // Неврология и психиатрия. — 2004. — № 8. — С. 73-76.
6. Пічкур Л.Д. Результати селективної фасцикулотомії ліктьового і серединного нервів верхніх кінцівок у хворих зі спастичними формами дитячого церебрального паралічу // Український неврологічний журнал. — 2009. — № 1. — С. 39-45.
7. Пічкур Л.Д. Результати селективної фасцикулотомії м’язово-шкірного нерва при лікування спастичності верхніх кінцівок у хворих на дитячий церебральний параліч // Міжнародний неврологічний журнал. — 2009. — № 2. — С. 6-11.
8. Полищук Н.Е. Повреждения позвоночника и спинного мозга / Полищук Н.Е., Корж Н.А., Фищенко В.Я. — К.: Книга плюс, 2001. — 540 с.
9. Пулик Д.А., Змановская В.А., Губина Е.Б., Леончук С.С., Буторина М.Н. Результаты многоуровневых одномоментных ортопедических операций и ранней реабилитации в комплексе с ботулинотерапией у пациентов со спастическими формами церебрального паралича / Пулик Д.А., Змановская В.А., Губина Е.Б., Леончук С.С., Буторина М.Н. // Неврология и психиатрия. — 2015. — № 4. — С. 41-48.
10. Цимбалюк В.І., Ямінський Ю.Я. Реконструктивно-відновна хірургія спинного мозку / Цимбалюк В.І., Ямінський Ю.Я. — К.: Авіценна, 2009. — С. 54-99.
11. Цимбалюк В.І. Шкали в нейрохірургії / В.І. Цимбалюк, Т.І. Петрів. — К.: Задруга, 2015. — 236 с.
12. Ямінський Ю.Я. Відновне хірургічне лікування хворих з наслідками травматичного ушкодження спинного мозку: Дис… докт. мед. наук: спец. 14.01.05. — нейрохірургія / Ю.Я. Ямінський. — К., 2012. — 315 с.
13. Hurley D.S., Sukal-Moulton T., Msall M.E., Gaebler-Spira D., Krosschell K.J., Dewald J.P. The cerebral palsy research registry: development and progress toward national collaboration in the United States // J. Child. Neurol. — 2011. — № 26. — P. 1534-1541.
14. Thorley M., Donaghey S., Edwards P., Copeland L., Kentish M., McLennan K., Lindsley J., Gascoigne-Pees L., Sakzewski L., Boyd R.N. Evaluation of the effects of botulinum toxin A injections when used to improve ease of care of comfort in children with cerebral palsy whom fre non-ambulant: a double blind randomized controlled trial // BMC Pediatr. — 2012. — № 9. — 120 p.
/53.jpg)
/53_2.jpg)

/54.jpg)
/55_5.jpg)
/56.jpg)