Статья опубликована на с. 69-74
Введение
В последнее время интерес к метаболическому синдрому (МС) стал смещаться из кардиологии [17] в сторону других областей медицины, что прослеживается в появлении научных работ, посвященных изучению кластеров МС, например, в офтальмологии, урологии и, естественно, диабетологии. Так, исследуется влияние длительности сахарного диабета (СД) на распространенность диабетической ретинопатии (ДР) у больных СД 2-го типа с МС [3], клинико-функциональные и метаболические взаимосвязи при ишемической болезни сердца и ДР у больных СД 2-го типа [2], роль тканевой ренин-ангиотензин-альдостероновой системы в развитии МС, СД и его сосудистых осложнений [7], биометрические и биохимические показатели МС или риска его возникновения у больных с доброкачественной гиперплазией предстательной железы [5].
Цель: изучить морфометрические и биохимические кластеры МС у пациентов с СД 2-го типа на разных стадиях ДР.
Материалы и методы
Исследования проведены у 83 пациентов (166 глаз), разделенных на две группы. Первая группа (контрольная) состояла из лиц с МС без СД 2-го типа (24 человека обоих полов, средний возраст — 49,26 ± 2,14 года), вторая — из 59 пациентов обоих полов с СД 2-го типа, МС и ДР (средний возраст — 58,20 ± 0,99 года, средняя длительность СД — 9,19 ± 0,16 года), которую в зависимости от стадии ДР разделили дополнительно на 3 исследуемые подгруппы.
Критерием включения в исследование было добровольное информированное согласие пациента на участие в исследовании. Критерии исключения: наличие эндокринной и соматической патологии, приводящей к ожирению (синдром Кушинга, гипотиреоз, постпубертатная форма диспитуитаризма, синдром поликистозных яичников, другие эндокринопатии, в том числе наследственные, церебральное ожирение), СД 1-го типа, острые инфекционные заболевания, онкологические заболевания (в том числе в анамнезе), декомпенсация коморбидной патологии, психические расстройства, прием нейролептиков и антидепрессантов, наличие протеинурии, макулопатии, глаукомы и катаракты.
Исследования выполнены в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации (2008).
Обследование и лечение больных СД 2-го типа проводили согласно Унифицированному клиническому протоколу первичной и вторичной (специализированной) медицинской помощи «Цукровий діабет 2-го типу» и Приказу МЗ Украины № 1118 от 21.12.2012 «Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при цукровому діабеті 2-го типу».
У всех пациентов исследуемой и контрольной групп измеряли рост, массу тела, рассчитывали индекс массы тела (ИМТ), регистрировали систолическое (САД) и диастолическое артериальное давление (ДАД), определяли концентрации общего холестерина (ОХС), холестерина липопротеинов высокой плотности (ХС ЛПВП), холестерина липопротеинов низкой плотности (ЛПНП) и триглицеридов (ТГ). Наличие МС в контрольной группе пациентов устанавливали согласно признанным Всемирной организацией здравоохранения Рабочим критериям экспертов Национального института здоровья США (Adult Treatment Panel III, ATP III, 2001) и консенсусу Всемирной федерации по изучению сахарного диабета (IDF) [11, 13].
Офтальмологическое обследование проводили по общепринятой методике, включающей визиометрию, тонометрию, биомикроскопию, офтальмоскопию, флуоресцентную ангиографию, при необходимости — когерентную томографию сетчатки. Диагноз ДР ставился согласно классификации, предложенной E. Kohner и M. Porta (1992), в которой выделяют 3 основные стадии диабетической ретинопатии: непролиферативную, препролиферативную и пролиферативную [15].
Сравнение независимых выборок проводилось с помощью дисперсионного анализа. Первоначально проверяли распределение количественных показателей по всей выборке данных на соответствие закону Гаусса. В зависимости от типа распределения данных использовали параметрический критерий Фишера или непараметрический критерий Крускала — Уоллиса. Статистические характеристики представлены в виде среднего арифметического (M) и стандартной ошибки (m), а также 95 % доверительного интервала (95% СІ). Для сопоставления результатов с альтернативной вариацией признака (увеличение — уменьшение) для оценки достоверности разницы была применена формула определения критерия t относительно связанных выборок, что вытекает из закона биномиального распределения (по формуле ван дер Вардена) [12]. Уровень статистической значимости различий р < 0,05. Статистический анализ данных проводился с помощью компьютерной программы SPSS9.0.
Результаты
Средний ИМТ у больных СД 2-го типа соответствовал ожирению первой степени, а в контрольной группе — второй степени, хотя доверительный интервал содержал индивидуальные данные, указывающие на наличие первой и второй степеней ожирения во всех группах. При этом относительная частота ожирения разной степени выраженности в группах больных СД была статистически значимо большей на первой стадии ДР (р < 0,001) и статистически значимо меньшей — на второй стадии ДР (р < 0,001). При этом в целом относительная частота ожирения во всех исследуемых группах была статистически значимо ниже, чем в контроле (р < 0,001). Увеличение окружности талии (ОТ) свыше рекомендуемой нормы (больше 94 см у мужчин и 80 см у женщин) было выявлено во всех исследуемых группах и в группе сравнения. Статистически значимые различия (р1 = 0,01) проявились в наибольшей ОТ у женщин на второй стадии ДР по сравнению с контрольной группой (табл. 1).
/70.jpg)
Повышение САД свыше верхней допустимой границы нормы было характерно как для больных СД, так и для пациентов контрольной группы. Среди пациентов с СД 2-го типа максимальное САД определялось на третьей стадии ДР, а минимальное — на второй стадии ДР. При этом относительная частота артериальной гипертензии (АГ) (по САД) была статистически значимо большей на первой и третьей стадиях ДР по сравнению с контролем (р < 0,001) и достигла наибольшего значения на третьей стадии ДР. Выявлено также статистически значимое (р < 0,001) уменьшение относительной частоты АГ (по САД) на второй стадии ДР по сравнению с другими стадиями. Превышение нормального уровня ДАД фиксировалось на первой, третьей стадиях ДР и в контрольной группе, в то время как на второй стадии ДР ДАД было статистически значимо ниже (р = 0,05) по сравнению с другими стадиями ДР. Относительная частота АГ по ДАД была статистически значимо большей (р < 0,02) на первой и третьей стадиях ДР по сравнению с группой контроля и статистически значимо меньшей (р < 0,001) — на второй стадии ДР по сравнению с другими стадиями и контролем (табл. 2).
/71.jpg)
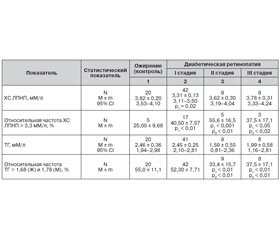
Исследование биохимических (лабораторных) параметров МС показало, что у пациентов с ожирением и у больных с СД 2-го типа средняя концентрация ОХС превышала верхнюю границу нормы. При этом в группе диабетических больных содержание ОХС в плазме крови было меньше, чем в контрольной группе, что подтвердилось при сравнении относительной частоты гиперхолестеринемии. Так, было выявлено статистически значимое ее уменьшение на всех стадиях ДР (р < 0,001, р < 0,02, р < 0,01 соответственно) без статистически значимых межгрупповых различий между ними. Концентрация ХС ЛПВП в целом находилась в пределах нормальных значений как в исследуемых группах, так и в группе контроля со статистически значимым (р = 0,04) увеличением его содержания в группе больных со второй стадией ДР по сравнению с первой стадией. Относительная частота сниженной концентрации ХС ЛПВП оказалась статистически значимо меньшей во всех исследуемых группах по сравнению с контролем (р < 0,01, р < 0,001, р < 0,001 соответственно). При этом выявлено, что среди пациентов с СД статистически значимая наиболее высокая относительная частота сниженной концентрации ХС ЛПВП характерна для первой стадии ДР (табл. 3).
/72.jpg)
Содержание ХС ЛПНП, в отличие от ХС ЛПВП, превышало верхнюю границу нормы как в контроле, так и у пациентов с СД 2-го типа со статистически значимым (р = 0,02) его снижением на первой стадии ДР по сравнению с контрольной группой. Обнаружено, что относительная частота дислипидемии (по ХС ЛПНП) статистически значимо больше на всех стадиях ДР по сравнению с группой контроля (р < 0,01, р < 0,001, р < 0,05 соответственно). При этом имеет место статистически значимое (р < 0,01) увеличение относительной частоты дислипидемии (по ХС ЛПНП) у пациентов со второй стадией ДР по сравнению с первой стадией, а также статистически значимое уменьшение относительной частоты искомой дислипидемии в группе с третьей стадией ДР по сравнению со второй стадией (р < 0,02) (табл. 4). Характерно, что величина относительной дислипидемии на третьей стадии ДР (37,5 ± 17,1) (%) фактически достигла величины, свойственной первой стадии (40,50 ± 7,57) (%). Концентрация ТГ во всех исследуемых группах и в контроле была выше верхней границы нормы, находясь на уровне контрольной группы у пациентов на первой стадии ДР и снижаясь у пациентов со второй и третьей стадиями ДР. При этом выявлено статистически значимое снижение относительной частоты гипертриглицеридемии у пациентов со второй и третьей стадиями ДР по сравнению с первой (р < 0,01) и контрольной группой (р < 0,01) (табл. 4).
/72_2.jpg)
Обсуждение результатов
Результаты собственных исследований по изучению морфометрических, функциональных и биохимических кластеров МС у пациентов с СД 2-го типа на разных стадиях ДР показывают, что все пациенты с ДР имеют фенотипические и клинико-биохимические признаки метаболического синдрома, а именно: ожирение, судя по ИМТ (31,7–36,3 кг/м2), увеличенная ОТ вне зависимости от пола (до 118,3 см у мужчин и до 128,7 см у женщин), артериальную гипертензию (САД до 164 мм рт.ст. и ДАД до 96 мм рт.ст.), дислипидемию (повышение фракции ХС ЛПНП до 4,24 мМ/л) на фоне гиперхолестеринемии (до 6,63 мМ/л) и гипертриглицеридемии (до 2,81 мМ/л). Сходные с нашими данные, однако без распределения пациентов на стадии диабетической ретинопатии, были получены Р. Гусейновой и В. Мирзазаде (2010) [3]. В работе были проанализированы результаты обследования 115 больных СД 2-го типа с МС и 45 больных СД 2-го типа без МС. Авторами показано повышение, как и в наших исследованиях, ИМТ, САД и ДАД, триглицеридов, общего холестерина и ХС ЛПНП при нормальных показателях ХС ЛПВП у больных СД 2-го типа с МС, однако при труднообъяснимом отсутствии достоверной разницы этих показателей с пациентами с СД 2-го типа без МС.
По результатам работы видно, что ДР стартует на фоне ожирения у 83,4 % больных (с увеличением ОТ), АГ — у 71,4 % больных, гиперхолестеринемии — у 61,9 %, дислипидемии — у 47,6 % больных и гипертриглицеридемиии — у 52,3 %. Развитие ДР сопровождается такими неблагоприятными статистически значимыми изменениями показателей МС, как увеличение относительной частоты (удельного веса пациентов) АГ (по САД и ДАД), повышение относительной частоты дислипидемии на фоне ожирения, гиперхолестеринемии и гипертриглицеридемии.
Дальнейшее прогрессирование ДР ассоциируется с увеличением окружности талии у женщин (на второй стадии), определенным снижением удельного веса пациентов с ожирением (на второй и третьей стадиях), увеличением удельного веса пациентов с дислипидемией (по фракции ХС ЛПНП) (на второй стадии) на фоне сохранения высокого удельного веса пациентов с АГ по САД и ДАД (на третьей стадии), гиперхолестеринемии, стабильных показателей ХС ЛПВП и снижения (но не до нормы) концентрации ТГ в крови (на второй и третьей стадиях).
Повышение относительной частоты АГ указывает на то, что пациенты на третьей стадии ДР находятся в группе повышенного риска возникновения сосудистых событий, в том числе и на глазном дне, поскольку уровень контроля артериального давления у них не соответствует принятым международным и украинским протоколам и клиническим рекомендациям. Так, анализ научных доказательств, проведенный Ю.М. Сіренко (2012) [6], показывает, что оптимальным уровнем артериального давления для предотвращения развития сердечно-сосудистых осложнений у больных СД 2-го типа являются: САД — 130–135 мм рт.ст. и ДАД — < 80 мм рт.ст., а не < 140/80 мм рт.ст., как указано в Европейских рекомендациях по профилактике сердечно-сосудистых заболеваний 2012 года [10]. Учитывая наличие отечественных клинических рекомендаций «Артериальная гипертензия» и Унифицированного клинического протокола, утвержденных приказом МЗ Украины № 384 от 24.05.2012 [1], по мнению украинских кардиологов, не следует изменять целевой уровень АД для больных СД 2-го типа, утвержденный в них, — 130/< 80 мм рт.ст. В нашем исследовании пациенты с ДР не достигают оптимального уровня контроля артериального давления.
Роль АГ как второго (после состояния компенсации углеводного обмена) значимого фактора риска развития и прогрессирования ДР была установлена, как показано в обзоре данных литературы и клинических исследований М.Л. Кирилюк (2012) [4], М.A. Testa и соавт. [16] еще в 1985 году, которые установили, что даже незначительное увеличение АД в пределах значений от 130/80 до 140/90 мм рт.ст. ускоряет прогрессирование ДР.
Исследование WESDR [14] показало, что при СД высокое ДАД является таким же мощным фактором риска ДР, как и неудовлетворительная компенсация СД. Присутствие АГ в дебюте заболевания сопровождалось увеличением риска развития пролиферативной стадии ДР на 91 %. Наименьший риск ДР отмечается при ДАД < 75 мм рт.ст. Другими авторами также было показано, что развитие и прогрессирование ДР в большей степени коррелирует с уровнем диастолического АД [9].
Анализ собственных данных биохимических исследований показывает, что концентрация ХС ЛПНП в крови у пациентов с ожирением и у больных с ДР не соответствует клиническим рекомендациям Европейского кардиологического общества и Европейского общества атеросклероза (ESC/EAS) 2016 года [8], согласно которым содержание ХС ЛПНП в крови у больных с МС и СД 2-го типа (эти две патологии сейчас уже не рассматриваются отдельно) не должна превышать 2,6 мМ/л, а триглицеридемия натощак и после еды должна быть менее 1,8 мМ/л. Факт снижения относительной частоты гипертриглицеридемии на второй-третьей стадиях ДР указывает, возможно, на то, что она играет важную роль на ранних стадиях ДР, являясь одним из пусковых патогенетических механизмов ее развития.
Резюмируя полученные результаты анализа формирования и проявления кластеров МС при СД 2-го типа у офтальмологических больных, можно сказать, что пациенты с ДР — это больные с формирующимся андроидным ожирением, АГ, гиперхолестеринемией, дислипидемией, гипертриглицеридемией, то есть с классическими кластерами МС.
Можно отметить некоторые особенности: у больных с СД 2-го типа и ДР меньше величина относительной частоты ожирения, гиперхолестеринемии, гипертриглицеридемии и больше величина относительной частоты АГ.
Выводы
1. Возникновение непролиферативной стадии ДР характеризуется такой статистически значимой негативной динамикой кластеров МС, как возрастание на фоне ожирения удельного веса больных с АГ и дислипидемией по сравнению с контролем.
2. Переход в препролиферативную стадию ДР характеризуется статистически значимым дальнейшим увеличением относительной частоты дислипидемии по сравнению с первой стадией и формированием абдоминального ожирения (увеличением ОТ) у женщин.
3. Развитие пролиферативной стадии ДР ассоциируется со статистически значимым повышением относительной частоты АГ по сравнению со второй стадией на фоне ожирения, дислипидемии и гипертриглицеридемии.
4. Пациенты с СД 2-го типа на третьей стадии ДР находятся в группе повышенного риска возникновения сосудистых событий, в том числе и на глазном дне, что необходимо учитывать при хирургическом, физиотерапевтическом и медикаментозном лечении.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов при подготовке статьи.
Список литературы
1. Артеріальна гіпертензія. Оновлена та адаптована клінічна настанова, заснована на доказах. Додаток до Наказу МОЗ України № 384 від 24.05.2012 «Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при артеріальній гіпертензії». — www.moz.gov.ua/ua/portal/dn_20120524_384.html.
2. Боданова А.А., Мкртумян А.М., Давыдов А.Л. и др. Структура поздних сосудистых осложнений при впервые выявленном сахарном диабете 2 типа // Сахарный диабет. — 2006. — Т. 9, № 4. — С. 35-37. — DOI: http://dx.doi.org/10.14341/2072-0351-6187.
3. Гусейнова Р.Р., Мирзазаде В.А. Влияние длительности сахарного диабета на распространенность диабетической ретинопатии у больных сахарным диабетом 2 типа с метаболическим синдромом // Сахарный диабет. — 2010. — Т. 13, № 2. — С. 94-96. — DOI: http://dx.doi.org/10.14341/2072-0351-5682.
4. Кирилюк М.Л. Медикаментозное лечение и профилактика диабетической ретинопатии при сахарном диабете 1 типа // Міжнародний ендокринологічний журнал. — 2012. — № 5(45). — С. 70-75.
5. Кирилюк М.Л., Костєв Ф.І., Підаєв А.В., Шаталюк С.С. Біометричні та біохімічні показники метаболічного синдрому або ризику його виникнення у хворих із доброякісною гіперплазією передміхурової залози // Клінічна ендокринологія і ендокринна хірургія. — 2012. — № 3(40). — С. 53-58.
6. Сіренко Ю.М. Цільовий рівень АТ при цукровому діабеті 2-го типу: оцінка наукових доказів // Міжнародний ендокринологічний журнал. — 2012. — № 6(46). — С. 10-14.
7. Шестакова М.В. Роль тканевой ренин-ангиотензин-альдостероновой системы в развитии метаболического синдрома, сахарного диабета и его сосудистых осложнений // Сахарный диабет. — 2010. — Т. 13, № 3. — С. 14-19. — DOI: http://dx.doi.org/10.14341/2072-0351-5481.
8. Catapano A.L., Graham I., de Backer G. et al. 2016 ESC/EAS Guidelines for the Management of Dyslipidaemias // European Heart Journal. — 2016. — Vol. 37, Issue 39. — P. 2999-3058. — doi:10.1093/eurheartj/ehw272.
9. Chase H.P., Garg S.K., Jackson W.E. et al. Blood pressure and retinopathy in type 1 diabetes // Ophtalmology. — 1990. — № 97. — P. 155-159.
10. European Guidelines on cardiovascular disease prevention in clinical practice (version 2012). The Fifth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice // Eur. Heart J. — 2012. — Vol. 33(13). — P. 1635-1701.
11. Executive summary of the third report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) // JAMA. — 2001. — Vol. 285. — Р. 2486-2497.
12. Glantz S.A. Primer of biostatistics. 4th Edition. — McGraw-Hill, New York, St. Louis, San-Francisco, Madrid, Milan, Sydney, Tokyo, Toronto; 1994.
13. Grundy S.M., Cleeman J.I., Daniels S.R. et al. Diagnosis and Management of the Metabolic Syndrome // Circulation. — 2005. — Vol. 112. — P. 2735-2752. — http://dx.doi.org/10.1161/CIRCULATIONAHA.105.169404.
14. Klein R., Klein B.E.K., Moss S.E. et al. The Wisconsin Epidemiologic Study of Diabetic Retinopathy. XVII. The 14-year incidence and progression of diabetic retinopathy and associated risk factors in type 1 diabetes // Ophtalmology. — 1998. — Vol. 105. — P. 1801-1805.
15. Kohner E.M., Porta M. Screening for diabetic retinopathy in Europe: A field handbook. — Boehringer Mannheim, Italy, 1992.
16. Testa M.A., Puklin J.E., Sherwin R.S. et al. Clinical predictors of retinopathy and its progression in patients with type 1 diabetes during CSII and conventional insulin treatment // Diabetes. — 1985. — Vol. 34(Suppl. 3). — P. 61-68.
17. The metabolic syndrome and cardiovascular disease mortality in middle-aged men / H.-M. Lakka, D.E. Laaksonen, T.A. Lakka [et al.] // JAMA. — 2002. — Vol. 283. — P. 2909-2916.

/70.jpg)
/71.jpg)
/72.jpg)
/72_2.jpg)