Статтю опубліковано на с. 20-26
Вступ
Спастичність — частий неврологічний розлад, елемент синдрому центрального парезу, притаманний для 85 % випадків розсіяного склерозу [1], 35 % — гострого порушення мозкового кровообігу з персистуючою геміплегією [2], 72–91 % — дитячого церебрального паралічу [3], 45–78 % — спінальної травми [4–8]. Тяжкі форми спастичності з розвитком контрактур у паретичних кінцівках протягом 1-го року спостерігають в 11–43 % спінальних хворих [9]. Станом на 2005 рік у світі проживало 2,5 млн осіб, які перенесли хребетно-спинномозкову травму [10]. Отже, контингент спінальних хворих, які страждають від синдрому спастичності, становить тепер не менше 2 млн осіб.
Традиційне визначення спастичності (за Lance J.W., 1980): це руховий розлад, для якого характерне посилення рефлексів розтягу (міотатичних рефлексів), обумовлене надмірною збудливістю нейронального апарату, є компонентом синдрому центрального парезу [11]. Сучасні дані свідчать, що цей розлад є наслідком неадекватної компенсації втрати збуджуючих супраспінальних впливів на мотонейрони нижче рівня травми. Нормальна функція мотонейрона полягає в чітко окресленому в часі підсиленні точних низхідних супраспінальних впливів до величини, достатньої для активації м’яза. Це забезпечується здатністю мотонейронів у відповідь на супраспінальні серотонін- та норадренергічні впливи, синхронні до тригерних кірково-спинномозкових, генерувати так звані платоподібні підпорогові деполяризаційні потенціали; за наявності платодеполяризації поодинокі збуджувальні кірково-спинномозкові впливи призводять до кількасекундного розрядження мотонейронів у вигляді пачок потенціалів дії (ПД), достатнього для формування збуджуючого електричного впливу на м’яз задовільної інтенсивності [12, 13]. Після спінальної травми денервовані мотонейрони поступово набувають здатності генерувати платоподібні деполяризаційні потенціали незалежно від супраспінальних впливів [13]. На початкових етапах травми, під час нівелювання спінального шоку, збільшення збудливості мотонейронів нижче рівня травми пов’язане з підвищенням експресії субодиниць NMDA-рецепторів глутамату [14], збільшенням активності глутаматергічних аферентів мотонейронів [15]. Починаючи з третього тижня (не раніше 14-ї доби, зазвичай через кілька тижнів після спінальної травми) [13, 16] провідну роль відіграє механізм зміни редагування пре-мРНК серотонінових 5-НТ2С і, ймовірно, норадреналінових α1-рецепторів мотонейрона [17–19]. У певних точках пре-мРНК деаміназа ADAR2 (adenine deaminase acting on RNA 2) перетворює аденозин в інозин, що системою трансляції розпізнається як гуанозин, що змінює амінокислотну послідовність і зменшує афінність рецептора до ліганду — нередагований варіант має значну конституційну, незалежну від наявності ліганду активність [16, 20, 21]. За умов спінальної травми експресія ADAR2 у тканині спинного мозку зменшується [18].
З урахуванням наведених даних актуалізуються дослідження впливу нейроінженерних втручань на перебіг синдрому спастичності, оскільки їх ефективність щодо відновлення функції травмованого спинного мозку зазвичай пов’язують із протизапальними, ней–ропротекторними та ремієлінізуючими ефектами [22]. Такого роду дослідження нині проводяться рідко [23, 24] і не торкаються випадків трансплантації мезенхімальних стовбурових клітин у комплексі зі штучними матриксами.
Зважаючи на це, ми дослідили вплив імплантації фрагментів аморфного макропористого біосумісного матриксу NeuroGelTM [25–30], асоційованого з ксеногенними стовбуровими клітинами кісткового мозку (СККМ), на перебіг синдрому спастичності при експериментальній спінальній травмі.
Матеріали та методи
Дослідження виконано з дотриманням існуючих норм біоетики на білих безпородних щурах-самцях (віварії ДУ «Інститут нейрохірургії імені акад. А.П. Ромоданова НАМН України» та Інституту фізіології імені О.О. Богомольця НАН України) віком 5 міс. і масою 250 г, утримуваних у стандартних умовах. Сформовано 3 експериментальні групи: «контроль» — травма спинного мозку (n = 16); «нейрогель» — травма спинного мозку + гомотопічна імплантація фрагмента NeuroGelTM (n = 20); «нейрогель + СККМ» — травма спинного мозку + гомотопічна імплантація фрагмента NeuroGelTM, асоційованого зі СККМ зрілої миші (n = 16).
Макропористий гідрогель NeuroGelTM (полі[N-(2-гідроксипропіл)-метакриламід]) є комерційним препаратом, синтезованим у лабораторії E. Pinet (FISO Technologies Inc., Quebec, Канада) шляхом гетерогенної полімеризації та асоціації, має пори різних розмірів — < 2, 2–50 та 51–300 нм [26].
СККМ отримували від мишей-самців, позитивних за експресією зеленого білка флуоресценції (лінія FVB-Cg-Tg(GFPU)5Nagy/J), віком 3 міс. і масою 40 г, шляхом вимивання зі стегнових кісток середовищем RPMI‑1640 (Sigma, США). Із цією метою в глибоко анестезованої тварини (внутрішньоочеревинне введення суміші розчинів ксилазину (Sedazіn, Bіowet, Польща; 15 мг/кг) та кетаміну (Calypsol, «Гедеон Ріхтер А.О.», Угорщина; 70 мг/кг)) обидві стегнові кістки в стерильних умовах видаляли шляхом перетину в ділянках колінного та кульшового суглобів, очищали від м’яких тканин, поміщали в 70 % розчин етилового спирту, обидва епіфізарні кінці кожної кістки стинали, під тиском через діафіз за допомогою інсулінового шприца пропускали рідке середо–вище RPMI‑1640, вимиваючи вміст порожнини кістки. Для підрахунку кількості клітин в отриманому змиві його об’ємну одиницю змішували з 3% розчином оцтової кислоти в пропорції 1 : 20 і переглядали в камері Горяєва. Клітинний змив вносили в культуральний флакон із площею поверхні 25 см2 або чашку Петрі діаметром 60 мм, загальна кількість клітин становила не менше 10 млн. У подальшому клітини висівали по 4 • 105 клітин/см2 та культивували в СО2-інкубаторі в умовах зволоженого повітря з 5% СО2 при температурі 37 °С протягом 2 тижнів, змінюючи живильне середовище кожні 2–3 доби. Перший пасаж проводили при 80% конфлуентності моношару, знімаючи клітини за допомогою 0,02% розчину трипсину/версену (Sigma, США), та пересаджували їх в нові флакони з щільністю 2 • 104 клітин/см2. СККМ на другий пасаж висаджували в 4-лункові планшети по 3 × 104 у кожну лунку та культивували протягом 7 діб.
Частку життєздатних клітин у суспензії визначали на лазерному цитофлюориметрі-сортері BD FACSAria (Becton Dickinson, США) за рівнем накопичення в клітині флуоресцентного ДНК-зонда 7-аміноактиноміцину. Упродовж експерименту частка життєздатних клітин становила 94,1 ± 0,6 %.
Культивування СККМ здійснювали в середовищі, що містило 42,5 % RPMI‑1640 (Sigma, США), 42,5 % DMEM, 15 % фетальної бичачої сироватки, 2 mM L-глутаміну, 1 нг/мл основного фактора росту фібробластів (Sigma, США). Фенотипування клітин за маркерами CD34, CD44, CD45, CD73, CD90, CD117 проводили з використанням моноклональних антитіл до мембранних антигенів миші, мічених флуорохромами (Becton Dickinson, США). Клітини культури досліджували на здатність до направленого диференціювання в адипогенному та остеогенному напрямках. Проадипогенне диференціювання включало культивування в середовищі DMEM із високим вмістом глюкози (4,5 г/л; Sigma, СШA), 5 % конячої сироватки та 10 % ембріональної телячої сироватки (Sigma, СШA), 1 мкл дексаметазону (Sigma, СШA), 200 мкл індометацину (Sigma, СШA), 500 мкл ізобутилметилксантину (Sigma, СШA) та 5 мкг/мл інсуліну (Sigma, СШA); середовище змінювали тричі на тиждень; тривалість диференціації — 14 діб. Середовище для проостеогенного диференціювання містило: DMEM з низьким вмістом глюкози (1 г/л; Sigma, СШA), 10 % ембріональної телячої сироватки (Sigma, СШA), 100 нМ дексаметазону (Sigma, СШA), 10 мМ β-гліцерофосфату (Sigma, СШA) та 50 мкг/мл аскорбат‑2-фосфату (Sigma, СШA). Середовище змінювали тричі на тиждень; тривалість диференціювання — 30 діб. За спектром експресії поверхневих маркерів та здатністю до спрямованого диференціювання клітини відповідали ознакам СККМ.
Через 5 діб культивування в середовище укладали фрагменти NeuroGelTM розміром 16 мм3, культивували протягом 10 діб, до моменту трансплантації. Фрагменти розтинали на рівновеликі частини розміром 2 мм3, одну з яких фіксували для імуногістохімічної верифікації асоційованих клітин у товщі матриксу, інші використовували для трансплантації. За даними імуногістохімічного дослідження, СККМ добре проникають у товщу гелю, колонізують наявні у ньому пори, проявляють ознаки активної життєдіяльності та диференціювання.
Модель спінальної травми — лівобічне пересічення половини спинного мозку зрілого щура на рівні Т11 [31]. Оперативні втручання здійснювали в умовах загального знеболювання (внутрішньоочеревинне введення суміші розчинів ксилазину (Sedazіn, Bіowet, Польща; 15 мг/кг) і кетаміну (Calypsol, «Гедеон Ріхтер А.О.», Угорщина; 70 мг/кг)), після виконання доступу до спинного мозку на рівні Т11 здійснювали наскрізний прокол його тканини в дорсовентральному напрямку зразу ж ліворуч від задньої серединної судини, у сформований канал вводили браншу офтальмологічних ножиць, другою браншею охоплювали лівий півокіл спинного мозку і перетинали його в кілька прийомів, повноту перетину забезпечували проведенням кінця складених бранш зігнутого по ребру мікропінцета по внутрішній поверхні лівої частини стінки каналу хребта. У тварин групи «ней–рогель» у рану спинного мозку імплантували фрагмент NeuroGelTM розміром ~ 1 мм3, у тварин групи «нейрогель + СККМ» — фрагмент NeuroGelTM, асоційований із ксеногенними СККМ. У тварин усіх експериментальних груп вікно доступу в хребтовий канал прикривали фрагментом підшкірної фасції, м’які тканини та шкіру з’єднували крученими поліамідними хірургічними нитками (ум. № 1, ПАТ «Київхімволокно») у два ряди вузлових швів, ділянку рани обробляли 5% спиртовим розчином йоду. У задню шийну ділянку підшкірно вводили розчин біциліну‑5 (ПАТ «Київмедпрепарат»; ~ 150–200 тис. ОД на 1 тварину), внутрішньоочеревинно — розчин дексаметазону (KRKA, Словенія; 6 мг/кг). Після вказаних маніпуляцій протягом 2–4 годин тварин утримували в приміщенні з підвищеною температурою повітря (30 °C), надалі — у клітках по 3–6 особин при середній температурі 21–24 °C.
Показник функції (ПФ) задньої іпсилатеральної щодо зони травми кінцівки (ЗІК) визначали згідно зі шкалою D.M. Basso, M.S. Beattie та J.C. Bresnahan (ВВВ) [31, 32] (діапазон — 0–21 бал); показник спастичності (ПС) ЗІК — згідно зі шкалою Ashworth [33], що загалом включає виявлення легкого підвищення тонусу м’язів кінцівки під час пасивних рухів (1 бал), відчутного підвищення тонусу м’язів протягом усього обсягу пасивного руху (2 бали), значного підвищення тонусу м’язів з обмеженням пасивних рухів (3 бали), вираженої ригідності та контрактури досліджуваного суглоба (4 бали). Дослідження рівня спастичності здійснювали на рівні надп’ятково-гомілкового та колінного суглоба ЗІК. Визначення ПФ та ПС ЗІК здійснювали протягом перших 2 місяців — наприкінці кожного тижня, у подальшому — наприкінці кожного місяця.
Тривалість спостереження для усіх тварин становила 28 тижнів; виведення тварин з експерименту здійснювали шляхом передозування вказаних вище наркотичних препаратів.
Статистичну обробку даних здійснювали за допомогою програмного пакета Statistica 10.0, для встановлення вірогідності різниці середніх значень ПФ ЗІК між групами використовували U-тест Манна — Уїтні, результати оцінки вірогідності подавали у вигляді значень показника р із звичним їх трактуванням. Вірогідність різниці ПФ та ПС ЗІК на різних термінах спостереження кожної окремо взятої групи оцінювали за Уїлкоксоном. Кореляцію між значеннями ПС та ПФ ЗІК тварин групи на кожному з термінів дослідження, на різних термінах спостереження кожної тварини, а також середніх по групі значень ПФ та ПС ЗІК упродовж експерименту оцінювали за допомогою непараметричного коефіцієнта рангової кореляції Спірмена, результати оцінки виражали у вигляді значення коефіцієнта r зі звичним їх трактуванням.
Результати та обговорення
Імплантація NeuroGelTM нормалізує розподіл значень ПС ЗІК (рис. 1а, б), трансплантація СККМ, асоційованих із NeuroGelTM, видозмінює його (рис. 1в).
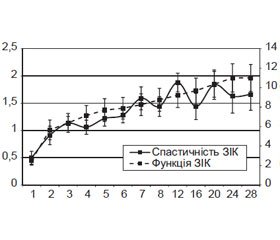
Найінтенсивніший, лінійний приріст значень ПС ЗІК (до 1,8 ± 0,3 бала за шкалою Ashworth; р < 0,05) у групі «контроль» спостерігали протягом 1-го місяця (рис. 2); протягом 6–8-го тижня відмічали повільніше збільшення зі сталою швидкістю (протягом 6–7-го тижня — вірогідне, р < 0,05), протягом 5-го місяця реєстрували вірогідне (р < 0,05) збільшення показника до 2,6 ± 0,4 бала, у подальшому — невірогідне зменшення до 2,5 ± 0,4 бала, що відповідало суттєвому підвищенню мимовільного опору м’язів ЗІК при пасивних рухах у тестованих суглобах за умов обмеження діапазону цих рухів.
/20-26/23-1.jpg)
Перший період значущого (р ≤ 0,005) приросту ПС ЗІК у групі «нейрогель» (рис. 2) виявляли на 3-му тижні (до 1,0 ± 0,2 бала за шкалою Ashworth), другий — протягом 7-го тижня (1,4 ± 0,1 бала), третій — протягом 5-го місяця (до 1,8 ± 0,2 бала), у подальшому значущих змін не виявляли. Станом на 28-й тиждень спостереження ПС ЗІК становив 1,7 ± 0,2 бала, що відповідало суттєвому підвищенню мимовільного опору м’язів ЗІК при пасивних рухах у тестованих суглобах за умов обмеження діапазону цих рухів.
Динаміка ПС ЗІК у групі «нейрогель + СККМ» відповідає виявленій для групи «нейрогель» (рис. 2), відрізняючись відсутністю значущого приросту протягом 3-го тижня, наявністю значущого приросту протягом 3–5-го місяця. Станом на 28-й тиждень спостереження ПС ЗІК у групі становив 1,7 ± 0,3 бала за шкалою Ashworth.
Значущу різницю між значеннями ПФ ЗІК у групах «нейрогель» та «контроль» виявляли на 7-му добу та на 5–7-му і 12–24-му тижнях, між групами «нейрогель + СККМ» та «контроль» — на 7-му добу та 7–8-му та 16-му тижнях; максимальну різницю ПС ЗІК між групами «нейрогель + СККМ» та «нейрогель» — на 12-му тижні спостереження (р = 0,059).
При аналізі кореляції індивідуальних значень ПФ та ПС ЗІК кожної тварини на різних термінах спостереження в групі «контроль» виявлені 3 тварини (18,8 %) із помірною та сильною від’ємною кореляцією (r = –0,69, r = –0,84, r = –0,64 відповідно), 1 — з помірною додатною кореляцією (r = 0,61); у групі «нейрогель» — 3 тварини (20 %) із помірною додатною кореляцією (r = 0,7), 1 — із помірною від’ємною кореляцією (r= –0,57); у групі «нейрогель + СККМ» — 1 тварину із сильною (r = 0,94) та 2 — із помірною додатною кореляцією (r = 0,58, r = 0,69).
При аналізі кореляції індивідуальних значень ПФ та ПС ЗІК різних тварин на кожному з термінів спостереження в групі «контроль» виявлено помірну та сильну від’ємну кореляцію (r < –0,5) на 3–6-му та 8–28-му тижнях; у групі «нейрогель» — сильну (r ≤ –0,75) та помірну (–0,75 < r ≤ –0,65) від’ємну кореляцію на 12–
28-му та 3–8-му тижнях відповідно; у групі «нейрогель + СККМ» — сильну (12–28-й тиждень, r ≤ –0,79) та помірну (3-й, 5–7-й тиждень, —0,73 ≤ r ≤ –0,58) від’ємну кореляцію.
При аналізі кореляції середніх по групі значень ПФ та ПС ЗІК на різних термінах спостереження для групи «контроль» виявлено помірну додатну кореляцію (r = 0,38 за Спірменом, r = 0,62 за Пірсоном), для групи «нейрогель» — сильну додатну кореляцію (r = 0,94 за Спірменом), для групи «нейрогель + СККМ» — сильну додатну кореляцію (r = 0,9 за Спірменом), що відповідає картині, отриманій при співставленні динаміки обох показників у часі (рис. 3).
Висновки
1. Імплантація NeuroGelTM суттєво полегшує перебіг синдрому післятравматичної спастичності.
2. Трансплантація СККМ у комплексі з NeuroGelTM не призводить до значущих змін величини ПС ЗІК порівняно з ізольованою імплантацією NeuroGelTM, однак суттєво змінює динаміку синдрому спастичності.
3. На відміну від групи «контроль» у разі імплантації NeuroGelTM та NeuroGelTM, асоційованого зі СККМ, при від’ємній кореляції індивідуальних значень ПФ та ПС ЗІК у межах кожного з термінів спостереження визначали сильну додатну кореляцію значень обох показників, усереднених по групах, упродовж загального періоду спостереження.
Список литературы
1. Prevalence and treatment of spasticity reported by multiple sclerosis patients / M.A. Rizzo, O.C. Hadjimichael, J. Preiningerova, T.L. Vollmer // Mult. Scler. — 2004. — Vol. 10, № 5. — P. 589-595.
2. Spasticity after stroke: its occurrence and association with motor impairments and activity limitations / D.K. Sommerfeld et al. // Stroke. — 2004. — Vol. 35, № 1. — P. 134-139.
3. Odding E. The epidemiology of cerebral palsy: incidence, impairments and risk factors / E. Odding, M.E. Roebroeck, H.J. Stam // Disabil. Rehabil. — 2006. — Vol. 28, № 4. — P. 183-191.
4. Maynard F.M. Epidemiology of spasticity following traumatic spinal cord injury / F.M. Maynard, R.S. Karunas, W.P. Waring // Arch. Phys. Med. Rehabil. — 1990. — Vol. 71, № 8. — P. 566-569.
5. Skold C. Spasticity after traumatic spinal cord injury: nature, severity, and location [Text] / C. Skold, R. Levi, A. Seiger // Phys. Med. Rehabil. — 1999. — Vol. 80, № 12. — P. 1548-1557.
6. A database of self-reported secondary medical problems among VA spinal cord injury patients: its role in clinical care and management [Text] / J.S. Walters et al. // J. Rehabil. Res. Dev. — 2002. — Vol. 39, № 1. — P. 53-61.
7. Spasticity, an impairment that is poorly defined and poorly measured / S. Malhotra, A.D. Pandyan, C.R. Day, P.W. Jones, H. Hermens // Clin. Rehabil. — 2009. — Vol. 23, № 7. — P. 651-658.
8. Longitudinal changes in medical complications in adults with pediatric-onset spinal cord injury / M. Hwang, K. Zebracki, K.M. Chlan, L.C. Vogel // J. Spinal Cord Med. — 2014. — Vol. 37, № 2. — P. 171-178.
9. Incidence and predictors of contracture after spinal cord injury — a prospective cohort study / J. Dion et al. // Spinal Cord. — 2012. — Vol. 50, № 8. — P. 579-584.
10. Adams M. International campaign for cures of spinal cord injury paralysis (ICCP): another step forward for spinal cord injury research [Text] / M. Adams, J.F. Cavanagh // Spinal Cord. — 2004. — Vol. 42, № 5. — P. 273-280.
11. Nielsen J.B. The spinal pathophysiology of spasticity — from a basic science point of view / J.B. Nielsen, C. Crone, H. Hultborn // Acta Physiol. (Oxf.) — 2007. — Vol. 189, № 2. — P. 171-180.
12. Heckman C.J. Persistent inward currents in motoneuron dendrites: implications for motor output [Text] / C.J. Heckman, M.A. Gorassini, D.J. Bennett // Muscle Nerve. — 2005. — Vol. 31, № 2. — P. 135-156.
13. Recovery of neuronal and network excitability after spinal cord injury and implications for spasticity [Text] / J.M. D’Amico, E.G. Condliffe, K.J.B. Martins et al. // Front. Int. Neurosci. — 2014. — Vol. 8, Art. 36. — P. 1-24.
14. Global gene expression analysis of rodent motor neurons following spinal cord injury associate molecular mechanisms with development of post — injury spasticity [Text] / J. Wienecke et al. // J. Neurophysiol. — 2010. — Vol. 103, № 2. — P. 761-778.
15. Spinal shock revisited: a four-phase model [Text] / J.F. Ditunno et al. // Spinal Cord. — 2004. — V. 42, № 7. — P. 383-395.
16. The time course of serotonin 2C receptor expression after spinal transection of rats: an immunohistochemical study [Text] / L-Q. Ren et al. // Neuroscience. — 2013. — Vol. 236. — P. 31-46.
17. Recovery of motoneuron and locomotor function after spinal cord injury depends on constitutive activity in 5-HT2C receptors [Text] / K.C. Murray, A. Nakae, M.J. Stephens et al. // Nature Med. — 2010. — Vol. 16, № 6. — P. 694-701.
18. Decrease of mRNA editing after spinal cord injury is caused by down-regulation of ADAR2 that is triggered by inflammatory response [Text] / A.F. Di Narzo, A. Kozlenkov, Y. Ge et al. // Sci. Rep. — 2015. — Vol. 5, Art. 12615. — P. 1-15.
19. Serotonergic transmission after spinal cord injury [Text] / R. Nardone, Y. Holler, A. Thomschewski et al. // J. Neural. Transm. (Vienna). — 2015. — Vol. 122, № 2. — P. 279-295.
20. Regulation of serotonin‑2C receptor G-protein coupling by RNA editing [Text] / C.M. Burns et al. // Nature. — 1997. — Vol. 387, № 6630. — P. 303-308.
21. RNA editing of the human serotonin 5-hydroxytryptamine 2C receptor silences constitutive activity [Text] / C.M. Niswender, S.C. Copeland, K. Herrick-Davis et al. // J. Biol. Chem. — 1999. — Vol. 274, № 14. — P. 9472-9478.
22. Oliveri R.S. Mesenchymal stem cells improve locomotor recovery in traumatic spinal cord injury: Systematic review with meta-analyses of rat models [Text] / R.S. Oliveri, S. Bello, F. Biering-Sørensen // Neurobiol. Dis. — 2014. — Vol. 62. — P. 338-353.
23. Clinical observation of fetal olfactory ensheathing glia transplantation (OEGT) in patients with complete chronic spinal cord injury [Text] / J. Wu et al. // Cell. Transplant. — 2012. — Vol. 21, Suppl. 1. — P. 33-37.
24. Amelioration of motor/sensory dysfunction and spasticity in a rat model of acute lumbar spinal cord injury by human neural stem cell transplantation [Text] / S. van Gorp et al. // Stem Cell. Res. Ther. — 2013. — Vol. 4, Article 57. — P. 1-22.
25. Spinal cord reconstruction using NeuroGel implants and functional recovery after chronic injury [Text] / S. Woerly et al. // J. Neurosci. Res. — 2001. — Vol. 66, № 6. — Р. 1187-1197.
26. Reconstruction of the transected cat spinal cord following NeuroGel implantation: axonal tracing, immunohistochemical and ultrastructural studies [Text] / S. Woerly et al. // Int. J. Dev. Neurosci. — 2001. — Vol. 19, № 1. — Р. 63-83.
27. Spinal cord repair with PHPMA hydrogel containing RGD peptides (NeuroGel) [Text] / S. Woerly et al. // Biomaterials. — 2001. — Vol. 22, № 10. — Р. 1095-1111.
28. Prevention of gliotic scar formation by NeuroGel allows partial endogenous repair of transected cat spinal cord [Text] / S. Woerly et al. // J. Neurosci. Res. — 2004. — Vol. 75, № 2. — P. 262-272.
29. Expression of heat shock protein (HSP)-25 and HSP‑32 in the rat spinal cord reconstructed with NeuroGel [Text] / S. Woerly et al. // Neurochem. Res. — 2005. — Vol. 30, № 6–7. — P. 721-735.
30. Цымбалюк В.И. Спинной мозг. Элегия надежды: Монография [Текст] / В.И. Цымбалюк, В.В. Медведев. — Винница: Новая Книга, 2010. — 944 с.
31. Модель пересічення половини поперечника спинного мозку. І. Технічні, патоморфологічні та клініко-експериментальні особливості [Текст] / В.І. Цимбалюк та ін. // Укр. нейрохірург. журнал. — 2016. — № 2. — С. 18-27.
32. Basso D.M. A sensitive and reliable locomotor rating scale for open field testing in rats [Text] / D.M. Basso, M.S. Beattie, J.C. Bresnahan // J. Neurotrauma. — 1995. — Vol. 12, № 1. — P. 1-21.
33. Модель поперечного пересічення половини спинного мозку. Частина ІІ. Стан нервово-м’язового апарату, синдром посттравматичної спастичності та хронічний больовий синдром [Текст] / В.І. Цимбалюк та ін. // Укр. нейрохірург. журнал. — 2016. — № 3. — С. 5-13.

/20-26/22-1.jpg)
/20-26/23-1.jpg)
/20-26/24-1.jpg)