Резюме
Актуальність. Атеротромботичний підтип ішемічного інсульту становить 50 % випадків захворювання та є причиною інвалідизації працездатного населення середнього віку. Судинні порушення можуть бути пов’язані зі змінами у структурі генів ангіотензинперетворюючого ферменту (АСЕ), ангіотензиногену (AGT) та бета-фібриногену (FGB). Мета дослідження. Дослідити зв’язок наявності I/D (rs1799752) поліморфізму гена АСЕ, Т174М (rs4762) поліморфізму гена AGT та С-148Т (rs1800787) поліморфізму гена FGB із ризиком раннього розвитку ішемічного інсульту атеротромботичного підтипу в популяції осіб білої раси, які проживають на території України. Матеріали та методи. Генетичний аналіз було проведено 78 хворим (24 жінки, 54 чоловіки), які перенесли ішемічний інсульт, та 55 особам популяційного контролю (20 жінок, 35 чоловіків), які не мали тяжких серцево-судинних захворювань. Середній вік пацієнтів експериментальної групи становив 53,9 ± 9,43 року, групи контролю — 59,8 ± 14,8 року. Поліморфізми генів AGT та FGB досліджували методом полімеразної ланцюгової реакції з подальшою рестрикцією ампліфікованих фрагментів. Генотипування поліморфізму I/D гена АСЕ було проведено методом алель-специфічної полімеразної ланцюгової реакції. Результати. Дослідження ризику розвитку захворювання показало, що носії I/D- та DD-генотипу гена АСЕ мають менший ризик захворіти на ішемічний інсульт атеротромботичного підтипу, ніж носії I/І-генотипу (OR = 0,303, 95% CI 0,134–0,688; р < 0,05, та OR = 0,303, 95% CI 0,134–0,688; р < 0,05 відповідно). Носії поліморфного генотипу -148СТ гена FGB частіше ніж удвічі ризикують захворіти на ішемічний інсульт (OR = 2,452; 95% CI 1,201–5,005; р < 0,05), ніж носії генотипу -148СС. Зв’язок поліморфізму гена AGT T174M із ризиком розвитку ішемічного інсульту був відсутній. Висновки. Поліморфний генотип -148С/Т гена FGB, а також алель І та генотип ІІ гена АСЕ є факторами ризику раннього розвитку ішемічного інсульту атеротромботичного підтипу в популяції осіб, які проживають на території України.
Актуальность. Атеротромботический подтип ишемического инсульта составляет 50 % случаев заболевания и является причиной инвалидизации работоспособного населения среднего возраста. Сосудистые нарушения могут быть связаны с изменениями в структуре генов ангиотензинпревращающего фермента (АСЕ), ангиотензиногена (AGT) и бета-фибриногена (FGB). Цель исследования. Исследовать связь наличия I/D (rs1799752) полиморфизма гена АСЕ, Т174М (rs4762) полиморфизма гена AGT и С-148Т (rs1800787) полиморфизма гена FGB с риском раннего развития ишемического инсульта атеротромботического подтипа в популяции лиц белой расы, которые проживают на территории Украины. Материалы и методы. Генетический анализ был проведен 78 больным (24 женщинам, 54 мужчинам), которые перенесли ишемический инсульт, и 55 лицам популяционного контроля (20 женщин, 35 мужчин), которые не имели тяжелых сердечно-сосудистых нарушений. Средний возраст пациентов экспериментальной группы составлял 53,9 ± 9,43 года, а группы контроля — 59,8 ± 14,8 года. Полиморфизмы генов AGT и FGB исследовали методом полимеразной цепной реакции с последующей рестрикцией амплифицированных фрагментов. Генотипирование полиморфизма I/D гена АСЕ было проведено методом аллель-специфической полимеразной цепной реакции. Результаты. Исследование риска развития заболевания показало, что носители I/D- и DD-генотипа гена АСЕ имеют меньший риск развития ишемического инсульта атеротромботического подтипа, чем носители I/І-генотипа (OR = 0,303, 95% CI 0,134–0,688; р < 0,05, и OR = 0,303, 95% CI 0,134–0,688; р < 0,05 соответственно). Носители полиморфного генотипа -148СТ гена FGB в два раза чаще рискуют заболеть ишемическим инсультом (OR = 2,452; 95% CI 1,201–5,005; р < 0,05), чем носители генотипа -148СС. Связь полиморфизма гена AGT T174M с риском развития ишемического инсульта отсутствовала. Выводы. Полиморфный генотип -148СТ гена FGB, а также аллель I и генотип I/І гена АСЕ являются факторами риска раннего развития ишемического инсульта атеротромботического подтипа в популяции лиц, которые проживают на территории Украины.
Background. Atherothrombotic ischemic stroke accounts for about 50 % of all cases of ischemic strokes. It is a highly invalidating disease that affected not only older people, but also young adults, who can work, and children. Blood vessels damage can be linked with genetic changes in candidate genes, such as angiotensin-converting enzyme (ACE), angiotensinogen (AGT) and beta-fibrinogen (FGB). We aimed to investigate the association between I/D polymorphism (rs1799752) of ACE gene, T174M (rs4762) polymorphism of AGT gene and C-148T polymorphism of FGB gene with risk of early onset of atherothrombotic ischemic stroke in Ukrainian Caucasian population. Materials and methods. 78 cases (24 females and 54 males, mean age was 53.90 ± 9.43 years) and 55 controls (20 females and 35 males, mean age was 59.8 ± 14.8 years) were enrolled in this study. FGB and AGT polymorphisms were determined by polymerase chain reaction (PCR) followed by digestion with restriction enzymes. ACE polymorphism was determined by allele specific PCR method. Results. Risk assessment showed significant lower risk for I/D and D/D genotype of ACE gene carriers (odds ration (OR) = 0.303, 95% confidence interval (CI): 0.134–0.688; р < 0.05, and OR = 0.303, 95% CI: 0.134–0.688; р < 0.05, respectively) than for I/I genotype. Patients with -148CT genotype of FGB gene had a higher risk of developing ischemic stroke compared with -148CC carriers (OR = 2.452; 95% CI: 1.201–5.005; р < 0.05). No risk was obtained for polymorphism T174M of AGT gene. Conclusions. Our findings suggest that I/I genotype of ACE gene and C/T genotype of FGB gene are associated with early onset of atherothrombotic ischemic stroke in Ukrainian Caucasian population.
Статтю опубліковано на с. 20-26
Робота виконана в рамках НДР «Дослідити молекулярно-клітинні патологічно-компенсаторні процеси при ішемічному інсульті з метою оптимізації нейрохірургічних та терапевтичних заходів» (2014–2016 рр.).
Вступ
Маніфестація ішемічного інсульту є раптовою і майже непередбачуваною подією. На ймовірність виникнення порушення мозкового кровообігу може вказувати наявність в анамнезі пацієнта визнаних науковим світом факторів ризику, таких як артеріальна гіпертензія, цукровий діабет та гіперхолестеринемія. Проте далеко не в усіх, хто має високий тиск або підвищений рівень холестерину, розвивається ішемічний інсульт. Враховуючи наявність спадкової складової в етіології цього захворювання, світові наукові дослідження зосереджені на визначенні генів-кандидатів, продукти яких можуть призводити до дисфункції ендотелію судин та порушення системи гемостазу.
Одними з часто обговорюваних у такому аспекті є гени, що кодують білки — регулятори ренін-ангіотензин-альдостеронової системи (РААС) та фібриногену, а саме ген ангіотензиногену (AGT), ангіотензинперетворюючого ферменту (ACE) та β-ланцюга фібриногену (FGB).
Ренін виробляється юкстамедулярними клітинами нирок та розщеплює ангіотензиноген, який синтезується в печінці до утворення ангіотензину І. Після чого АСЕ — цинкова металопептидаза, розташована на поверхні епітеліальних та ендотеліальних клітин, перетворює неактивний декапептид ангіотензин І в активний октапептид та вазоконстриктор ангіотензин ІІ [1]. Під дією ангіотензину ІІ з наднирників вивільняється альдостерон, який сприяє реабсорбції натрію та води з сечі та підвищенню кров’яного тиску. Інша функція цього ферменту, яка веде також до підвищення тиску, полягає в метаболізуванні брадикініну — сильного вазодилататора. Таким чином, білок АСЕ відіграє суттєву роль у підтриманні нормобаричного стану кров’яного тиску. Ген, що кодує цю цинкову металопептидазу, розташований на довгому плечі 17-ї хромосоми у локусі 17q23, має 16 екзонів та 25 інтронів [2]. На даний час відомо понад 10 поліморфізмів цього гена, але найбільш дослідженим і функціонально значимим поліморфізмом є наявність або відсутність Alu-повтору (287bp) у 16-му інтроні. Відсутність цього повтору в обох алелях гена призводить до двократного підвищення рівня ангіотензину II у плазмі крові. Цей факт пов’язують із ризиком розвитку кардіологічних, ниркових патологій, ускладнень діабету та порушенням мозкового кровообігу.
Ген AGT розташований на довгому плечі хромосоми 1 у локусі 1q42-q43 та має 5 екзонів [3]. Продукт цього гена, як було сказано вище, є субстратом реніну та попередником вазоконстриктора ангіотензину ІІ. На сьогодні відомо понад 30 поліморфних сайтів у цьому гені. Заміна амінокислоти треонін на амінокислоту метіонін (Т174М) через заміну цитозину на тимін у положенні 521 в екзоні 2 є однією з найбільш досліджуваних однонуклеотидних замін, яка призводить до збільшення концентрації білка в плазмі крові. Зв’язок наявності цього поліморфізму із захворюваннями серцево-судинної системи є предметом дискусії багатьох наукових робіт. Велика популяційна варіабельність частот алелей гена ангіотензиногену від 0,912 для М-алелі в мешканців Африки та Азії до 0,122 в мешканців європейських країн [3] доводить необхідність визначення цього зв’язку для кожної етнічної групи окремо.
Ген FGB кодує β-ланцюг білка фібриногену — ключового білка системи гемостазу. Цей ген розташований на 4-й хромосомі у локусі 4q 31. Підвищення рівня фібриногену в плазмі крові призводить до гіперкоагуляції і, як наслідок, тромбозу. Синтез β-ланцюга є швидкість-лімітуючою стадією у процесі синтезу зрілого білка, тому генетичні порушення в промоторному регіоні гена змінюють рівень продукції фібриногену. Існує декілька поліморфізмів гена FGB, найбільш дослідженим із яких є С-148Т. Його наявність асоціюється із 10–30% збільшенням концентрації фібриногену в плазмі крові [4]. Тому визначення зв’язку наявності поліморфізму у хворих, які перенесли ішемічний інсульт у працездатному віці, із розвитком захворювання є доцільним.
Ішемічний інсульт, як синдромальне захворювання, має різне патологічне походження. Розрізняють атеротромботичний, кардіоемболічний, лакунарний, гемодинамічний та гемореологічний підтипи ішемічного інсульту [5]. Найбільш поширеним є атеротромботичний підтип. Саме для цього підтипу ішемічного інсульту визначення вищевказаних поліморфних змін може стати основою профілактичних та лікувальних заходів.
Мета роботи — дослідити зв’язок наявності I/D (rs1799752) поліморфізму гена ангіотензинперетворюючого ферменту, Т174М (rs4762) поліморфізму гена ангіотензиногену та С-148Т (rs1800787) поліморфізму гена фібриногену з ризиком раннього розвитку ішемічного інсульту атеротромботичного підтипу в популяції осіб, які проживають на території України.
Матеріали та методи
Генетичний аналіз було проведено 78 хворим (24 жінки, 54 чоловіки), які перенесли ішемічний інсульт, та 55 особам популяційного контролю (20 жінок, 35 чоловіків), які не мали тяжких серцево-судинних захворювань. Середній вік пацієнтів експериментальної групи становив 53,9 ± 9,43 року, групи контролю — 59,8 ± 14,8 року. Усім пацієнтам було проведене стандартне неврологічне та клініко-інструментальне дослідження. Усі особи належали до європеоїдної раси.
На проведення роботи було отримано дозвіл комісії з біоетики ДУ «Інститут нейрохірургії ім. А.П. Ромоданова НАМН України». Кожний пацієнт та особа популяційного контролю давали згоду на участь у дослідженні.
Молекулярно-генетичне дослідження було виконано на зразках венозної крові. Геномна ДНК була ізольована за допомогою комерційно-доступного набору «ДНК-сорб-Б» (ФБУН ЦНИИ эпидемиологии Роспотреб-надзора, Росія).
Генотипування поліморфізму I/D гена АСЕ було проведено алель-специфічним методом полімеразної ланцюгової реакції (ПЛР) за допомогою комплекту реагентів для ідентифікації поліморфізмів Neo-Gene_ACE I/D (LabNeogene P.C., Україна). Наявності генотипу I/I відповідав фрагмент 480вр, генотипу DD — фрагмент 193вр, наявність обох фрагментів свідчила про генотип I/D.
Поліморфізми генів AGT та FGB досліджували методом ПЛР із подальшою рестрикцією ампліфікованих фрагментів за допомогою комплектів реагентів для ідентифікації поліморфізмів Neo-Gene_AGT T174M та Neo-Gene-β-fibrinogen C-148T (LabNeogene P.C., Україна). Для поліморфізму Т174М розщеплення рестриктазою Bsp19 I дає фрагменти 353вр для ТТ-генотипу, 202вр та 151вр — для ММ-генотипу та 151вр, 202вр, 353вр — для ТМ-генотипу. Для поліморфізму С-148Т розщеплення рестриктазою HindIII дає фрагменти 97вр та 265вр для генотипу СС, 362вр — для генотипу ТТ, 97вр, 265вр, 362вр — для генотипу СТ.
Візуалізацію продуктів ампліфікації та рестрикції проводили у 2% агарозному гелі.
Статистичну обробку даних проводили за загальноприйнятою методикою варіаційної статистики.
Частоти розподілення генотипів у вибірках перевіряли на відхилення від рівноваги Харді — Вайнберга за критерієм χ2 Пірсона [6]. Всі відмінності вважали статистично значимими при р < 0,05.
Асоціацію між захворюванням та генотипом також визначали за допомогою критерію χ2 Пірсона, порівнюючи розподіл генотипів та алелей за кожним поліморфізмом між групами пацієнтів та контролю.
Відношення шансів (OR, odds ratio) з 95% довірчим інтервалом (95% СІ) розраховували для рідкісної алелі та носіїв рідкісної алелі (гетерозигота + гомозигота за рідкісною алеллю) відносно гомозигот за частою алеллю.
Розрахунок релятивного ризику наявності певної алелі для розвитку захворювання оцінювали за формулою RR = ax (b + d)/bx (a + c), де а і b — кількість хворих, які мали (а) або не мали (b) цієї алелі, с і d — кількість осіб контрольної групи, які мали (с) або не мали (d) цієї алелі. Оцінка проведена відповідно до наступних значень: RR > 1 — наявність прямого зв’язку, RR < 1 — наявність оберненого зв’язку, RR = 1 — відсутність залежності. Така ж оцінка проведена і для відношення шансів.
Статистичну обробку отриманих даних проводили з використанням пакета статистичних програм Statistica 6.0 for Windows (Stat Soft Inc, США), Microsoft Office Exсel 2003 та інтернет-ресурсу «Медицинская статистика».
Результати
Розподіл частот генотипів поліморфізмів генів ангіотензинперетворюючого ферменту, ангіотензиногену та β-ланцюга фібриногену та оцінка відповідності популяційній рівновазі Харді — Вайнберга проводилися окремо в контрольній групі та групі хворих на ішемічний інсульт. Відхилення від рівноваги Харді — Вайнберга не було виявлено для жодного поліморфізму (табл. 1–3).
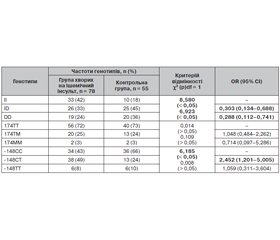
Аналіз розподілу алелей досліджуваних генів серед хворих на ішемічний інсульт та осіб контрольної групи виявив статистично значиму (р < 0,05) різницю зустрічальності алелі І порівняно з алеллю D для поліморфізму I/D гена АСЕ. За нашими даними, алель І зустрічалася частіше у групі хворих на інсульт (табл. 4). Статистично значимої різниці між частотами алелей для поліморфізмів С-148Т та Т174М генів FGB та AGT відповідно виявлено не було (табл. 4). Але виявлено істотне підвищення зустрічальності алелі Т серед хворих на ішемічний інсульт атеротромботичного підтипу.
Таким чином, алель І є фактором ризику раннього розвитку ішемічного інсульту в осіб білої раси, які проживають на території України (RR = 1,35; 95% CI 1,098–1,699; р < 0,05) (розрахунок проведено для алелі І як фактора ризику).
Розподіл генотипів та значення відношення шансів для досліджуваних поліморфізмів наведені в табл. 5.
Аналіз розподілу генотипів досліджуваних поліморфних сайтів у групах хворих на ішемічний інсульт та популяційного контролю виявив вірогідну різницю (р < 0,05) частот генотипів поліморфізму I/D гена АСЕ. Збільшення ризику виникнення захворювання спостерігалось у носіїв генотипу ІІ порівняно з особами, які мали гомозиготний DD (RR = 1,575; 95% CI 1,097–2,262; р < 0,05) або гетерозиготний I/D (RR = 1,535; 95% CI 1,112–2,119; р < 0,05) (розрахунок проведено для генотипу ІІ як фактора ризику).
При порівняльному аналізі частот генотипів поліморфізму С-148Т гена FGB встановлено асоціацію генотипу -148СТ із ризиком виникнення захворювання (RR = 1,531; 95% CI 1,142–2,045; р < 0,05).
Для поліморфних генотипів 174ТM та 174ТТ гена AGT асоціація із ризиком раннього розвитку ішемічного інсульту була відсутня.
Обговорення
Отримані нами результати показали більший відсоток носіїв генотипу ІІ гена АСЕ у групі хворих на ішемічний інсульт порівняно з групою контролю. Різні метааналізи підтверджують або спростовують зв’язок між наявністю DD-генотипу та розвитком тієї чи іншої патології, а наявність ІІ генотипу переважно асоціюється з позитивним прогнозом. Але є певна кількість досліджень типу «випадок — контроль», результати яких подібні до отриманих нами.
Схожі результати були отримані індійськими вченими для чоловіків при дослідженні ризику виникнення ішемічного інсульту серед осіб середнього віку [7]. Розподіл генотипів у контрольній групі наближався до отриманого нами (II — 16,5 %, ID — 63,7 %, DD — 19,6 %). Проте у групі хворих на ішемічний інсульт ними був отриманий дещо менший відсоток носіїв генотипу ІІ, ніж у колег (II — 29 %, ID — 56 %, DD — 15 %). Поясненням такого розподілу може бути кількісна перевага осіб чоловічої статі в нашому дослідженні.
Переважання ІІ-генотипу в групі хворих на гіпертонію було зафіксоване китайськими вченими для достатньо локалізованої популяції тайванців [8]. Розподіл генотипів для хворих на гіпертензію мав вигляд: II — 32 %, ID — 48 %, DD — 20 %; II — 18 %, ID — 54 %, DD — 28 % — для контрольної групи.
Пакистанські вчені продемонстрували статистично вірогідну перевагу генотипу ІІ (OR = 6,755; CI 3–14,9) [9] при нефротичному синдромі в дітей — патології, яка, за багатьма літературними джерелами, асоціюється переважно з наявністю DD-алелі.
Механізм цього явища лишається незрозумілим. Можливо, має значення локалізованість вищезазначених етнічних груп, а значить, і менший вплив зовнішнього генетичного матеріалу, який «розбавляє» збалансований часом генетичний фон популяції і змінює результати дослідження. Крім того, відомо, що ангіотензин ІІ індукує ангіогенез [10]. Можливо, особи, які мають менший рівень ангіотензину ІІ і, відповідно, генотип ІІ, складніше утворюють колатералі кровеносного русла. Через це атеросклеротичне ураження судин, що має місце у хворих на ішемічний інсульт у нашому дослідженні, легше реалізується в гостре порушення мозкового кровообігу.
Гіперактивність ренін-ангіотензин-альдостеронової системи є важливим фактором ендотеліальної дисфункції. Її залучення в патогенез серцево-судинних захворювань підтверджується застосуванням інгібіторів АСЕ в лікуванні артеріальної гіпертензії, серцевої недостатності та цереброваскулярних патологій. Ген ангіотензинперетворюючого ферменту експресується різними тканинами організму, включаючи ендотелій легень та судин. Білок, що виробляється ендотелієм легень, перетворює ангіотензин І в ангіотензин ІІ, що потрапляє в кровоносне русло та регулюється реніном. Проте існує локальна ренін-ангіотензинова система (РАС) для багатьох тканин, включаючи мозок. У цій системі АСЕ може обернено регулюватися ангіотензином І та ІІ [11]. Роль тканинної РАС до кінця не з’ясована. Відомо про її участь у проліферації клітин та функціонуванні мітохондрій. Можливо, підвищений рівень ангіотензину ІІ, що має місце в носіїв алелі D, відіграє протективну роль у тканинній РАС, впливаючи на покращення мікроциркуляції нервової тканини, бо серед осіб популяційного контролю генотип DD частіше зустрічався в осіб старшого віку (дані не показані). У будь-якому разі необхідне подальше вивчення значень генетичних змін білків РААС для розвитку порушень мозкового кровообігу.
Поліморфізм Т174М справляє певний патогенетичний ефект на роботу гена AGT, проте фенотипові прояви порушення нормального рівня ангіотензиногену, імовірно, є популяційно-специфічними і залежать від роботи інших генів РАС. Отримані нами дані не показали, що алель М може бути віднесена до алелі ризику розвитку ішемічного інсульту атеротромботичного підтипу в популяції осіб, які проживають на території України.
Очікуваним результатом стала вірогідна різниця частоти носіїв рідкісної алелі (гетерозигота + гомозигота за рідкісною алеллю) відносно гомозигот за частою алеллі поліморфізму С-148Т між досліджуваними групами. Відсутність різниці частоти генотипу ТТ між групами може бути пояснена низьким відсотком його зустрічальності в популяції. Індонезійськими вченими при дослідженні ризику виникнення ішемічного інсульту в осіб молодого віку було встановлено, що хворі на ішемічний інсульт мали більший уміст фібриногену в плазмі крові, ніж здорові особи (в середньому 419,2 проти 351 мг/дл), і ризик розвитку захворювання в носіїв мутантної алелі, відповідно, був збільшений у 2,46 раза [12], як і в нашому експерименті. Підвищений рівень фібриногену асоціюється із збільшенням рівня С-реактивного білка та інтерлейкіну-6 у плазмі крові [13]. Це говорить про те, що розвиток порушення мозкового кровообігу через збільшений рівень фібриногену в плазмі крові в носіїв поліморфізму С-148Т відбувається не лише через ризик тромбозу, а й через постійну циркуляцію молекул запалення та реактивність ендотелію судин. Таким чином, алель Т поліморфного сайта С-148Т є фактором ризику раннього розвитку ішемічного інсульту атеротромботичного підтипу в осіб, які проживають на території України, що має бути враховано при проведенні профілактичних та лікувальних заходів.
Висновок
Отримані нами результати доводять зв’язок наявності поліморфізму С-148Т гена β-ланцюга молекули фібриногену із ризиком раннього розвитку ішемічного інсульту атеротромботичного підтипу в осіб, які проживають на території України. Наявність інсерційного генотипу (ІІ) поліморфізму I/D гена ангіотензинперетворюючого ферменту також є фактором ризику розвитку порушення мозкового кровообігу за ішемічним типом у зазначеній популяційній групі. Частота поліморфізму Т174М не відрізнялася між дослідними групами.
Відкритим лишається питання механізму впливу інерційного поліморфізму на розвиток захворювання, що є підставою для подальшого дослідження.
Будь-який окремий поліморфізм гена пояснює 1–8 % випадків від загального ризику захворювання в окремій популяції, що може здатися незначним. Але разом із наявністю інших генетичних порушень, епігенетичними факторами та впливом навколишнього середовища він може стати основою патологічного процесу. Тому більш комплексне дослідження молекулярно-генетичної детермінованості раннього виникнення ішемічного інсульту дозволить окреслити критерії ризику для кожного пацієнта, що дасть можливість вчасно провести профілактичні або лікувальні заходи та запобігти розвитку захворювання або мінімізувати його наслідки.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Fishchuk L.E. Genetic polymorphisms of the renin-angiotensin system in breast cancer patients / L.E. Fishchuk, N.G. Gorovenko // Exp. Oncol. — 2013. — № 32(2). — P.101-104.
2. Association of angiotensin-converting enzyme (ACE) and fatty acid binding protein 2 (FABP2) genes polymorphism with type 2 diabetes mellitus in Northern India / T.R. Sayed, F. Jalees, A. Faisal [et al.] // J. of Renin-Angiotensin-Aldosteron Sys. — 2014. — № 15(4). — P. 572-579.
3. Чанг Н.Т. Исследование ассоциации Т174М и М235Т гена ангиотензиногена с ишемической болезнью сердца в ростовской популяции / Н.Т. Чанг, Т.П. Шкурат // Эпидемиология. — 2010. — Т. 11. — С. 63-77.
4. Дослідження впливу поліморфного варіанта С-148Т гена β-ланцюга фібриногену на режим дозування варфарину / І.В. Малярчук, Н.Г. Горовенко, А.Р. Бабочкіна, Н.С. Осипенко // Кровообіг та гемостаз. — 2014. — № 1–2. — С. 115-118.
5. Верещагин Н.В. Принципы диагностики и лечения больных в остром периоде инсульта / Н.В. Верещагин, М.А. Пирадов, З.А. Суслина // ConsiliumMedicum. — 2001. — Т. 3, № 5. — С. 221-225.
6. Бабич П.Н. Применение современных статистических методов в практике клинических исследований. Сообщение второе. Применение критерия хи-квадрат / П.Н. Бабич, А.В. Чубенко, С.Н. Лапач // Український медичний часопис. — 2004. — № 2. — С. 138-144.
7. ACE I/D genotype and I allele predicts ischemic stroke among males in South India / M. Vijayan, R. Chinniah, P.M. Ravi [et al.] // Meta Gene. — 2014. — № 2. — P. 661-669.
8. Angiotensinogen gene gaplotype and hypertension interaction with ACE gene I allele / C.T. Tsai, D. Fallin, F.T. Chiang [et al.] // Hypertension. — 2003. — № 41(1). — P. 9-15.
9. Association of the ACE-II genotype with the risk of nephroticsyndrome in Pakistani children / S. Shahid, A. Abid, S.Q. Mehdi [et al.] // Gene. — 2012. — № 493(1). — P. 165-168.
10. Angiotensin II-indused process of angiogenesis is mediated by spleen tyrosine kinase via VEGF receptor phosphorilation / K.B. Cuneyt, Y.S. Chi, A.Y. Fariborz // Am. J. Physiol. Heart Circ. Physiol. — 2011. — № 301. — P. 1043-1056.
11. Renin-angiotensin-aldosterone system blockade for cardiovascular disorders: current status / T.K. Ma, K.K. Kam, B.P. Yam, Yat-Yin Lam // Br. J. Pharmacol. — 2010. — № 160(6). — P. 1273-1292.
12. Association of β-fibrinogen promoter gene polymorphism (-148C/T), hyperfibrinogenemia and ischemic stroke in young adult patients / I. Imran, L. Rusdi, I. Ponpon [et al.] // Egyptian Journal of Medical Human Genetics. — 2015. — № 16. — P. 11-17.
13. Fibrinogen beta-chain -C148T polymorphism is associated with increased fibrinogen, C-reactive protein and interleukin -6 in patients undergoing coronary artery bypass grafting / E. Wypasek, E. Stepien, M. Kot [et al.] // Inflamation. — 2012. — № 35. — Р. 429-435.

/22.jpg)
/23.jpg)